鴿avUCP基因克隆、原核表達與多抗制備
李晨星 潘廣偉 宋思進

摘 要:解偶聯蛋白(uncoupling proteins,UCPs)是線粒體內膜上具有調節質子跨膜轉運作用的轉運蛋白,在細胞的產熱、氧化還原、活性氧產生等許多細胞過程中起著關鍵作用。鳥類解偶聯蛋白(avian uncoupling protein avUCP)通過調控脂類利用和細胞代謝產熱參與機體的脂肪代謝和能量平衡,多種環境和激素因子調控其轉錄和翻譯水平。為了更好地理解avUCP參與鳥類代謝產熱的分子機理,該研究以鳥類模式生物之一鴿為實驗材料,克隆了鴿avUCP基因的部分保守序列,基于原核表達系統,構建了pET32a-avUCP原核表達載體,成功表達了鴿avUCP重組融合蛋白,經Ni2+親和層析法純化重組蛋白,SDS-PAGE結果顯示,所得到的目標蛋白分子量與預測值一致,表明純化得到了高純度目標蛋白。以目標蛋白為抗原免疫新西蘭大白兔,5免后制備抗血清,ELISA檢測結果顯示效價為1∶51200。Western blot檢測結果表明,該抗體不僅可以免疫結合重組avUCP蛋白,而且與鴿(Columba)、畫眉(Garrulax canorus)和灰背椋鳥(Sturnus sinensis)骨骼肌中的avUCP抗原蛋白同樣具有良好的特異性免疫反應,說明制備的抗體具有較好的特異性和保守性。該研究將為分子水平研究鳥類能量代謝的規律和調控機理提供必要的抗體基礎。
關鍵詞:鴿;avUCP;基因克隆;原核表達;多克隆抗體
Abstract:Uncoupling proteins(UCPs),which are transporters in the mitochondrial membrane that regulate proton transport across the membrane,play a pivotal role in thermogenesis,redox balance,reactive oxygen species and many other cellular processes. Avian uncoupling protein(avUCP)takes extensively part in fat metabolism and energy balance by regulating lipid utilization and cellular thermogenetic metabolism. A variety of environmental and hormonal factors regulate its transcription and translation. In order to better understand the molecular mechanism of avUCP involved thermogenetic metabolism,the fusion protein of avUCP from Pigeon,one of the avian model organisms,was successfully expressed in the prokaryotic expression system. Firstly,some conserved sequences of pigeon avUCP gene were cloned,and the prokaryotic expression vector pET32a-avUCP was constructed by using gene recombination method. The target fusion protein was purified by Ni-NAT purification system. The results of SDS-PAGE showed that the molecular weight of the target protein was consistent with the predicted value. New Zealand white rabbits were immunized with target protein antigen,and anti-serum was obtained after five times immunization. Western blot analysis showed that the antibody could immunologically bind to recombinant avUCP protein and nature avUCP proteins of G.canorus,S. sinensis and C.livia. The results revealed the antibody had higher immune-specificity and conservatism in birds. This study will provide the necessary antibody for the study of the regulation mechanism of energy metabolism in birds at the molecular level.
Key words:Pigeon;avUCP; Gene cloning; Prokaryotic expression; Polyclonal antibody
動物的產熱(Thermogenesis)包括專性產熱(obligatory thermogenesis)和兼性產熱(facultative thermogenesis)[1]。專性產熱是指為維持生命基本功能所發生的所有合成和分解代謝生物化學過程中以副產物的形式產生的熱量,產生于所有器官,如基礎代謝率(basal metabolic rate,BMR)和靜息代謝率(resting metabolic rate,RMR)[2]。兼性產熱又稱為適應性產熱(adaptive thermogenesis),是指對環境溫度或飲食的變化發生響應的產熱作用,其目的是保護生物體免受低溫脅迫或調節飲食變化后的能量平衡,只發生在部分組織中,如肌肉的顫抖性產熱(shivering thermogenesis,ST)、褐色脂肪組織(brown adipose tissue,BAT)的非顫抖性產熱(nonshivering thermogenesis,NST)及食物誘導產熱(diet-induced thermogenesis,DIT)等[3]。糖類、脂肪和蛋白質三大營養物質在細胞線粒體內的氧化放能是動物產熱的主要生物化學基礎,而線粒體內膜上的質子泄漏(proton leak)是動物代謝產熱變化的重要潛在機制之一[4]。通過電子傳遞鏈向外泵送質子,線粒體的氧化磷酸化會在內膜兩側產生質子電-化學勢能(ΔP)。質子通過F0/F1- ATP合成酶重新進入線粒體基質,由ADP和無機磷酸鹽(Pi)生成ATP。若質子不通過F0/F1-ATP合成酶進行ATP合成,而直接通過線粒體內膜回到基質則被稱為質子泄漏或解偶聯(uncoupling),其結果導致貯存在ΔP中的自由能以熱的形式被消耗[5]。作為線粒體轉運載體蛋白家族成員之一的解偶聯蛋白-1(uncoupling protein-1,UCP-1)是調控上述機制的主要蛋白[6]。Nicholls等在哺乳動物的褐色脂肪組織(brown adipose tissue,BAT)中首次發現了該蛋白,UCP-1僅在BAT中特異表達,在寒冷或飲食不足時以增加產熱[7,8]。自此,小哺乳動物BAT中的UCP-1調控的非顫抖性產熱在適應性產熱中的作用得到了廣泛而深入的研究。1997年以后哺乳動物的同源蛋白UCP-2[9]、UCP-3[10]、UCP-4[11]和UCP-5[12]也相繼被發現。
鳥類缺少褐色脂肪組織,因此與哺乳動物相比其非顫抖性產熱的研究相對滯后。2001年Raimbault等人通過對雞(Gallus gullus)的骨骼肌cDNA文庫進行篩選,獲得了與哺乳動物UCP-1同源的鳥類UCP(avian UCP,avUCP)cDNA[13]。此后,avUCP在鳥類非顫抖性產熱中的作用得到了較為充分的研究。冷暴露條件下,雛鴨(Anas platyrhynchos)、雞和疣鼻棲鴨(Cairina moschata)等鳥類avUCP的mRNA表達均顯著上調[14];日眠(torpor)和蘇醒(rewarming)時,蜂鳥avUCP mRNA的表達較清醒狀態分別升高3.4倍和2.2倍[15];體外條件下,與從未下過水的幼年王企鵝(Aptenodytes patagonicus)相比,實驗性冷水浸泡或自然適應海洋低溫個體的胸肌細胞呼吸中存在線粒體的跨膜質子電導,同時伴隨avUCP mRNA表達豐度的顯著升高[16]。有研究表明,食物誘導也可以導致鳥類avUCP mRNA表達發生變化[17]。大量的實驗證據表明,avUCP在鳥類的產熱調節中具有類似哺乳動物UCP-1的重要調控作用。除了產熱以外,還有研究認為avUCP通過解偶聯機制參與降低線粒體的氧化應激水平[18]。總之,avUCP與鳥類肌肉組織中線粒體的能量代謝存在密切關系。
為了滿足人類醫學和小哺乳動物能量代謝的科研需求,人、大鼠和小鼠等的UCP-1抗體試劑相繼實現商品化生產。然而,有關avUCP的研究則相對滯后,目前尚無商品化抗體供研究者使用。受到抗體缺乏的影響,關于鳥類avUCP表達水平的研究多局限于mRNA水平。本研究以鳥類模式生物之一鴿為實驗材料,對其肌肉組織avUCP基因進行同源克隆,常規方法原核表達avUCP重組蛋白并純化,免疫新西蘭大白兔制備兔抗鴿avUCP多克隆抗體,為深入研究鳥類avUCP的功能及其在鳥類代謝產熱中的貢獻和作用機制提供必要的檢測工具。
1 材料與方法
1.1 試驗材料與試劑 健康成年美國白羽王鴿購自黑龍江省大慶市花鳥魚市場。王鴿飼養于動物房內,環境溫度為25℃±0.5℃,光周期為16h∶8h(光照∶黑暗),相對濕度為50%~60%,市售標準鴿糧飼養。15d后斷頭法處死動物,迅速取胸肌組織投入液氮速凍,隨即轉入-80℃冰箱存放備用。
基因克隆用的高保真KOD DNA聚合酶和dNTP購自東洋紡(上海)生物科技有限公司;RNA提取試劑Trizol、膠回收試劑盒、BamH I和EcoR I限制性內切酶、T4連接酶、蛋白質分子量標準和羊抗兔IgG二抗購自賽默飛世爾科技(中國)有限公司;cDNA合成試劑盒和DNA分子量Marker購自寶日醫生物技術(北京)有限公司;pEASY-blunt cloning vector載體購自北京全式金生物技術有限公司;弗氏完全佐劑(FCA)和弗氏不完全佐劑(FIA)購自西格瑪奧德里奇(上海)貿易有限公司;其他試劑購自國藥集團化學試劑北京有限公司。引物合成和測序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 鴿avUCP基因的克隆與原核表達載體構建 采用Trizol法提取鴿肌肉組織總RNA,利用隨機引物法合成cDNA的第一條鏈,具體方法參照試劑盒說明書進行。
美國國家生物技術信息中心(NCBI)網站獲取原鴿(Columba livia)的avUCP基因序列信息(KU166860.1)。采用同源克隆的方法,設計含有酶切位點的引物。上游引物avUCP-5:5-CGCGGATCCACAGGGCTGGCGGCGCGGCTGCTG-3(下劃線表示設計的BamH I酶切位點),下游引物avUCP-5:5-CCGGAATTCtcGCGCTGCAGCTGCTCGTAGGAGG-3(下劃線表示設計的EcoR I酶切位點,小寫字母為防止移碼突變引入的堿基)。預測的目的片段的大小為552bp。
PCR擴增反應條件如下:94℃預變性2min,94℃變性15s,60℃退火30s,68℃延伸1min,35個循環,68℃終止循環10min。用1.5%瓊脂糖凝膠對PCR產物進行電泳分離。膠回收純化目的片段方法參照說明書執行。
純化后的目的片段連接pEASY-blunt cloning vector,PCR法和測序法同時檢測載體的連接情況,連接成功后,載體命名為pEASY-avUCP。測序正確的pEASY-avUCP載體與pET32a空載體分別使用BamH I和EcoR I限制性內切酶進行雙酶切,酶切產物利用T4連接酶連接,連接產物轉化DH5a感受態細胞,抗性篩選陽性克隆,PCR測序檢測目的片段與原核表達載體的連接情況,測序正確構建好的原核表達載體命名為pET32a-avUCP。
1.2.2 重組蛋白avUCP的誘導表達和純化 測序正確的重組表達質粒pET32a—avUCP轉入原核表達感受態BL21(DE3)中,37℃培養過夜后,隨機挑選陽性菌落克隆于含卡那霉素(50ug/mL)的LB液體培養液中37℃,220r/min培養。當OD600檢測值為0.5~0.7時,取出2.5mL菌液,加入IPTG至終濃度為1mmol/L,繼續培養3h,收集菌體,使用12% SDS-PAGE檢測重組蛋白表達情況。重組菌株用18℃低溫擴大培養,0.2mmol/L和0.5mmol/L IPTG誘導表達,搖床過夜培養,4℃,5000r/min離心5 min,收集菌體。12% SDS-PAGE檢測重組蛋白表達對不同濃度IPTG的響應情況。純化參考孜拉吉古麗·西克然木等[19]的方法。
1.2.3 重組蛋白avUCP的多克隆抗體制備 參考李銘等(2018)的方法[20]制備多克隆抗體。
1.2.4 ELISA檢測抗體效價 抗原經包被液(0.05mol/L碳酸鹽緩沖液,pH9.6)稀釋至2?g/mL后包被ELISA板,每孔100?L,4℃過夜。棄掉包被液后PBST(0.01M PBS緩沖液+0.05%TWEEN-20)重復洗板3次,每孔150?L,每次3min。5%脫脂乳封閉,每孔100?L,37℃溫育1h后洗滌同上。每孔加入按比例稀釋的抗血清或陰性對照血清100?L,37℃溫育1h后洗滌同上。每孔加1∶5000羊抗兔IgG-HRP二抗100?L,37℃溫育1h后洗滌同上。每孔加底物顯色液OPD 100?L,37℃溫育條件下避光顯色5~10min,顏色有明顯梯度變化時,每孔加入2moL/L的濃硫酸100μL終止顏色反應,酶標儀492nm處測定吸光度。結果判斷:空白OD<0.05,陰性對照OD<0.2,(試驗孔OD值-空白孔OD值)/(陰性對照孔OD值-空白孔OD值)>2判定為陽性[21]。
1.2.5 重組蛋白avUCP多克隆抗體的特異性檢測 采用Western雜交方法檢測制備的重組蛋白avUCP多克隆抗體的特異性。SDS-PAGE結束后,將膠體放于轉膜液(25mMTris,192mM甘氨酸,20%甲醇,pH8.0)中。用100%的甲醇激活適當大小的PVDF后將其置于轉膜液中平衡5~10min。按由下到上的順序放置濾紙-電泳膠-PVDF膜-濾紙于轉移槽上,15V電轉30min后,雙蒸水清洗2次,每次10min。然后用5%脫脂奶粉在4℃下封閉PVDF膜過夜。次日,以重組蛋白avUCP多克隆抗體為一抗(1:3000),室溫孵育2h。用TBS-T(20mM Tris-HCl,150mM Nacl,0.05% Tween 20,pH8.0)洗膜3次,每次15min。以含有辣根過氧化物酶(HRP)標記的羊抗兔IgG為二抗(1:5000),室溫撫育1h。TBS-T膜3次,每次15min,ECL發光液室溫孵育1min后成像拍照。
2 結果與分析
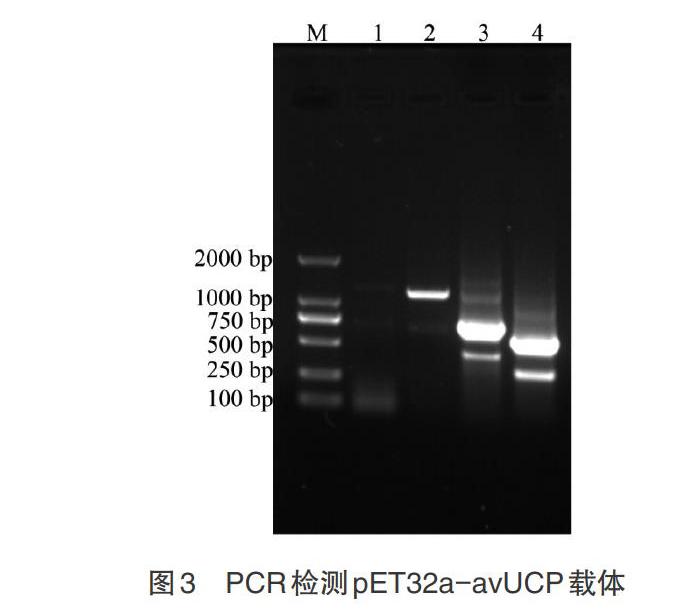
2.1 鴿avUCP基因與表達載體 以鴿的總RNA反轉錄產物cDNA為模板,利用高保真的KOD酶進行avUCP基因的PCR擴增,得到與預期結果相一致的長度為552bp的目的條帶(圖1A)。膠回收后,連接平末端pEASY-blunt克隆載體,抗性篩選獲得陽性克隆,提取質粒后,利用載體引物M13F和M13R檢測目的片段與載體的連接情況。結果如圖1B所示,條帶大小為752bp,符合預期結果,目的基因成功連接到pEASY-blunt載體上。PCR鑒定正確的質粒送公司測序,王鴿avUCP基因與原鴿具有100%的同源性。
2.2 鴿avUCP重組蛋白的誘導表達 首先用1mmol/L的IPTG誘導表達avUCP重組蛋白,經SDS-PAGE檢測,得到分子量大小約為37.7kDa的目的條帶,符合預期結果(圖4泳道2)。為了純化avUCP重組蛋白,采用18℃低溫條件和不同濃度的IPTG(0.2、0.5mmol/L)誘導重組蛋白,并超速離心分離菌體的上清和沉淀。結果顯示,低溫條件下,不同濃度的IPTG誘導,avUCP重組蛋白以包涵體的形式存在(圖4泳道4和6)。
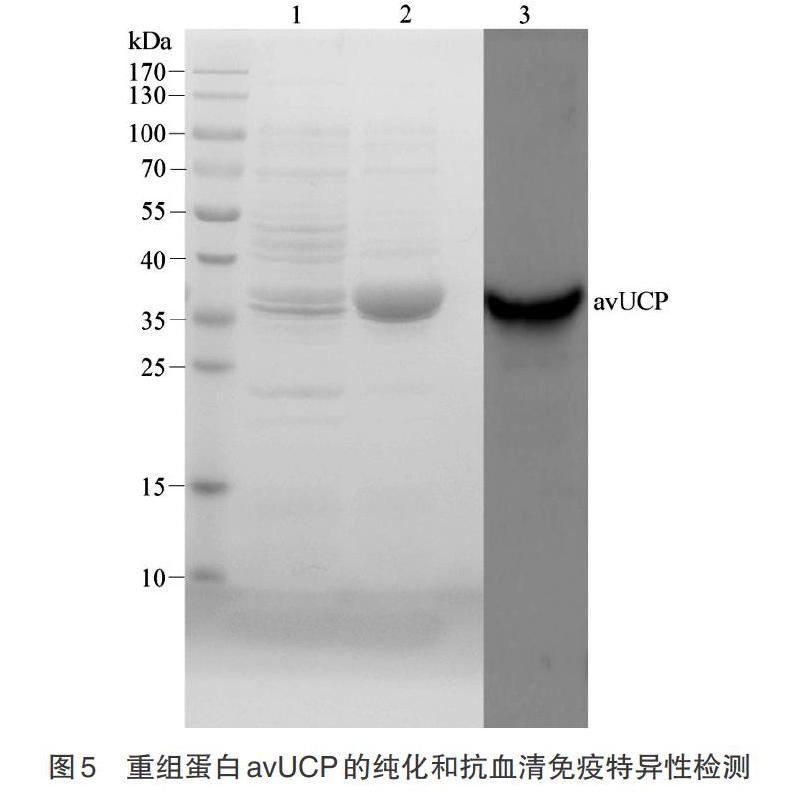
2.3 鴿avUCP重組蛋白和免疫特異性 利用8M尿素溶解包涵體,His標簽親和層析avUCP重組蛋白,純化的重組蛋白目的條帶單一,符合多克隆抗體制備的要求(圖5泳道2)。以制備的鴿avUCP抗血清為一抗,以純化的avUCP重組蛋白為抗原進行Western blot 分析。結果顯示,免疫反應獲得的抗血清能夠與重組蛋白結合且與預期條帶大小相一致(圖5泳道3)。
2.4 鴿avUCP多克隆抗體的效價檢測 以純化好的重組蛋白為抗原,對新西蘭大白兔連續免疫5次后,ELISA法檢測血清抗體效價,實驗結果見表1。經計算可得,當抗血清稀釋度為1∶51200時,各樣品在492nm處的吸光值之間的關系為(0.37-0.045)/(0.154-0.045)=2.98,即檢測孔大于陰性對照2倍以上。
2.5 鴿avUCP重組蛋白抗血清免疫保守性 為了檢測制備的avUCP重組蛋白抗血清的保守性和適用性,分別提取灰背椋鳥(Sturnus sinensis)、王鴿和畫眉(Garrulax canorus)的肌肉組織總蛋白作為抗原進行Western blot分析。結果顯示,所制備的抗體與上述3種鳥肌肉組織中的avUCP均可結合且與預期條帶大小相符(圖6),表明制備的抗血清對鳥類的avUCP具有較好的免疫原性。
3 討論
哺乳動物UCPs作為生物體細胞內線粒體氫離子轉運蛋白,參與生物體發育的多種細胞過程,包括:組織產熱代謝、細胞ROS的響應、脂代謝的調控及糖原和胰島素穩態的調控等[22]。與哺乳動物相比,鳥類基因組中僅有一個UCP(avUCP),不存在哺乳動物UCP1和 UCP2的相似物[23]。已有的研究表明,avUCP參與鳥類的代謝產熱和能量平衡等[15,24,,25]。來源于人和鼠源的UCPs抗體已經廣泛用于免疫沉淀、Western blot、免疫組化和蛋白定位等研究。然而,對avUCP功能的研究常因avUCP蛋白相關抗體的缺少而受到限制。因此,制備針對avUCP的高質量抗體對于鳥類能量代謝的研究是必要的。
大腸桿菌(Escherichia.coli)表達系統是目前應用最為廣泛的制備多克隆抗體的原核表達系統。在原核表達系統中,外源基因的表達除了受基因自身結構的影響外,還受溫度、IPTG濃度和pH值等影響[26]。本研究摸索發現18℃低溫條件下,IPTG的濃度對avUCP的誘導表達產生影響,0.2和0.5mmol/L誘導后,重組融合蛋白均可在包涵體中表達。采用8M尿素溶解包涵體,親和層析avUCP融合蛋白。
avUCP同源的哺乳動物的UCP3基因存在組織表達特異性,骨骼肌表達量較高,可能的原因是其參與骨骼肌的能量代謝[27]。已有報道,avUCP基因在鳥類的骨骼肌中特異表達,參與體溫調節[28]。因此,本研究以鳥類模式生物之一-鴿為對象,提取其胸肌組織中的總RNA,克隆獲得其avUCP基因的部分序列,用于抗體的制備。人工制備特異性抗體的方法包括:多克隆抗體、單克隆抗體和基因工程抗體[29]。基于實驗成本、周期和目的要求,本研究選擇制備avUCP多克隆抗體。免疫原的線性表位是決定決定抗原特異性的關鍵。利用Immune Epitope Database and Analysis Resource(IEDB)在線工具分析avUCP蛋白序列,選取親水性較高、線性表位較好的第114~297個氨基酸序列作為免疫多肽序列。本研究成功純化了含有該序列的融合6個His標簽的重組蛋白,免疫獲得的抗體效價達到1∶51200,說明選擇的抗原片段具有良好的免疫原性。同時,利用Western blot方法顯示制備的抗體具有很好的特異性。
avUCP編碼307個氨基酸,與人類、哺乳動物和植物UCP具有較高的同源性[27]。avUCP氨基酸序列含有3個線粒體載體特征結構域,此結構域特征與人[30]、鼠[31]和魚[32]的UCP相應序列特征相一致,暗示著其在進化過程中具有高度的保守性。已有氨基酸序列分析表明,鴿avUCP與其他鳥類,如火雞(Meleagris gallopavo)、雞、鵪鶉(Coturnix japonica)和斑胸草雀(Taeniopygia guttata)的同源性高達約93%[33]。本研究利用制備的兔抗鴿avUCP抗體免疫檢測了鳥綱畫眉科畫眉鳥(Garrulax canorus)和椋鳥科灰背椋鳥(Sturnus sinensis)骨骼肌avUCP基因的表達情況。結果顯示所制備的抗體能夠雜交出單一且符合預期結果的目的條帶,表明本研究制備的抗體具有很好的保守性和適用性。
參考文獻
[1]AL–Mansour MI.Seasonal variation in basal metabolic rate and body compositionwithin individual sanderling bird Calidris alba[J].Journal of Biological Sciences,2004,4(4):564–567.
[2]Lindsay CV,Downs CT,Brown M.Physiological variation in Amethyst Sunbirds(Chalcomitra amethystina)over an altitudinal gradient in winter[J].Journal of Experimental Biology,2009,212(4):483–493.
[3]Himms-Hagen J. Brown adipose tissue thermogenesis:role in the thermoregulation,energy regulation and obesity[M]// Schonbaum E,Lomax P. Thermoregulation physiology and biochemistry. New York:Pergamon Press:1990,327–414.
[4]Vian A,Martin DB. The on-off switches of the mitochondrial uncoupling proteins[J].Trends in Biochemical Sciences,2009,35(5):298-307.
[5]Brand MD,Chien LF,Ainscow EK,et al. The causes and functions of mitochondrial proton leak[J].Biochimica et Biophysica Acta(BBA)- Bioenergetics,1994,1187(2):132-139.
[6]Cannon B,Golozoubova V,Matthias A,et al. Is there a life in the cold without UCP1? Uncoupling proteins and thermoregulatory thermogenesis[M]// Heldmaier G,Klingenspor M. Life in the cold. Berlin:Springer:2000,387-400.
[7]Nicholls DG,Bernson V,Heaton G. The identification of the component in the inner membrane responsible for regulating energy dissipation[M]// Girardier L,Seydoux J. Effectors of Thermogenesis. Basel:Birkhauser Verlag:1978,89-93.
[8]Klingenberg M,Huang SG. Structure and function of theuncoupling protein from brown adipose tissue[J].Biochimica et Biophysica Acta(BBA)- Biomembranes,1999,1415(2):271-296.
[9]Fleury C,Neverova M,Collins S,et al. Uncoupling protein-2:a novel gene linked to obesity and hyperinsulinemia[J].Nature Genetics,1997,15(3):269-72.
[10]Boss O,Samec S,Paoloni-Giacobino A,et al. Uncoupling protein-3:a new member of the mitochondrial carrier family with tissue-specific expression[J].FEBS Letters,1997,408(1):39-42.
[11]Mao WG,Yu XX,Zhong A,et al. UCP-4,a novel brain-specific mitochondrialprotein that reduces membrane potential in mammalian cells[J].FEBSLetters,1999,449(2),293-293.
[12]Yoshitomi H,Yamazaki K,Tanaka I. Cloning of mouseuncoupling protein 3 cDNA and 5′-flanking region,andits genetic map[J].Gene,1998,215(1):77-84.
[13]Raimbault S,Dridi S,Denjean F,et al. An uncoupling protein homologue putatively involved in facultative muscle thermogenesis in birds[J].Biochemical Journal,2001,353(3):441-444.
[14]Sami D,Okanlawon O,Quirine S,et al. Gene expression,tissue distribution and potential physiological role of uncoupling protein in avian species[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2004,139(3):273-283.
[15]Vianna CR,Hagen T,Zhang CY,et al. Cloning and functional characterization of an uncoupling protein homolog in hummingbirds[J].Physiological Genomics,2001,5(3):137-145.
[16]Talbot DA,Duchamp C,Rey B,et al. Uncoupling protein and ATP/ADP carrier increase mitochondrial proton conductance after cold adaptation of king penguins[J].The Journal of Physiology,2004,558(1):123-135.
[17]Collin A,Malheiros RD,Moraes VMB,et al. Effects of dietary macronutrient content on energy metabolism and uncoupling protein mRNA expression in broiler chickens[J].British Journal of Nutrition,2003,90(2):261-269.
[18]Abe T,Mujahid A,Sato K,et al. Possible role of avian uncoupling protein in down-regulating mitochondrial superoxide production in skeletal muscle of fasted chickens[J].FEBS Letters,2006,580(20):4815-4822.
[19]孜拉吉古麗·西克然木,馬紀,庫爾班·吐松,等.小胸鱉甲胞外銅鋅超氧化物歧化酶重組蛋白的原核表達及多克隆抗體制備[J].四川動物,2019,38(4):387-393.
[20]李銘,張志國,胡敏,等.鴿Beclin1基因克隆,原核表達與多克隆抗體制備[J].中國家禽,2018,40(17):19-22.
[21]賈琳琳.王鴿α-Syn基因克隆及AVM急性中毒對其在腦組織中表達的影響[D].哈爾濱:東北農業大學:2011. 25-27.
[22]Ferver A,Dridi S. Regulation of avian uncoupling protein(av-UCP)expression by cytokines and hormonal signals in quail myoblast cells[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2020,248:110747.
[23]Emre Y,Hurtaud C,Ricquier D,et al. Avian UCP:The Killjoy in the Evolution of the Mitochondrial Uncoupling Proteins[J].Journal of Molecular Evolution,2007,65(4):392-402.
[24]Klein A,Margit Kulcsár,Virág Krízsik,et al. Effects of environmental temperature on thyroid hormones in the barn owl(Tyto alba)[J].Acta Veterinaria Hungarica,2006.,54(3):321-331.
[25]Rey B,Roussel D,Romestaing C,et al. Up-regulation of avian uncoupling protein in cold-acclimated and hyperthyroid ducklings prevents reactive oxygen species production by skeletal muscle mitochondria[J].BMC Physiology,2010,10(1):5.
[26]尹珊.豬瘟病毒Erns、NS4A、NS4B、NS5A蛋白的原核表達及多克隆抗體的制備[D].南寧:廣西大學.2013.
[27]賈俊靜,李青,趙彥光,等.調節禽類體內產熱作用的候選基因-禽解偶聯蛋白質基因[J].中國家禽,2003,7(1):118-120.
[28]Walter I,Seebacher F. Endothermy in birds:underlying molecular mechanisms[J].Journal of Experimental Biology,2009,212(15):2328-2336.
[29]李軍.Nanog基因的原核表達、蛋白純化及抗體制備[D].楊凌:西北農林科技大學.2007.
[30]Solanes G,Vidal-Puig A,Grujic D,et al. The human uncouplingprotein-3 gene Genomic structure,chromosomallocalization,and genetic basis for short and long formtranscripts[J].The Journal of Biological Chemistry,1997,272(41):25433-25436.
[31]Yoshitomi H,Yamazaki K,Tanaka I. Cloning of mouseuncoupling protein 3 cDNA and 5′-flanking region,andits genetic map[J].Gene,1998,215(1):77-84.
[32]Wen Z Y,Liang X F,He S,et al. Molecular cloning andtissue expression of uncoupling protein 1,2 and 3 genesin Chinese perch(Siniperca chuatsi)[J].ComparativeBiochemistry and Physiology. Part B,2015,185(3):24-33.
[33]田勇,李國勤,陶爭榮,等.鴿UCP3基因克隆、序列特征及組織表達分析[J].農業生物技術學報,2018,26(11):1938-1948.
(責編:王慧晴)

