保護(hù)液結(jié)合暫養(yǎng)工藝對(duì)花鱸無水活運(yùn)效果的影響
張玉晗,謝 晶
(上海海洋大學(xué)食品學(xué)院,上海水產(chǎn)品加工及貯藏工程技術(shù)研究中心,上海冷鏈裝備性能與節(jié)能評(píng)價(jià)專業(yè)技術(shù)服務(wù)平臺(tái),食品科學(xué)與工程國(guó)家級(jí)實(shí)驗(yàn)教學(xué)示范中心(上海海洋大學(xué)),上海 201306)
花鱸(Lateolabrax maculatus)屬魚綱(Pisces)、鱸形目(Perciforms)、鮨科(Serranidae)、常鱸亞科(Oligorinae)、花鱸屬(Lateolabrax),因其具有生長(zhǎng)快、抗病強(qiáng)、營(yíng)養(yǎng)豐富、味道鮮美特點(diǎn),成為我國(guó)主要的養(yǎng)殖海水魚品種之一。花鱸捕撈后可以通過低溫誘導(dǎo)休眠的方式進(jìn)行無水保活,花鱸生態(tài)冰溫零點(diǎn)溫度(臨界溫度)為4 ℃,經(jīng)低溫?zé)o水保活運(yùn)輸后,恢復(fù)常溫的魚體可回到正常狀態(tài)并存活一段時(shí)間。
VC既是一種具廣泛生理功能的營(yíng)養(yǎng)素,又是一種具免疫作用的免疫調(diào)節(jié)因子,有明顯的抗感染作用,但許多硬骨魚類自身缺少合成VC的酶,必須通過飼料或食物獲得[1-2]。研究表明,花鱸幼魚、大黃魚血清溶菌酶活力隨著VC添加量的增加而升高[2-3]。姜(Zingiber officinale)性味辛、微溫,藥用其根莖,具有調(diào)節(jié)機(jī)體免疫功能的作用[4]。李曉璐等[5]將生姜液運(yùn)用在脆肉鯇的活體運(yùn)輸實(shí)驗(yàn)中,有效地提高了其24 h運(yùn)輸?shù)拇婊盥省H芫甘且环N低分子質(zhì)量、不耐熱的堿性蛋白,作為機(jī)體非特異免疫因子之一,其參與了機(jī)體的多種免疫反應(yīng),在機(jī)體正常防御功能和非特異免疫中具有保持機(jī)體生理平衡的重要作用[6-7]。研究表明溶菌酶的應(yīng)用能極大延長(zhǎng)海產(chǎn)品或水產(chǎn)品的保鮮期,可為貯藏、運(yùn)輸?shù)葞碇T多方便[8]。山梨糖醇分子可提高魚體表保水性,低溫下蛋白酶變性程度低,起到抗凍效果[9]。本實(shí)驗(yàn)嘗試在花鱸暫養(yǎng)、運(yùn)輸過程中加入保護(hù)液,然后進(jìn)行模擬無水活運(yùn),考察采用保護(hù)液的保活新工藝對(duì)花鱸血液生化指標(biāo)、鰓組織Na+/K+-ATPase活性、血清溶菌酶活性、免疫球蛋白M(immunoglobulin M,IgM)水平等魚體非特異性免疫能力指標(biāo)的影響,將保護(hù)液包裝新工藝與傳統(tǒng)濕木屑包裝工藝運(yùn)輸后魚體情況做對(duì)比,為升級(jí)無水活運(yùn)包裝工藝提供參考。
1 材料與方法
1.1 材料與試劑
花鱸魚購自上海蘆潮港水產(chǎn)品市場(chǎng)。挑選體質(zhì)健康、無外傷、鱗片完整、大小基本一致(長(zhǎng)40 cm)的活花鱸魚作為實(shí)驗(yàn)材料。實(shí)驗(yàn)用水:由經(jīng)顆粒活性炭過濾后曝氣的自來水和海鹽配制而成,實(shí)驗(yàn)開始前的1 d配制,連續(xù)曝氣24 h后用于實(shí)驗(yàn)。所制得水的性質(zhì):水溫22~23 ℃、鹽度16‰~17‰、溶解氧4~6 mg/L、pH 7.5~8.5[10]。
溶菌酶、純度98%山梨糖醇(14.7 kDa) 上海生工生物工程有限公司。
1.2 儀器與設(shè)備
LX-100VTR模擬運(yùn)輸振動(dòng)臺(tái) 上海魯軒儀器設(shè)備廠;SH-1000Lab-全波長(zhǎng)酶標(biāo)儀 北京宏昌信科技有限公司;5810R高速冷凍離心機(jī) 上海艾測(cè)電子科技有限公司;BS-200全自動(dòng)生化分析儀 深圳邁瑞生物醫(yī)療電子股份有限公司;乳酸測(cè)定試劑盒、ATP酶試劑盒、溶菌酶測(cè)試盒、IgM測(cè)試盒 南京建成生物工程研究所。
1.3 方法
1.3.1 花鱸魚的暫養(yǎng)
采用周期饑餓馴化花鱸[11],喂食1 d饑餓3 d,兩周期;喂食早晚各一次,投喂魚體質(zhì)量10%飼料;暫養(yǎng)水中加入VC(25、30 mg/L)[12],CK組暫養(yǎng)水中不加VC,暫養(yǎng)密度1 尾/50 L;禁食暫養(yǎng)時(shí)間12 h;先暫養(yǎng)后冷馴化,冷水機(jī)按照3 ℃/h降溫速率將暫養(yǎng)箱中水溫從22~23 ℃降至臨界生態(tài)溫度4 ℃;此時(shí),魚體呼吸頻率(24±3)次/min,呼吸不規(guī)律,魚體失去平衡、魚腹朝上,裂鰓,刺激反應(yīng)遲鈍。
1.3.2 配制保護(hù)液G
保護(hù)液G包括:溶菌酶0.08%~0.10%(質(zhì)量分?jǐn)?shù),下同)、山梨糖醇0.2%~0.4%、生姜液0.6%~1%,鹽度為16‰~17‰,pH 7.5~8.5,剩余為水。
姜液制備[5]:取栽種4 個(gè)月嫩姜洗凈、瀝干,此時(shí)的姜纖維細(xì)、味道微辣,不含較多姜辣素,姜辣素對(duì)花鱸的刺激小;帶皮用榨汁機(jī)榨汁(每千克原料加入約150 mL蒸餾水進(jìn)行混合榨汁),并用200 目紗布過濾,收集姜汁,隔水加熱至沸騰,裝入帶蓋容器,放至常溫,蓋上蓋子冷卻至4 ℃,備用。
1.3.3 魚的處理與運(yùn)輸
將暫養(yǎng)箱中觸摸應(yīng)激反應(yīng)十分微弱的魚撈出,將魚分為6 個(gè)實(shí)驗(yàn)組和CK組,具體見表1,每組樣品30 條,實(shí)驗(yàn)總數(shù)為210 條。CK組不添加保護(hù)液暫養(yǎng)12 h,降溫休眠后撈出,直接裝入帶有濕木屑(木屑事先放入4 ℃、鹽度16‰~17‰、pH 7.5~8.5的水中浸濕)的泡沫箱中。實(shí)驗(yàn)組放入保護(hù)液G中浸漬2~3 s后,按1 條/箱放于泡沫箱內(nèi),注意用保護(hù)液涂抹魚身各部位(包括魚鰓)。然后將兩組魚裝入塑料袋內(nèi)(1 箱/袋),充入氧氣(氧濃度監(jiān)測(cè)儀)80%、扎緊袋口[13],放入振動(dòng)臺(tái)上的大保溫箱內(nèi),保持4 ℃運(yùn)輸溫度。
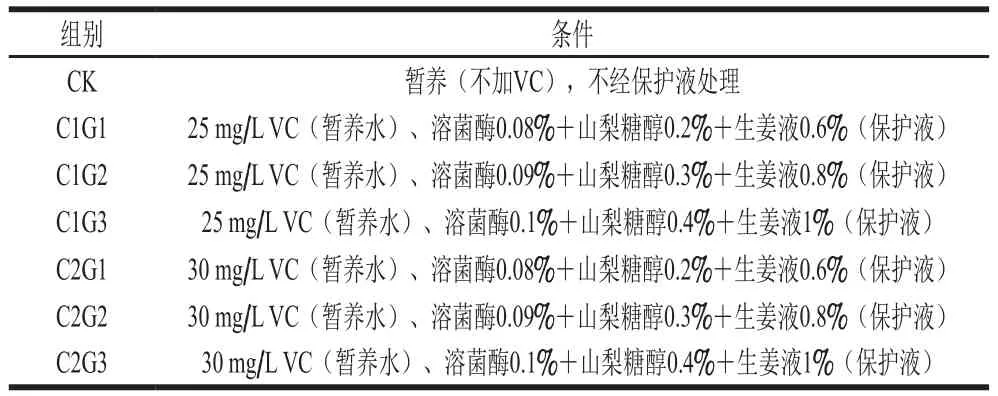
表1 暫養(yǎng)結(jié)合不同濃度保護(hù)液實(shí)驗(yàn)組Table 1 Combinations of temporary culture and protective solutions
在振動(dòng)臺(tái)上進(jìn)行模擬運(yùn)輸實(shí)驗(yàn),運(yùn)輸過程:B級(jí)路面1 h(80 km/h)→A級(jí)路面5 h(100 km/h)→B級(jí)路面2 h(80 km/h)[14-15]。模擬運(yùn)輸結(jié)束后,打開包裝,取出魚,放入養(yǎng)殖水中,以5 ℃/h升溫速率將水溫升至22~23 ℃喚醒(由預(yù)實(shí)驗(yàn)確定),觀察喚醒過程中魚的反應(yīng)并記錄喚醒結(jié)束后死亡率。
花鱸魚生理指標(biāo)檢測(cè)時(shí)間點(diǎn)為:運(yùn)輸開始0 h(暫養(yǎng)結(jié)束,未涂保護(hù)液)和運(yùn)輸1、2 h和8 h(運(yùn)輸結(jié)束時(shí))及喚醒后。每個(gè)測(cè)試點(diǎn)隨機(jī)選取5 條魚進(jìn)行指標(biāo)測(cè)試。
1.3.4 樣品處理
木棒敲擊花鱸致死,稱質(zhì)量并量體長(zhǎng),采用1 mL一次性醫(yī)用注射器(預(yù)先用1 g/100 mL肝素鈉溶液潤(rùn)洗)尾部靜脈取血,采取血樣在4 ℃冰箱放置2 h后,4 ℃、10 000 r/min離心5 min制備血清,血清移入-80 ℃保存?zhèn)溆谩?/p>
魚采血后,取兩側(cè)第二鰓弓的鰓絲,用生理鹽水洗凈吸干水分,用生理鹽水配成10 mg/mL組織均漿,4 ℃、3 000 r/min離心10 min,取上清液-80 ℃保存?zhèn)溆谩?/p>
1.3.5 血液生化指標(biāo)的測(cè)定
總蛋白、白蛋白、尿素、肌酐、尿酸、血糖質(zhì)量濃度采用全自動(dòng)生化分析儀測(cè)定,單位均為g/L。乳酸濃度采用乳酸測(cè)定試劑盒測(cè)定,單位為nmol/L。
1.3.6 組織指標(biāo)測(cè)定
鰓Na+/K+-ATPase活力采用ATP酶試劑盒定,單位為U/mg。
1.3.7 血液非特異性免疫能力指標(biāo)測(cè)定
血清溶菌酶、IgM質(zhì)量濃度分別采用溶菌酶測(cè)試盒、IgM測(cè)試盒測(cè)定。
1.4 數(shù)據(jù)處理與分析
應(yīng)用SPSS 19.0軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析,結(jié)果以 ±s表示,顯著性分析采用Duncan多重比較法,P<0.05表示顯著性差異。
2 結(jié)果與分析
2.1 不同處理對(duì)花鱸無水活運(yùn)過程中血液生化指標(biāo)的影響
2.1.1 不同處理對(duì)花鱸無水活運(yùn)過程中血清總蛋白、白蛋白質(zhì)量濃度的影響
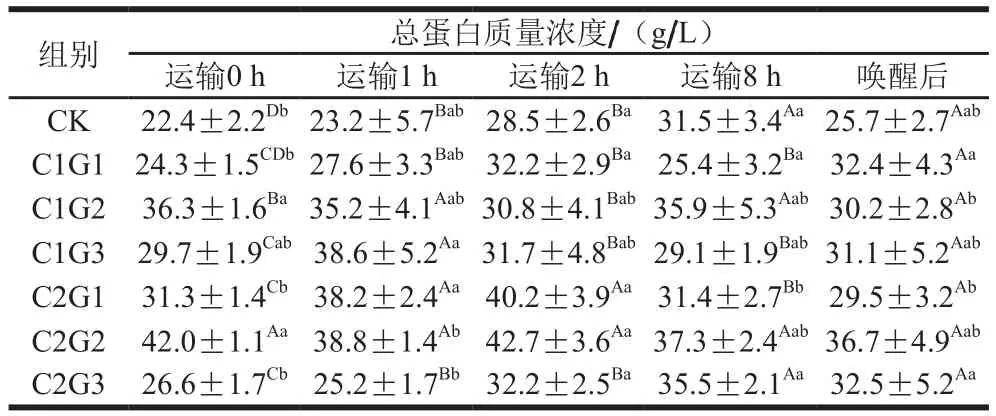
表2 不同處理對(duì)花鱸無水活運(yùn)過程中血清中總蛋白質(zhì)量濃度的影響Table 2 Effects of different treatments on serum total protein concentration during waterless transportation of Lateolabrax maculatus

表3 不同處理對(duì)花鱸無水活運(yùn)過程中血清中白蛋白質(zhì)量濃度的影響Table 3 Effects of different treatments on serum albumin concentration during waterless transportation of Lateolabrax maculatus
在生態(tài)冰溫?zé)o水保活過程中,花鱸血清中的總蛋白、白蛋白質(zhì)量濃度能準(zhǔn)確反映機(jī)體蛋白質(zhì)的吸收與代謝,以及肝功能的代謝情況。白蛋白由肝臟合成,在血液中起著載體的作用,與血液中大部分水分、膽紅素、尿酸、鈣等結(jié)合而進(jìn)行運(yùn)送,與代謝、營(yíng)養(yǎng)關(guān)系密切,當(dāng)長(zhǎng)期處于不良狀態(tài)時(shí),白蛋白含量會(huì)顯著下降[16]。由表2、3可知,運(yùn)輸0 h,CK組花鱸血清中的總蛋白和白蛋白質(zhì)量濃度顯著低于各保護(hù)液處理組(P<0.05),這說明暫養(yǎng)水中加入VC有助于提高花鱸肝功能,降低魚類的應(yīng)激反應(yīng),其中30 mg/L添加量效果明顯。喚醒后與保活過程中相比,半數(shù)以上保護(hù)液使用組花鱸血清中的總蛋白和白蛋白質(zhì)量濃度沒有顯著性差異(P<0.05),表明包裝運(yùn)輸前對(duì)魚身涂抹保護(hù)液可維持花鱸魚體代謝穩(wěn)定。C2G2保護(hù)液使用組花鱸在保活運(yùn)輸過程中血清中的總蛋白和白蛋白質(zhì)量濃度保持穩(wěn)定,且高于其他保護(hù)液處理組。喚醒后,花鱸由于處于無水、缺氧狀態(tài),總蛋白和白蛋白質(zhì)量濃度都顯著下降(P<0.05)。與保活運(yùn)輸8 h后相比,魚體與喚醒后(水中復(fù)蘇后)總蛋白和白蛋白質(zhì)量濃度變化不顯著(P<0.05),表明運(yùn)輸結(jié)束后,魚體肝功能不能在短時(shí)間內(nèi)恢復(fù)正常。
2.1.2 不同處理對(duì)花鱸無水活運(yùn)過程中血清尿素、肌酐、尿酸質(zhì)量濃度的影響

表4 不同處理對(duì)花鱸無水活運(yùn)過程中血清尿素質(zhì)量濃度的影響Table 4 Effects of different treatments on serum urea concentration during waterless transportation of Lateolabrax maculatus

表5 不同處理對(duì)花鱸無水活運(yùn)過程中血清肌酐質(zhì)量濃度的影響Table 5 Effects of different treatments on serum creatinine concentration during waterless transportation of Lateolabrax maculatus

表6 不同處理對(duì)花鱸無水活運(yùn)過程中血清尿酸質(zhì)量濃度的影響Table 6 Effects of different treatments on serum uric acid concentration during waterless transportation of Lateolabrax maculatus
尿素、肌酐、尿酸水平是反映腎功能代謝情況的重要指標(biāo),尿素是氮化合物代謝的產(chǎn)物,也是維持血液滲透壓的主要成分[17]。由表4可看出,CK組血液中尿素水平偏高,使用保護(hù)液之后各使用組的尿素水平顯著下降(P<0.05)。肌酐水平是腎臟機(jī)能的一個(gè)重要指標(biāo),腎臟機(jī)能發(fā)生障礙時(shí),血液中肌酐含量會(huì)升高。由表5可知,除CK、C1G1、C1G2組外,花鱸無水活運(yùn)過程中肌酐水平隨運(yùn)輸時(shí)間延長(zhǎng)而下降,喚醒后有所回升,保活過程中各組肌酐水平有所差異,C2G2保護(hù)液使用組肌酐水平未見明顯上升。腎功能減退時(shí)尿酸質(zhì)量濃度會(huì)升高,表6顯示CK組尿酸水平在保活運(yùn)輸過程中顯著升高(P<0.05),添加保護(hù)液后尿酸水平上升速率減緩,喚醒后回落,C2G2組尿酸水平變化不明顯,說明在保活運(yùn)輸中鰓、腎功能部分受到抑制。CK組血清尿素、肌酐、尿酸水平持續(xù)遞增,運(yùn)輸8 h時(shí)出現(xiàn)最高值,表明隨運(yùn)輸時(shí)間延長(zhǎng)代謝廢物在血液中有積累,長(zhǎng)時(shí)間的無水環(huán)境造成花鱸體內(nèi)代謝廢物無法及時(shí)排出,這是花鱸不能長(zhǎng)時(shí)間無水運(yùn)輸?shù)闹匾蛩刂弧J褂帽Wo(hù)液后,運(yùn)輸過程也會(huì)導(dǎo)致3 個(gè)指標(biāo)數(shù)值有所上升,其中8 h較高,喚醒后有所下調(diào),表明花鱸在低溫?zé)o水條件下保活代謝廢物會(huì)在體內(nèi)累積,并在喚醒后得到改善,但還不能確定魚體是否因此受到不可逆損傷[18]。使用保護(hù)液可有效降低花鱸鰓、腎功能損傷,綜合比較下C2G3組保活效果最好,保護(hù)液在花鱸體表形成一層保護(hù)膜的同時(shí)也有利于魚體將代謝廢物排出,保護(hù)液起到促進(jìn)魚體與外界物質(zhì)交換作用。
2.1.3 不同處理對(duì)花鱸無水活運(yùn)過程中血清中血糖、乳酸水平的影響

表7 不同處理對(duì)花鱸無水活運(yùn)過程中血清血糖質(zhì)量濃度的影響Table 7 Effects of different treatments on serum glucose concentration during waterless transportation of Lateolabrax maculatus

表8 不同處理對(duì)花鱸無水活運(yùn)過程中血清乳酸濃度的影響Table 8 Effects of different treatments on the concentration of lactate in serum during the waterless transport of Lateolabrax maculatus
血糖是魚體生理活動(dòng)所需能量的來源之一。從表7中可看出,CK組血糖質(zhì)量濃度在整個(gè)保活運(yùn)輸0~2 h上升可能是因?yàn)閼?yīng)激反應(yīng);除C2G1、C2G3組外,各處理組運(yùn)輸8 h后喚醒過程中血糖質(zhì)量濃度下降可能是能量消耗造成的,徐中平[19]發(fā)現(xiàn)低溫處理后的星斑川鰈血糖濃度顯著升高。運(yùn)輸0 h時(shí),CK組與各保護(hù)液使用組相比血糖質(zhì)量濃度差異不顯著(P>0.05),這表明暫養(yǎng)過程中添加VC對(duì)花鱸血糖水平影響不大。使用保護(hù)液后,運(yùn)輸1 h與0 h相比,血糖水平降低,運(yùn)輸時(shí)間延長(zhǎng)血糖水平還是會(huì)出現(xiàn)因積累顯示較高水平,使用保護(hù)液已經(jīng)很大程度降低了花鱸運(yùn)輸應(yīng)激。
乳酸是葡萄糖在無氧條件下發(fā)生酵解提供能量時(shí)的產(chǎn)物,肌肉產(chǎn)生的乳酸大部分會(huì)進(jìn)入血液,而乳酸濃度增加會(huì)對(duì)血液中血紅蛋白運(yùn)輸氧的能力產(chǎn)生影響,導(dǎo)致血液最大氧結(jié)合量減少。從表8可以看出,各處理組血清中乳酸濃度在運(yùn)輸2 h內(nèi)顯著上升(P<0.05),血液中血糖濃度上升進(jìn)而造成了肌肉乳酸濃度上升,導(dǎo)致魚體供氧量減少。此結(jié)果與戴志遠(yuǎn)等[20]研究的紫貽貝無水保活過程中乳酸濃度變化一致,這可能也是限制保活時(shí)間進(jìn)一步延長(zhǎng)的重要因素之一。與CK組相比,各保活液處理組在運(yùn)輸8 h時(shí)乳酸積聚量減少。運(yùn)輸0 h,CK組與各保護(hù)液使用組相比乳酸濃度差異不顯著(P>0.05),說明暫養(yǎng)過程中VC添加量對(duì)花鱸血清中乳酸濃度的影響也不明顯。
2.2 不同處理對(duì)花鱸無水活運(yùn)過程中鰓組織指標(biāo)的影響
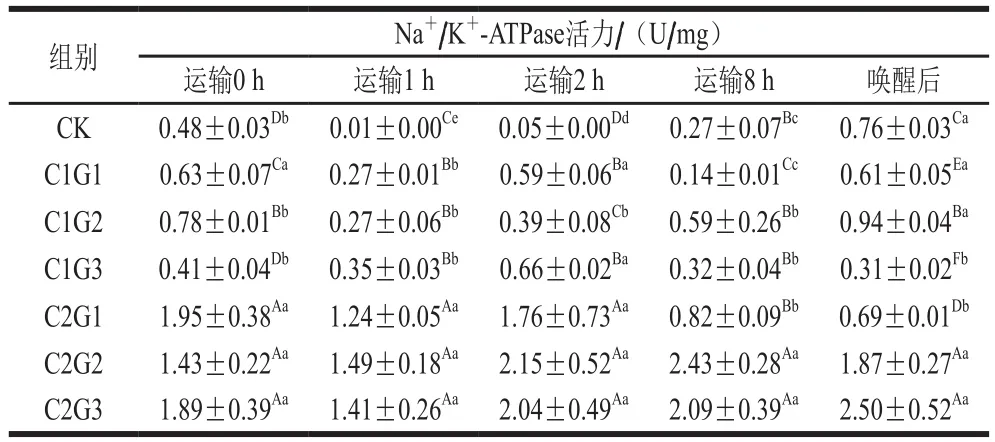
表9 不同處理組對(duì)花鱸無水活運(yùn)過程中鰓組織Na+ /K+-ATPase活力的影響Table 9 Effects of different treatments on gill NKA activity during waterless transportation of Lateolabrax maculatus
Na+/K+-ATPase的主要生物學(xué)意義在于其為逆濃度差和電位差轉(zhuǎn)運(yùn)物質(zhì),即一旦膜上的離子通道開放,Na+、K+會(huì)迅速順濃度差跨膜擴(kuò)散[21-22]。由表9可知,運(yùn)輸0 h,暫養(yǎng)水中加入VC顯著提高了鰓組織細(xì)胞中的Na+/K+-ATPase活力(P<0.05),且隨VC添加量增加而增加,可能是因?yàn)閂C提高了花鱸的抗氧化酶活性,減少了花鱸低溫條件下的氧化應(yīng)激。孔祥會(huì)等[23]低溫馴化鋸緣青蟹并研究發(fā)現(xiàn)其抗氧化防護(hù)與ATPase活性有關(guān)系。運(yùn)輸過程中,使用保護(hù)液維持了魚鰓絲細(xì)胞內(nèi)Na+/K+-ATPase的活性[24],完成正常的離子轉(zhuǎn)運(yùn)。C2G2組鰓Na+/K+-ATPase活力最強(qiáng),因而可以更好地維持細(xì)胞內(nèi)外離子水平的穩(wěn)定性,使鰓細(xì)胞得以保持正常生理功能。
2.3 保活過程中花鱸非特異性免疫指標(biāo)的分析
2.3.1 不同處理對(duì)花鱸無水活運(yùn)過程中血清中溶菌酶水平的影響
溶菌酶是生物體內(nèi)非特異性免疫防御體系中具有廣譜抗菌作用的堿性酶,具有抗菌、消炎、抗病毒等作用[25]。溶菌酶廣泛分布于魚體的黏液、血清和某些淋巴組織中,是魚類非特異性免疫系統(tǒng)的重要組成部分[26]。生態(tài)冰溫?zé)o水活運(yùn)過程中花鱸持續(xù)處于低溫環(huán)境下。不同學(xué)者在對(duì)羅非魚進(jìn)行低溫馴化研究中認(rèn)為在低溫環(huán)境下非特異性免疫占有主導(dǎo)地位[27-29]。由表10可知,CK組血清中溶菌酶質(zhì)量濃度明顯較低,說明在暫養(yǎng)水中添加VC可以明顯提高花鱸血清中溶菌酶活力,但降溫處理還是造成了所有處理組過低的溶菌酶活力,保護(hù)液使用組血清溶菌酶質(zhì)量濃度隨運(yùn)輸時(shí)間的延長(zhǎng)不再下降,反而明顯升高。一方面可能是因?yàn)楸Wo(hù)液中加入了溶菌酶,一定程度上補(bǔ)足了環(huán)境因素造成的溶菌酶消耗;另一方面可能是因?yàn)楸Wo(hù)液中添加了生姜液,生姜可激活單核細(xì)胞的分泌功能,使溶菌酶大量釋放,促使溶菌酶質(zhì)量濃度增高。研究表明生姜液可使小鼠血清溶菌酶活性顯著增高,但不同劑量引起溶菌酶活性變化的程度有所不同[30]。運(yùn)輸8 h時(shí)C2G2組溶菌酶活力最高,為CK組7.68 倍,運(yùn)輸8 h喚醒后,花鱸血清中溶菌酶質(zhì)量濃度維持較高水平,這可能是由于水溫的升高提升了溶菌酶活力。
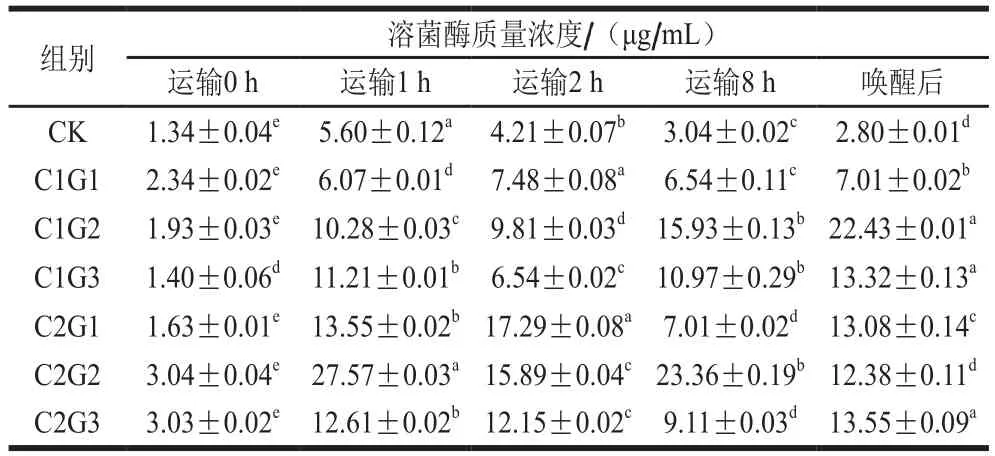
表10 不同處理組對(duì)花鱸無水活運(yùn)過程中血清溶菌酶質(zhì)量濃度的影響Table 10 Effects of different treatments on serum lysozyme concentration during waterless transportation of Lateolabrax maculatus
2.3.2 不同處理對(duì)花鱸無水活運(yùn)過程中血清中IgM水平的影響
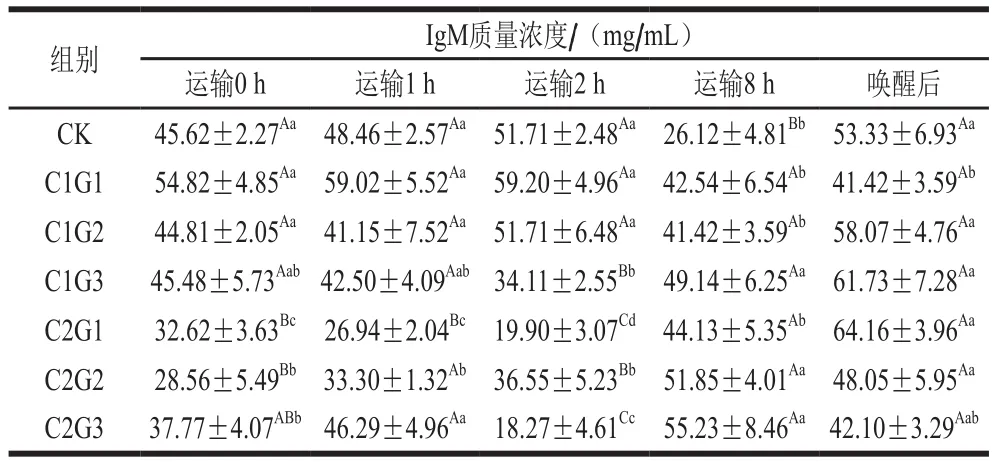
表11 不同處理組對(duì)花鱸無水活運(yùn)過程中血清IgM質(zhì)量濃度的影響Table 11 Effects of different treatments on serum IgM concentration during waterless transportation of Lateolabrax maculatus
IgM是硬骨魚體內(nèi)一種重要免疫球蛋白,因此IgM質(zhì)量濃度通常被認(rèn)定為是評(píng)價(jià)魚體免疫應(yīng)答反應(yīng)的重要指標(biāo)[31]。由表11可見,溫度對(duì)魚類免疫系統(tǒng)的影響非常復(fù)雜,有學(xué)者認(rèn)為低溫可以減慢代謝循環(huán)因而抑制或延遲抗體的釋放[29]。花鱸低溫?zé)o水活運(yùn)過程全程處于低溫環(huán)境,可能導(dǎo)致了IgM質(zhì)量濃度降低。侯亞義等[32]報(bào)道了虹鱒血漿中IgM的濃度是溫度依賴型的,即高溫時(shí)它們的濃度升高,反之濃度降低。運(yùn)輸0 h(暫養(yǎng)結(jié)束未涂抹保護(hù)液),IgM質(zhì)量濃度隨暫養(yǎng)水中VC添加量的升高而降低,VC可增強(qiáng)魚體免疫應(yīng)答耐受性。使用保護(hù)液一定程度上可增強(qiáng)花鱸細(xì)胞免疫功能和機(jī)體抗感染能力。
2.4 經(jīng)不同處理的花鱸無水活運(yùn)結(jié)束后的死亡率
將生態(tài)冰溫?zé)o水活運(yùn)后的花鱸放入4 ℃水中以5 ℃/h速率升溫至22~23 ℃喚醒,可以觀察到魚尾擺動(dòng)幅度越來越大,魚鰓開始不規(guī)律地開閉,呼吸頻率越來越大,逐漸接近正常水平,魚體恢復(fù)正常的游動(dòng)。

表12 不同處理對(duì)花鱸無水活運(yùn)結(jié)束后死亡率的影響Table 12 Effect of different treatments on mortality after waterless transportation of Lateolabrax maculatus
如表12所示,花鱸常溫水中喚醒后8 h各組均出現(xiàn)死魚現(xiàn)象,且隨著時(shí)間的延長(zhǎng),花鱸死亡率不斷升高。這是因?yàn)榛|經(jīng)過降溫、包裝、運(yùn)輸、喚醒過程中的應(yīng)激,體內(nèi)能量不足,免疫系統(tǒng)紊亂。暫養(yǎng)水中加入VC可以增強(qiáng)花鱸免疫機(jī)能,又具有抗感染作用。保護(hù)液中的生姜、溶菌酶、山梨糖醇具有保持機(jī)體生理平衡、抗應(yīng)激、抗凍的作用。研究加入保護(hù)液后花鱸死亡率呈下降趨勢(shì),且劑量越高效果越明顯。喚醒結(jié)束后1 d死亡率數(shù)據(jù)表明,運(yùn)輸期間使用保護(hù)液能延長(zhǎng)花鱸運(yùn)輸后存活時(shí)間,為商業(yè)銷售提供時(shí)間保障。
3 結(jié) 論
花鱸通過低溫誘導(dǎo)休眠的方式進(jìn)行無水保活,禁食暫養(yǎng)12 h后冷馴化至臨界冰溫4 ℃,包裝后振動(dòng)臺(tái)模擬無水保活時(shí)間可達(dá)到8 h,以5 ℃/h速率升水溫至22~23 ℃喚醒后魚體可回到正常狀態(tài)并存活一段時(shí)間。現(xiàn)有的包裝運(yùn)輸技術(shù)花鱸喚醒1 d之內(nèi)的死亡率高,并沒有為保活運(yùn)輸后的銷售爭(zhēng)取時(shí)間。本實(shí)驗(yàn)研究以保護(hù)液包裝取代現(xiàn)的濕木屑包裝,可節(jié)省更多運(yùn)輸空間,提高花鱸無水活運(yùn)效果,花鱸無水活運(yùn)后死亡率降低了1%~5%,延長(zhǎng)了銷售期,可獲得更高的經(jīng)濟(jì)效益。
研究結(jié)果表明,無水保活花鱸魚暫養(yǎng)水中加入30 mg/L VC,暫養(yǎng)12 h,冷馴化后包裝前浸入G2(溶菌酶0.09%+山梨糖醇0.3%+生姜液0.08%)保護(hù)液中涂抹,取出后獨(dú)立包裝進(jìn)行無水活運(yùn)效果最好。保護(hù)液中的生姜可使花鱸血清溶菌酶質(zhì)量濃度顯著增高,保護(hù)液中不同生姜?jiǎng)┝靠梢鹑芫富钚宰兓某潭炔煌吼B(yǎng)和運(yùn)輸過程中加入保護(hù)液可增強(qiáng)花鱸肝、腎功能及能量代謝,維持鰓組織正常離子運(yùn)轉(zhuǎn),一定程度上可增強(qiáng)花鱸細(xì)胞免疫功能和機(jī)體抗感染能力。

