染料木素通過TIPE 2負性調控Akt活性促進脂多糖活化的巨噬細胞凋亡
劉素娟,叢 麗,張 勇,向麗萍,謝小林,柏萍娟,向雪萍,符曉華
(湖南師范大學,小分子靶向藥物研究與創制實驗室,湖南 長沙 410013)
動脈粥樣硬化是一種以脂質堆積和動脈管壁慢性炎癥為特征的疾病,巨噬細胞在動脈粥樣硬化發生發展中扮演重要角色。研究顯示[1],促進早期活化巨噬細胞凋亡,可以降低細胞密度,減少病變面積,有效抑制動脈粥樣硬化的早期進展。染料木素(genistein,GEN)是一類富含于豆類植物中的異黃酮類化合物,既是一種植物雌激素,又是天然的酪氨酸激酶抑制劑,具有藥源豐富、毒副作用小等優點,在抗腫瘤、抗氧化和保護心血管等方面具有藥理活性。課題組前期體內、體外研究證實,GEN及其新型合成類似物能夠調控炎癥信號通路,抑制動脈粥樣硬化[2-3]。本實驗以脂多糖(lipopolysaccharides,LPS)活化的RAW264.7細胞為受試對象,探討GEN對活化巨噬細胞外源性凋亡途徑的影響,為其防治動脈粥樣硬化提供實驗依據。
1 材料與方法
1.1 材料
1.1.1細胞培養 RAW264.7細胞購于中國科學院細胞庫(上海),置于37 ℃、5% CO2培養箱中,以含10%胎牛血清和1%鏈霉素/青霉素的高糖DMEM培養基培養,待細胞處于對數生長期時開始實驗。將RAW264.7細胞接種于12孔板(5×107·L-1),貼壁后,依據慢病毒感染說明書分別加入表達綠色熒光蛋白的腫瘤壞死因子α誘導蛋白8樣分子2(tumor necrosis factor-α-induced protein 8-like 2,TIPE 2)對照和TIPE 2過表達慢病毒顆粒。
1.1.2試劑與抗體 GEN(446-72-0),Sigma公司,純度≥98%;LPS(L8880),Solarbio公司,純度≥99%;高糖DMEM培養基、胎牛血清、磷酸鹽緩沖液(phosphate buffered saline,PBS)、鏈霉素/青霉素(03-034-1B),BI公司;CCK 8試劑盒、Annexin V-FITC/PI試劑盒、TRIzol、AceQ qPCR SYBR Green Master Mix、HiScript Ⅱ Q RT SuperMix for qPCR、GAPDH抗體,Vazyme公司;COX-2、iNOS、TIPE 2抗體,Affinity公司;caspase-8、caspase-3、Akt、p-Akt抗體,ImmunoWay公司;兔IgG、鼠IgG,ComWin Biotech公司;β-actin抗體,CMCTAG公司;RIPA細胞裂解液、BCA蛋白濃度測定試劑盒,Beyotime公司;慢病毒顆粒,Genechem公司。
1.1.3儀器 二氧化碳培養箱(美國Thermo,3131),多功能酶標儀(美國Bio-Tek,Synergy 2),流式細胞儀(美國BD,FACS Cantoll 488N),熒光顯微鏡(日本Olympus,IX51)、倒置相差顯微鏡(日本Olympus,VMD-P300B),高速冷凍離心機(德國Eppendorf,5404C),電泳槽、電轉膜儀(美國Bio-Rad,552BR)、熒光定量PCR儀(美國Bio-Rad,CFX Connect),化學發光凝膠成像系統(上海天能科技有限公司,Tanon-5500)。
1.2 方法
1.2.1CCK8檢測細胞活力 制備單細胞懸液(5×107·L-1),接種于96孔板(100 μL/孔),待細胞貼壁后,加入10 μmol·L-1GEN預孵育2 h,再用1 mg·L-1LPS處理24 h。吸棄上清,PBS洗2遍,每孔加入10 μL CCK 8試劑和90 μL完全培養基,輕搖混勻,置于培養箱內孵育2 h。設置空白孔、對照孔,每組3個復孔,使用多功能酶標儀檢測各孔在450 nm處的OD值。細胞活力/%=(處理孔-空白孔)/(對照孔-空白孔)×100%。
1.2.2Annexin V-FITC/PI檢測細胞凋亡 制備單細胞懸液(5×107·L-1),接種于12孔板(1 mL/孔),待細胞貼壁后,10 μmol·L-1GEN預孵育2 h,再用1 mg·L-1LPS孵育24 h后加藥處理。胰酶(不含EDTA)消化后,收集細胞至離心管(800 r·min-1,7 min離心),PBS洗2遍,加入100 μL結合緩沖液重懸細胞,將細胞密度調整至3×105·mL-1,取195 μL細胞懸液加入5 μL Annexin V-FITC,混勻后室溫避光孵育10 min;用200 μL結合緩沖液洗滌細胞(800 r·min-1,7 min);再用190 μL結合緩沖液重懸細胞,加入5 μL碘化丙啶溶液,輕輕混勻后上流式細胞儀檢測細胞凋亡率。
1.2.3qRT-PCR 采用TRIzol法提取總RNA,多功能酶標儀檢測RNA純度和濃度,依據HiScript? Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)逆轉錄試劑說明書合成cDNA,采用AceQ?qPCR SYBR?Green Master Mix試劑盒進行相對熒光定量檢測,以2-△△Ct法分析基因表達。引物序列見Tab 1。

Tab 1 Sequences of primer
1.2.4Western blot 使用預冷的PBS洗細胞3遍,加入細胞裂解液于冰上裂解10 min并離心(12 000×g,4 ℃,10 min),提取總蛋白,BCA試劑盒測定蛋白濃度。取40 μg樣品,于10% SDS-PAGE凝膠中電泳;將蛋白轉移至PVDF膜(polyvinylidene fluoride membranes,PVDF)上;在5%脫脂牛奶中室溫封閉1 h,TBST(TBS包含0.05% Tween-20)洗3遍;加入一抗4 ℃孵育過夜,抗體稀釋比為iNOS(1 ∶2 000)、COX-2(1 ∶2 000)、caspase-8(1 ∶1 000)、caspase-3(1 ∶1 000)、TIPE 2(1 ∶1 000)、Akt(1 ∶1 000)、p-Akt(1 ∶1 000)、β-actin(1 ∶10 000)、GAPDH(1 ∶10 000),TBST洗3遍;加入二抗室溫孵育1 h,抗體稀釋比為羊抗兔(1 ∶10 000)、羊抗鼠(1 ∶10 000),TBST洗3遍,ECL化學發光顯影,凝膠成像系統檢測蛋白表達水平。
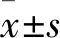
2 結果
2.1 GEN促進LPS活化的RAW264.7細胞凋亡
2.1.1制備LPS活化RAW264.7細胞模型 與對照組相比,1 mg·L-1LPS組TNF-α、IL-6 mRNA(P<0.05,Fig 1 A)和iNOS、COX-2蛋白表達(Fig 1 B)均上調,說明LPS能夠活化RAW264.7細胞用于后續實驗。
2.1.2GEN降低活化RAW264.7細胞活力 如Fig 2所示,與對照組相比,LPS組細胞活力明顯增強(P<0.05);與LPS組相比,GEN+LPS組細胞活力明顯減弱(P<0.05)。
2.1.3GEN促進活化RAW264.7細胞凋亡 如Fig 3A所示,對照組、LPS組、GEN+LPS組細胞凋亡率依次為0.120±0.75、0.007±1.06、0.243±0.96。如Fig 3B、C所示,與對照組相比,LPS組caspase-8和caspase-3 mRNA及蛋白表達均減少;與LPS組相比,GEN+LPS組caspase-8和caspase-3 mRNA及蛋白表達均增多。

Fig 1 Effects of LPS on inflammatory mediators
2.2 GEN上調活化RAW264.7細胞TIPE 2表達如Fig 4所示,與對照組相比,LPS組TIPE 2 mRNA和蛋白表達均減少;與LPS組相比,GEN+LPS組TIPE 2表達增多。
2.3 GEN上調TIPE 2減少AKT磷酸化,促進活化RAW264.7細胞凋亡

Fig 2 Effects of GEN on viability
2.3.1慢病毒載體成功感染RAW264.7細胞 分別將TIPE 2對照和TIPE 2過表達慢病毒顆粒感染至RAW264.7細胞,72 h后熒光顯微鏡觀察感染效率在90%以上(Fig 5 A);與TIPE 2對照組相比,TIPE 2過表達組TIPE 2 mRNA和蛋白表達均上調(Fig 5 B),證實慢病毒已感染目的細胞,并上調TIPE 2表達,可用于后續實驗。

Fig 3 Effects of GEN on apoptosis of activated RAW264.7

Fig 4 Effects of GEN on TIPE 2

Fig 5 RAW264.7 cells infected by lentiviral vector
2.3.2TIPE 2增強GEN促進活化RAW264.7細胞凋亡的作用 如Fig 6所示,與TIPE 2對照+LPS組相比,TIPE 2對照+GEN+LPS組和TIPE 2過表達+LPS組caspase-8、caspase-3 mRNA和蛋白表達均上調;與TIPE 2對照+GEN+LPS組相比,TIPE 2過表達+GEN+LPS組caspase-8、caspase-3 mRNA和蛋白表達均上調。
2.3.3GEN和TIPE 2抑制活化RAW264.7細胞Akt磷酸化 如Fig 7所示,與TIPE 2對照+LPS組相比,TIPE 2對照+GEN+LPS組和TIPE 2過表達+LPS組p-Akt蛋白表達下調,Akt蛋白表達無明顯改變;與TIPE 2對照+GEN+LPS組相比,TIPE 2過表達+GEN+LPS組p-Akt蛋白表達下調,Akt蛋白表達無明顯變化。
3 討論
巨噬細胞在動脈粥樣硬化各發展階段都發揮重要作用,從病變起始到斑塊破裂和心血管臨床事件的發生。促進活化巨噬細胞凋亡不僅可以抑制炎癥因子的釋放,還可以減少巨噬細胞源性泡沫細胞的形成,抑制動脈粥樣硬化早期斑塊的發生[4]。LPS是革蘭氏陰性細菌外膜的主要成分,通過與模式識別受體TLR4(toll-like receptor 4,TLR4)結合形成復合物,激活巨噬細胞;還可以增強血管炎癥介質釋放,促進動脈粥樣硬化發展[5]。基于此,本研究擬通過LPS活化RAW264.7細胞模型,針對影響活化巨噬細胞凋亡的分子機制,探討防治動脈粥樣硬化的策略。結果顯示,1 mg·L-1LPS孵育RAW264.7細胞24 h,可以促進TNF-α、IL-6、COX-2和iNOS的合成,證實了LPS能夠活化巨噬細胞,符合文獻報道。
凋亡是由基因控制的細胞程序性死亡,涉及凋亡蛋白的激活、表達及調控,目前主要有3條細胞凋亡途徑,分別為內質網通路、線粒體通路和死亡受體通路。Fas相關死亡結構域蛋白(fas-associated protein with death domain,FADD)與受體結合后,誘導蛋白質構像改變,暴露死亡域,結合caspase-8形成死亡誘導信號復合物,激活外源性細胞凋亡途徑[6]。caspase-3位于執行性凋亡蛋白的最下游,在細胞凋亡中必不可少。文獻報道,蛇床子素可以通過調控PI3K/Akt/Bcl-2激活線粒體凋亡途徑誘導外陰癌細胞凋亡,抑制癌細胞增殖[7]。向麗萍等[8]研究證實,GEN能夠調控miR-21表達,上調CHOP和caspase-3,激活內質網凋亡途徑,促進活化巨噬細胞凋亡。課題組前期研究表明,10 μmol·L-1GEN預孵育RAW264.7細胞2 h能夠促進活化巨噬細胞凋亡[8],故我們采用10 μmol·L-1GEN作用于RAW264.7細胞開展后續實驗。本研究顯示,GEN可以降低活化巨噬細胞活力,增加凋亡率,并上調caspase-8和caspase-3蛋白表達。這些結果提示,GEN通過外源性凋亡途徑促進活化巨噬細胞凋亡可能是其發揮藥理作用的機制之一。
TIPE 2是一種先天免疫的負調控因子,在免疫細胞和免疫器官中均表達豐富,可以作為炎性疾病的藥物作用靶標,既能夠抑制T細胞受體和Toll樣受體介導的細胞活化,又能夠直接結合caspase-8,促進Fas介導細胞凋亡[9]。Lou等[10]研究顯示,氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)通過下調TIPE 2表達促進動脈粥樣硬化,而TIPE 2能夠調節巨噬細胞對ox-LDL的反應。Zhang等[11]研究表明,TIPE 2調控p38和ERK1/2激酶信號,抑制血管平滑肌細胞表型轉換與增殖,并抑制小鼠頸動脈新生內膜的形成。本實驗結果顯示,GEN上調活化巨噬細胞TIPE 2表達,而過表達TIPE 2能夠促進活化巨噬細胞凋亡,并與GEN具有協同作用。這表明,GEN可能通過上調TIPE 2表達促進活化巨噬細胞凋亡。

Fig 6 Effects of TIPE 2-overexpression on apoptosis of activated RAW264.7 cells promoted by

Fig 7 Effects of GEN and TIPE 2 on activity of Akt in activated RAW264.7 cells
Akt是一種絲氨酸/蘇氨酸蛋白激酶,通過多個胞外、胞內信號,產生促炎和抗炎細胞因子及吞噬、自噬和凋亡作用,在巨噬細胞生物學和炎性疾病中發揮重要功能。涂獻坤等[12]研究表明,丙泊酚可以調節PI3K/Akt信號通路促進神經細胞存活,從而減輕大鼠腦缺血性損傷。另有文獻報道,GEN可以調控PI3K-Akt信號通路發揮抗氧化作用,而TIPE 2缺乏將激活Akt,抑制細胞死亡,促進遷移[13-14]。本研究結果顯示,過表達TIPE 2抑制活化巨噬細胞Akt磷酸化,且與GEN具有協同作用,這表明GEN對活化巨噬細胞Akt活性的抑制與TIPE 2表達改變有關。
綜上所述,我們的研究表明,GEN可能通過上調TIPE 2表達,抑制LPS誘導的RAW264.7細胞Akt磷酸化,進而激活外源性凋亡通路,促使活化巨噬細胞凋亡。調控TIPE 2表達及Akt磷酸化對研究GEN防治動脈粥樣硬化具有指導意義,但GEN可能是一種涉及多種藥理學作用機制的天然化合物,其促進活化巨噬細胞凋亡的機制仍需進一步研究。
(致謝:本實驗在湖南師范大學小分子靶向藥物研究與創制實驗室完成,衷心感謝各位老師及同學對本實驗的指導和幫助。)

