微血管張力測定技術(shù)在血管內(nèi)皮去除中的應(yīng)用
張文文,唐 娜,孫瑞霞,鐘 華,何 芳
(1.新疆石河子大學(xué)第一附屬醫(yī)院重癥醫(yī)學(xué)科,新疆 石河子 832002;2. 新疆石河子大學(xué)醫(yī)學(xué)院病理生理教研室,新疆地方與民族高發(fā)病教育部重點(diǎn)實(shí)驗(yàn)室,新疆 石河子 832002)
高血壓是全球范圍內(nèi)影響人類健康最常見的心腦血管病之一,已成為目前重大的公共衛(wèi)生問題。其患病率居高不下,且呈持續(xù)上升的趨勢[1],目前我國高血壓控制現(xiàn)狀低于發(fā)達(dá)國家,因此,我國高血壓防治任重而道遠(yuǎn)。
已知長期過高的血壓導(dǎo)致血管內(nèi)皮功能障礙,而血管內(nèi)皮功能障礙與心腦血管疾病也緊密相關(guān),是其發(fā)生發(fā)展的病變基礎(chǔ),因此改善血管內(nèi)皮功能已成為心腦血管疾病治療的關(guān)鍵靶點(diǎn)[2]。
目前,關(guān)于微血管測量技術(shù)在疾病研究中應(yīng)用的報(bào)道逐年增多,但是由于該技術(shù)操作步驟復(fù)雜、費(fèi)時(shí),限制了該技術(shù)在國內(nèi)的應(yīng)用普及[3]。尤其對于血管內(nèi)皮功能障礙的研究,國內(nèi)尚無統(tǒng)一的標(biāo)準(zhǔn);已有關(guān)于血管內(nèi)皮去除方式的研究,存在大小動脈相互混淆的現(xiàn)象,并不完全適用于所有微動脈的研究。而筆者對微血管壓力肌動血管內(nèi)皮的去除所作的研究匯報(bào),有助于血管內(nèi)皮去除的標(biāo)準(zhǔn)化,提高微血管測量技術(shù)研究數(shù)據(jù)的可信度。
1 材料
1.1 實(shí)驗(yàn)動物12周齡 ♂ ,體質(zhì)量(200~250)g,自發(fā)性高血壓大鼠(spontaneous hypertensive rats,SHR)和正常血壓大鼠(Wistar-Kyoto rats,WKY),每組各6只,購自北京維通利華實(shí)驗(yàn)動物技術(shù)有限公司(動物合格許可證編號SCXK(京)2007-0001),符合SPF清潔級標(biāo)準(zhǔn)。飼養(yǎng)條件:溫度(20±2) ℃、濕度(48±2)%。大鼠分籠飼養(yǎng),飼養(yǎng)期間,大鼠自主飲食,自由飲水。適應(yīng)性飼養(yǎng)1周后開始實(shí)驗(yàn),所有實(shí)驗(yàn)均在符合動物實(shí)驗(yàn)倫理要求下進(jìn)行。
1.2 實(shí)驗(yàn)試劑及配制苯腎上腺素(phenylephrine,PE,批號:LRAA9501)、硝普鈉(sodium nitroprusside,SNP,批號:LRAA2556)、吲哚美辛(indomethacin,批號:WXBC4210V)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA,批號:0915S04)均購自美國Sigma公司;乙酰膽堿(acetylcholine,ACh,批號:BCBR3675V)購自美國APexbio公司;L-NAME(批號:S287702)購自美國Selleck公司;其余試劑均為國產(chǎn)分析純。
溶液配制:生理鹽溶液(physiologic saltsolution, PSS)成分(mmol·L-1):NaCl 118.9, KCl 4.69,MgSO4·7H2O 1.17,KH2PO41.18,CaCl22.5, NaHCO325,EDTA 0.026,G 5.5。高鉀外液(high potassium physiological salt solution,KPSS,相當(dāng)于60 mmol·L-1KCl)成分(mmol·L-1):KCl 123. 70,MgSO4·7H2O 1. 17,KH2PO41. 18,CaCl22. 5,NaHCO325,EDTA 0.026,G 5.5。充分搖勻溶解后,充入混合氣體(95%O2+5%CO2),氧飽和10~15 min,時(shí)間過久易致液體中氣體過多,最后粘附于血管上,pH調(diào)節(jié)至7.40后使用。所配置的液體均放置在冰箱(4 ℃)中保存,使用前充分搖勻。
1.3 儀器壓力肌動圖系統(tǒng)(DMT,110P型)(丹麥Denmark公司)、倒置相差顯微鏡(美國Olympus公司)、光學(xué)顯微鏡(日本Olympus公司)、P-97微電極拉制儀(美國Sutter公司)、微型負(fù)壓吸引器(GL-802型)(海門市其林貝爾儀器制造有限公司)、撕囊鑷和角膜剪(蘇州六六視覺科技有限公司)、Dumont鑷子(意大利)等。
2 方法
2.1 大鼠血壓測量使用BP-6鼠尾無創(chuàng)血壓測量儀檢測大鼠清醒安靜狀態(tài)下尾動脈血壓,每只不少于3次,結(jié)果取平均值。
2.2 標(biāo)本制備大鼠腹腔注射戊巴比妥鈉 40 mg·kg-1,待動物麻醉后斷頭處死,迅速取出腸管,注意:誤用力牽拉腸管,置于4 ℃、氧飽和的PSS液中。在裝有固定膠的培養(yǎng)皿中固定標(biāo)本,注意:固定時(shí)不宜過度牽拉。在顯微鏡下仔細(xì)分離2級腸系膜動脈血管分支,注意區(qū)分動靜脈(動脈細(xì)、圓,彈性好,色淺;靜脈扁、寬,彈性差,色深)。仔細(xì)清除動脈周圍脂肪、結(jié)締組織,注意手法一定要輕柔,勿用力牽拉血管,碰觸血管,避免損傷血管內(nèi)皮,降低血管活性。剪取無分支的血管段(長度2~3 mm)備用。
2.3 血管套接及血管內(nèi)皮去除(Fig 1) 首先,排空微電極兩端的氣體,將血管一端套接在玻璃微電極上(直徑約50 μm),注意誤碰及玻璃微電極尖端,防止電極斷裂或電極玻璃碎渣進(jìn)入血管,平衡升壓階段,隨壓力升高,液體流動,劃破血管,致數(shù)據(jù)不準(zhǔn)或?qū)嶒?yàn)失敗。用10-0眼科尼龍線固定血管。用裝有過濾PSS液注射器緩慢沖走血管內(nèi)的殘留物,注意手法要輕,誤用力過猛,損傷血管內(nèi)皮。而微血管內(nèi)皮去除,國內(nèi)目前尚未見標(biāo)準(zhǔn)的方法。本研究方法其實(shí)施步驟如下:對于去除內(nèi)皮的血管環(huán),用撕囊鑷夾取血管的無需測量部分,將血管圍繞電極尖端輕輕旋轉(zhuǎn)1圈[4],破壞血管內(nèi)皮的完整性,注意:手法要輕,誤刺穿血管。然后血管一端套接完成后,用注射器向血管內(nèi)推注氣體,再次破壞血管內(nèi)皮完整性。之后用裝有過濾PSS液的注射器緩慢沖洗血管,以相同的方法套接血管的另一端。給予血管活性藥物之前,先給予吲哚美辛(環(huán)氧合酶抑制劑)、L-NAME(NO合酶抑制劑)共同預(yù)孵育血管20 min,且其持續(xù)存在于整個(gè)實(shí)驗(yàn)過程[5]。將血管固定好的灌流槽迅速轉(zhuǎn)移至倒置顯微鏡臺上,開啟光學(xué)顯微鏡,調(diào)整放大倍數(shù)為10 (物鏡)×10 (目鏡)。將與電極兩端相連的玻璃瓶蓋用力旋緊,使其形成一個(gè)密封系統(tǒng)。接著進(jìn)行管路氣體的排除,用裝有5 ml過濾PSS液的注射器將P1端管路里的氣體排至裝有過濾PSS液(100 mL)的玻璃瓶中,P2端管路里氣體排至廢液瓶中,整體形成一個(gè)液封狀態(tài),確保整個(gè)循環(huán)中無殘留氣體,以防氣體流動至血管腔中,造成血管損傷。操作期間注意手法要輕緩,步驟要清晰,以免損壞壓力換能器。在恒溫(37 ℃)的水浴槽中持續(xù)恒速通以(95% O2和5% CO2)混合氣體。
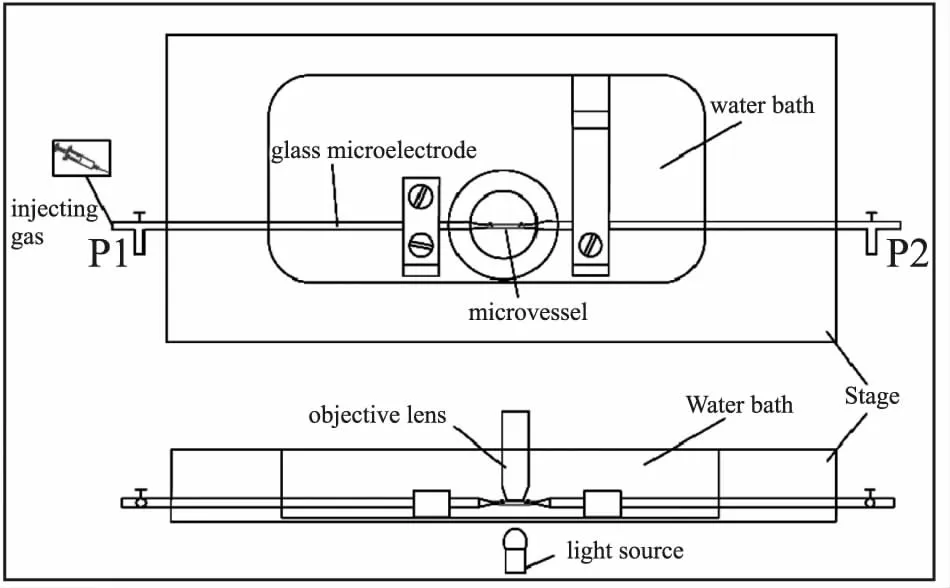
Fig 1 Vascular socket and endothelial removal in water bath of pressure motor system
2.4 壓力平衡及血管活性檢測初始平衡階段保持液體流動,參數(shù)設(shè)定(首先開啟壓力、溫度,P1端20 mmHg,P2端5 mmHg),以便沖走血管內(nèi)的殘留物,平衡持續(xù)時(shí)間約為3 min;然后調(diào)整參數(shù)(P2端上調(diào)至20 mmHg,時(shí)間 5 min,之后以10 mmHg為一個(gè)梯度,每個(gè)梯度穩(wěn)定5 min,使管腔內(nèi)壓力逐漸升至60 mmHg穩(wěn)定);之后血管在60 mmHg穩(wěn)定孵育1 h,平衡孵育期間每20 min更換1次水浴槽內(nèi)的PSS液體。平衡穩(wěn)定1 h后進(jìn)行標(biāo)準(zhǔn)化檢測。先用血管收縮劑KCl(60 mol·L-1)收縮血管,激發(fā)最大血管活性,收縮平穩(wěn)后,用內(nèi)皮依賴性血管舒張劑ACh (10-5mol·L-1)舒張血管——舒張幅度大于70%~80%可認(rèn)為內(nèi)皮完整,小于10%則認(rèn)為血管內(nèi)皮去除。之后用PSS液連續(xù)沖洗3次,再次平衡穩(wěn)定20 min后開始實(shí)驗(yàn)。
2.5 記錄藥物對血管舒縮活動的影響檢測血管符合實(shí)驗(yàn)標(biāo)準(zhǔn)后,正式開始實(shí)驗(yàn)時(shí),打開負(fù)壓吸引器(給藥期間負(fù)壓吸引器處于持續(xù)開啟狀態(tài)),水浴槽內(nèi)的PSS液控制在5 mL,采取累積給藥法依次加入不同濃度PE、ACh和/或SNP (10-9mol·L-1,10-8mol·L-1,10-7mol·L-1,10-6mol·L-1,10-5mol·L-1和10-4mol·L-1),在血管反應(yīng)達(dá)穩(wěn)定狀態(tài)后,依次逐漸加入高一級別濃度的藥物,分別觀察并記錄該藥物對血管直徑的作用。用Myoview軟件控制血管內(nèi)壓力并記錄實(shí)驗(yàn)數(shù)據(jù)。
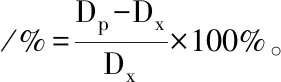

3 結(jié)果
3.1 大鼠血壓值比較如Fig 2所示,與WKY大鼠相比,SHR的血壓值(SBP、DBP、MAP)明顯增高(P<0.01)。
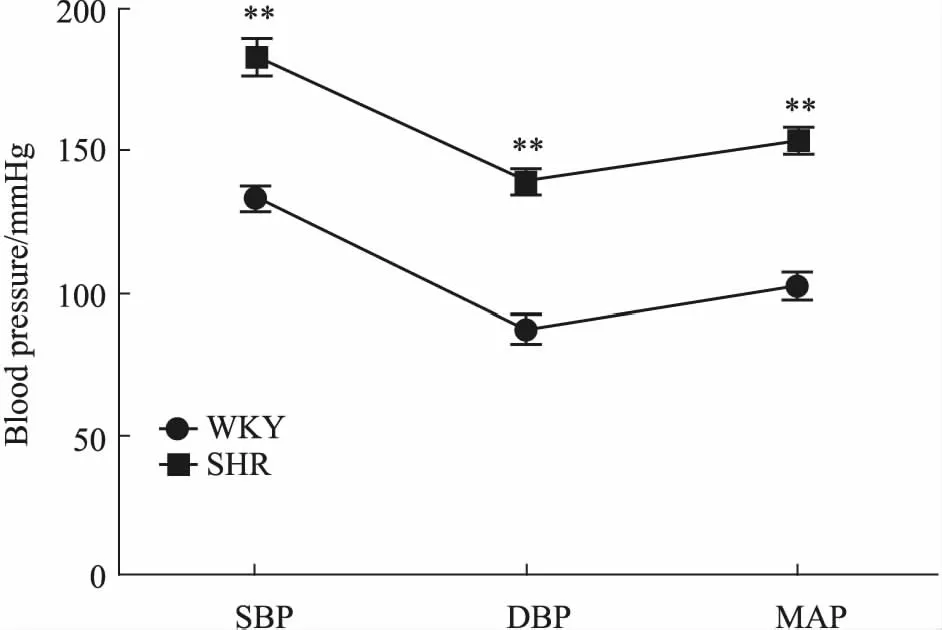
Fig 2 Comparison of blood pressure values between
3.2 血管內(nèi)皮對大鼠腸系膜動脈血管收縮反應(yīng)的影響給予不同濃度的PE收縮血管,觀察其對大鼠腸系膜動脈血管直徑的影響(Fig 3),WKY和SHR腸系膜動脈對PE的收縮反應(yīng)呈現(xiàn)明顯的濃度依賴性,隨PE濃度增加,血管收縮逐漸增大;無論內(nèi)皮完整還是去除時(shí),各濃度PE誘發(fā)的SHR血管收縮反應(yīng)均明顯大于WKY大鼠(P<0.05)。內(nèi)皮完整時(shí),當(dāng)PE濃度為10-7mol·L-1~10-4mol·L-1時(shí),WKY和SHR腸系膜動脈收縮率分別為(3.21±0.32)%vs(8.96±1.00)% (P<0.01)、(7.56±0.90)%vs(15.93±0.92)% (P<0.01)、(30.59±1.00)%vs(40.78±0.63)% (P<0.01)、(34.52±0.40)%vs(44.56±0.68)% (P<0.01)。內(nèi)皮去除時(shí),當(dāng)PE濃度為10-8~10-4mol·L-1時(shí),WKY和SHR腸系膜動脈收縮率分別為(1.45±0.23)%vs(5.87±0.20)% (P<0.01)、(2.84±0.27)%vs(12.65±0.36)% (P<0.01)、(23.72±0.53)%vs(30.46±0.47)% (P<0.01)、(37.71±0.51)%vs(46.15±0.46)% (P<0.01)、(39.17±0.43)%vs(48.16±0.41)% (P<0.05)。而WKY和SHR內(nèi)皮去除組分別與其內(nèi)皮完整組相比,收縮反應(yīng)增強(qiáng),當(dāng)PE濃度為10-6mol·L-1~10-5mol·L-1時(shí),WKY腸系膜動脈收縮率分別為(7.59±0.90)%vs(23.72±0.53)% (P<0.01)、(30.59±1.00)%vs(37.71±1.25)% (P<0.01)。當(dāng)PE濃度為10-8mol·L-1~10-5mol·L-1時(shí),SHR腸系膜動脈收縮率分別為(5.16±0.92)%vs(5.87±0.20)% (P<0.05)、(8.96±1.00)%vs(12.65±0.36)% (P<0.01)、(15.93±0.92)%vs(30.46±0.47)% (P<0.01)、(40.78±0.63)%vs(46.15±0.46)% (P<0.01)。
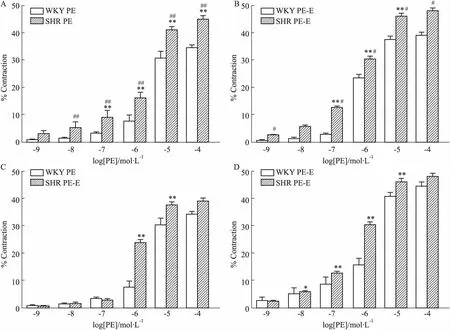
Fig 3 Comparison of contractions and diastolic amplitudes of mesenteric artery inWKY and n=6)
3.3 血管內(nèi)皮對大鼠腸系膜動脈血管舒張反應(yīng)的影響給予不同濃度的ACh、SNP舒張血管后,觀察其對大鼠腸系膜動脈血管直徑的影響(Fig 4),WKY和SHR腸系膜動脈對ACh、SNP的舒張反應(yīng)呈現(xiàn)明顯的濃度依賴性,隨ACh、SNP濃度的增加,血管舒張逐漸增大。內(nèi)皮完整時(shí),各濃度ACh誘發(fā)的SHR血管舒張反應(yīng)均明顯小于WKY大鼠(P<0.01);內(nèi)皮去除時(shí),各濃度SNP誘發(fā)的SHR血管舒張反應(yīng)均明顯大于WKY大鼠(P<0.01),當(dāng)ACh濃度為10-7mol·L-1~10-6mol·L-1時(shí),WKY和SHR腸系膜動脈舒張率分別為(48.00±3.68)%vs(17.50±2.87)% (P<0.01)、(61.40±2.32)%vs(26.50±1.89)% (P<0.01)。當(dāng)SNP濃度為10-7mol·L-1~10-5mol·L-1時(shí),WKY和SHR腸系膜動脈舒張率分別為(2.86±0.50)%vs(21.59±0.30)% (P<0.01)、(7.37±0.68)%vs(40.10±0.40)% (P<0.01)、(13.78 ±1.22)%vs(46.41±0.12)% (P<0.05)。
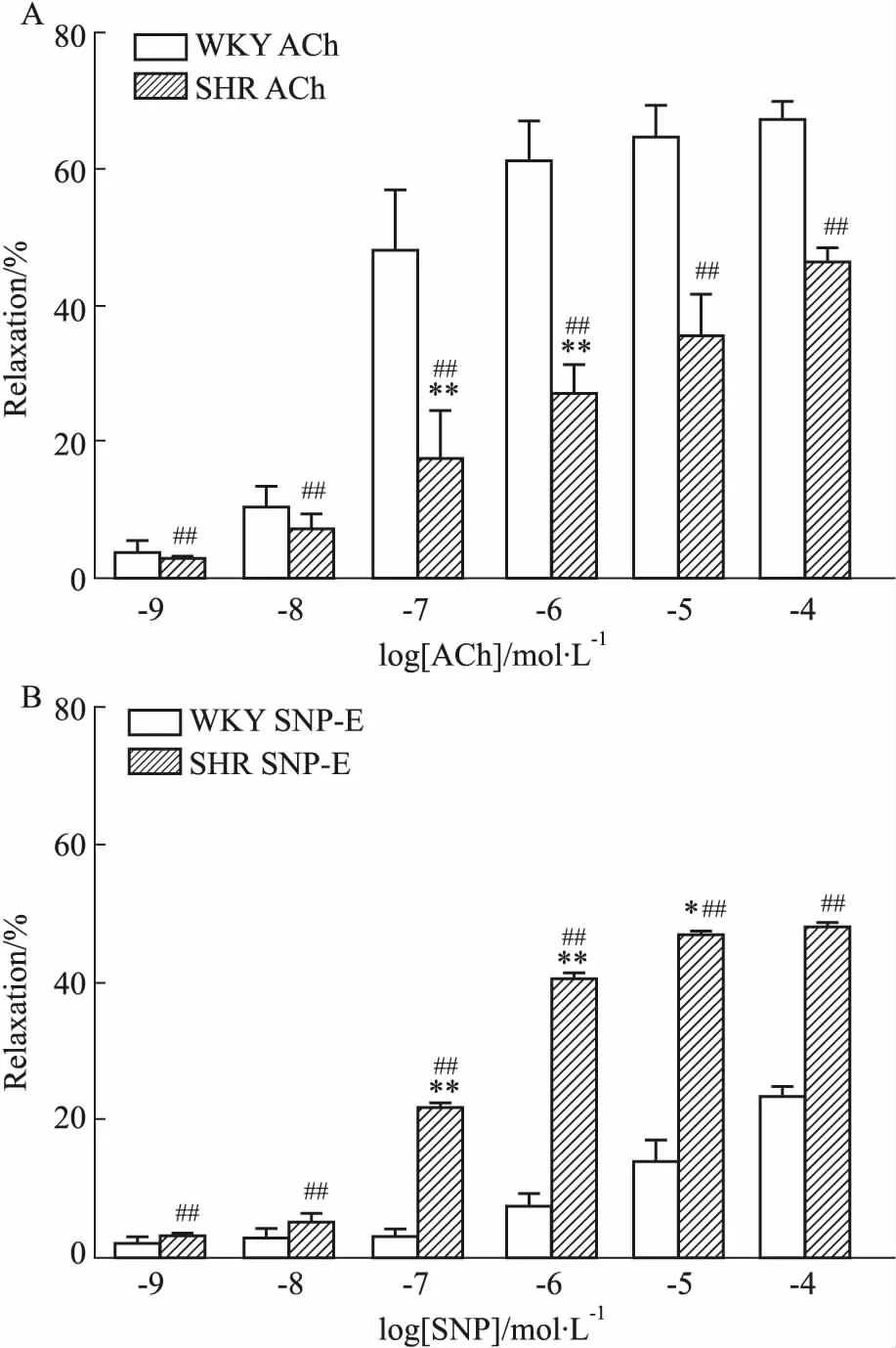
Fig 4 Comparison ofcontractions and diastolic amplitudes of mesenteric artery inWKY and SHR n=6)
4 討論
機(jī)體微血管對組織器官的血流供應(yīng)以及正常血壓的維持發(fā)揮著重要作用[7],微血管結(jié)構(gòu)功能障礙也是高血壓、冠心病、中風(fēng)等疾病的危險(xiǎn)因素。研究表明,高血壓為心腦血管疾病的主要誘因,發(fā)病的關(guān)鍵部位在血管,直接發(fā)病環(huán)節(jié)為外周血管阻力增高[8],嚴(yán)重影響著人們的身心健康;同時(shí)微動脈與大動脈血管功能損傷也是高血壓發(fā)病的主要原因。完整的血管內(nèi)皮在調(diào)節(jié)血管張力、正常血壓的維持、抑制血小板粘附和聚集以及白細(xì)胞的粘附、平滑肌細(xì)胞增殖等生理過程中具有重要作用[9]。在高血壓的發(fā)生發(fā)展過程中,血管內(nèi)皮在受到高血糖、高血脂、氧化應(yīng)激及體內(nèi)高濃度的同型半胱氨酸等一系列有害因素作用時(shí),內(nèi)皮細(xì)胞釋放的舒血管因子減少,縮血管因子增多,打破了血管平衡穩(wěn)態(tài),從而導(dǎo)致血管收縮功能異常等一系列心腦血管事件的發(fā)生[10-11]。本研究結(jié)果也表明:SHR腸系膜動脈呈現(xiàn)明顯的血管收縮和舒張功能障礙。
血管內(nèi)皮細(xì)胞是襯于心、血管和淋巴管內(nèi)表面的單層扁平或多角形細(xì)胞,可通過分泌一系列血管活性物質(zhì)發(fā)揮調(diào)節(jié)血管緊張性、抗血栓形成、抑制平滑肌細(xì)胞增殖及血管壁炎癥反應(yīng)等功能[12]。內(nèi)皮功能障礙是多種心血管疾病的標(biāo)志(血管收縮、血栓形成和炎癥反應(yīng)),通過合成和釋放內(nèi)皮源性收縮因子(超氧陰離子、血栓素A2、內(nèi)皮素、血管緊張素II等)、舒張因子(NO、前列環(huán)素I2、ACh、內(nèi)皮源性超極化因子等),在血管張力、血壓調(diào)節(jié)、凝血、炎癥等過程中發(fā)揮關(guān)鍵作用。因此,對于維持血管內(nèi)環(huán)境穩(wěn)定,血管內(nèi)皮起著至關(guān)重要的作用。所以,微血管、血管內(nèi)皮已成為心腦血管疾病研究的重要方向。
已有的血管張力、壓力肌動技術(shù)報(bào)道,對大動脈和小動脈的血管功能研究報(bào)道也是相互混淆。目前已有的血管內(nèi)皮去除的研究報(bào)道多為機(jī)械(棉簽、鋼絲、頭發(fā)絲摩擦等)和藥物(注射Triton X-100溶液)去除兩種方式[13-14]。筆者認(rèn)為已有研究報(bào)道的血管內(nèi)皮去除方式多適用于大動脈、血管張力的研究,由于微血管壓力肌動研究屬于等張收縮研究,且血管直徑過小,操作困難,對血管活性的要求高于普通血管張力系統(tǒng)的研究,已有報(bào)道的血管內(nèi)皮去除方式并不完全適用于微動脈的研究。本研究采取壓力肌動技術(shù)檢測微血管功能,該技術(shù)的優(yōu)點(diǎn)在于對血管本身及血管活性損傷較小,更好的模擬動物體內(nèi)環(huán)境。本技術(shù)不同于普通血管張力研究,鋼絲需穿過血管的方式,容易損傷血管內(nèi)皮,使實(shí)驗(yàn)結(jié)果缺乏準(zhǔn)確性[15]。本研究采取血管套接在玻璃微電極(直徑約50μm),鑷子只需捏住套接電極的部分,而需要檢測的血管段保留其血管結(jié)構(gòu)和功能的完整性,降低實(shí)驗(yàn)數(shù)據(jù)的誤差。對于血管內(nèi)皮的去除,本研究摒棄以往棉簽、鋼絲摩擦的方式,采取機(jī)械和藥物相結(jié)合的方式,將血管圍繞玻璃微電極尖端輕輕旋轉(zhuǎn)1圈[4],血管一端套接完成后,向血管內(nèi)推注氣體,破壞血管內(nèi)皮。上述方式保證血管的良好活性,但不能保證血管內(nèi)皮完全去除,所以給藥階段繼續(xù)給予吲哚美辛(環(huán)氧合酶抑制劑)、L-NAME(NO合酶抑制劑)共同預(yù)孵育血管20 min,抑制內(nèi)皮源性舒張因子(NO、前列環(huán)素I2)的釋放,且吲哚美辛和L-NAME持續(xù)存在于整個(gè)實(shí)驗(yàn)過程[5]。本研究方法不同于已有研究報(bào)道的單純將血管圍繞玻璃微電極尖端旋轉(zhuǎn)1圈[4]或者向血管內(nèi)推注氣體,容易損傷血管,降低血管活性,不能更好的模擬動脈生理狀態(tài),且不能保證血管內(nèi)皮去除的程度。本研究在綜合既往研究報(bào)道的基礎(chǔ)上,經(jīng)過反復(fù)實(shí)踐,證明本血管內(nèi)皮去除的方法,可以大大降低對血管活性的損傷,更好的保證了血管的活性,結(jié)構(gòu)、功能的完整性,提高實(shí)驗(yàn)數(shù)據(jù)的準(zhǔn)確性。在本研究中,每個(gè)內(nèi)皮去除的血管環(huán),均給予KCl收縮血管,待穩(wěn)定后,給予ACh舒張血管,幅度小于10%,可以認(rèn)為血管內(nèi)皮的去除。本研究結(jié)果顯示:血管內(nèi)皮去除后,WKY和SHR的血管收縮增強(qiáng),以10-5mol·L-1最明顯(P<0.01)。對血管舒張的檢測,內(nèi)皮完整時(shí),與WKY大鼠相比,SHR的舒張功能明顯減弱;內(nèi)皮去除后,給予內(nèi)皮非依賴性血管舒張劑SNP,WKY大鼠的舒張反應(yīng)明顯減弱,本研究結(jié)果與已有的研究相似,高血壓大鼠血管收縮反應(yīng)增強(qiáng),舒張反應(yīng)減弱。筆者認(rèn)為此血管內(nèi)皮去除的技術(shù)方法可以用于之后的微血管內(nèi)皮功能障礙研究中,以提高微血管測量實(shí)驗(yàn)數(shù)據(jù)的準(zhǔn)確性和可靠性。
(致謝: 本實(shí)驗(yàn)在新疆地方與民族高發(fā)病教育部重點(diǎn)實(shí)驗(yàn)室完成,感謝課題組成員的幫助與支持。)

