梓醇對AGEs刺激巨噬細胞介導腎系膜細胞損傷的影響
王 威,富瑩雪,陳 璟,甘嘯陽,許惠琴,喻 斌,呂高虹,盧金福
(南京中醫藥大學藥學院,江蘇省中藥藥效與安全性評價重點實驗室,江蘇 南京 210023)
糖尿病腎病(diabetic nephropathy,DN)是糖尿病常見且危險的并發癥,以炎癥、腎小球系膜基質擴張、彌漫性腎小球基底膜增厚、間質纖維化和腎小管萎縮為主要特征,DN已被認為是終末期腎病(end stage renal disease,ESRD)的主要原因,晚期糖基化終末產物(advanced glycation end products,AGEs)在DN的發生和發展過程中起著關鍵作用。隨著近年來的深入研究,發現AGEs在DN炎性損傷中扮演重要角色[1],其中巨噬細胞是介導DN炎性腎損傷的關鍵炎性細胞。巨噬細胞廣泛分布在機體的各個器官和組織中,被稱為單核-巨噬細胞系統,主要參與免疫、炎性反應及內環境穩態的維持,AGEs可以刺激巨噬細胞釋放炎性細胞因子白細胞介素-1β(interleukin-1β,IL-1β)和腫瘤壞死因子-α(tumor necrosis factor,TNF-α),TNF-α可誘導細胞凋亡并且對腎小球系膜細胞和腎小管細胞具有細胞毒性,導致直接腎損傷[2]。研究表明,巨噬細胞在腎臟中的積聚與DN血肌酐、蛋白尿和間質纖維化水平呈正相關,與腎功能呈負相關;巨噬細胞浸潤也與糖尿病動物高血糖水平、腎小球免疫復合物沉積及進行性纖維化、趨化因子增加密切相關[3]。
梓醇(catalpol)是一種從生地黃中提取出來的環烯醚萜苷類化合物,研究表明,梓醇可以改善db/db糖尿病小鼠尿多且渾濁的狀況,恢復其受損腎功能,減輕腎臟病理變化,減輕腎小球系膜細胞外基質沉積,其機制與AGEs/RAGE/Sphk1信號通路的抑制有關[4]。梓醇能夠抑制AGEs誘導的單核細胞炎癥因子分泌,通過抑制細胞內氧化應激水平、核轉錄因子(nuclear factor kappa-B,NF-κB)的轉位,從而抑制AGEs介導的炎癥[5]。有研究發現單核巨噬細胞和腎小球系膜細胞共培養,AGEs上調不規則趨化因子(fractalkine,Fkn)降低系膜細胞中基質金屬蛋白酶(matrix metalloproteinases,MMPs)表達,導致細胞外基質的積聚且提高單核細胞的遷移從而加劇DN[6]。綜上所述,本實驗采用體外巨噬細胞與系膜細胞共培養模型,探究梓醇干預AGEs刺激巨噬細胞對腎系膜細胞損傷的作用,為減輕糖尿病腎病炎性損傷提供理論研究依據。
1 材料
1.1 試劑與材料小鼠腎系膜細胞(MMCs)從中國科學院上海細胞庫購入;小鼠巨噬細胞(RAW264.7)由南京中醫藥大學藥理實驗室惠贈。梓醇(catalpol)標準品(HPLC≥98%),成都瑞芬思生物科技有限公司,批號:Z-005-180315;氨基胍(aminoguanidine)、MTT,Sigma公司,批號:079K1734V、MKBN7264V;DMEM/F-12 1 ∶1(1×)細胞培養基、胰酶、胎牛血清,美國Gibco公司;RIPA組織/細胞裂解液、DAPI染液、Triton X-100、山羊血清,Solarbio科技有限公司,批號:R0020、20190315、T8200、408J051;通用型組織固定液,武漢谷歌生物科技有限公司,批號:163618;FN、COL-Ⅳ、TGF-β抗體,英國Abcam公司;β-actin,Bioworld公司;Anti-rabbit IgG,美國CST公司;FITC-羊抗兔IgG,BOSTER生物工程有限公司,批號:BST13K28C05;小鼠白細胞介素-6(interleukin-6,IL-6)、白細胞介素-12(interleukin-12,IL-12)、TNF-α ELISA試劑盒,上海酶聯生物科技有限公司,批號:201902。
1.2 儀器Synergy HT酶標儀,美國Bio-Tek公司;電泳儀,美國BIO-RAD公司;CO2細胞培養箱,日本SANYO公司;冷凍離心機,美國BECKMAN公司;化學發光成像儀,美國GE公司;Ti型倒置熒光顯微鏡,日本Nikon公司;Transwell 3450、3413共培養板,美國Corning公司。
2 方法
2.1 AGEs的制備稱取適量的牛血清白蛋白(BSA)溶于PBS中,配制成濃度為50 g·L-1的溶液,再與0.5 mol·L-1的葡萄糖溶于0.2 mol·L-1PBS(pH 7.4)中。待溶解后,37 ℃避光孵育4個月,使其形成AGEs-BSA(即AGEs)。在平行條件下配制不含葡萄糖的上述BSA溶液,制備0-BSA(無糖基化BSA)溶液作為對照。4個月后,使用孔徑為分子量1萬的透析袋,置于10 mmol·L-1PBS(pH 7.4)中,4 ℃透析24 h,以除去未完全反應的葡萄糖。制備好的AGEs用0.22 μm濾器過濾除菌,-20 ℃保存備用,經BCA蛋白定量測濃度為22.6 g·L-1。
2.2 細胞培養小鼠系膜細胞(MMCs)和小鼠巨噬細胞(RAW264.7)培養于含1g·L-1胎牛血清和0.1g·L-1青霉素-鏈霉素DMEM/F12培養基中,取對數生長期細胞進行實驗。
2.3 MTT法檢測系膜細胞增殖取對數生長期的RAW264.7以1×108·L-1每孔1 mL接種于24孔板內,另取MMCs以5×107·L-1每孔0.5 mL接種于0.4 μm的Transwell小室,于細胞培養箱中培養24 h。當細胞貼壁時,24孔板和Transwell小室換無血清的DMEM/F12培養基饑餓培養24 h,依次分為空白對照組、模型組、氨基胍組(終濃度10.0 μmol·L-1)、梓醇組(終濃度0.1、1.0、10.0 μmol·L-1),每組設4個復孔,各組加藥培養1 h后,下層加入終濃度100 mg·L-1的 AGEs刺激RAW264.7,將Transwell小室移至24孔板上方共培養23 h。從孵箱中拿出共培養板舍去上層小室內培養液,MTT法測定吸光度值(490 nm),并計算細胞增殖率。
細胞增殖率/%=[(ODx-ODControl)/ODControl]×100%
2.4 免疫熒光法檢測腎系膜細胞表達COL-Ⅳ熒光強度將細胞爬片置于Transwell小室,取對數生長期的RAW264.7以1×108·L-1每孔2 mL接種于6孔板內,另取MMCs以2×108·L-1每孔0.5 mL接種于0.4 μm小室爬片。分組與給藥處理按“2.3”項,每組設置3個復孔。冰PBS小心沖洗爬片3次,固定液固定15 min,用PBS稀釋的Triton X-100通透20 min,加入PBS配制山羊血清封閉1 h,每片加0.2 mL COL-Ⅳ一抗4 ℃過夜。d 2每片爬片加入PBS稀釋的0.2 mL FITC-羊抗兔IgG孵育2 h,PBS洗3次,滴加DAPI染液,5 min后PBS洗4遍吸去爬片液體后上機檢測,使用Image Pro Plus 6軟件統計分析。
2.5 Western blot法檢測腎系膜細胞相關蛋白表達取對數生長期RAW264.7以1×108·L-1每孔2 mL接種于6孔板內,另外取對數生長期MMCs以2×108·L-1每孔2 mL接種于0.4 μm的Transwell小室。分組與給藥處理同“2.3”項,每組設置3個復孔。吸除小室內液體,用不含EDTA的胰酶將MMCs吹打混懸于小室中并離心收集,加入裂解液提蛋白,并測定蛋白濃度。蛋白樣品按體積加上樣緩沖液,95 ℃煮5 min后,進行聚丙烯酰氨凝膠電泳,轉膜至PVDF膜上,加入0.5 g·L-1BSA封閉液,室溫2 h后加入一抗4 ℃過夜。d2 PBST洗3次,加入HRP二抗,室溫2 h后ECL顯色。利用Image J軟件分析各組灰度值β-actin為內參計算FN、COL-Ⅳ、TGF-β蛋白表達量。
2.6 ELISA法檢測巨噬細胞上清液中IL-6、IL-12、TNF-α的分泌取對數生長期的RAW264.7以1×108·L-1每孔1 mL接種于24孔板內,另取MMCs以5×107·L-1,每孔0.5 mL接種于0.4 μm的Transwell小室,分組與給藥處理同“2.3”項,每組設置3個復孔。拿出共培養板,吸出下層巨噬細胞上清液,按說明書檢測上清中IL-6、IL-12、TNF-α水平。
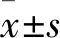
3 結果
3.1 梓醇對AGEs刺激巨噬細胞介導系膜細胞增殖的影響與空白對照組相比,AGEs刺激巨噬細胞介導系膜細胞增殖率升高(P<0.01),而梓醇(0.1、1.0、10.0 μmol·L-1)、氨基胍(10.0 μmol·L-1)可不同程度的抑制由AGEs刺激巨噬細胞介導系膜引起的細胞增殖(P<0.05,P<0.01)(Tab 1)。

Fig 1 Effect of catalpol on fluorescent expression of COL-IV in MMCs mediated by AGEs-stimulated RAW264.7

Tab 1 Effect of catalpol on proliferation rate in MMCs mediated by AGEs-stimulated RAW264.7
3.2 梓醇對AGEs刺激巨噬細胞介導系膜細胞表達COL-Ⅳ熒光強度的影響免疫熒光結果顯示,與空白對照組相比,AGEs刺激巨噬細胞介導系膜細胞COL-Ⅳ(Fig 1)蛋白熒光明顯增強(P<0.01),而加入梓醇(10.0 μmol·L-1)、氨基胍(10.0 μmol·L-1)干預后COL-Ⅳ蛋白熒光減弱(P<0.01)。
3.3 梓醇對AGEs刺激巨噬細胞介導系膜細胞FN、COL-Ⅳ、TGF-β蛋白表達的影響與空白對照組相比,AGEs刺激巨噬細胞介導系膜細胞FN、COL-Ⅳ、TGF-β(Fig 2)蛋白表達上調(P<0.01),而梓醇(0.1、1.0、10.0 μmol·L-1)、氨基胍(10.0 μmol·L-1)可不同程度的下調其表達(P<0.05,P<0.01),且梓醇的下調程度與濃度相關。
3.4 梓醇對AGEs刺激巨噬細胞分泌IL-6、IL-12、TNF-α的影響與空白對照組相比,AGEs可明顯提高巨噬細胞IL-6、IL-12、TNF-α分泌水平(P<0.01),而梓醇(0.1、1.0、10.0 μmol·L-1)、氨基胍(10.0 μmol·L-1)可不同程度的抑制其分泌(P<0.05,P<0.01),且梓醇的抑制程度與濃度相關(Tab 2、Tab 3、Tab 4)。

Fig 2 Effect of catalpolon expression of FN,COL-Ⅳ and TGF-β in MMCs mediated by AGEs-stimulated

Tab 2 Effect of catalpol on levels of IL-6 in RAW264.7 macrophages induced by

Tab 3 Effect of catalpol on levels of IL-12 in RAW264.7 macrophages induced by

Tab 4 Effect of catalpol on levels of TNF-α in RAW264.7
4 討論
DN是糖尿病嚴重的微血管并發癥,研究表明腎臟疾病的發展與巨噬細胞在腎組織中的遷移、浸潤、炎癥介質的高表達密切相關,并且可能是各種機制下游的共同環節[7]。
高血糖是DN炎癥發病機制的主要始動因素,長期高血糖導致AGEs在體內過多蓄積,一方面刺激巨噬細胞,通過分泌炎癥因子如IL-6、IL-12、TNF-α和誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等促進炎癥反應,導致腎固有細胞損傷,如腎小球系膜細胞增生、血管內皮細胞泡沫化和足細胞凋亡[8-9];另一方面在糖尿病環境下,AGEs刺激腎系膜細胞,使其分泌單核細胞趨化蛋白(monocyte chemotactic protein-1,MCP-1)等反過來激活、促進巨噬細胞從血液向腎臟富集并分泌大量炎癥因子加重腎系膜細胞的損傷,擴大炎癥加快DN的發展[10-11]。
研究發現轉化生長因子-β(transforming growth factor-β,TGF-β)是纖維化最關鍵的調節因子和纖維化的早期生物標志物,高血糖和炎癥可以刺激TGF-β的活性,被激活的TGF-β通過促進多種分子如纖維粘連蛋白(fibronectin,FN)、Ⅳ型膠原(Collage TypeⅣ,COL-Ⅳ)的分泌加速DN中的腎纖維化進程,進而加重DN[12]。研究結果表明[13],TGF-β激活激酶-1( TGF-β activated kinase-1,TAK1) 抑制劑可通過 TAK1 /MAPKs、MAPKs /NF-κB途徑抑制AGEs對巨噬細胞的激活和炎癥因子的表達。此外,腎小球系膜細胞分泌的FN、COL-Ⅳ等細胞外基質又可與AGEs形成交叉連接或通過與晚期糖基化終產物受體(receptor of advanced glycation endproducts,RAGE)結合來影響DN的病理過程[14],FN也可通過促進粘著斑激酶(focal adhesion kinase,FAK)和Src家族激酶(Src family kinase,SFK)活化從而誘導巨噬細胞遷移。研究表明,芳基烴受體(aryl hydrocarbon receptor,AhR)可通過氧化應激級聯調控環氧合酶-2(cyclooxygenase-2,COX-2)、前列腺素E2(prostaglandin E2,PGE 2)表達和細胞外基質沉積參與Nε-羧甲基賴氨酸(Nε-carboxymethyllysine,CML一種主要的晚期糖基化終產物)誘導的系膜細胞激活和巨噬細胞浸潤[15]。
本實驗建立了AGEs刺激巨噬細胞與腎系膜細胞共培養模型,AGEs刺激巨噬細胞后,其炎癥因子IL-6、IL-12、TNF-α分泌水平升高,與此同時腎系膜細胞FN、COL-Ⅳ、TGF-β蛋白表達水平升高,而加入梓醇再用AGEs刺激巨噬細胞后可下調其炎癥因子及系膜細胞蛋白表達水平,這提示梓醇可通過下調巨噬細胞炎癥因子水平緩解其對系膜細胞造成的損傷,其具體機制有待進一步探討。
(致謝:本實驗于江蘇省中藥藥效與安全性評價重點實驗室完成,感謝實驗室老師的指導和同學們的幫助。)

