控制性促排卵中三種促性腺激素使用4天后血FSH值及助孕結局分析
鄭波,戴芳芳,郭鈺英,郭影,劉彥民
(邢臺不孕不育專科醫院,邢臺 054001)
控制性卵巢刺激(COS)目的是以藥物手段在可控范圍內升高體內FSH水平,誘發多卵泡發育和成熟[1]。常用的COS藥物為外源性促性腺激素(Gn)。Gn類藥物分為2大類:天然Gn和基因重組Gn。天然Gn主要有從絕經婦女尿中提取的Gn,如尿源性人FSH(u-FSH);基因重組Gn主要包括重組 FSH(r-FSH)[2]等。目前國內應用此類藥物按照產地可以分為國產、進口兩類。為進一步比較不同r-FSH、u-FSH在輔助生殖技術中的應用,本文回顧性分析了在IVF/ICSI-ET技術中相關藥物的助孕過程及結局,旨在為Gn個體化應用提供參考。
資料與方法
一、研究對象與分組
1.不同Gn的應用:選取2017年12月至2018年12月于邢臺市生殖醫學中心(邢臺不孕不育專科醫院)接受IVF/ICSI-ET助孕,除外多囊卵巢綜合征、子宮畸形、子宮腺肌病、重度子宮內膜異位癥、復發性流產、宮腔粘連或結核患者,且均采用GnRH-a長方案助孕者為研究對象。共納入488個周期,根據Gn的不同分為3組:進口r-FSH(普麗康,100U/支,默沙東,荷蘭)330周期;國產r-FSH(金賽恒,75U/支,長春金賽藥業)95周期;國產u-FSH(麗申寶,75U/支,珠海麗珠醫藥)63周期。
2.國產r-FSH藥物的穩定性:選取上述應用國產r-FSH患者的95周期,按照藥品不同的藥品批次分為3組。批號1組(30個周期,藥物批號為20170616);批號2組(29個周期,藥物批號為201710022);批號3組(36個周期,藥物批號為201710023)。
二、診療回顧
1.促排卵及取卵:自前一月經周期的黃體中期肌肉注射長效 GnRH-a(曲普瑞林,達菲林,3.75mg/支,輝凌制藥,德國)1.00~1.25mg,16~20d后晨起空腹抽血,采用IMMULITE 2000XPi全自動化學發光法檢測內分泌激素水平,批間誤差和實驗誤差均符合實驗標準。結合B超檢查,達到垂體降調節標準(血 E2<183pmol/L、LH<3U/L、FSH<5U/L)后給予Gn 150~300U/d促排卵,卵泡中晚期必要時加用r-LH(樂芮,75U/支,雪蘭諾,瑞士)。應用Gn 4d后常規晨起空腹抽血檢測血FSH值,并按照75U/支統計每支藥物提升血液中FSH的水平,根據陰道B超監測卵泡生長情況隨時調整給藥劑量,當B超監測有2~3個卵泡徑線≥18mm時給予肌肉注射 HCG 10 000U,36~37h后取卵。
2.內膜厚度及容受性評分測定:HCG注射日超聲測量距離宮底15mm處內膜厚度。取卵后72h常規進行內膜容受性評分,評分采用美國GE公司Voluson-E8彩色多普勒超聲診斷儀。建立子宮內膜容受性評估的客觀標準方法以評估胚胎植入過程[3],將所測的子宮內膜厚度分為兩個等級,對不同厚度的內膜賦予不同的分值:≤7mm或≥15mm為1分;8~14mm為2分。內膜血流分型采用Applebaum 分型法[4-5],分為 A、B、C 型,并分別賦值1、2、3分;對于C型血流者,計數內膜內穿支血管數目并賦予不同的分值:≤2支計0分;3~6支計1分;≥6支計2分[4-5]。對每個患者進行綜合評分。
3.受精及移植:取卵后4~6h行IVF或ICSI,16~20h后觀察受精情況,72h評估胚胎質量后選擇1~2枚胚胎進行胚胎移植。
4.黃體支持:取卵后開始應用黃體酮軟膠囊(安琪坦,0.1g/粒,Besins-Iscovsco,法國)0.2g,每日3次陰道上藥。胚胎移植后2周測量血清β-HCG水平,移植后33~35d行B超檢查,以孕囊中可見胚芽和心管搏動者確定為臨床妊娠。
三、評價指標
1.不同Gn類型比較:分別比較3種不同藥物的啟動促排卵日FSH值、Gn應用4d后血清FSH增長情況、Gn總量、Gn天數、總獲卵數、ICSI周期MⅡ卵率、HCG注射日子宮內膜厚度、內膜容受性評分、可用胚胎數、移植胚胎數、臨床妊娠率、卵巢過度刺激綜合征(OHSS)發生率、早期流產率。
2.不同批次國產r-FSH比較:分別比較不同批次藥物Gn應用4d后MⅡ卵率、可用胚胎數、移植胚胎數、臨床妊娠率、OHSS發生率、早期流產率。
四、統計學分析
采用SPSS21.0統計學軟件進行分析,計量資料采用均數±標準差差()表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用one-way ANOVA方差分析;計數資料采用率(%)表示,組間比較采用χ2檢驗及Fisher檢驗;P<0.05為差異有統計學意義。
結 果
一、患者基本資料
共納入488個周期,其中進口r-FSH組330周期、國產r-FSH組95周期、國產u-FSH組63周期。3組對比分析,患者年齡、不孕年限、體重指數(BMI)、基礎血FSH(bFSH)值、AMH 值、助孕次數均無統計學差異(P>0.05)(表1)。
表1 不同Gn方案患者基本資料()
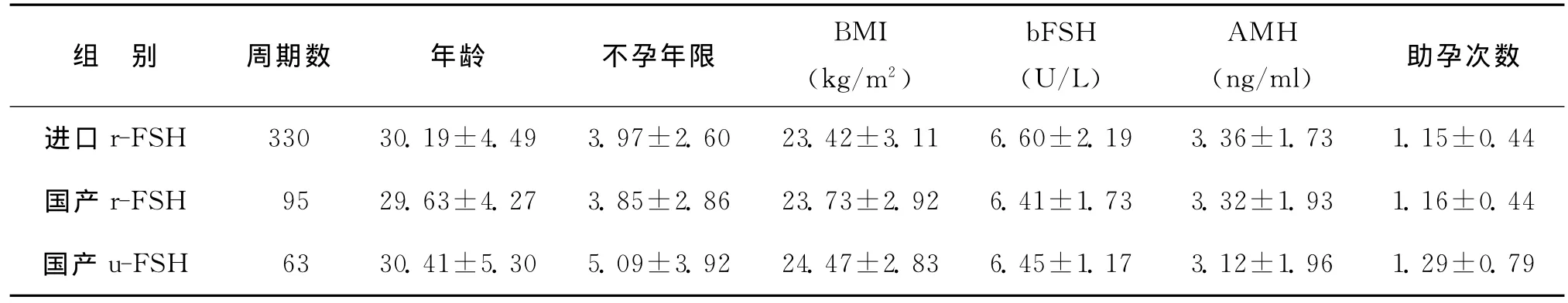
表1 不同Gn方案患者基本資料()
組 別 周期數 年齡 不孕年限 BMI(kg/m2)bFSH(U/L)AMH(ng/ml) 助孕次數進口r-FSH 330 30.19±4.49 3.97±2.60 23.42±3.11 6.60±2.19 3.36±1.73 1.15±0.44國產r-FSH 95 29.63±4.27 3.85±2.86 23.73±2.92 6.41±1.73 3.32±1.93 1.16±0.44國產u-FSH 63 30.41±5.30 5.09±3.92 24.47±2.83 6.45±1.17 3.12±1.96 1.29±0.79
二、不同Gn方案組助孕指標比較
3種不同Gn方案間啟動日血FSH水平、Gn天數、平均獲卵數、HCG日子宮內膜厚度、子宮內膜容受性評分、MⅡ卵率、可用胚胎數、移植胚胎數、臨床妊娠率、OHSS發生率、早期流產率均無統計學差異(P>0.05);Gn應用4d后血FSH上升水平,以國產u-FSH上升最高,國產r-FSH上升最低,且組間有統計學差異(P<0.05),而兩種r-FSH 組間無統計學差異(P>0.05);Gn總量以國產u-FSH 用量最大,進口r-FSH用量最低,國產u-FSH組與進口r-FSH 組間有統計學 差 異 (P<0.05),而 兩 種r-FSH間無統計學差異(P>0.05)(表2)。
三、不同批次國產r-FSH比較
3種不同批次的國產r-FSH間患者年齡、不孕年限、血AMH值、BMI、助孕次數、MⅡ卵率、可用胚胎數、移植胚胎數、臨床妊娠率、OHSS發生率、早期流產率等均無統計學差異(P>0.05)(表3)。
表2 不同Gn方案組助孕指標比較[(),%]
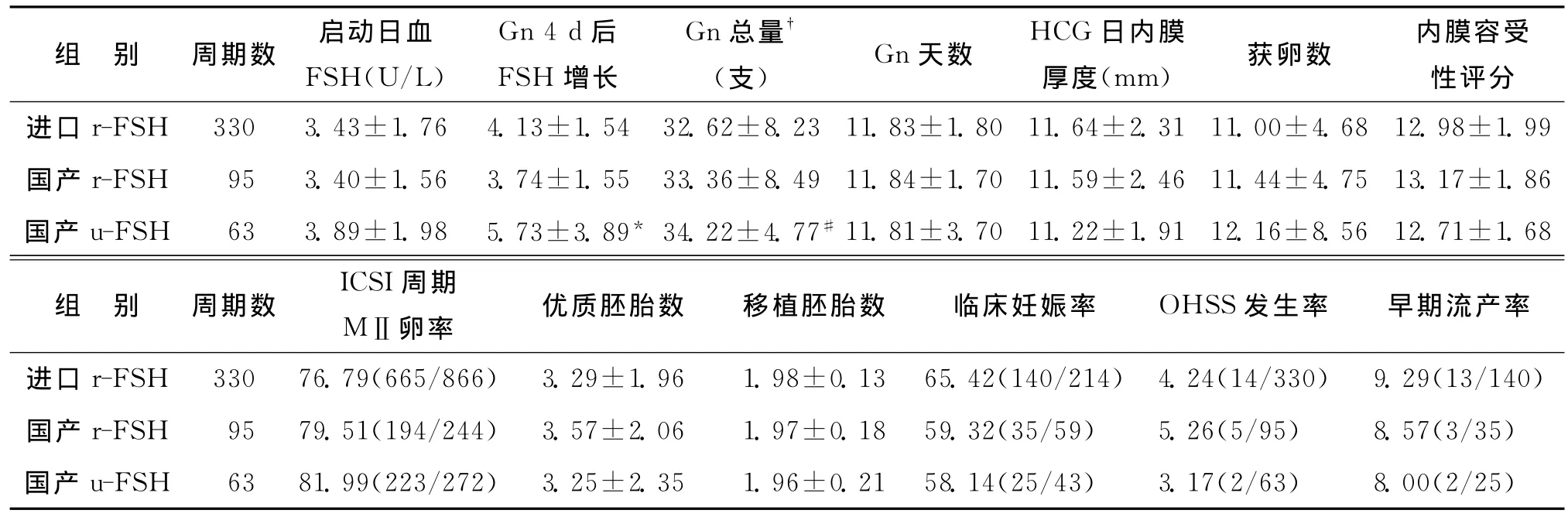
表2 不同Gn方案組助孕指標比較[(),%]
注:與國產r-FSH 組比較,*P<0.05;與進口r-FSH 組比較,#P<0.05;以每支75U計算
性評分進口r-FSH 330 3.43±1.76 4.13±1.54 32.62±8.23 11.83±1.80 11.64±2.31 11.00±4.68 12.98±1.99國產r-FSH 95 3.40±1.56 3.74±1.55 33.36±8.49 11.84±1.70 11.59±2.46 11.44±4.75 13.17±1.86國產u-FSH 63 3.89±1.98 5.73±3.89* 34.22±4.77#11.81±3.70 11.22±1.91 12.16±8.56 12.71±1.68組 別 周期數 ICSI周期MⅡ卵率 優質胚胎數 移植胚胎數 臨床妊娠率 OHSS發生率 早期流產率進口r-FSH 330 76.79(665/866) 3.29±1.96 1.98±0.13 65.42(140/214) 4.24(14/330) 9.29(13/140)國產r-FSH 95 79.51(194/244) 3.57±2.06 1.97±0.18 59.32(35/59) 5.26(5/95) 8.57(3/35)國產u-FSH 63 81.99(223/272) 3.25±2.35 1.96±0.21 58.14(25/43) 3.17(2/63) 8.00(2/25)組 別 周期數 啟動日血FSH(U/L)Gn 4d后FSH增長Gn總量images/BZ_41_1434_1077_1448_1101.png(支) Gn天數 HCG日內膜厚度(mm) 獲卵數 內膜容受
表3 不同批次國產r-FSH助孕指標[(),%]
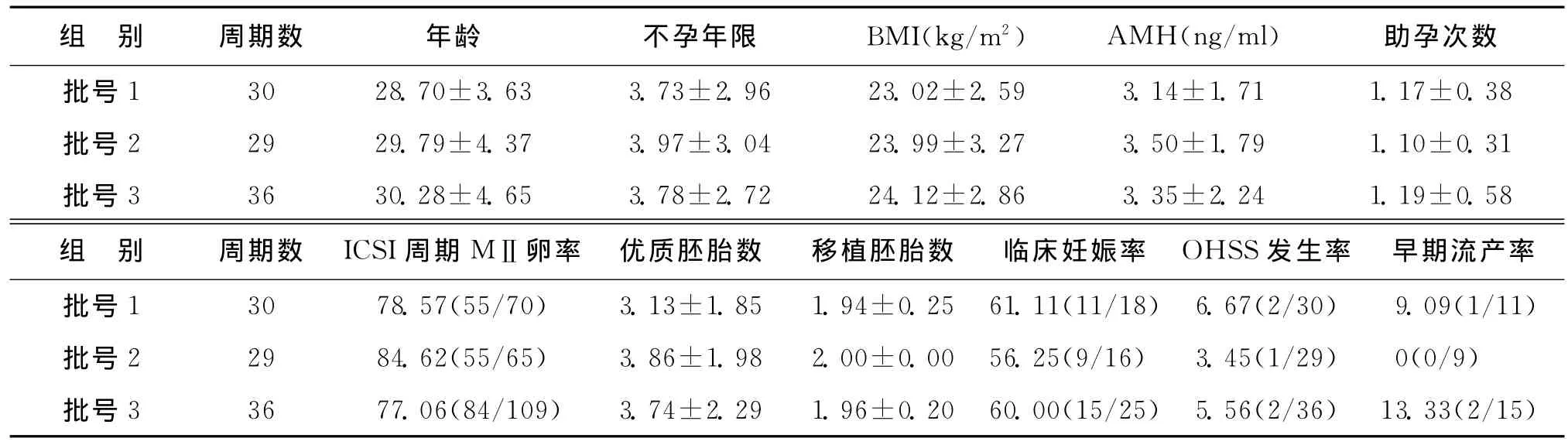
表3 不同批次國產r-FSH助孕指標[(),%]
組 別 周期數 年齡 不孕年限 BMI(kg/m2) AMH(ng/ml) 助孕次數批號1 30 28.70±3.63 3.73±2.96 23.02±2.59 3.14±1.71 1.17±0.38批號2 29 29.79±4.37 3.97±3.04 23.99±3.27 3.50±1.79 1.10±0.31批號3 36 30.28±4.65 3.78±2.72 24.12±2.86 3.35±2.24 1.19±0.58組 別 周期數 ICSI周期MⅡ卵率 優質胚胎數 移植胚胎數 臨床妊娠率 OHSS發生率 早期流產率批號1 30 78.57(55/70) 3.13±1.85 1.94±0.25 61.11(11/18) 6.67(2/30) 9.09(1/11)批號2 29 84.62(55/65) 3.86±1.98 2.00±0.00 56.25(9/16) 3.45(1/29) 0(0/9)批號3 36 77.06(84/109) 3.74±2.29 1.96±0.20 60.00(15/25) 5.56(2/36) 13.33(2/15)
討 論
眾所周知,給予Gn進行控制性促排卵是體外受精-胚胎移植助孕技術的重要環節之一,目前臨床上常用的 Gn主要分為兩種,即r-FSH、u-FSH,且有進口和國產兩類藥,不同藥物應用目的是一致的,均為達到用最少的藥物,獲得最好數量的優質卵子,最好的妊娠結局。不同藥物之間雖均是升高外源性FSH,達到促排卵目的,但因來源不同、制備工藝不同,在臨床上應用也存在差異。臨床醫生須很好地掌握各類藥物的內在區別才可能更好地達到個體化應用、更好的療效。另外,垂體降調節后,垂體分泌被有效地抑制[6],隨后卵泡的募集與發育完全依賴外源性Gn[7]。目前臨床上應用的外源性FSH制劑需每日給藥,多次給藥后,在3~4d內血中蓄積達到穩態[2]。
u-FSH是通過收集絕經期婦女尿液,并經過一系列純化步驟而獲得[8],r-FSH 是采用重組技術在中華倉鼠卵巢細胞系中產生而獲得,由于原材料來源及生產工藝的不同,基因重組理論上較尿源性具有更穩定的生物活性和更小的批間差異[9]。u-FSH因其來源是絕經期婦女尿液,而絕經期婦女本身呈高度糖基化。r-FSH因其來源無法產生高糖基化FSH,同時在純化過程中使糖進一步丟失而產生低糖基化[4]。糖基化不同也使其特性有所不同,例如有報道高糖基化FSH使得卵泡生長速度較低糖基化慢,卵泡閾值高選擇,且高糖基化FSH具有更長的半衰期及慢的清除率[9-10]。國產r-FSH 是目前國內首創基因重組FSH,對其報道的例數較少。
本研究在充分降調節基本排除內源性Gn影響后,通過對比不同藥物按照75U為支數劑量單位,檢測每類藥物連續用藥4d,血藥濃度達到穩態后,判斷其血藥濃度達到穩定值的多少,同時對比其總的用藥支數,初步判斷其生物利用方面情況,以及對比其對助孕結局的影響。結果顯示在單支升高FSH值方面國產u-FSH最高,其明顯高于兩種r-FSH,其總用藥量亦明顯高于兩種r-FSH,考慮u-FSH從人體尿液中提取,吸收入血的濃度可能更高,而其半衰期長、清除率慢可能是其血藥濃度較r-FSH高的主要原因,而其實際的生物利用度不足使其臨床應用中表現為血FSH“虛高”,需要臨床醫生對此注意;國產r-FSH與進口r-FSH相比,兩者用藥4d后血中FSH的濃度相當。ICSI技術是卵子取出后4~6h拆除顆粒細胞同時觀察卵子成熟度,較IVF技術可以更好地反映 MⅡ卵的情況[11],亦是反映COS的重要指標之一。本研究比較了不同Gn組ICSI周期的MⅡ卵率,3組間無統計學差異,進一步說明3種藥物在促進卵子生長和成熟方面無明顯差異,即使血中的FSH含量不同、用藥量不同。
3種藥物組的Gn天數、平均獲卵數、可用胚胎數、移植胚胎數、臨床妊娠率、OHSS發生率、早期流產率均無統計學差異,此結果與van Wely等[12]有關尿源性與基因重組藥物COS無明顯差異的報道結論相一致。不同促排卵藥物和促排卵方案的助孕效果存在差異,主要原因是對子宮內膜容受性的影響不同[13-14]。本研究也顯示子宮內膜的厚度、子宮內膜容受性評分方面均無統計學差異,表明3種藥物對胚胎質量及子宮內膜容受性的影響是相似的。
FSH在優質卵泡的生長以及優質卵子的產生中起到非常重要的作用,根據“兩細胞兩促性腺激素”假說,FSH作用于顆粒細胞,與顆粒細胞上的G蛋白家族受體結合通過cAMP依賴的蛋白激酶途徑誘導芳香化酶的活性、增加LH受體;FSH可剌激卵丘細胞分泌促卵母細胞成熟因子,也可促進卵丘細胞擴展,破壞卵丘細胞與卵母細胞之間的細胞連接,使得卵丘內的信息不能傳入卵母細胞而解除卵母細胞減數分裂的抑制狀態;還可通過調節卵巢內的肽類物質,如IGF、EGF等的生成調控卵泡發育[15]。IVF/ICSI-ET助孕中,尤其是垂體降調節后,抑制了內源性的Gn,而通過外源性Gn刺激提高FSH水平,使已募集的卵泡不致閉鎖并且能夠繼續發育[16],進一步使卵子成熟并獲取。如出現藥物的使用或藥物本身批間差異較大或不穩定,則卵泡及卵子在生長成熟過程中可能出現因FSH波動造成的生長卵泡及卵子數量的差異及質量的下降。因此,穩定的藥物生物學效應及作用對促排卵尤為重要。關于國產r-FSH,目前對其數據性總結分析的臨床研究較少,本中心通過參加中國紅十字基金會-成長天使基金“關愛家庭生育健康”公益項目資助,對使用患者情況進行總結分析,結果顯示國產r-FSH的各批次間,使用4d血藥濃度達到穩定后,升高血中FSH的情況無差異,Gn使用的天數、Gn使用總量、獲卵數亦均無統計學差異,可以看出國產r-FSH不同批次間效果穩定,這與其產品生產過程中精準的氨基酸序列、精準的空間結構折疊、精確的糖基化修飾有關。
綜上所述,本研究中所用的3種FSH制劑,因來源及生產工藝等的不同,人體內有不同的吸收及入血濃度;雖然卵泡的募集及生長均需要血中一定的FSH濃度,高濃度的FSH可能導致多卵泡發育或OHSS,但不同藥物提升的FSH濃度并不代表其可能的生物學效應,臨床促排卵需要根據不同藥物特點個體化治療。另外,國產r-FSH各批間藥效穩定,臨床助孕過程及助孕結局良好。

