關節鏡下微骨折術后早期CPM對膝關節軟骨損傷修復效果的影響研究
劉 軍,吳 凱,劉寶應
膝關節軟骨損傷為骨關節常見疾病,而關節軟骨無血管、神經及淋巴組織,損傷難以自行修復,若患者未得到及時治療,可發展為骨關節炎等疾病,嚴重影響患者日常工作及生活。目前,膝關節軟骨損傷常用治療方法有軟骨移植、軟骨再生及微骨折術。軟骨移植僅能修復較小面積缺損,且存在供區再損傷可能;軟骨再生可修復較大面積缺損,但再生軟骨耐磨性及韌性較差,仍需進一步完善[1];而微骨折術適用于中度軟骨損傷患者,且價格相對低廉,患者接受度較高。關節鏡下微骨折術具有操作簡單、創傷小、恢復快等優點,可通過人為制造微型骨折,使髓腔小血管破裂,致髓腔干細胞滲出在軟骨表面形成纖維凝塊,應力刺激軟骨修復機制,達到修復軟骨損傷、恢復關節功能的目的[2]。早期持續被動活動(continuous passive motion, CPM)為一種持續規律的早期非負重關節活動及應力刺激方法,可通過刺激骨髓干細胞和擠壓干細胞及生長因子均勻分布促進蛋白多糖及膠原蛋白形成,進而促進軟骨修復[3]。但目前關于微骨折術后早期CPM的研究較少。對此,本研究回顧性分析我院2013年6月—2017年6月收治的行關節鏡下微骨折術治療的61例膝關節軟骨損傷患者臨床資料,以探討關節鏡下微骨折術后早期CPM對軟骨損傷修復效果的影響,現報告如下。
1 資料與方法
1.1一般資料 61例膝關節軟骨損傷患者納入標準:術前經臨床及影像學檢查確診為膝關節軟骨損傷者;單膝損傷者;具有手術指征者;臨床資料完整者。排除標準:風濕性關節炎者;合并其他部位軟骨損傷者;伴血液、免疫系統疾病者;伴心、肝、腎等重要器官功能障礙者;溝通障礙者;隨訪期間失訪者。根據術后開始CPM時間的不同將所有患者分為觀察組32例和對照組29例。觀察組男19例,女13例;年齡29~47(38.19±7.02)歲;受傷側別:左側17例,右側15例;軟骨損傷面積2~5(3.79±0.71)cm2;損傷程度(Outerbridge分級):Ⅰ級4例,Ⅱ級7例,Ⅲ級9例,Ⅳ級12例;損傷部位:股骨內髁10例,髕骨關節面6例,股骨外髁5例,股骨滑車及內側脛骨平臺各4例,外側脛骨平臺3例;受傷原因:運動22例,摔倒10例;病程3~18(12.25±2.41)個月;手術時間67~110(84.65±17.36)min;術中出血量58~124(91.32±19.55)ml。對照組男16例,女13例;年齡29~47(37.24±7.11)歲;受傷側別:左側15例,右側14例;軟骨損傷面積2~5(3.67±0.69)cm2;損傷程度:Ⅰ級4例,Ⅱ級8例,Ⅲ級7例,Ⅳ級10例;損傷部位:股骨內髁11例,髕骨關節面5例,股骨外髁及股骨滑車各4例,內側脛骨平臺3例,外側脛骨平臺2例;受傷原因:運動21例,摔倒8例;病程3~17(12.11±2.25)個月;手術時間65~108(83.57±17.12)min;術中出血量55~120(90.59±19.04)ml。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準同意。
1.2治療方法
1.2.1對照組:給予關節鏡下微骨折術治療及術后24 h開始CPM的康復訓練。手術操作:①予手術入口及關節腔內局部浸潤麻醉(1%利多卡因10 ml+0.5%羅哌卡因40 ml),準備灌注液(0.9%氯化鈉溶液3000 ml)以保證術中視野清晰;②麻醉成功后行關節鏡探查,并灌注沖洗關節腔,清除懸浮的顆粒狀物質和軟骨碎屑;③取出關節腔內游離體,射頻清理增生滑膜組織,修整損傷半月板,行半月板部分成形術;④Ⅰ~Ⅲ級損傷者給予射頻消融修整軟骨創面,予軟骨成形術;⑤Ⅳ級損傷者予剝脫、分離不穩定軟骨碎片處理(使用刮匙、刨削器等器械磨削修整),顯露穩定的正常軟骨邊緣,并射頻修整軟骨邊緣為斜坡狀;⑥使用微骨折尖錐在軟骨缺損區鉆孔(孔距3 mm、孔間距3 mm、孔深3 mm),待關節腔灌注壓力降低,以見脂肪滴或孔中滲血為宜;⑦吸盡關節內液體,觀察創面滲血形成血凝塊情況,檢查是否存在遺漏區域,必要時補充穿孔,并待創面形成血凝塊后結束手術。康復訓練:①待麻醉消退后,指導患者進行踝、趾關節自主活動,每次15 min,5/d。②術后24 h開始CPM,具體方法:a.使用下肢HLPT-YTK-C型CPM儀(浙江省金華市博亞醫療器械有限公司生產),使患肢足尖朝上,固定大腿、小腿且不壓迫血管及神經,輔助患肢膝關節行被動屈膝訓練;b.訓練時使用固定帶,保證患肢活動角度達到要求,并在訓練期間觀察患者反應,對不能承受者適當調整角度,確保鍛煉有效;c.每日增加患肢活動角度10°,每次20 min,3/d;d.每次訓練后立即冰敷,若患者出現嚴重腫脹或關節液滲出加重,則適當減少訓練量;e.每日按時訓練,至膝關節屈曲達100°以上為止。總治療時間1周。③術后24 h輔助患者行床上患肢直腿高抬訓練,每分鐘10次,每次10 min,3~5/d。④術后6周內避免患肢負重,6周后據患者情況逐漸增加負重,8周后始練習上下樓,并12周內以循序漸進的方式逐漸恢復日常活動。
1.2.2觀察組:給予關節鏡下微骨折術治療及術后6 h開始CPM的康復訓練,手術方法同對照組,術后6 h開始CPM(總治療時間1周),余康復訓練同對照組。
1.3觀察指標 ①術前及術后2周時膝關節液相關指標:穿刺抽取兩組膝關節液0.5~1.0 ml,使用酶聯免疫吸附法(enzyme-linked immunosorbent assay, ELISA)檢測白細胞介素1β(IL-1β)、腫瘤壞死因子α(TNF-α)、基質金屬蛋白酶13(MMP13)水平,試劑由南京建成生物科技有限公司生產;采用ELISA法檢測Ⅱ型膠原C-端肽(CTX-Ⅱ)水平,試劑由美國桑切斯公司生產。②術前及術后24周時評估膝關節功能:使用中文版牛津膝關節評分(oxford knee score-Chinese version, OKS-CV)、Tegner運動功能評分評估兩組膝關節功能變化情況。OKS-CV量表包含12個條目,每個條目0~4分,總分為0~48分,評分越高表示膝關節功能越好[4];Tegner運動功能評分量表包含10項膝關節相關運動,根據患者自我運動能力評分,總分0~10分,評分越高表示膝關節運動功能越好[5]。并記錄兩組膝關節曲度。③術前及術后24周生活滿意度:使用生活滿意度量表(satisfaction with life scale, SWLS)評估兩組生活滿意度,該量表包含5個條目,每個條目1~7分,總分為5~35分,評分越高表示生活滿意度越高[6]。④治療期間并發癥發生情況。

2 結果
2.1兩組治療前后膝關節液相關指標比較 兩組術前膝關節液IL-1β、TNF-α、MMP13、CTX-Ⅱ水平比較差異無統計學意義(P>0.05)。術后2周時,兩組膝關節液IL-1β、TNF-α、MMP13、CTX-Ⅱ水平均較術前降低,且觀察組上述指標水平低于對照組,差異均有統計學意義(P<0.05或P<0.01),見表1。
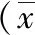
表1 術后不同時間行CPM的膝關節軟骨損傷兩組治療前后膝關節液IL-1β、TNF-α、MMP13、CTX-Ⅱ水平比較±s)
注:觀察組為予關節鏡下微骨折術治療及康復訓練中于術后6 h開始CPM的膝關節軟骨損傷患者組,對照組為予關節鏡下微骨折術治療及康復訓練中于術后24 h開始CPM的膝關節軟骨損傷患者組;CPM為持續被動活動,IL-1β為白細胞介素1β,TNF-α為腫瘤壞死因子α,MMP13為基質金屬蛋白酶13,CTX-Ⅱ為Ⅱ型膠原C-端肽;與同組術前比較,aP<0.05
2.2兩組治療前后膝關節功能比較 兩組術前OKS-CV評分、Tegner運動功能評分及膝關節曲度比較差異均無統計學意義(P>0.05)。術后24周時,兩組OKS-CV評分、Tegner運動功能評分及膝關節曲度均較術前升高,且觀察組上述指標均高于對照組,差異均有統計學意義(P<0.05或P<0.01),見表2。
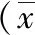
表2 術后不同時間行CPM的膝關節軟骨損傷兩組治療前后OKS-CV評分、Tegner運動功能評分及膝關節曲度比較±s)
注:觀察組為予關節鏡下微骨折術治療及康復訓練中于術后6 h開始CPM的膝關節軟骨損傷患者組,對照組為予關節鏡下微骨折術治療及康復訓練中于術后24 h開始CPM的膝關節軟骨損傷患者組;CPM為持續被動活動,OKS-CV為中文版牛津膝關節評分;與同組術前比較,aP<0.05
2.3兩組治療前后生活滿意度比較 兩組術前SWLS評分比較差異無統計學意義(P>0.05)。術后24周時,兩組SWLS評分均較術前升高,且觀察組高于對照組,差異均有統計學意義(P<0.01),見表3。
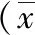
表3 術后不同時間行CPM的膝關節軟骨損傷兩組治療前后生活滿意度量表評分比較±s,分)
注:觀察組為予關節鏡下微骨折術治療及康復訓練中于術后6 h開始CPM的膝關節軟骨損傷患者組,對照組為予關節鏡下微骨折術治療及康復訓練中于術后24 h開始CPM的膝關節軟骨損傷患者組;CPM為持續被動活動,與同組術前比較,bP<0.01
2.4治療期間并發癥 觀察組治療期間出現1例(3.12%)關節液滲出加重,減少訓練量后緩解;對照組未出現明顯并發癥。
3 討論
關節軟骨為一種特異化固態的結締組織,大部分關節軟骨為透明軟骨,由軟骨細胞和基質構成[7-9]。基質中的膠原約占透明軟骨干重的60%,與關節軟骨抗張強度有關,其中Ⅱ型膠原為膠原的主要類型,也是纖維網的基本成分和關節軟骨的結構基礎[10-11]。而在病理狀態下,關節軟骨基質可由炎性因子等介導出現持續性降解,并引起軟骨細胞損傷,造成關節軟骨進一步損傷[12-13]。因此,關節軟骨基質修復對關節軟骨損傷治療非常重要。微骨折術可通過持續規律應力刺激間充質干細胞向軟骨細胞增殖及分化而促進軟骨修復,還能作用于缺損區周圍軟骨細胞使其分泌大量基質,使軟骨組織中膠原成分增多,利于軟骨再生[14]。近年來,我國腔鏡技術發展迅速,關節鏡不僅創傷小,而且術野清晰,在微骨折術中的應用越來越廣泛[15]。
但臨床研究發現,膝關節軟骨損傷術后6~8周內需嚴格限制負重,以避免術區承受過大負荷而阻礙纖維軟骨形成[16]。然而動物實驗研究表明,術后早期運動及應力刺激可促進蛋白多糖及Ⅱ型膠原形成,故在保證患肢適當運動的同時,避免患肢負重非常重要[17]。CPM則能通過儀器使患者患肢在無負重狀態下對創面行適當應力持續規律刺激,并通過運動使蛋白多糖及膠原蛋白均勻分散于創面及其周圍,對軟骨修復有積極意義[18]。本研究旨在觀察采用關節鏡下微骨折術后早期CPM治療膝關節軟骨損傷的效果,結果顯示:觀察組術后2周膝關節液IL-1β、TNF-α水平降低幅度大于對照組,考慮此結果與CPM增加關節周圍軟組織活動,改善血液循環,進而促進局部炎癥消散,使關節腔內炎性反應降低有關[19]。另外國內學者研究發現,IL-1β可誘導軟骨細胞凋亡,并抑制軟骨細胞增殖;而TNF-α則能增加關節局部毛細血管通透性,使局部組織水腫,阻礙局部組織修復[20]。故術后早期CPM不僅能降低軟骨損傷局部炎性反應,而且還能改善軟骨組織修復情況。此外,觀察組術后2周膝關節液MMP13、CTX-Ⅱ水平降低幅度也大于對照組。MMP13可降解Ⅱ型膠原,抑制軟骨修復;CTX-Ⅱ則為Ⅱ型膠原代謝產物,能反映Ⅱ型膠原代謝病理變化[21]。上述結果表明,關節鏡下微骨折術后早期CPM可減少透明軟骨降解,促進軟骨損傷修復和軟骨再生,有利于患者預后。
本研究還發現,觀察組術后24周OKS-CV評分、Tegner運動功能評分及膝關節曲度均優于對照組。分析原因為術后早期CPM可促進膝關節運動,使關節液中未分化的骨髓干細胞轉化為關節軟骨細胞,加速軟骨再生;且CPM造成關節內規律性壓力變化,使相關營養物質更易通過滑膜孔刺激關節內軟骨細胞代謝,從而促進膝關節恢復[22]。然而有學者認為,微骨折術后早期血凝塊難以承受持續性機械壓力,而應予科學制動,以維持關節軟骨組織的穩定性和持久性[23]。但本研究結果提示,術后早期CPM可促進軟骨組織修復,且不破壞術區血凝塊穩定性,與王立新和杜向陽[23]研究結果不一致。引起結果不一致的原因可能為:CPM通過儀器支撐患肢,一來可減少患肢負重,避免術區壓力增加;二來能調節患肢運動幅度和頻率,使患肢在適當范圍內運動,可避免不科學的運動方案導致術區負荷過大情況的發生[24]。不僅如此,觀察組術后24周SWLS評分也較術前明顯升高,進一步說明關節鏡下微骨折術后早期CPM對患者關節功能恢復有積極作用。也有學者指出,術后早期CPM可導致膝關節局部血管及神經受壓,或腫脹、滲出加重,影響患者術后恢復[25]。但本研究觀察組僅出現1例關節液滲出加重,未發生局部血管及神經受壓事件,對照組未出現明顯并發癥,提示術后早期CPM具有良好的安全性。但臨床在行膝關節軟骨損傷術后早期CPM時,仍應注意保護關節局部血管及神經,并根據患者具體情況調整訓練量,避免過度訓練引起腫脹、滲出加重等。
總之,關節鏡下微骨折術后早期CPM治療膝關節軟骨損傷,可有效降低術后關節腔內炎性反應程度,減少軟骨組織降解,促進關節軟骨修復及患肢膝關節功能恢復,對提高患者生活滿意度也有積極意義,且安全性良好。

