奧瑪環素研究進展
董璐瑤,李國慶,游雪甫,楊信怡
綜述
奧瑪環素研究進展
董璐瑤,李國慶,游雪甫,楊信怡
100050 北京,中國醫學科學院北京協和醫學院醫藥生物技術研究所抗感染藥物研究北京市重點實驗室(董璐瑤、李國慶、游雪甫、楊信怡);610000 成都,四川大學華西藥學院(董璐瑤)
奧瑪環素(omadacycline),別名 PTK 0796,是美國 Paratek 制藥公司開發的新型半合成四環素,由 Honeyman 等[1-3]通過兩步法從米諾環素衍生化獲得,為首個成功進入臨床應用的氨甲基四環素品種。其化學結構如圖 1 所示,分子式為 C29H40N4O7,相對分子量為 556.65。有別于替加環素(tigecycline)、eravacycline 等甘氨酰四環素,其主要結構特點是在米諾環素結構基礎上進行 C9 位氨甲基修飾,該修飾可幫助奧瑪環素克服細菌耐藥性、擴大抗菌譜、改善藥代動力學特性[3]。2018 年 10 月 2 日,奧瑪環素(對甲苯磺酸鹽:MW728.9)的靜脈注射劑及口服片劑獲得美國食品藥品監督管理局(FDA)批準上市,注冊的英文商品名為 Nuzyra,是繼 eravacycline 后 FDA 在同年批準的第二個新型廣譜四環素類抗生素[4]。2019 年第一季度,Paratek 制藥公司啟動奧瑪環素在美國醫療市場的推廣,同時,三種基于奧瑪環素的抗菌藥敏試驗產品(藥敏紙片、試紙條、MIC 微稀釋藥敏板)也先后獲得 FDA 批準上市[5]。奧瑪環素采用每日單劑量口服或靜脈用藥,主要用于治療成人的社區獲得性細菌性肺炎(CABP)和急性細菌性皮膚和皮膚結構感染(ABSSSI)。在我國,再鼎醫藥公司于 2017 年從 Paratek 公司獲得該藥在大中華區研發、生產、商業化的獨家許可。
本文重點圍繞奧瑪環素最新臨床前和臨床研究進展,從藥物作用機制及潛在耐藥性、臨床前藥理學、藥代動力學及臨床療效評價等方面作一綜述,為醫藥工作者提供參考。
1 作用機制與潛在耐藥性
奧瑪環素通過四環素類抗生素經典機制發揮作用,特異性地結合細菌核糖體30S 亞基的 A 位點,抑制氨酰基-tRNA 與該位點正常結合,致肽鏈延伸終止,阻斷蛋白質合成從而產生抑菌作用。體外條件下,其與核糖體 30S 亞基的親和力明顯強于四環素[6-7]。四環素類抗生素與 30S 亞基的結合具有可逆性,因此通常顯示抑菌活性。然而,體外條件下,奧瑪環素對肺炎鏈球菌、流感嗜血桿菌、卡他莫拉菌呈明顯殺菌活性[8]。
針對四環素類抗生素,細菌可利用基因編碼的外排泵、核糖體保護蛋白、修飾酶等機制產生耐藥性,尤以前兩種耐藥方式最為普遍。目前,在細菌中,已報道的外排泵編碼基因不少于23 種[如(A) ~(E)、(G)、(H)、(J)、(B) 等],核糖體保護基因不少于 11 種[如(M)、(O)、(S)、(A) 等][9]。編碼并已確認功能的修飾酶基因也有11 種[(X)、(47) ~(56)],其中(X)、(56) 已于人體病原菌中發現[9-12]。2014 – 2019 年,研究者先后采用 231 株攜帶外排泵編碼基因[(A) ~(D)、(J)、(41)、(K)、(L)]和(或)核糖體保護基因[(M)、(O)]的四環素耐藥菌檢測奧瑪環素的抗菌活性。結果顯示,奧瑪環素對金黃色葡萄球菌(以下均簡稱金葡菌)、腸球菌、鏈球菌屬、大腸埃希菌的最小抑菌濃度(MIC)分別為 0.125 ~ 2、0.125 ~ 1、≤ 0.06 ~ 0.5、0.25 ~ 4 μg/ml,明顯低于對照藥四環素和多西環素(MIC 分別為 4 ~ > 64 和≤ 0.06 ~ 64 μg/ml),顯示奧瑪環素較前代四環素品種能更有效克服上述兩類耐藥機制[2, 6, 13]。

圖 1 奧瑪環素(A)與米諾環素(B)化學結構式
現認為,奧瑪環素 C7 的修飾基團有助于其克服細菌外排泵耐藥機制,而 C9 的氨甲基修飾可使其克服細菌的核糖體保護機制。這可能與前者使其結構難以成為外排泵的有效底物,而后者可大幅增強其與核糖體的親和力有關[13-14]。不過,奧瑪環素并不能抵抗 Tet(X) 等修飾酶的作用。Tet(X) 屬四環素破壞酶類,具黃素單加氧酶活性。針對替加環素的研究顯示,在 O2、NADPH、Mg2+存在的情況下,Tet(X) 會通過輔酶黃素腺嘌呤二核苷酸將替加環素母核 D 環的 C11α 羥化,從而使藥物對核糖體的親和力下降(解離常數增至 2 倍以上),難以抑制細菌蛋白質合成[15]。奧瑪環素因具相同的母核 D 環結構,推測同樣無法克服這類修飾酶的破壞作用。最近我國報道了 3 株攜帶(X4) 耐替加環素(MIC = 4 ~ 8 μg/ml)的大腸埃希菌亦對奧瑪環素低敏感(MIC = 4 ~ 8 μg/ml),也證實了這一推測[16]。
2 臨床前藥理學
2.1 體外抗菌活性
奧瑪環素抗菌譜廣,與其他類型抗生素無交叉耐藥性,對臨床常見革蘭氏陽性菌、革蘭氏陰性菌、非典型病原體、厭氧菌等均具有良好的抑菌活性。截至目前,全球范圍內已測定逾 10 萬株臨床分離菌對奧瑪環素的體外藥敏[17-19]。
表 1 ~ 3 匯總了 2016 年 SENTRY 抗菌藥物監測項目中68 家醫療機構從住院病人分離的 21000 株臨床菌對奧瑪環素的體外藥敏數據[17]。

表 1 奧瑪環素及對照藥對革蘭氏陽性菌和革蘭氏陰性菌的體外抗菌活性
續表 1

細菌(菌株數)奧瑪環素 四環素 替加環素 MIC 范圍(μg/ml)MIC50(μg/ml)MIC90(μg/ml) MIC 范圍(μg/ml)MIC50(μg/ml)MIC90(μg/ml) MIC 范圍(μg/ml)MIC50(μg/ml)MIC90(μg/ml) 肺炎克雷伯菌(1771)0.25 ~ 3228 ≤ 0.25 ~ 162> 16 ≤ 0.06 ~ 411 肺炎克雷伯菌 CS(1264)0.25 ~ 3214 ≤ 0.25 ~ 161> 16 ≤ 0.06 ~ 40.50.5 肺炎克雷伯菌 CNS(507)0.25 ~ 3228 0.5 ~ 1616> 16 ≤ 0.06 ~ 422 肺炎克雷伯菌 TR(430)0.5 ~ 32416 --- ≤ 0.06 ~ 422 產酸克雷伯菌(423)0.25 ~ 3212 ≤ 0.25 ~ 1618 ≤ 0.06 ~ 20.50.5 產酸克雷伯菌 TR(30)0.25 ~ 32216 --- ≤ 0.06 ~ 211 陰溝腸桿菌復合群(752)0.25 ~ 3224 0.5 ~ 16216 0.12 ~ 40.50.5 陰溝腸桿菌復合群 CS(542)0.5 ~ 3224 0.5 ~ 1624 0.12 ~ 40.50.5 陰溝腸桿菌復合群 CNS(210)0.25 ~ 3224 1 ~ 162> 16 0.12 ~ 411 陰溝腸桿菌復合群 TR(87)1 ~ 32416 --- 0.12 ~ 422 其他腸桿菌屬(250)0.5 ~ 1614 0.5 ~ 1614 0.12 ~ 40.50.5 其他腸桿菌屬 TR(17)2 ~ 161616 --- 0.5 ~ 422 枸櫞酸桿菌屬(354)0.25 ~ 1614 0.5 ~ 1614 0.12 ~ 20.50.5 枸櫞酸桿菌屬 TR(23)0.5 ~ 848 --- 0.12 ~ 211 奇異變形桿菌(463)2 ~ 3216> 32 1 ~ 16> 16> 16 0.25 ~ 844 奇異變形桿菌 TR(458)2 ~ 3216> 32 --- 0.25 ~ 844 變形桿菌屬 IP(317)0.5 ~ 32832 0.5 ~ 1616> 16 0.25 ~ 822 變形桿菌屬 IP,TR(169)0.5 ~ 32832 --- 0.25 ~ 822 流感嗜血桿菌(803)0.12 ~ 1611 ≤ 0.06 ~ 80.51 0.06 ~ 10.250.25 流感嗜血桿菌 BLP(201)0.25 ~ 411 0.25 ~ 10.50.5 0.06 ~ 10.250.25 流感嗜血桿菌 BLN(602)0.12 ~ 1611 ≤ 0.06 ~ 80.51 0.06 ~ 10.250.25 卡他莫拉菌(408)0.06 ~ 0.50.250.25 0.12 ~ 0.50.250.5 ≤ 0.015 ~ 0.120.060.06
注:MSSA = 甲氧西林敏感金葡菌;MRSA = 甲氧西林耐藥金葡菌;PS = 青霉素敏感;PI = 青霉素中介;PR = 青霉素耐藥;TR = 四環素耐藥;VS = 萬古霉素敏感;VNS = 萬古霉素不敏感;BLN = β-內酰胺酶陰性;BLP = β-內酰胺酶陽性;CNS = 頭孢他啶不敏感;CS = 頭孢他啶敏感;IP = 吲哚陽性;MIC = 最小抑菌濃度。
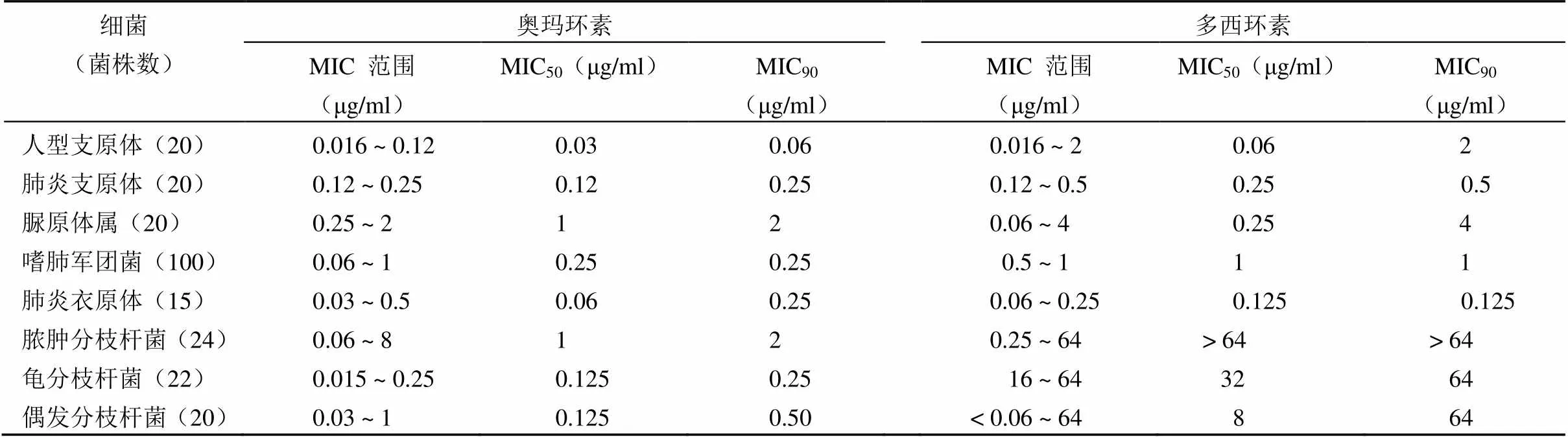
表 2 奧瑪環素及對照藥對非典型病原體的體外抗菌活性

表 3 奧瑪環素及對照藥對厭氧菌的體外抗菌活性
盡管美國臨床和實驗室標準協會(CLSI)和歐盟抗菌藥敏試驗委員會(EUCAST)尚未制訂針對奧瑪環素的體外藥敏折點,但根據 FDA 建立的敏感/中介/耐藥判斷標準(金葡菌≤ 0.5/1.0/≥ 2.0;糞腸球菌≤ 0.25/0.5/≥ 1.0;鏈球菌≤ 0.12/0.25/≥ 0.5;腸桿菌科細菌≤ 4/8/≥ 16;流感/副流感嗜血桿菌≤ 2/4/≥ 8,單位:μg/ml)可以看到,奧瑪環素對革蘭氏陽性菌體外抗菌活性很強,95.5% ~ 100% 的受試革蘭氏陽性菌對奧瑪環素敏感,且該藥對 MRSA、VNSE、PRSP、各類四環素耐藥株、大環內酯耐藥株的 MIC90明顯低于四環素(0.12 ~ 0.5 μg/ml vs.4 ~ > 16 μg/ml),僅稍高于替加環素(0.06 ~ 0.25 μg/ml)。受試革蘭氏陰性菌中,88% 的腸桿菌科細菌、99.4% 的流感嗜血桿菌、94.4% 的副流感嗜血桿菌、100% 的卡他莫拉菌對奧瑪環素敏感。腸桿菌科細菌中,尤以大腸埃希菌對奧瑪環素敏感性最高(敏感率 99%,MIC50和 MIC90分別為 0.5 和 2 μg/ml),且四環素耐藥株的敏感率亦可達 97.2%。此外,4 μg/ml 的奧瑪環素對 89.7% 的肺炎克雷伯菌、96.0% 的產酸克雷伯菌、93.6% 的陰溝腸桿菌、96.0% 的枸櫞酸桿菌屬、85.2% 的粘質沙雷氏菌、71.2% 的鮑曼不動桿菌、82.2% 的嗜麥芽窄食單胞菌,以及 67.7% ~ 76.7% 的四環素耐藥株具有抑制作用。但奧瑪環素對假單胞菌屬、變形桿菌屬、普羅維登菌屬、摩根氏菌屬體外抗菌活性不佳[17-18, 20]。
奧瑪環素對支原體、衣原體、嗜肺軍團菌、快速生長分枝桿菌等非典型病原體均具良好體外抗菌活性,MIC90明顯低于多西環素(0.06 ~ 2 μg/ml vs. 0.125 ~ > 64 μg/ml)。其對厭氧菌的體外抗菌活性與替加環素類似,對脆弱擬桿菌、擬桿菌、產氣莢膜梭狀芽胞桿菌、艱難梭菌的 MIC90分別為4、1、16 和 0.5 μg/ml[17, 20]。該藥對貓、犬咬傷引起感染的多種細菌也具有抗菌活性,例如其對多殺巴斯德氏菌的 MIC 為 0.25 μg/ml,但對艾肯氏和諾卡氏菌的抗菌活性較弱,MIC90分別為 16 和 8 μg/ml[20]。此外,體外聯合藥敏試驗顯示奧瑪環素與臨床常用的抗菌藥物均不存在拮抗作用[21]。
2.2 抗生素后效應
Hinshaw 等[22]測定了奧瑪環素作用于金葡菌、肺炎鏈球菌、腸球菌、大腸埃希菌的抗生素后效應(PAE),他們將 5 倍 MIC 的奧瑪環素作用于受試菌 1 h 后移除,并繼續監測細菌的生長抑制曲線。結果顯示奧瑪環素對 4 種受試菌的 PAE 優于利奈唑胺,與替加環素類似,但后者對腸球菌的 PAE 時間更長。
2.3 體內抗菌活性
Macone等[13]采用包括四環素/阿奇霉素耐藥肺炎鏈球菌在內的多個菌株作為感染菌,評價了奧瑪環素在 CD-1 小鼠全身感染模型中的體內抗菌效應。結果顯示,奧瑪環素治療小鼠的半數有效劑量(ED50)總體與替加環素相當(0.30 ~ 3.34 mg/kg vs. 0.58 ~ 4.13 mg/kg),低于萬古霉素、多西環素、利奈唑胺等對照藥(0.91 ~ > 54 mg/kg)。此外,Lepak、Endermann、McKenney、Steenbergen、Kim 等采用多種實驗動物感染模型,系統地評價了奧瑪環素的體內抗菌活性及療效[17, 23-25]。總體而言,在不同體內感染模型中,奧瑪環素與對照藥物比較,均表現出不俗的抗菌療效,具體結果參見表 4。值得注意的是,由于嚙齒類動物口服奧瑪環素的生物利用度較低,故動物試驗中多數采用靜脈或腹腔給藥方式[13, 17]。
3 藥代動力學
3.1 健康受試者
I 期臨床研究中,健康受試者單劑量靜脈注射奧瑪環素 100 mg、口服奧瑪環素 300、450、600 mg 的藥代動力學(PK)參數見表 5[26]。結果顯示,奧瑪環素max、與口服劑量正相關,藥物口服吸收較快,絕對生物利用度 34.5%,即 300 mg 口服與 100 mg 靜注的血藥濃度基本相當[27-29]。奧瑪環素的血漿蛋白質結合率低(21.3% ± 9.7%),表觀分布容積大(300 mg 口服達794 L),后者提示藥物組織滲透率高,治療全身性感染時具有優勢。該藥易滲透至上皮細胞襯液(ELF)中,表明其是治療下呼吸道細菌感染的有效選擇。在一項包含 58 名健康成人受試者的 I 期臨床對比研究中,研究者發現奧瑪環素組受試者血漿、ELF、肺泡細胞中的0-24和0-12水平均為替加環素組的3 倍[30]。奧瑪環素全身清除率低(11 ~ 35 L/h)、消除半衰期長(13 ~ 17 h),支持每天一次給藥。靜脈注射 100 mg 奧瑪環素,27% 以原型經腎臟排出,腎臟清除率為 2.4 ~3.3 L/h;口服 300 mg 奧瑪環素時則主要由糞便排出(77.5% ~ 84.0%),另約 14.4% 經腎臟排出[27-28, 30-31]。
研究中發現,奧瑪環素的吸收受膳食種類及攝入時間的影響。與給藥前禁食(max= 0.548 μg/ml,= 9.399 h·μg/ml)相比,給藥前 2 小時攝入高脂非乳制品食物和高脂乳制品食物會使受試者max和分別降至 0.329、0.318 μg/ml 和 3.854、3.478 h·μg/ml[28]。研究者通過進一步對比口服給藥前 4 小時和服藥后 2 小時內禁食測得的奧瑪環素 PK 數據,建議奧瑪環素服藥前 4 小時、服藥后 2 小時內均應嚴格禁食(可飲水),且用藥后 4 小時內應避免攝入乳制品、抗酸劑、維生素、含二價或三價陽離子的食物[28]。
3.2 特殊人群
I 期臨床研究中,Berg 等[31]報道晚期腎病(ESRD)患者透析前后靜脈注射 100 mg 奧瑪環素,各項 PK 參數與健康受試者比較無統計學差異。另一項研究中比較了輕、中、重度肝臟損傷受試者與健康受試者靜脈注射和口服奧瑪環素(單劑量 50 mg 或 100 mg 靜脈注射,單劑量 150 mg 或 300 mg 口服)的 PK 參數,結果顯示各肝損組與對照組患者間亦無顯著差別[28]。為進一步考察年齡、性別對奧瑪環素 PK 參數的影響,另有研究者[28]分別測定了青年(33 ~43 歲)和老年(65 ~ 73歲)男、女性受試者單劑量口服200 mg 奧瑪環素后的 PK 數據。盡管兩年齡段女性受試者的均值(13.57和 16.12 h·μg/ml)均略高于對應的男性受試者(9.33 和 9.99 h·μg/ml),但組間缺乏統計學意義[28]。因此,現認為奧瑪環素的 PK 不受患者年齡、性別、腎功或肝功不全影響,相應患者用藥時無需調整劑量[21]。

表 4 不同動物模型中奧瑪環素的抗菌效果


表 5 健康人體單次給予奧瑪環素后藥代動力學參數標黃請核對
注:= 血藥濃度-時間曲線下面積;max= 峰濃度;1/2= 消除半衰期;max= 達峰時間;a采自100 mg 靜脈給藥、300 mg 口服、450 mg口服劑量健康受試者。
3.3 PK/PD
同其他四環素類藥物一樣,奧瑪環素主要的 PK/PD 參考指標為/MIC,常作為體內給藥量及抗菌活性的預測指標。I 期臨床研究中,參考藥物對肺炎鏈球菌和 MSSA 的 MIC 水平,奧瑪環素組受試者(n = 41,首日每 12 小時00 mg 靜注兩次,繼而每日一次 100 mg 靜注)對這兩種病原菌的0-24/MIC90分別是替加環素對照組受試者(n = 17,首日 100 mg 靜注給藥一次,繼而每日一次 50 mg 靜注)的 3.2 倍(97.8 vs. 30.8)和 1.5 倍(46.9 vs.30.8)[8, 32]。
3.4 藥物相互作用
人肝細胞和肝微粒體體外試驗顯示奧瑪環素肝臟代謝率極低,既非細胞色素P450 酶也非葡萄糖醛酸轉移酶的有效底物、誘導劑或抑制劑。I 期臨床研究中觀察到,受試者給予 P-糖蛋白(P-gp)抑制劑可使 300 mg 單劑量口服奧瑪環素的和max分別升高 25% 和 9%,該藥遂被認為是 P-gp 底物,但其并不抑制和誘導 P-gp 的轉錄表達。此外,奧瑪環素不是其他轉運蛋白如 OAT-1、OAT-3、OATP1B1、OATP1B3、BCRP、MRP2 的底物,亦不抑制這些蛋白的表達。鑒于此,人們認為奧瑪環素體內與其他藥物發生相互作用的風險較低[28-29]。
4 臨床療效
2012 年的隨機、單盲、多中心 II 期臨床試驗中首次比較了奧瑪環素與利奈唑胺聯合或不聯合氨曲南治療復雜性皮膚和皮膚軟組織感染(cSSSI,現稱ABSSSI)的療效。219 例患嚴重膿腫、傷口感染、下肢潰瘍、蜂窩織炎的 cSSSI 成年患者(≥18 歲)隨機入組,分別接受奧瑪環素(100 mg iv. qd./d,可改為200 mg po. qd./d)和利奈唑胺(600 mg iv. bid./d,可改為 600 mg po. bid./d)治療。在停藥后 7 ~ 14 d 的療效判定(TOC)終點,意向治療(ITT)、調整意向治療(MITT)、臨床可評估(CE)、微生物學可評估(ME)各患者群中奧瑪環素的治療成功率均高于利奈唑胺。
2018 年兩項隨機、雙盲、多中心 III 期臨床試驗OASIS 和 OASIS-2 進一步比較了奧瑪環素與利奈唑胺治療急性細菌性皮膚和皮膚結構感染(ABSSSI)成年受試者的安全性和有效性。兩研究分別入組 655 例和 735 例 ABSSSI 患者,其中傷口感染、蜂窩織炎、嚴重膿腫各占 33%、38%、29% 和 58%、24%、18%。受試者 1:1 隨機分配接受奧瑪環素(OASIS:首日100 mg iv. bid./d,后100 mg iv. qd./d,3 d 后可改為 300 mg po. qd./d;OASIS-2:450 mg po. qd./d,2 d 后 300 mg iv. qd./d)或利奈唑胺(OASIS:100 mg iv. bid./d,3 d 后可改為 600 mg po. bid./d;OASIS-2:600 mg po. bid./d)治療 7 ~ 14 d。結果顯示,無論在給藥后 48 ~ 72 h 早期臨床反應的 FDA 主要終點 ECR,或末次給藥后 7 ~ 14 d 的歐洲藥監局(EMA)主要終點 PTE,奧瑪環素 MITT 和 CE 患者群的治療成功率和細菌清除率(如 MRSA 85.6% vs. 79.4%,化膿性鏈球菌 69% vs. 56.3%,鏈球菌屬 86% vs. 73.3%,萬古霉素敏感糞腸球菌 100% vs. 70%)等同或高于利奈唑胺。最終,II、III 期臨床試驗結果均顯示奧馬環素治療 ABSSSI 的療效不劣于利奈唑胺。
始于 2017 年的另一項隨機、雙盲、多中心 III 期臨床試驗(OPTIC)則比較了奧瑪環素與莫西沙星治療社區獲得細菌性肺炎(CABP)成年受試者的安全、有效性。774 例 CABP 患者隨機入組接受奧瑪環素(首日 100 mg iv. bid/d,后 100 mg iv. qd/d,3 d 后可改為 300 mg po. qd./d)和莫西沙星(400 mg iv. qd/d,3 d 后可改為 400 mg po. bid./d)治療 7 ~ 14 d。在給藥后 72 ~ 120 h 的 ECR 和末次治療后5 ~ 10 d 的 PET,奧馬環素治療 OPTIC 的成功率和細菌清除率(如對非典型病原體 92.4% vs. 91.5%,革蘭氏陰性菌 84.8% vs. 80.9%,肺炎鏈球菌 86% vs. 91.2%,金葡菌 86% vs. 91.2%)均不劣于莫西沙星[21, 33]。II、III 期臨床試驗中奧瑪環素及對照藥對各受試人群的療效比較參見表 6[33]。
5 不良反應
OPTIC 和 OASIS/OASIS-2 的 III 期臨床試驗中,奧瑪環素受試患者中總的治療相關不良反應(TEAE)發生率低于莫西沙星組(41.1% vs. 48.5%),稍高于利奈唑胺組(OASIS:48.3% vs. 45.7%;OASIS-2:53.5% vs. 37.3%)。奧瑪環素組最常見的不良反應是輕度胃腸道反應(惡心、嘔吐)、注射部位反應、丙氨酸氨基轉移酶(ALT)升高,其他氨酸氨基轉移酶(AST、GGT)升高、高血壓、頭痛、腹瀉、便秘、失眠等亦較常見,但多數 TEAE 在試驗期間得以解決,未導致治療中斷,部分常見 TEAE 參見表 7。需注意的是,在人類牙齒發育過程中(妊娠中/晚期、嬰兒期、8 歲以下兒童期),使用奧瑪環素可能導致永久性牙齒變色(黃灰牙、棕色牙)和牙釉質發育不全,及可逆性的骨生長抑制(停藥后可恢復)。使用該藥還可能引起抗凝劑樣作用、毒蕈堿受體拮抗作用(心率加快),但誘發臨床意義上的心律不齊、血壓升高、心血管毒性的可能性小。另外,該藥有誘發艱難梭狀芽胞桿菌相關性腹瀉(CDAD)風險,但最近一項人結腸臨床監測模型中,使用該藥每日一次連續灌注7 d,雖對腸道菌群中的雙歧桿菌、脆弱芽孢桿菌、乳桿菌、腸球菌有明顯殺減作用(降低 2 ~ 8 log10CFU/ml),但并無促進艱難梭菌發芽或毒素產生的證據,而對照使用的莫西沙星則在相同條件下明顯誘導 CDI(營養細胞增殖和可檢測毒素),提示奧瑪環素在臨床環境中誘導 CDAD 的風險性尚低[21, 29, 33-35]。總之,綜合三項 III 臨床試驗結果及其他治療相關分析,奧瑪環素在患者中總體安全且耐受性良好。

表 6 II、III 期臨床試驗中奧瑪環素治療患者的臨床療效
注:ABSSSI = 急性細菌性皮膚和皮膚結構感染;CABP = 社區獲得性細菌性肺炎;cSSSI = 復雜皮膚及皮膚結構感染;OASIS = 奧瑪環素治療急性細菌性皮膚和皮膚結構感染研究;OPTIC = 奧瑪環素治療社區獲得性肺炎研究;CI = 置信區間;TOC = 療效判定終點;ITT = 意向治療人群;MITT = 調整意向治療人群;CE = 臨床可評估人群;ME = 微生物學可評估人群;ECR = 早期臨床反應;PTE = 治療后評價。

表 7 III 期臨床試驗中患者出現的奧瑪環素治療相關不良反應數及比例(%)
注:ABSSSI = 急性細菌性皮膚和皮膚結構感染;CABP = 社區獲得性細菌性肺炎;iv = 靜脈注射;po = 口服給藥;OASIS = 奧瑪環素治療急性皮膚和皮膚結構感染研究;OPTIC = 奧瑪環素治療社區獲得性肺炎研究;ALT = 丙氨酸氨基轉移酶。
6 小結與展望
近十多年來,新型四環素藥物的開發方興未艾,替加環素、eravacycline、sarecycline、奧瑪環素等相繼問世。奧瑪環素的開發初衷,是為尋找克服細菌對現有四環素品種的耐藥性,同時提供抗菌譜廣、口服生物利用度高、消化道副作用低的品種,從該藥目前的臨床表現來看,已實現上述目標。奧瑪環素主要優點是 PK 參數不受年齡、性別、肝/腎功能影響,與其他藥物相互作用風險低,從而用藥劑量固定、處方簡單,尤其對于無法服用其他抗生素(如氟喹諾酮類、β-內酰胺類)的患者,該藥無疑是一種很好的選擇。過去十余年中,除利奈唑胺、德拉沙星(delafloxacin)等少數品種,針對 CABP 和 ABSSSI 新開發的大多數抗生素為靜脈注射劑型,在療效相當前提下,與需入院靜脈輸注的藥物相比,奧瑪環素這類口服藥物應可有效節省患者的醫療成本。目前,臨床上對于替加環素治療碳青霉烯耐藥腸桿菌科細菌(CRE)引起的醫院獲得性肺炎(HAP)、呼吸機相關性肺炎(VAP)的療效尚存疑義,隨著奧瑪環素的上市,未來人們亦會關注其治療 HAP、VAP 的情況。考慮到奧瑪環素對包括 MRSA、VRE、PRSP、CRE 和耐多藥不動桿菌屬在內的諸多耐藥菌擁有不錯的體內、外抗菌活性,人們對其治療包括 CRE 在內的耐藥菌導致的HAP、VAP抱有良好期待。另外,為進一步擴展其適應證,該藥兩項治療尿路感染(一項治療膀胱炎和單純性 UTI,一項治療急性腎盂腎炎)的 II 期臨床試驗正在進行中。鑒于奧馬環素在已有臨床試驗中的優異表現,人們對其治療 UTI 亦有良好期望[3,8, 20, 35-36]。
[1] Villano S, Steenbergen J, Loh E. Omadacycline:development of a novel aminomethylcycline antibiotic for treating drug-resistant bacterial infections. Future Microbiol, 2016, 11(11):1421-1434.
[2] Honeyman L, Ismail M, Nelson ML, et al. Structure-activity relationship of the aminomethylcyclines and the discovery of omadacycline. Antimicrob Agents Chemother, 2015, 59(11):7044- 7053.
[3] Dur?es F, Sousa E. Omadacycline:a newly approved antibacterial from the class of tetracyclines. Pharmaceuticals (Basel), 2019, 12(2):E63.
[4] Chambers HF. Omadacycline - the newest tetracycline. N Engl J Med, 2019, 380(6):588-589.
[5] Paratek Pharmaceuticals. Paratek pharmacruticals launches NUZYRA (Omadacycline) in the United States. (2019-02-05) [2019-10-28]. http://www.globenewswire.com/news-release/2019/02/05/1710995/0/en/Paratek-Pharmaceuticals-Launches-NUZYRA-Omadacycline-in-the-United-States.html.
[6] Draper MP, Weir S, Macone A, et al. Mechanism of action of the novel aminomethylcycline antibiotic omadacycline. Antimicrob Agents Chemother, 2014, 58(3):1279-1283.
[7] Olson MW, Ruzin A, Feyfant E, et al. Functional, biophysical, and structural bases for antibacterial activity of tigecycline. Antimicrob Agents Chemother, 2006, 50(6):2156-2166.
[8] Burgos RM, Rodvold KA. Omadacycline:a novel aminomethylcycline. Infect Drug Resist, 2019, 12:1895-1915.
[9] Roberts MC. Update on acquired tetracycline resistance genes. FEMS Microbiol Lett, 2005, 245(2):195-203.
[10] Thaker M, Spanogiannopoulos P, Wright GD. The tetracycline resistome. Cell Mol Life Sci, 2010, 67(3):419-431.
[11] Tian Z, Zhang Y, Yang M. The origin, environmental distribution and potential application of tetracycline resistance gene-tet(X). Environ Chem, 2014, 33(12):2027-2037. (in Chinese)
田哲, 張昱, 楊敏. 四環素類藥物酶修飾基因-tet(X)的起源、分布及在環境中的作用. 環境化學, 2014, 33(12):2027-2037.
[12] Park J, Gasparrini AJ, Reck MR, et al. Plasticity, dynamics, and inhibition of emerging tetracycline resistance enzymes. Nat Chem Biol, 2017, 13(7):730-736.
[13] Macone AB, Caruso BK, Leahy RG, et al. In vitro and in vivo antibacterial activities of omadacycline, a novel aminomethylcycline. Antimicrob Agents Chemother, 2014, 58(2):1127-1135.
[14] Someya Y, Yamaguchi A, Sawai T. A novel glycylcycline, 9-(N,N-dimethylglycylamido)-6-demethyl-6-deoxytetracycline, is neither transported nor recognized by the transposon Tn10-encoded metaltetracycline/H+ antiporter. Antimicrob Agents Chemother, 1995, 39(1):247-249.
[15] Moore IF, Hughes DW, Wright GD. Tigecycline is modified by the flavin-dependent monooxygenase TetX. Biochemistry, 2005, 44(35):11829-11835.
[16] Chen C, Cui CY, Zhang Y, et al. Emergence of mobile tigecycline resistance mechanism in Escherichia coli strains from migratory birds in China. Emerg Microbes Infect, 2019, 8(1):1219-1222.
[17] Karlowsky JA, Steenbergen J, Zhanel GG. Microbiology and preclinical review of omadacycline. Clin Infect Dis, 2019, 69(Supplement_1):S6-S15.
[18] Pfaller MA, Huband MD, Shortridge D, et al. Surveillance of omadacycline activity tested against clinical isolates from the United States and Europe as part of the 2016 SENTRY Antimicrobial Surveillance Program. Antimicrob Agents Chemother, 2018, 62(4):e02327-17.
[19] Huband MD, Pfaller MA, Shortridge D, et al. Surveillance of omadacycline activity tested against clinical isolates from the United States and Europe:Results from the SENTRY Antimicrobial Surveillance Programme, 2017. J Glob Antimicrob Resist, 2019, 19:56-63.
[20] Watkins RR, Deresinski S. Omadacycline:a novel tetracycline derivative with oral and intravenous formulations. Clin Infect Dis, 2019, 69(5):890-896.
[21] Baker DE. Omadacycline. Hosp Pharm, 2019, 54(2):80-87.
[22] Hinshaw R, Stapert L, Shinabarger D, et al. Post-antibiotic effect of omadacycline against target pathogens//American Society of Microbiology (ASM) Microbe, Boston, MA, 2016:Abstract 512. [2019-10-28]. https://paratekpharma.com/media/1272/post-antibiotic- effect-of-omadacycline-against-target-pathogens-6-21-16.pdf.
[23] Lepak AJ, Zhao M, Marchillo K, et al. In vivo pharmacodynamic evaluation of omadacycline (PTK 0796) against Streptococcus pneumonia in the murine pneumonia model. Antimicrob Agents Chemother, 2017, 61(5):e02368-16.
[24] Lepak AJ, Zhao M, Marchillo K, et al. In vivo pharmacodynamics evaluation of omadacycline (PTK 0796) against Staphylococcus aureus (SA) in the murine thigh infection model//IDWeek, San Diego, CA, 2017:Abstract 1531. [2019-10-28]. https://idsa.confex.com/idsa/ 2017/webprogram/Paper65611.html.
[25] Steenbergen J, Tanaka SK, Miller LL, et al. In vitro and in vivo activity of omadacycline against two biothreat pathogens, Bacillus anthracis and Yersinia pestis. Antimicrob Agents Chemother, 2017, 61(5):e02434-16.
[26] Bundrant LA, Tzanis E, Garrity-Ryan L, et al. Safety and pharmacokinetics o f the aminomethylcycline antibiotic omadacycline administered to healthy subjects in oral multiple-dose regimens. Antimicrob Agents Chemother, 2018, 62(2):e01487-17.
[27] Sun H, Ting L, Machineni S, et al. Randomized, open-label study of the pharmacokinetics and safety of oral and intravenous administration of omadacycline to healthy subjects. Antimicrob Agents Chemother, 2016, 60(12):7431-7435.
[28] Rodvold KA, Pai MP. Pharmacokinetics and pharmacodynamics of oral and intravenous omadacycline. Clin Infect Dis, 2019, 69(Supplement_1):S16-S22.
[29] Gallagher JC. Omadacycline:a modernized tetracycline. Clin Infect Dis, 2019 , 69(Supplement_1):S1-S5.
[30] Gotfried MH, Horn K, Garrity-Ryan L, et al. Comparison of omadacycline and tigecycline pharmacokinetics in the plasma, epithelial lining fluid, and alveolar cells of healthy adult subjects. Antimicrob Agents Chemother, 2017, 61(9):e01135-17.
[31] Berg JK, Tzanis E, Garrity-Ryan L, et al. Pharmacokinetics and safety of omadacycline in subjects with impaired renal function. Antimicrob Agents Chemother, 2018, 62(2):e02057-17.
[32] GlobeNewswire 2017. Omadacycline concentrations exceed tigecycline levels in lungs and epithelial lining fluid according to pharmacokinetic/pharmacodynamic (PK/PD) data. (2017-04-25) [2019-10-28]. https://www.marketscreener.com/PARATEK-PHARMA CEUTICALS-I-18426416/news/Omadacycline-Concentrations-Exceed-Tigecycline-Levels-in-Lungs-and-Epithelial-Lining-Fluid-According-24260313/.
[33] Barber KE, Bell AM, Wingler MJB, et al. Omadacycline enters the ring:a new antimicrobial contender. Pharmacotherapy, 2018, 38(12):1194-1204.
[34] Moura IB, Buckley AM, Ewin D, et al. Omadacycline gut microbiome exposure does not induce clostridium difficile proliferation or toxin production in a model that simulates the proximal, medial, and distal human colon. Antimicrob Agents Chemother, 2019, 63(2):e01581-18.
[35] Bassetti M, Peghin M, Castaldo N, et al. The safety of treatment options for acute bacterial skin and skin structure infections. Expert Opin Drug Saf, 2019, 18(8):635-650.
[36] LaPensee K, Lodise T. Potential cost-savings with once-daily aminomethylcycline antibiotic versus vancomycin in hospitalized patients with acute bacterial skin and skin structure infections. Am Health Drug Benefits, 2018, 11(9):449-459.
國家自然科學基金(81273427);北京協和醫學院“協和青年科研基金”(33320140177、3332016139);中國醫學科學院醫學與健康科技創新工程(2016-I2M-3-014);“十三五”國家科技重大專項(2019ZX 09721001)
楊信怡,Email:yangxinyi1976@hotmail.com;游雪甫,Email:xuefuyou@hotmail.com
2019-10-29
10.3969/j.issn.1673-713X.2020.01.009

