TRPM7通道在腫瘤發生發展過程中的作用研究進展
鄧 蕊, 余蘇云,王 蔚,黃 帥,李曉曼,陳文星,2,王愛云,2,吳媛媛,陸 茵,2
(南京中醫藥大學1. 藥學院,江蘇省中藥藥效與安全性評價重點實驗室,2. 江蘇省中醫藥防治腫瘤協同創新中心,江蘇 南京 210023)
離子濃度,促進腫瘤細胞生存與增殖。此外,TRPM7表達升高與腫瘤侵襲、轉移能力的增加密切相關,且這種作用可能是通過促進上皮細胞-間充質轉化及腫瘤血管生成產生的。TRPM7在腫瘤發生發展中的作用,使其成為惡性腫瘤的預后指標和潛在治療靶點。該文對TRPM7與腫瘤進程的研究進展進行綜述,探討TRPM7介導腫瘤發展的機制及靶向TRPM7的臨床治療腫瘤策略,為后續研究和臨床治療提供一定參考。
惡性腫瘤是危害人類健康的主要問題之一[1],目前采用的治療手段主要包括手術切除及放、化療。手術切除僅適用于惡性腫瘤初期,且大部分患者預后不良,甚至出現復發;而放化療通常伴隨著極大的毒副作用,并容易產生耐藥現象。
因此,特異性靶向腫瘤細胞,實現對惡性腫瘤的高效治療成為了目前研究領域的熱門方向之一。近年來許多研究表明,瞬時電位受體 (transient receptor potential,TRP)通道家族中成員TRPM7的激活與腫瘤發展進程緊密相關[2-3],其可通過調節細胞內陽離子濃度、誘導細胞周期紊亂,促進上皮細胞-間充質轉化(epithelial-mesenchymal transition,EMT)、血管生成等過程,促進腫瘤的生存、增殖、侵襲及轉移。此外,TRPM7特殊的C-末端激酶結構域也與腫瘤轉移相關,并可能作為治療腫瘤的特異性靶點。本文對TRPM7的結構及功能特點進行簡介,對TRPM7與腫瘤發生發展的相關性及TRPM7的潛在靶向治療藥物進行綜述。希望通過本文能夠加深對TRPM7通道的認識,并為臨床靶向TRPM7治療腫瘤藥物的開發提供一定的參考。
1 TRPM7的結構和功能
1.1 TRPM7的結構特點TRPM7于2001年同時被Ryazanov、Runnels和Nadler實驗室分別克隆出來,并曾被命名為CHAK1、TRP-PLIK和LTRPC7。人全長TRPM7轉錄物含有7 263個核苷酸,編碼的TRPM7通道蛋白由1 865個氨基酸構成,分子質量為210 ku。與其他TRP蛋白相同[4],功能性TRPM7通道由4種TRPM7單體形成同源四聚體(Fig 1),具有6個長度約為21個氨基酸的跨膜區段(S1-S6),S5與S6之間有1個內嵌式通道結構,形成孔通道環。成孔環中的兩個帶負電荷的氨基酸(E1047和E1052)對于Ca2+、Mg2+及其他二價陽離子的通過,以及通道的pH敏感性具有重要作用。除具有這些TRP通道蛋白的典型結構特征外,TRPM7蛋白N-末端還含有4個TRPM亞家族的同源結構域 (melastatin homology domain,MHD)[5],在離子轉運過程中起著至關重要的作用。C-末端含有α-絲氨酸/蘇氨酸蛋白激酶結構域[6],能夠自磷酸化及磷酸化蛋白質底物,在鎂離子穩態和缺氧神經細胞死亡的調節中起重要作用。
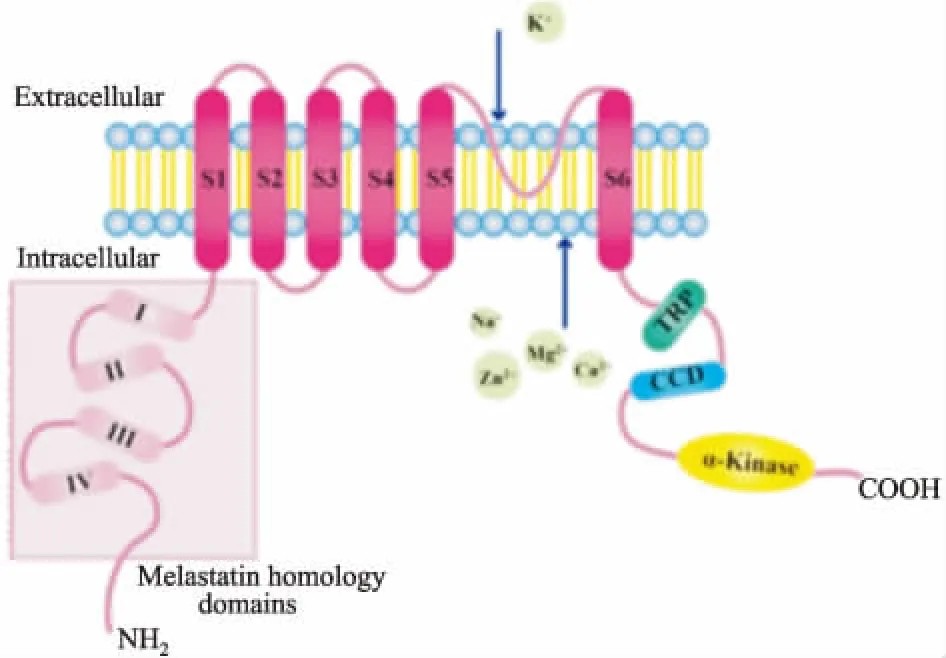
Fig 1 A schematic diagram to illustrate protein structure of TRPM7 channel-kinase
1.2 TRPM7的功能特性TRPM7是一種二價陽離子選擇性通道,在感知刺激,如光、溫度和細胞內Mg2+及Ca2+濃度變化中起關鍵作用[7]。
TRPM7通道蛋白廣泛分布于哺乳動物及脊椎動物體內各組織器官的細胞中,包括心、腦、腎、肺、脂肪、骨骼、視網膜等。有研究表明,TRPM7的主要生理功能包括:① 維持細胞內Mg2+穩態,在生物體內TRPM7與TRPM6裝配形成的雜四聚體能夠維持細胞內Mg2+穩態,進而保證Mg2+與ATP和其他核苷酸、蛋白質、磷脂和核酸能夠正常結合,避免細胞增殖損傷并保持細胞活力;② 介導微量金屬離子進入細胞,包括生理上必需的二價金屬陽離子,如Zn2+、Mn2+、Co2+,以及非生理或有毒金屬,如Ni2+、Cd2+、Ba2+和S2-,這些微量金屬離子有助于維持酶的空間構象及酶促反應的正常進行;③ 參與神經遞質的釋放,TRPM7表達于交感神經元的突觸小泡膜上,通過提供陽離子或與突觸蛋白形成復合物,調節交感神經末梢膽堿能神經遞質的釋放;④ 影響細胞黏附,TRPM7的輕微過表達導致細胞內Ca2+濃度增加,并伴隨著激酶非依賴性細胞的擴散及黏著斑的形成;⑤ 影響細胞存活,當細胞內TRPM7處于過表達或不表達狀態時,都會導致細胞凋亡;⑥ 影響胚胎發育,從早期胚胎發育開始,TRPM7就在哺乳動物體內持續表達,對胚胎的正常發育起重要作用。如果在小鼠胚胎發育過程中完全敲除TRPM7基因,將會導致小鼠胚胎的死亡。
2 TRPM7與腫瘤發生發展的相關性
眾多研究表明,TRPM7與多種人類惡性腫瘤相關[8],并在腫瘤中呈現異常過表達。Yee等[9]通過免疫組化評估了366個正常及胰腺癌患者胰腺組織樣品中TRPM7的表達,與正常胰腺組織相比,大多數胰腺癌樣本中的TRPM7均呈現中水平或高水平表達。另一項研究證實,前列腺癌細胞中TRPM7處于過表達狀態,并確定Ca2+/Mg2+比率的改變在前列腺癌發展過程中的必需作用。
此外,TRPM7在乳腺癌、膠質母細胞瘤及肺癌細胞系和組織中同樣異常過表達,并與腫瘤侵襲及轉移能力增強相關。Guilbet等[10]研究發現,TRPM7通道蛋白在雌激素受體(estrogen receptor,ER)陰性浸潤性乳腺癌上皮細胞中高表達,而在非侵入性腫瘤樣本中并未出現高表達現象。Chen等[11]對正常人星形膠質細胞NHA及人膠質母細胞瘤U87細胞進行TRPM7表達水平檢測,結果顯示,與NHA細胞相比,U87細胞中TRPM7 mRNA和蛋白表達明顯升高。沉默TRPM7的表達后,腫瘤細胞侵襲及轉移能力明顯下降。Liu等[12]發現,與正常肺泡細胞相比,TRPM7在肺腺癌或肺鱗狀細胞癌中異常高表達。同時,TRPM7表達的上調伴隨著腫瘤球體形成能力的增加及干性標志物的增多,而TRPM7表達的下調伴隨著間充質細胞標志物波形蛋白的減少,以及上皮細胞標志物E-鈣黏蛋白的增加。綜上,TRPM7在多種惡性腫瘤中處于異常過表達狀態,并與腫瘤的發生、發展密切相關,因此,TRPM7可能成為潛在的惡性腫瘤治療靶點。
3 TRPM7作用于腫瘤發生發展的具體過程及可能機制
腫瘤的生長與進展伴隨著生存、增殖、浸潤、遷移與轉移等多個復雜環節,而TRPM7異常表達與腫瘤發生、發展多個環節相關,說明TRPM7很可能參與并促進了腫瘤的發展。那么,TRPM7在腫瘤發生、發展中作用的具體機制是什么呢?
3.1 TRPM7誘導腫瘤細胞周期紊亂腫瘤細胞在機體內的持續增殖與存活是腫瘤發展的初始階段,內源或外源性因素導致正常細胞突變形成的腫瘤細胞,具有在機體內無限增殖的能力。TRPM7的促生存與促增殖作用已在胰腺癌、咽癌、甲狀腺癌、視網膜母細胞瘤、前列腺癌等多種癌細胞中得到證實[13]。
在胰腺癌中,TRPM7在維持增殖和防止復制性衰老中至關重要,且下調TRPM7可使胰腺癌細胞周期停滯于G0/G1期和G2/M期,從而抑制癌細胞增殖。細胞內的Ca2+被認為能夠通過刺激與細胞周期進程相關基因的表達,以及激活參與DNA復制和有絲分裂過程中的酶,在該進程中起著關鍵的調節作用。而TRPM7作為Ca2+進出細胞的調節劑,必然與Ca2+濃度變化所導致的細胞周期的改變有著某種關系。Hanano等[14]在視網膜母細胞瘤(retinoblastoma,RB)細胞中發現,當培養基內的Ca2+濃度在一定范圍內(0~3 mmol·L-1)時,RB細胞的生長速率與Ca2+濃度呈明顯正相關性。基于TRPM7為調節細胞內Mg2+及其他陽離子濃度的觀點,進一步探索RB細胞中TRPM7基因的表達,發現TRPM7的抑制和沉默會降低TRPM7介導的Ca2+內流,延緩G1/S細胞周期進程,并減少視網膜母細胞瘤細胞的增殖。此外,Sun等[15]研究發現,膽固醇能通過TRPM7增加Ca2+內流,促進細胞增殖,并且TRPM7還能夠通過誘導Akt及ERK通道的激活,促進前列腺細胞的增殖,而細胞中TRPM7的過表達明顯增強了膽固醇的這種作用。綜上,TRPM7雖然在多種癌細胞中都具有促進其生存及增殖的作用,但作用機制可能不同,如在RB細胞系中,誘導癌細胞增殖的為內源性TRPM7;而在前列腺癌細胞系中,過表達的TRPM7通過刺激細胞外Ca2+/Mg2+比率的增加,流入膽固醇的Ca2+增多,進一步導致癌細胞的增殖。
3.2 TRPM7抑制腫瘤細胞凋亡Gao等[16]研究表明,TRPM7的過表達對膀胱癌患者的預后不良,甚至促進腫瘤的復發,而在敲低TRPM7的表達后,膀胱癌細胞系5637及T24細胞都表現出明顯的凋亡現象。Kim等[17]發現,Mg2+對于胃癌細胞的存活過程至關重要,而敲低TRPM7后,胃癌細胞明顯凋亡,且膜片鉗實驗結果顯示,TRPM7樣電流幅度明顯降低。在另一項由高葡萄糖水平誘導的神經元損傷的研究中,發現TRPM7的過表達,能夠導致內質網應激及神經細胞凋亡的產生,且這種作用似乎并不是由TRPM7的激酶功能所誘導的[18]。綜上,TRPM7對不同細胞凋亡的調控作用可能是通過不同途徑產生的,因此,仍需對TRPM7誘導腫瘤細胞凋亡的具體機制進行更深入的探討。
3.3 TRPM7促進癌細胞侵襲與轉移過程腫瘤細胞獲得侵襲能力并發生擴散轉移,是腫瘤發生、發展過程中最為致命的環節。在早期實驗中,TRPM7就被觀察到在HEK293細胞中的過表達能夠導致細胞與基質的分離,預示著TRPM7可能在腫瘤侵襲與轉移的過程中也起作用。近年來,越來越多實驗證實,TRPM7的確在腫瘤侵襲及轉移過程中起著重要作用。Ha等[19]證實,TRPM7的表達與腎細胞癌細胞系ACHN和SN12C遷移及侵襲作用的產生相關。Davis等[20]在乳腺癌細胞MDA-MB-468中發現,TRPM7能夠調節表皮生長因子(epidermal growth factor,EGF)所誘導的信號轉導和轉錄激活因子3(STAT3)的磷酸化。Rybarczyk等[8]發現,TRPM7通道能夠調節兩種胰腺癌細胞系中的Mg2+穩態,通過沉默TRPM7明顯降低了細胞的侵襲能力,同時對細胞活力不造成影響。另一項實驗觀察到,在高轉移性ER陰性乳腺癌中,TRPM7的沉默抑制了細胞的遷移,且TRPM7的激酶結構域在這個過程中是必需的。綜上,TRPM7在腫瘤侵襲及轉移過程,尤其在EMT及腫瘤血管生成過程中發揮促腫瘤轉移作用,且這種作用與TRPM7激酶結構域及TRPM7對Mg2+、Ca2+穩態的調節相關。
3.3.1TRPM7促進EMT發生 EMT是一種使得不能移動的上皮細胞轉化為具有移動能力的間質細胞的過程。在癌癥中,EMT與腫瘤的發生、發展、轉移、腫瘤干性及耐藥性密切相關[21]。許多研究表明,TRPM7能夠介導EMT的發生。N-鈣黏蛋白和波形蛋白是EMT過程的關鍵標志物,其表達量的增加預示著EMT的發生。Kuipers等[22]發現,TRPM7通過EMT轉錄因子SOX4的張力調節,對于維持乳腺癌細胞中的間充質表型起著促進作用,使用靶向TRPM7的shRNA敲除乳腺癌細胞MDA-MB-231中的TRPM7后,使細胞中典型間充質細胞數量減少。微陣列分析發現,SOX4水平隨TRPM7表達減少而下降,并發現SOX4及TRPM7表達同時減少后,間充質標志物N-鈣黏蛋白和波形蛋白表達降低,證實了TRPM7-SOX4軸的激活在保持乳腺癌細胞間充質樣細胞狀態中的作用。Chen等[23]發現,前列腺癌(PCa)細胞和組織中TRPM7明顯高表達,并進一步證實,TRPM7的缺乏抑制了不同PCa細胞系的遷移和侵襲,而TRPM7的過表達增加了PCa細胞的遷移。同時,PCa細胞中TRPM7的敲低逆轉了EMT狀態,且伴隨著基質金屬蛋白酶的下調和E-鈣黏蛋白的上調。將肺腺癌或鱗狀細胞肺癌樣本中與正常肺泡樣本中TRPM7進行對比,發現癌癥樣本中TRPM7異常高表達,并可能導致患者預后不良。進一步敲低肺癌細胞系A549及95D中TRPM7的表達,結果顯示,TRPM7蛋白的下調伴隨著間充質細胞標志物波形蛋白mRNA的下調,而上皮細胞標志物E-鈣黏蛋白mRNA表達則上調。此外,腫瘤微環境中許多因子的釋放能夠導致EMT的發生,而這些因子受細胞內鈣信號的調控。前列腺癌細胞DU154和PC3中,EMT所介導的細胞遷移能夠被TRPM7表達的增加所促進,而TRPM7的沉默減弱了TGF-β所誘導的細胞遷移,且EMT標記減少,而這種作用是由Mg2+所介導的。由此,TRPM7對于腫瘤細胞EMT過程有明顯的促進作用,并且這種作用可能與其介導的細胞內外離子濃度的改變相關。
3.3.2TRPM7誘導腫瘤血管生成 腫瘤快速生長的過程伴隨著大量血管的新生,新生血管為腫瘤細胞提供足夠的能量,并成為腫瘤擴散轉移的媒介。Mg2+在血管生成的多個階段起著調節作用,而TRPM7能夠調控細胞內Mg2+的穩態,由此,TRPM7通過調控Mg2+在細胞內外的分布,對腫瘤血管生成應該也起著某些作用。研究發現,人微血管內皮細胞(human microvascular endothelial cell,HMEC)存在于腫瘤周圍的微脈管系統中,并且在腫瘤新血管生成的過程中起主導作用。Mg2+缺乏抑制了HMEC的增殖和遷移,沉默TRPM7的表達后,得到了相似的結果。細胞外Mg2+的減少,明顯降低了HMEC中TRPM7的表達,表明HMEC中這種由于Mg2+缺乏所導致的細胞增殖及遷移抑制由TRPM7所介導。但TRPM7下調所介導的腫瘤血管生成抑制,目前并沒有在其他類型的內皮細胞,如人臍靜脈內皮細胞(HUVEC)或內皮集落形成細胞中得到驗證。因此,TRPM7對腫瘤血管生成的調節不僅可能與其陽離子通道功能相關,還可能依賴于內皮細胞的類型。
4 TRPM7的潛在靶向治療藥物
近年來,對多種腫瘤細胞系的研究已證實,TRPM7通道在多種腫瘤細胞中異常表達,并參與調節多個腫瘤細胞發展過程,如生存、增殖、遷移和侵襲。同時,小鼠異種乳腺癌模型中,TRPM7也被證實具有調節乳腺癌細胞轉移形成的能力。由此推測,TRPM7有作為惡性腫瘤治療靶點的潛力。目前,已發現的TRPM7抑制劑主要包括非特異性通道阻滯劑、天然代謝物及一系列合成化合物等。其中,最有效的TRPM7抑制劑是NS8593和Waixenicin A。
NS8593能夠高效、特異地與TRPM7結合,并抑制TRPM7通道的功能。NS8593在乳腺癌細胞系MDA-MB-468中被證實,能夠抑制TRPM7所介導的EMT的發生及波形蛋白的表達。NS8593通過由TRPM7的成孔環和NS8593的咪唑環介導的分子相互作用,直接和可逆地阻斷TRPM7通道,并且這種阻斷作用取決于細胞內Mg2+濃度。
Waixenicin A是一種來源于軟珊瑚Sarcotheliaedmondsoni的天然萜類化合物,通過Mg2+依賴性途徑,抑制TRPM7所介導的Mg2+電流的產生。Zierler等[24]在大鼠嗜堿性白血病(RBL)細胞中證實,Waixenicin A能夠有效抑制TRPM7所導致的細胞增殖,同時,細胞內Mg2+濃度的增加能夠增強Waixenicin A對TRPM7通道的抑制作用。從分子水平上來解釋,Waixenicin A通過與位于激酶結構域內Lys-1648的Mg2+結合位點相互作用而在細胞內起作用。Kim等[25]在Cajal間質細胞(ICCs)中闡明了TRPM7通道的作用,Waixenicin A對ICCs起搏活動的影響及人胃癌和乳腺癌細胞系AGS和MCF-7細胞存活率的影響。Waixenicin A能夠降低ICCs起搏活動的幅度,同時抑制AGS細胞活力和TRPM7樣電流。此外,Waixenicin A似乎能夠特異性地阻斷TRPM7通道,而對其他離子通道,如CRAC、TRPM2、TRPM4和TRPM6沒有影響,并且當細胞內存在一定濃度的Mg2+時,較低劑量的Waixenicin A能夠對腫瘤細胞起到抑制作用。因此,Waixenicin A是一種非常有應用前景的TRPM7阻斷劑。
此外,槲皮素(quercetin,QCT)是一種廣泛存在于各種水果、蔬菜與谷物中的天然黃酮類化合物,被發現能夠增加過表達TRPM7的HEK293細胞的凋亡,并抑制胃癌細胞系AGS中TRPM7的過表達,具有治療胃癌的潛力。人參中的活性成分之一,人參皂苷Rg3能夠通過阻斷TRPM7通道活性,抑制胃癌細胞的生長和存活[27]。目前,雖然已經有多種TRPM7抑制劑被發現,但大多數特異性較差或有效濃度較高,可能在靶向腫瘤細胞的同時也損害了正常細胞。同時,這些抑制劑中,大多數是通過抑制TRPM7對于陽離子的透過作用而抑制其誘導的腫瘤發展,但靶向TRPM7激酶結構域而抑制其促腫瘤的抑制劑較少。因此,在之后的研究中應著眼于TRPM7靶向抑制劑的開發。
5 總結與展望
TRPM7是一種在人體內普遍表達的離子通道,具有內在激酶活性,在多種細胞過程、生理反應、早期發育、器官發生和人類疾病,尤其是癌癥中發揮調節作用。實驗證據表明,TRPM7通道激酶在癌癥發生、發展過程中有重要作用,包括不受控制的細胞周期進展、存活、增殖、生長、遷移、侵襲、EMT、血管生成和轉移。TRPM7的促腫瘤作用與其調節二價陽離子通過,尤其在調控Mg2+與Ca2+通過中起著重要作用。此外,TRPM7的C-末端激酶結構域能夠識別和磷酸化細胞溶質底物,也可能參與了腫瘤細胞進程。其中,Ca2+與調節癌細胞增殖和活力更相關,而Mg2+與TRPM7的激酶結構域似乎與腫瘤細胞的侵襲及轉移過程關聯更緊密。盡管目前對于TRPM7通道參與腫瘤進程的報道較多,但大多為體外實驗結果,缺少相應的動物模型進行佐證。同時,TRPM7的抑制劑通常特異性較差。因此,TRPM7具有成為腫瘤治療靶標的巨大潛力,需要進一步的探索與研究。

