線粒體DNA量與胚胎質量及妊娠關系研究
倪夢霞,王瑋,鄭愛燕,丁潔,蒲艷,鄒琴燕,孟慶霞,許詠樂,李紅,偶健
(南京醫科大學附屬蘇州醫院 蘇州市立醫院 生殖與遺傳中心,蘇州 215002)
目前,染色體異常仍然是造成胚胎移植失敗及流產的主要原因,而在染色體正常的胚胎中至少有30%左右依然無法獲得成功妊娠[1]。這說明除了染色體外,還有其他因素影響IVF結局。胚胎發育是一個需要大量能量供應的動態過程,近年來,有研究表明卵母細胞中線粒體的分布變化可以通過調節ATP的生成來影響受精能力及胚胎的發育質量[2-3]。受精后,精子中的線粒體很快就會全部降解,胚胎中的線粒體幾乎都來自于卵母細胞。若卵母細胞發生異常,可能會導致胞質內的ATP供求不平衡,主要表現為染色體分離障礙、細胞分裂障礙、受精障礙等[4-7]。線粒體與其他細胞器相比,最大的特征就是含有獨立的遺傳物質,還可以通過氧化磷酸化等一系列生化反應產生ATP。
由于卵母細胞中的線粒體數目呈動態變化,所以無法準確計算[8-11]。而現有的用以評估線粒體的指標包括線粒體DNA(mtDNA)的數量及突變、線粒體的結構/分布及跨膜電位、ATP水平、ROS水平等[4]。本研究通過采用二代測序(NGS)的方法檢測mtDNA量,探討mtDNA量與胚胎形態、基因組及妊娠的關系,希望可以結合植入前遺傳學檢測(PGT)技術篩查出質量較好的胚胎以供患者移植。
資料與方法
一、研究對象
選取2017年6月至2018年9月來自南京醫科大學附屬蘇州醫院生殖中心的293個周期1 071個囊胚。所有夫婦均簽署了體外受精(IVF)和PGT知情同意書,醫院生殖倫理委員會對此研究項目通過倫理審查。所用胚胎均由患者簽訂知情同意用于科研。
二、研究方法
1. 囊胚期胚胎形態學評估:根據Garnder囊胚評分法對囊胚期胚胎進行形態學評估。先根據囊胚的擴張和孵出程度將囊胚分成1~6期:1期:出現囊胚腔,擴張體積小于囊胚總體積的50%;2期:囊胚腔擴張體積大于囊胚總體積的50%;3期:囊胚腔占滿整個胚胎,但還未充分擴張;4期:囊胚腔完全擴張,胚胎體積增發,透明帶變薄;5期:擴張的囊胚從透明帶的破口處孵出一小部分,未能完全脫出;6期:囊胚的內細胞團及滋養層細胞已從透明帶中孵出。3~6期囊胚再對囊胚內細胞團細胞數目分級為A級(細胞數目多,結合緊密)、B級(細胞數目少,結合松散)、C級(細胞數目極少,不清晰);根據3~6期囊胚的外滋養層細胞數目及排列形態分級為A級(細胞數目多,形態呈鐮刀形且連續平鋪在透明帶內側)、B級(數目少,排列松散,非連續姓平鋪在透明帶內側)、C級(數目極少且幾乎沒有大的滋養層細胞)。形態學評分3BB及以上定義為優質胚胎,3BB以下為非優質胚胎。
2. 滋養層活檢:所有胚胎在第3天用激光技術孵化,放入新鮮的培養基培養至第5天或第6天后,若胚胎已發育成完整的胚泡即可考慮進行活檢。使用ZILOS-tk激光器(Hamilton Thorne BioSciences,美國)對胚泡滋養外胚層進行打孔后將囊胚再孵育4~6 h,待囊胚腔擴張,滋養外胚層細胞從透明帶打孔處擠出后可進行活檢。具體活檢方法見參考文獻[12]。
3. NGS-PGT:對所有活檢樣本進行全基因組擴增后建庫。等溫擴增和富集后,使用PGM測序儀(ABI Ion Torrent PGM,美國)進行測序。使用Ion Reporter software進行測序結果解讀,通過界面分析數據或后臺linux界面分析數據進行染色體分析,以此判斷胚胎的染色體是否正常。
4. NGS-mtDNA:對PGT分析的數據(包含mtDNA和核DNA的混合物)進行優化計算[13],通過將映射到線粒體基因組的讀數除以映射到核基因組的讀數,可計算出胚胎中的相對mtDNA量。每批樣本的讀數都需要進行校準,以減少NGS實驗期間的差異性。
5. 移植策略:優先移植PGT結果正常胚胎。如果有多個PGT結果正常胚胎則結合形態學評估進行移植,優先移植形態學評分優質胚胎。如果無PGT正常胚胎可以移植,在充分遺傳咨詢的情況下可以考慮移植PGT嵌合結果胚胎。每次均移植一枚囊胚。
6. 分組分析:根據Garnder形態學評估分為優質胚胎組(n=652)和非優質胚胎組(n=419);再根據PGT結果分為正常、異常、嵌合三個亞組。進行不同組間、亞組間的比較。
三、統計學分析
采用SPSS 19.0進行統計學分析。組間比較采用獨立樣本t檢驗;P<0.05為差異有統計學意義。
結 果
一、mtDNA量與胚胎質量
形態學評分優質胚胎(3BB及以上)共652枚,非優質胚胎(3BB以下)共419枚。兩組間mtDNA量無顯著差異(P>0.05),但兩組中PGT正常結果亞組的mtDNA量均顯著低于PGT異常結果亞組(P<0.05);而兩組中的PGT嵌合結果亞組的mtDNA量與其他兩個亞組比較,均無顯著差異(P>0.05)(表1)。

表1 不同形態質量/PGT結果囊胚的mtDNA量(-±s)
注:與PGT正常結果亞組比較,*P<0.05
二、mtDNA量與妊娠
2017年6月至2018年9月這一時間段PGT正常的囊胚共移植了85枚(包括68枚優質胚胎,17枚非優質胚胎)。其余PGT正常囊胚處于冷凍狀態,或者由于患者有多枚正常但只移植一枚,或者還未到患者召回移植時間暫時未移植。移植PGT正常結果組胚胎發現,妊娠結局為流產或者未孕的胚胎相比于正常妊娠組其平均線粒體DNA量在數值上較高,但無統計學差異(P>0.05)(表2)。以正常妊娠的平均mtDNA量0.086%作為切割值,低值組(mtDNA≤0.086%)的臨床妊娠率為73.33%,高于高值組(mtDNA>0.086%)的妊娠率(67.5%),但無統計學差異(P>0.05)(表3)。

表2 PGT正常結果組不同妊娠結局的胚胎mtDNA量(-±s)
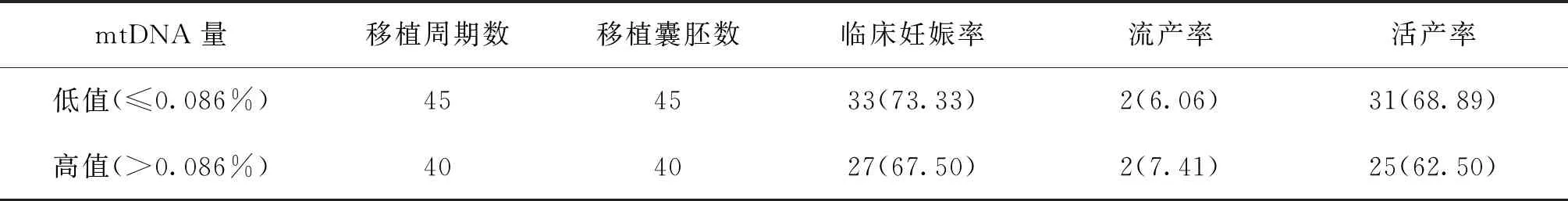
表3 以mtDNA量0.086%為切割值的臨床妊娠情況[n(%)]
有6個移植周期無PGT正常胚胎可以移植,在充分遺傳咨詢的情況下選擇PGT嵌合結果胚胎進行移植。其中2個mtDNA量相對較高的胚胎1個未妊娠、1個流產,而另外4個mtDNA量相對較低的胚胎均正常分娩(表4)。
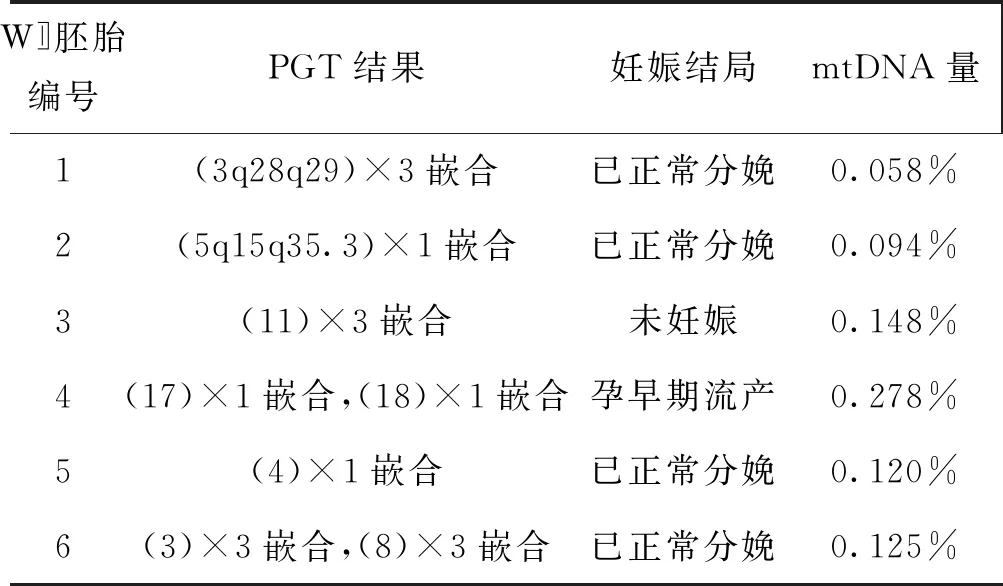
表4 PGT嵌合結果組胚胎mtDNA量與妊娠結局
討 論
雖然輔助生殖技術在近幾十年來飛速發展,但較多難題仍亟待解決。IVF的成功率依然較低,除染色體異常外,還有哪些因素會造成胚胎發育停滯?有學者認為卵母細胞中的線粒體質量會影響受精能力及胚胎發育質量[13-14]。線粒體作為卵母細胞中含量最豐富的細胞器,以“能量工廠”的身份為早期胚胎發育過程中的一系列細胞活動提供ATP。胚胎發育至囊胚期,ATP的產生上調以滿足胚胎進一步發育和分化所需的能量[4]。但是由于線粒體呈動態分布,無法準確計算其數目,所以要研究線粒體與胚胎發育之間的關系,還需找到可以評估線粒體數目的指標。mtDNA作為線粒體所特有的遺傳物質,在卵母細胞中每個線粒體只包含一個mtDNA拷貝[15]。當胚胎發育到不同階段時,其拷貝數也會處于不同水平,因此可通過檢測mtDNA量來評估線粒體水平[16]。
近年來,很多學者都密切關注mtDNA量與IVF成功率的關系。mtDNA由于不具備核基因的修復機制,也缺乏組蛋白的保護,所以其突變率更高[5]。其發生突變會導致氧化磷酸化能力降低,從而影響卵母細胞的受精能力及胚胎的早期發育能力[8]。根據以往的研究發現,有一部分學者認為mtDNA量與胚胎移植的成功率有顯著相關性,即高于一定的閾值時移植率降低,低于一定的閾值則移植率增加[17-18]。這與“quiet embryo”假說一致,quiet embryo提出代謝狀態平穩的胚胎較代謝旺盛的胚胎存活力更高[19]。而另外一部分學者發現mtDNA量與胚胎發育質量之間并沒有顯著相關性[20-21]。造成實驗結果差異的原因暫不明確,推測可能與種族、地域、環境及選取的實驗標本和檢測方法有關。
本研究為了探討mtDNA量與胚胎質量與妊娠率之間的相關性,共收集了1 071個囊胚,采用NGS進行PGT和mtDNA量檢測,發現mtDNA量與PGT結果有一定相關性:在胚胎PGT正常結果組中mtDNA量更低,而且移植PGT正常結果組胚胎其正常妊娠對應的平均線粒體DNA量更低,但由于移植數量較少,暫未發現統計學差異。
由于卵裂期胚胎細胞分裂時染色體分配的不穩定[22],嵌合胚胎隨之形成,因此卵裂期的活檢往往會發生檢測的卵裂球與實際剩下的胚胎染色體不一致的情況。因此囊胚期活檢正在逐步取代卵裂期活檢[23]。
而囊胚期的胚胎在很大程度上也都是嵌合型的胚胎,通過二代測序技術在植入前遺傳學診斷領域的應用,發現用其檢測外滋養層細胞會出現一定比例的嵌合結果,在這種情況下,如何判斷胚胎內細胞團(未來的胎兒)的狀態將是一個難題[24]。
研究推測存在一種胚胎自我修復機制,嵌合有二倍體細胞的胚胎,染色體正常和異常的細胞可能存在分裂效率和趨向的差異,非整倍體細胞最終被正常的二倍體細胞淘汰掉或者排除出內細胞團[25-26]。在這種情況下,我們通過檢測外滋養層細胞的結果判斷胚胎的好壞會使我們浪費掉寶貴的內細胞團正常胚胎。
我們在移植PGT嵌合結果組胚胎時發現,mtDNA量較低的胚胎可能更傾向于胎兒正常結果,其正常妊娠的幾率更高。mtDNA可能給我們開啟了一個窗口,線粒體反映的是整個胚胎的能耗狀態,對于低能耗的嵌合體胚胎可能代表了其自我修復過程已趨于成功,內細胞團正常的機會要高于那些高能耗(mtDNA量較高)的胚胎。當然由于數據有限,要證明其相關性還需進一步擴大樣本。
綜上所述,mtDNA量的檢測可能反映胚胎質量與妊娠結局,也可能反映嵌合胚胎的實際狀態,未來或許可以作為胚胎選擇的一項補充指標。但若要將這一指標應用于臨床,則需要進一步加大樣本量,并且建立一定的模型來充分驗證。

