赤霉素和低溫處理對桃種胚發芽生長的影響
許建蘭 馬瑞娟 俞明亮 張妤艷 丁輝
摘要:以早紅2號桃種胚為試材,研究不同赤霉素濃度和低溫處理時間對桃種胚萌發和植株生長的影響,并比較蓮座狀苗與正常苗體內激素差異。結果表明,在同樣的低溫處理條件下,隨著赤霉素濃度的提高,子葉開張比例不斷增加。當培養基中加入1.0 mg/L及以上赤霉素濃度時,低溫培養30 d和60 d畸形苗即可消失;當培養基中加入 0.5 mg/L 及以上赤霉素濃度時,低溫培養90 d畸形苗即可消失,且發現同樣條件下赤霉素濃度越高,畸形苗率越低。對種胚發芽后正常苗與蓮座狀苗進行比較,發現IAA含量正常苗高于蓮座狀苗,GA和ZA含量則相反。綜上,在早紅2號種胚處理時加入適量的赤霉素可減少蓮座狀苗的比例,進而提高胚培種子成苗率,對提高早熟桃種子育苗效率具有重要意義。
關鍵詞:桃;低溫時間;激素;赤霉素;種胚;植株生長
中圖分類號: S662.101 ?文獻標志碼: A ?文章編號:1002-1302(2020)23-0121-03
目前桃新品種選育主要通過常規雜交授粉進行,通常果實生育期100 d以內的桃,生長時間短,種子在常規處理條件下不能萌發或萌發率極低,即使長成實生苗,早期生長也比較弱小[1-2]。因此需接種在培養基中,經過適當的培養后才能萌發成苗。種子休眠是高等植物的普遍現象,在生產上,桃種子需要經過一段時間低溫處理才能正常生長,若休眠未能及時解除,往往出現發芽率低甚至隔年發芽的現象[3],有些即使發芽生長仍會出現不良狀況,嚴重影響正常育苗工作。縮短低溫處理時間、增加溫室過渡生長時間是一種提高實生苗壯實度的有效方法。但不經過足夠低溫處理的胚發芽后葉片會長成蓮座狀,不能正常生長,嚴重的最終導致死亡。
有研究表明,赤霉素(GA3)是一種生長調節劑,在休眠方面已有大量報道[4-7],但多集中于晚熟桃種子處理,而關于早熟胚打破休眠方面報道較少。劉艷萍[8]和孫紅梅[9]先后研究了低溫解除休眠的生理生化變化,表明休眠主要依靠GA3和ABA含量控制。高效液相色譜(HPLC)是常用的植物內源激素分析方法,但HPLC存在流程繁瑣、費時長、不能同時聯合測定等問題[10]。而液質聯用(LS-MS)解決了HPLC的不足,在激素檢測中達到了很好的效果。為此,筆者在總結前人研究的基礎上,采用液質聯用技術,樣品一次處理,分時出峰,從而更方便快捷測定植株激素含量。
本試驗通過探索不同赤霉素濃度對解除早熟桃種子休眠和促進實生苗生長的影響,并比較正常苗與蓮座狀苗在激素水平上的差異,為后期種子處理、實生苗健壯生長提供理論依據和參考。
1 材料與方法
1.1 試驗材料
試驗于2017年進行,桃試驗材料取自國家果樹種質南京桃資源圃,品種為早紅2號,果實生育期94 d。樹體生長健壯,株行距3 m×5 m,自然開心形,按常規栽培措施管理。
1.2 試驗方法
1.2.1 樣品處理 果實近成熟時采收,經70%乙醇和20%NaOCl溶液消毒,取出種仁接種到5種不同培養基中,對照,WPM;處理1~4為WPM培養基中分別添加不同濃度的GA3(0.5、1.0、1.5、2.0 mg/L),蔗糖20 g/L,瓊脂粉4.8 g/L,pH值5.7。每處理接種30個,3次重復。接種后分別置于4 ℃低溫環境中處理30、60、90 d,比較不同低溫處理時間對子葉張開比例、胚根生長的影響。后置于組培室(24 ℃)進行光照培養30 d,統計不同處理株高、葉片數、蓮座狀苗比例。
1.2.2 激素含量測定 分別取蓮座狀苗和正常苗新鮮植株,采用液質聯用檢測技術(LC-MS)測定IAA、GA3、ZA等激素的含量。樣品制備時各稱取約0.5 g,于液氮研磨至粉碎,加入5 mL異丙醇/鹽酸提取緩沖液,4 ℃振蕩30 min,加入10 mL二氯甲烷,4 ℃振蕩30 min,于4 ℃、13 000 r/min離心 5 min,取下層有機相;避光以氮氣吹干有機相,以200 μL甲醇(0.1%甲酸)溶解,過0.45 μm濾膜,進HPLC-MS/MS檢測。每處理10個植株,重復3次。液相條件:色譜柱采用安捷倫ZORBAXSB-C18反相色譜柱(2.1 mm×150 mm,3.5 μm),流動相A ∶ B=(甲醇/0.1%甲酸) ∶ (水/0.1%甲酸),洗脫梯度:0~2 min,A=20%;2~14 min,A遞增至80%;14~15 min,A=80%;15.1 min,A遞減至20%;15.1~20 min,A=20%,柱溫30 ℃,進樣體積2 μL;質譜條件:氣簾氣:15 psi;噴霧電壓:4 500 V;霧化氣壓力:65 psi;輔助氣壓力:70 psi;霧化溫度400 ℃。
1.3 數據分析
數據用Excel和SPSS軟件進行統計分析。
2 結果與分析
2.1 不同低溫處理時間對種胚生長的影響
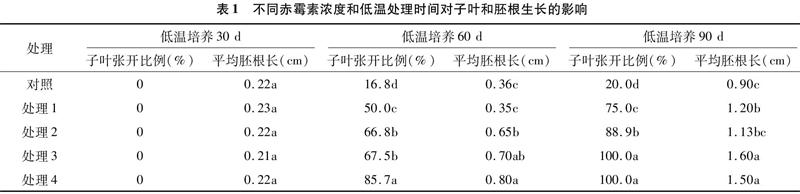
從表1可以看出,在同樣的低溫處理條件下,隨著赤霉素濃度的提高,子葉開張比例不斷增加。在低溫處理30 d時,所有處理的子葉均未變化,保持閉合狀態,隨著低溫處理時間的延長,子葉不同程度開展,表明種胚即將發芽生長。低溫處理60 d時,以處理4子葉開張比例最高,為85.7%,與其他處理達顯著差異;胚根最長,為0.8 cm,與對照和處理1、處理2達顯著差異水平。低溫處理90 d時,處理3和處理4子葉全部張開,胚根長度分別為 1.6 cm 和1.5 cm,處理3和處理4差異不顯著,與其他處理達顯著差異水平。
2.2 不同赤霉素濃度下低溫處理30 d對試管苗生長的影響
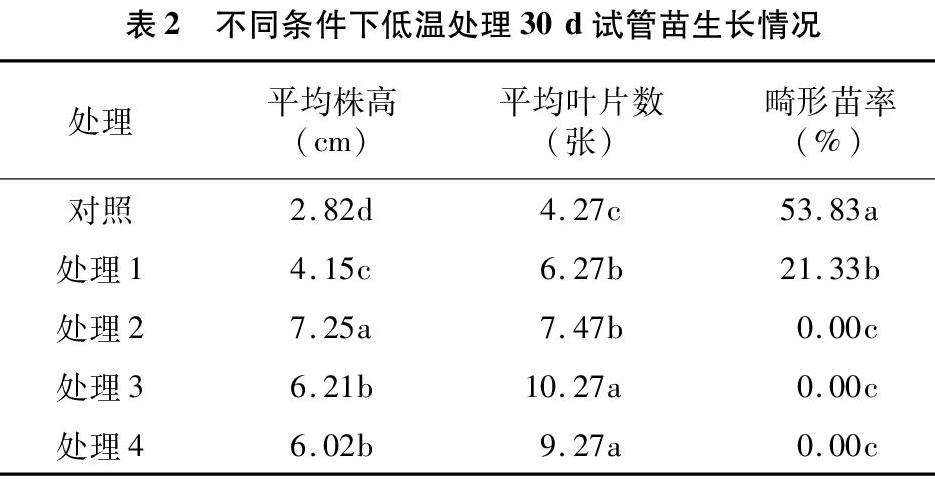
從表2可以看出,低溫處理30 d后,處理2平均株高最高,為7.25 cm,與其他處理達顯著差異水平;平均葉片數以處理3最多,為10.27片,其次是處理4,為9.27片,處理3和處理4差異不顯著,與對照、處理1、處理2達顯著差異水平;以不加赤霉素的對照處理畸形苗率最高,為53.83%,與其他處理達顯著差異水平,其次是處理1畸形苗率,為21.33%,可以發現,當培養基中加入1.0 mg/L及以上赤霉素,在低溫培養30 d時畸形苗即可消失。
2.3 不同赤霉素濃度下低溫處理60 d對試管苗生長的影響
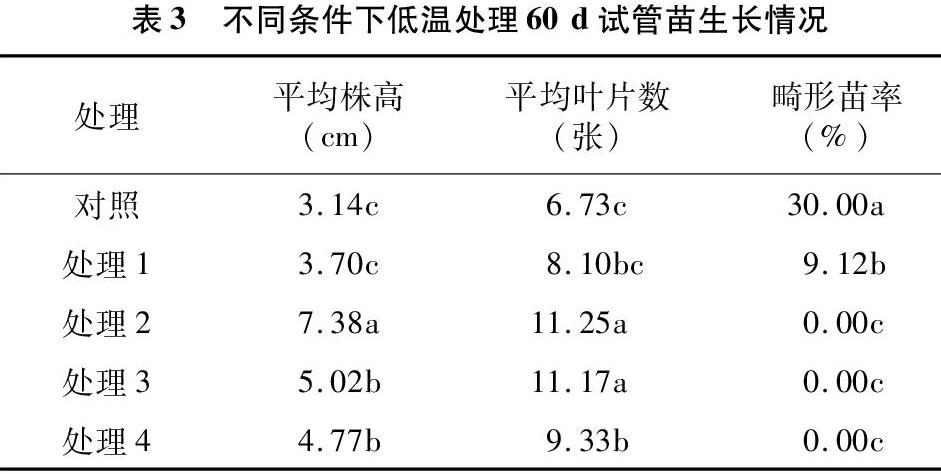
從表3可以看出,低溫處理60 d后,處理2平均株高最高,為7.38 cm,與其他處理達顯著差異水平;平均葉片數以處理2最多,為11.25片,其次是處理3,為11.17片,處理2和處理3差異不顯著,與對照、處理1、處理4達顯著差異水平;以不加赤霉素的對照畸形苗率最高,為30%,與其他處理達顯著差異水平,其次是處理1畸形苗率,為9.12%,可以發現,當培養基中加入1.0 mg/L及以上赤霉素,在低溫培養60 d時無畸形苗。
2.4 不同赤霉素濃度下低溫處理90 d對試管苗生長的影響
從表4可以看出, 低溫處理90 d后, 處理4平均株高最高,為5.16 cm,其次為處理3,平均株高4.87 cm,處理3和處理4與其他處理達顯著差異水平;平均葉片數以處理4最多,為11.60張,其次是處理3,為11.26張,與處理1、處理2差異顯著;以不加赤霉素的對照畸形苗率最高,為11.13%,與其他處理達顯著差異水平,比較發現,當培養基中加入0.5 mg/L及以上赤霉素,在低溫培養90 d時無畸形苗。
2.5 正常苗與蓮座狀苗體內激素含量差異
通過對正常苗與蓮座狀苗的比較,看出正常生長的苗IAA含量顯著高于蓮座狀苗,正常苗和蓮座狀苗IAA含量分別為5.98 ng/g和2.93 ng/g;而GA3和ZA含量以蓮座狀苗較高,正常苗和蓮座狀苗GA3含量分別為0.028 ng/g和0.116 ng/g,正常苗和蓮座狀苗ZA含量分別為0.05 ng/g和2.23 ng/g,且正常苗與蓮座狀苗間達顯著差異水平(表5)。
3 討論與結論
植物激素是指由植物細胞接受一定的信號誘導,在植物特定組織代謝合成的,并通過與特定的蛋白質受體結合來調節植物生長發育的微量生理活性有機物質[11]。植物激素的研究也一直是植物科學熱點和前沿的領域之一,隨著科技的發展,植物生長調節劑調控植物生長發育的重要作用越來越受人們重視。植物生長調節劑調節和控制作物生長發育的方法,既能協調植株的生長發育又能協調植株與外界條件的關系[12]。赤霉素除可以打破種子休眠外,在促進植株生長方面也具有一定作用[13]。
桃種子需要經過一定的低溫層積才能正常發芽生長,低溫層積所需時間也因品種不同而存在差異[3],而同一品種隨著層積時間的延長,蓮座狀苗比例明顯降低。本試驗中早紅2號加入0.5 mg/L赤霉素低溫處理30、60、90 d,蓮座狀苗比例分別為21.35%、9.11%和0,與前人報道的隨層積時間越長,非正常苗比例越少的結論[14]一致。對照中不加赤霉素在低溫培養90 d時仍有一定比例的蓮座狀苗,而加入赤霉素的處理,當濃度達到0.5 mg/L低溫培養90 d時均無畸形苗,說明培養基中加入赤霉素一定程度上刺激了種子發芽,有助于提高正常苗的比例。比較發現,不同處理中加入赤霉素苗的高度均高于對照,與前人報道的赤霉素可以促進莖的伸長結果[12]一致。將正常苗與蓮座狀苗比較,發現正常苗IAA含量高于蓮座狀苗,可能是由于正常苗生長健壯,更有利于分泌生長素類物質,進而促進實生苗的生長。
本試驗中早熟桃種子處理時加入一定量的赤霉素,有效減少了早紅2號蓮座狀苗的比例,進而提高胚培種子成苗率,研究結果可為解除早熟桃種子休眠提供參考,對提高早熟桃種子育苗效率具有重要意義。
參考文獻:
[1]浙江農業大學. 果樹育種學[M]. 上海:上海科學技術出版社,1996:277-279.
[2]Amnon EE. Temperate fruit crops in warm climates[M]. Boston:Kluwer Academic Publishers,2000:60-80.
[3]張 義. 桃種子休眠原因及解除休眠方法研究概述[J]. 湖北農學院學報,2001(4):382-384.
[4]陶 俊,陳云志. 桃種子的休眠與萌發研究——種皮的調控作用[J]. 果樹科學,1996,13(4):233-236.
[5]俞奔馳,黃富宇,呂 平,等. 劍麻葉片內源激素高效液相色譜測定方法研究[J]. 安徽農業科學,2011,39(22):13266-13267,13289.
[6]吉九平,王業遴. 桃種子層積中激素的變化及其與破眠的關系[J]. 南京農業大學學報,1987(1):25-30.
[7]劉用生,李秀菊. 桃種子休眠研究進展[J]. 河南職技師院學報,1992,20(2):44-48.
[8]劉艷萍. 百合鱗莖低溫解除休眠過程中生理生化變化研究[D]. 沈陽:東北林業大學,2007.
[9]孫紅梅. 低溫解除百合鱗莖休眠的效應及其生理生化機制研究[D]. 沈陽:沈陽農業大學,2003.
[10]孟新法. 不同濃度赤霉素對解除桃種子休眠及實生苗生長的效應[J]. 北京農業大學學報,1988,14(4):447-451.
[11]潘瑞熾. 植物生理學[M]. 5版.北京:高等教育出版社,2004:167-200.
[12]段 娜,賈玉奎,徐 軍,等. 植物內源激素研究進展[J]. 中國農學通報,2015,31(2):159-165.
[13]王江英,朱朋波,湯雪燕,等. 外源赤霉素誘導矮生山茶恨天高植株生長的轉錄組分析[J]. 江蘇農業學報,2020,36(1):47-56.
[14]Frisby J W,Seeley S D. Chilling of endodorment peach propagules:Ⅱ Initial seedling growth[J]. J Amer Soc Hort Sci,1993,118(2):253-257.羅素梅,陳鴻賓,賴金莉,等. 3個三角梅品種的光響應及光合特性[J]. 江蘇農業科學,2020,48(23):124-128.

