菠蘿酸性轉化酶基因家族初步生物信息學及表達分析
宋康華 侯曉婉 賈志偉 洪克前 谷會 張魯斌


摘? 要:酸性轉化酶(acid invertase, AIN)在菠蘿采后蔗糖降解過程中起著重要作用,基于菠蘿全基因組數據庫,預測菠蘿AIN家族基因并進行生物信息學分析,解析其在采后菠蘿不同貯藏溫度下的表達變化情況,為闡明AIN基因在采后菠蘿果實貯藏特性中的作用奠定基礎。以水稻AIN家族基因為探針,在菠蘿全基因組中鑒定到2個菠蘿細胞壁酸性轉化酶基因(cell wall acid invertase, CWIN)和2個液泡酸性轉化酶基因(vacuolar acid invertase, VIN),分別命名為AcCWIN1、AcCWIN2、AcVIN1、AcVIN2,設計編碼區引物進行測序驗證,并進行生物信息學分析。進化分析結果表明,AcCWIN1、AcCWIN2和AcVIN1、AcVIN2蛋白分別歸于細胞壁酸性轉化酶和液泡酸性轉化酶2個進化支上,且均屬于糖基水解酶家族GH32,基因結構、保守域和保守基序均一致。熒光定量分析結果表明,菠蘿果肉中AcVIN1和AcVIN2在果實采后貯藏過程中表達量升高,且AcVIN1在發生黑心病的部位大量表達,而AcCWIN1和AcCWIN2在采后貯藏過程中表達量逐漸降低,且隨著貯藏溫度的升高其表達量降低,預示AcVIN1、AcVIN2較AcCWIN1、AcCWIN2在菠蘿采后蔗糖降解和黑心病的發生方面發揮著更為重要的作用。
關鍵詞:菠蘿;酸性轉化酶;生物信息學分析;基因家族;表達分析
中圖分類號:S961.6? ? ? ? 文獻標識碼:A
Abstract: Acid invertase plays an important role in the process of sucrose degradation of postharvestal pineapple. Based on the genome database of pineapple, AIN genes were identified and analyzed using the bioinformatics method, and the expression of AIN genes under different storage temperatures were analyzed, which would lay a foundation for clarifying the characteristics of AIN genes in postharvestal pineapple fruit storage. In this study, two cell wall invertase and two vacuolar invertase genes were identified in the pineapple genome using the AIN family gene of rice as the probe, named as AcCWIN1, AcCWIN2, and AcVIN1, AcVIN2 respectively, and verified sequences were further analyzed for bioinformatics information. The evolutionary analysis showed that AcCWIN1, AcCWIN2, and AcVIN1, AcVIN2 belonged to the two evolutionary branches of the cell wall acid invertase and vacuole acid invertase, respectively, which belonging to the glycohydrolase family GH32, and the gene structure, conserved domain and conserved motif were consistent. Fluorescence quantitative analysis showed that the expression of AcVIN1 and AcVIN2 increased during postharvest storage at room temperature, and AcVIN1 was abundantly expressed at the site of blackheart disease. The expression of AcCWIN1 and AcCWIN2 decreased gradually during postharvest storage at 10 ℃, 25 ℃ and 38 ℃, and were depressed with storage temperature increased, indicating that AcVIN1 and AcVIN2 played a more important role in sugar degradation and blackheart disease of pineapple than AcCWIN1 and AcCWIN2.
Keywords: pineapple; acid invertase; biological information; gene family; quantitative analysis
DOI: 10.3969/j.issn.1000-2561.2020.12.003
蔗糖轉化酶(sucrose invertase),是調節蔗糖代謝的關鍵酶之一,能不可逆地催化蔗糖裂解形成葡萄糖和果糖,其不僅存在于光合作用組織中,也廣泛存在于根、果實等非光合作用的組織中。根據亞細胞定位不同,分為細胞壁、液泡和胞質轉化酶3類;根據酶的最適pH不同,可將轉化酶分為酸性和中性或堿性兩類,研究表明蔗糖轉化酶在調節韌皮部蔗糖卸載、控制貯藏器官中糖分的組成、細胞滲透調節及參與果實對逆境脅迫的響應與信號轉導等方面都具有重要作用[1]。細胞壁轉化酶和液泡轉化酶屬于酸性轉化酶,具有相似的酶學特性,最適pH為4.5~5.5,可水解蔗糖和其他β-果糖類寡糖,因此又被稱為β-呋喃果糖苷酶(β-Fructofuranosidase)[2],多樣化程度較高,細胞壁酸性轉化酶(cell wall acid invertase, CWIN)在生長發育過程中起著維持植物滲透脅迫和逆境應答的作用,進一步研究發現細胞壁蔗糖轉化酶與維管束植物共演化,而液泡酸性轉化酶(vacuolar acid invertase, VIN)是己糖積累的重要調節因子,在果實發育后期及采后蔗糖代謝中發揮著重要作用[3]。
菠蘿果實中絕大部分的糖都在液泡中積累,酸性轉化酶基因的表達受器官和發育特異性、糖信號、脅迫及激素的調節,而酶活性則受反應產物和內源蛋白抑制子的調節,菠蘿酸性轉化酶在果實收獲前期活性降低,與菠蘿果實蔗糖的大量積累呈現負相關[4],前人在玉米中研究發現干旱脅迫可誘導液泡酸性轉化酶基因Ivr2的表達,促使植株中葡萄糖和果糖的積累,但在不同的器官中其調控模式并不相同[5]。已有研究結果表明,番茄細胞壁轉化酶基因LIN6在防御應激反應途徑中發揮著重要作用,可被茉莉酸甲酯和脫落酸誘導,并且在低溫脅迫下可維持葉片中較高光合速率和可溶性糖含量增強植株的耐寒性[6]。而液泡酸性轉化酶則在果實成熟過程中發揮主要作用,研究發現番茄中液泡酸性轉化酶基因SlVI受果實成熟抑制轉錄因子RIN的直接調控,與液泡酸性轉化酶抑制子基因SlVIF相互作用調控果實的糖代謝進而影響乙烯的產生和果實的成熟[7]。果蔬貯藏過程中液泡酸性轉換酶活性可影響貯藏器官中糖組分及耐冷性,研究發現桃果實PpVIN2在冷害中被大量誘導,在低溫冷藏中的糖代謝機制扮演重要角色[8],而馬鈴薯液泡酸性轉化酶基因KCVIN1和KCVIN2被證明是冷藏過程導致馬鈴薯低溫糖化的關鍵基因[9]。酸性轉化酶基因家族與果蔬品質和抗逆性大小有著極為密切的聯系,酸性轉化酶基因的功能已陸續在其他物種如甘蔗[10]、無核柑橘[11]、辣椒[12]中得到鑒定和研究。已知酸性轉化酶基因在植物中以家族存在,成員數量因物種不同而異,菠蘿采后蔗糖的降解與酸性轉化酶關系密切,但目前尚無在基因組水平上的報道,2015年菠蘿(Ananas comosus L. Merr)基因組測序完成[13],為在全基因組水平上對其進行基因家族系統的生物信息學分析和重要功能基因的發掘提供了良好的平臺。菠蘿果實采后貯藏過程中面臨各種逆境脅迫,因此對酸性轉化酶基因家族生物信息學和表達特性的研究,對進一步研究酸性轉化酶在菠蘿采后貯藏過程中蔗糖降解和果實品質形成及逆境脅迫方面具有十分重要的意義,也可為菠蘿冬季果升糖降酸提高果實品質及采后貯藏保鮮奠定理論基礎。
本研究基于全基因組測序結果對菠蘿酸性轉化酶基因家族成員進行預測,并對菠蘿采后不同溫度貯藏下該家族基因的表達水平進行分析,為進一步鑒定采后菠蘿果實蔗糖降解的關鍵基因以及研究其與黑心病發病的關聯奠定基礎。
1? 材料與方法
1.1? 材料
以禾本科‘巴厘菠蘿為研究對象,供試菠蘿采自廣東省湛江市徐聞縣菠蘿試驗基地,選取無病蟲害、無機械損傷、果實大小一致的六至七成熟果實,用0.5 g/L咪鮮胺浸泡果實10 min,撈出置于陰涼通風處,待風干后將試驗用果放在套有0.02 mm聚乙烯薄膜袋的鏤空塑料筐中,室溫下(20 ℃)貯藏,并于3、6、9 d切開果實,在近果髓處進行取樣,在9 d時選取果實一側(以果髓為中心)發生黑心病的果肉和一側未發生黑心病的健康果肉,立即用液氮速凍以備提取RNA;在另一次獨立實驗中將實驗用果進行同樣處理,之后分別放于10、25、38 ℃的恒溫培養箱中貯藏,并于貯藏3、6、9 d進行取樣,取樣部位為菠蘿果實遠果髓處果肉,立即用液氮速凍,置于?80 ℃超低溫冰箱中備用。
1.2? 方法
1.2.1? 菠蘿AcAINs基因家族的篩選? 在數據庫網站http://www.ncbi.nlm.nih.gov/genome搜索與菠蘿親緣關系較近的水稻酸性轉化酶氨基酸序列(AAF87246),并以其保守結構域為探針在植物基因組網址(http://phytozome.jgi.doe.gov/pz/ portal.html)和菠蘿基因數據庫(http://pineapple. angiosperms.org/)Blast搜索,利用Pfam和SMART對搜索到的候選基因進一步確認,同時獲得其CDS、氨基酸序列及染色體位置信息。
1.2.2? 菠蘿AcAINs基因的鑒定及生物信息學分析? RNA提取采用植物RNA提取試劑盒(華越洋生物科技有限公司)。反轉錄試劑盒選用M-MLV反轉錄試劑盒(TaKaRa),參照已測序菠蘿基因組中AcAINs編碼區序列,設計相應的全長引物。
測定菠蘿AcAINs基因家族的基本理化性質,利用在線工具Expasy(http://web.expasy.org/ protparam/)進行分析蛋白分子量、等電點、不穩定指數、總平均疏水性、脂溶系數,二級結構及亞細胞定位預測分別運用https://npsa-prabi.ibcp. fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html及Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/ plant-multi/)進行預測,菠蘿及水稻、番茄的AINs蛋白序列多重比對利用Clustal W(1.83)進行,系統進化樹運用MEGA 6.0軟件Neighbor-joining繪制,BootStrap值為1000,其余參數均為默認值,菠蘿AcAINs基因內含子和外顯子結構分析采用在線軟件GSDS 2.0(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)進行分析,氨基酸序列的蛋白質保守區域在NCBI在線網站進行分析,蛋白保守基序分析采用在線工具MEME 4.0 (http://meme-suite.org/tools/meme)進行,基序長度設為6~200個氨基酸,基序大數目設置為5,保守基序功能注釋運用SMART(http://smart.embl-heidelberg.de/)在線工具。
1.2.3? 菠蘿AcAINs基因的表達分析? 使用軟件PrimerPremier 5.0 設計各基因的qRT-PCR引物,并在NCBI數據庫上檢測引物的特異性,各基因引物序列如表1,熒光定量PCR采用SYBR Gree II 試劑盒,采用Roche公司生產的LightCycler 480 qPCR儀器,采用Livak和Schmittgen[14]的2–CT 公式計算基因相對表達量。
2? 結果與分析
2.1? 菠蘿AcAINs基因家族的克隆及鑒定
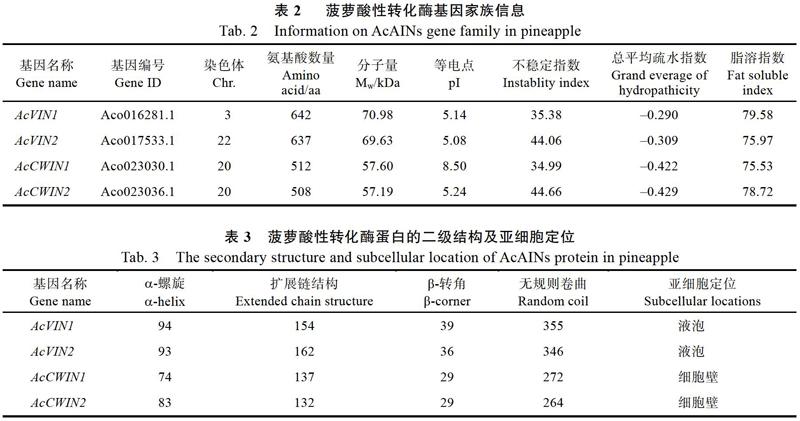
通過基因名查找在菠蘿基因組數據庫里找到4個酸性轉化酶基因(2個AcCWINs和2個AcAINs),將其分別命名為AcCWIN1、AcCWIN2和AcVIN1、AcVIN2,以提取的菠蘿果肉RNA為模板,用設計的全長特異性引物進行RT-PCR擴增,分別得到大小為1539、1527、1929、1914 bp的DNA片段(圖1),將目的DNA片段測序后通過NCBI Blast序列比對,結果顯示,所克隆的AcCWIN1、AcCWIN2和AcVIN1、AcVIN2全長序列與基因組已預測的對應的菠蘿基因具有較高的同源性,分別為99.48%、90.98%、92.25%、99.57%,證明所克隆的目的基因為預測的菠蘿細胞壁酸性轉化酶基因和菠蘿液泡酸性轉化酶基因。其基本理化性質的分析結果見表2,2個AcCWINs均分布在20號染色體上,AcVIN1分布在3號染色體上,而AcVIN2分布在22號染色體上,相應蛋白的氨基酸數目為508~642個,分子量在57.19~70.98 kDa之間;AcCWIN1等電點為8.50呈堿性,AcCWIN2和AcVIN1、AcVIN2等電點均小于7.0,呈酸性;AcVIN1和AcCWIN1蛋白不穩定指數小于40,為穩定蛋白,AcVIN2和AcCWIN2不穩定指數大于40,為不穩定蛋白;所有的AcAINs蛋白為親水性蛋白。其蛋白二級結構的分析結果見表3,4個AcAINs蛋白二級結構均由-螺旋、擴展鏈結構、-轉角和無規則卷曲組成,且各組成的百分比均為無規則卷曲>擴展鏈結構>-螺旋>-轉角。亞細胞定位預測AcCWIN1和AcCWIN2定位于細胞壁,而AcVIN1和AcVIN2定位于液泡中。
2.2? 菠蘿AcAINs基因家族基因結構、蛋白保守基序及系統進化分析
基因結構分析結果表明,菠蘿的AcAINs基因結構均由外顯子和內含子組成,AcCWIN1和AcVIN1均有5個內含子,AcCWIN2含有3個內含子,而AcVIN2含有6個內含子(圖2)。與模式植物水稻、番茄及其他植物AINs蛋白序列的系統進化樹分析結果表明,AcCWIN1、AcCWIN2和AcVIN1、AcVIN2分別與其他植物的細胞壁酸性轉化酶蛋白和液泡酸性轉化酶蛋白聚類在一起(圖3)。NCBI在線CDD分析結果發現,AcCWIN1和AcCWIN2均只含有1個Glyco_32結構域,而AcVIN1和AcVIN2除含有Glyco_32結構域外,在其N端還含有1個功能未知的DUF3357結構域,說明該家族基因屬于糖基水解酶基因家族GH32(圖4)。菠蘿AcAINs蛋白保守基序MEME預測結果如圖5所示,基序分析中,4個AcAINs蛋白的5個保守基序位置和序列均較為相似,并利用SMART和Pfam對預測的保守基序進行命名(表4)。
2.3? 菠蘿AcAIVs基因家族在采后不同時期及黑心病部位中的表達分析
對室溫(20 ℃)貯藏近果髓果肉(靠近果心處約1 cm)及10、25、38 ℃貯藏過程中遠果髓果肉不同時期的樣品提取RNA并進行反轉錄,用設計的熒光定量引物進行定量表達分析。結果表明,在室溫貯藏試驗中,AcCWIN1和AcCWIN2基因相對表達量隨貯藏時間延長逐漸降低,而AcVIN1和AcVIN2基因則隨貯藏時間延長相對表達量逐漸升高,比較黑心病發病果肉和健康果肉中4個基因的相對表達量發現,AcCWIN1基因表達量在二者之間差異不顯著,AcCWIN2和AcVIN2基因表達量在黑心病發病果肉中顯著下調,而AcVIN1則在黑心病發病部位中顯著上調(圖6)。在不同貯藏溫度試驗中,隨著貯藏時間的延長,菠蘿果肉中AcCWIN1、AcCWIN2和AcVIN1、AcVIN2基因表達量的變化趨勢與室溫貯藏下表達量的變化趨勢相一致,在25 ℃時貯藏3 d和6 d的菠蘿果肉中AcAIN1和AcVIN2的相對表達量均比10 ℃和38 ℃貯藏條件下高,其中25 ℃貯藏6 d時,AcVIN1基因表達量急劇升高至最大值后降低;在38 ℃貯藏9 d時,AcVIN1基因的相對表達量達到峰值;在25 ℃貯藏6 d及10 ℃和38 ℃貯藏9 d時AcVIN2基因的相對表達量均達到最大值(圖7)。
3? 討論
糖代謝是果實色澤、風味形成及其他營養物質代謝的重要基礎,是決定果實品質和商品價值的主要因素,在采后果實品質和成熟衰老調控方面,糖代謝的合理調控更為重要[15]。‘巴厘菠蘿以積累蔗糖為主,采后蔗糖的降解與蔗糖轉化酶的關系密不可分,然而菠蘿果實酸性轉化酶基因的研究尚未見報道,隨著植物基因組學研究的廣泛深入以及廣泛的基因家族分析,酸性轉化酶家族已相繼在其他物種陸續得到鑒定和研究,如番木瓜基因組中發現有6個酸性轉化酶基因,其中3個細胞壁轉化酶基因,3個液泡轉化酶基因[16];辣椒中含有9個酸性轉化酶基因,2個屬于液泡酸性轉化酶,7個屬于細胞壁酸性轉化酶[17];水稻編碼9個細胞壁酸性轉化酶基因(OsCIN1-9)和2個液泡酸性轉化酶基因(OsVIN1-2)[18-19]。本研究在菠蘿全基因組數據庫中共發現2個細胞壁轉化酶基因(AcCWIN1和AcCWIN2)和2個液泡轉化酶基因(AcVIN1和AcVIN2),基因克隆擴增出的條帶與預期大小相同且測序正確,前人研究表明植物酸性轉化酶基因的原始結構為7個外顯子6個內含子,在進化過程中可出現多次內含子丟失事件,導致其基因結構的多樣性[16]。在本研究中AcVIN2保留了原始基因的結構,AcCWIN1和AcVIN1在進化過程中均丟失了1個內含子,而與AcCWIN1位于同一染色體的AcCWIN2則進化程度較高,在進化過程中丟失一部分內含子和氨基酸序列。酸性轉化酶蛋白系統進化分析表明,菠蘿AcCWIN1、AcCWIN2和AcVIN1、AcVIN2氨基酸序列均能與其他植物的細胞壁轉化酶和液泡轉化酶蛋白分別聚類在一起,且與單子葉植物水稻、油棕、海棗等親緣關系較近。保守域預測發現AcCWIN1、AcCWIN2和AcVIN1、AcVIN2編碼蛋白均屬于糖基水解酶家族32(GH32),AcCWIN1、AcCWIN2編碼蛋白均含1個典型的Glyco_32結構域,而AcVIN1和AcVIN2編碼蛋白則含有2個保守結構域即位于 N-端的Pfam DUF3357結構域和Glyco_32結構域。保守基序分析發現,菠蘿AcAINs成員均含有5個保守基序,位置序列相對一致。
蔗糖代謝平衡在果實品質形成及抗逆性大小方面起著重要的作用,菠蘿果肉細胞內積累了大量的蔗糖及酚類物質,蔗糖代謝平衡在菠蘿果實后熟品質形成以及黑心病的觸發階段發揮重要作用。本研究采后菠蘿果實AcAINs基因在貯藏過程中的表達差異情況表明,在整個貯藏過程中,AcCWIN1、AcCWIN2在室溫及不同貯藏溫度下相對表達量逐漸降低,且貯藏溫度越高,其表達所受到的抑制程度越大。早期研究認為水稻細胞壁轉化酶OsVIN1主要通過卸載質外體蔗糖為子代組織提供碳源[19],在谷粒發育早期表達豐度較高后期降低,這與菠蘿AcCWIN1的表達量在果實貯藏過程中逐漸降低的趨勢較為一致,說明AcCWINs可能在菠蘿果實發育早期發揮更為重要的作用,而在菠蘿果實采后貯藏過程中蔗糖的降解可能主要發生在液泡,菠蘿細胞壁轉化酶與采后菠蘿蔗糖降解關系不密切。AcCWIN1在發生黑心病和健康果肉中的表達量不顯著,而AcCWIN2在發生黑心病果肉中由于黑心病引發系列的代謝失調其表達量顯著下調,說明菠蘿細胞壁轉化酶基因與黑心病的發病并不相關。AcVIN1、AcVIN2基因則在貯藏過程中表達量逐漸升高,說明AcVIN1、AcVIN2雖然在菠蘿果肉中表達豐度較低,但在菠蘿果實采后貯藏蔗糖降解過程中發揮了更為重要的作用,而AcVIN2和AcVIN1在黑心病發病部位與健康部位的表達量差異表明,AcVIN1的過量表達可能與菠蘿黑心病發病有著密切的聯系,這與Fukuoka等[20]研究發現液泡酸性轉化酶IbAIV基因的表達水平與甘薯黑心病的發病程度密切相關的結論較為一致,在發病程度嚴重的區域檢測到較高水平的果糖和葡萄糖含量,而細胞內高濃度的糖含量可觸發活性氧ROS的產生,ROS繼而引發酚類物質的積累及細胞膜完整性的破壞導致黑心病的發生,而‘巴厘菠蘿果實采后貯藏過程易發黑心病,褐變底物等酚類物質主要聚集在液泡,是否是因為AcVIN1在液泡中大量表達引起較高水平的果糖和葡萄糖含量而導致了黑心病的發生?蔗糖的降解速率是否與菠蘿的后熟進程及黑心病的發病有著密切的聯系[21]?這一具體機制還需要更深入和進一步的研究。
本研究對菠蘿酸性轉化酶基因家族進行了初步分析,為深入研究該基因家族的表達調控、結構和功能等提供參考數據及從整體水平上弄清酸性轉化酶調控采后菠蘿蔗糖降解機制,通過調控其表達來達到增強果實品質及提高果實抗逆性的目的。
參考文獻
Zhang Y L, Cao Y Q, Hu N N. Research progress in plant invertase[J]. Agricultural Science & Technology, 2017, 18(1): 21-22, 34.
趙杰堂. 蔗糖轉化酶在高等植物生長發育及脅迫響應中的功能研究進展[J]. 熱帶亞熱帶植物學報, 2016, 24(3): 352-358.
Wan J H, Wu L M, Yang Y J, et al. Evolution of sucrose metabolism: The dichotomy of invertases and beyond[J]. Trends in Plant Science, 2018, 23(2): 163-177.
Chen C C, Paull R E. Changes in sugar contents and activities of sugar metabolizing enzymes in pineapple fruit flesh during development[J]. Acta Horticulturae, 2000, 529(529): 191-198.
Kim J Y, Brangeon J, Prioul J L, et al. A maize vacuolar invertase, Ivr2, is induced by water stress. Organ/tissue specificity and diurnal modulation of expression[J]. Plant Physiology, 2000, 124(1): 71-84.
Wu Z J, Cheng Z H, Meng H W. Analysis of cell wall invertase function in leaves of tomato under cold stress[M/OL]. 2012, 1: 49-52. DOI Bookmark:10.1109/iCBEB.2012.66.
Qin G Z, Zhu Z, Wang W H, et al. A tomato vacuolar invertase inhibitor mediates sucrose metabolism and influences fruit ripening[J]. Plant Physiology, 2016, 172(3): 1596-1611.
He X X, Wei Y Y, Kou J Y, et al. PpVIN2, an acid invertase gene family member, is sensitive to chilling temperature and affects sucrose metabolism in postharvest peach fruit[J]. Plant Growth Regulation, 2018, 86(2): 169-180.
Deng S Y, Mai Y T, Niu J. Fruit characteristics, soluble sugar compositions and transcriptome analysis during the development of Citrus maxima “seedless”, and identification of SUS and INV genes involved in sucrose degradation[J]. Gene, 2019, 689: 131-140.
鄭月霞, 許玉林, 張積森, 等. 甘蔗可溶性酸性轉化酶基因的克隆及序列分析[J]. 熱帶作物學報, 2012, 33(11): 2007-2011.
Kumari V, Das N. Vacuolar invertases in potato (Solanum tuberosum L.): Molecular cloning, characterization, sequence comparison, and analysis of gene expression in the cultivars[J]. Acta Physiologiae Plantarum, 2013, 35(7): 2055-2068.
Shen L B, Qin Y L, Qi Z Q, et al. Genome-wide analysis, expression profile, and characterization of the acid invertase gene family in pepper[J]. International Journal of Molecular Science, 2018, 20(1): 15.
Ming R, VanBuren R, Wai C M, et al. The pineapple genome and the evolution of CAM photosynthesis[J]. Nature Genetics, 2015, 47(12): 1435-1442.
Livak J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
李芋萱, 曾凱芳, 王寶剛, 等. 不同處理對采后果實糖代謝過程影響研究進展[J]. 食品科學, 2015, 36(5): 283-288.
嚴丹鳳, 吳曉慧, 耿夢婷, 等. 番木瓜酸性轉化酶基因家族預測及生物信息學初步分析[J]. 基因組學與應用生物學, 2014, 33(2): 374-381.
魏華偉, 柴松琳, 胡克玲, 等. 辣椒酸性蔗糖轉化酶基因家族鑒定及表達[J]. 分子植物育種, 2019, 17(15): 4900- 4907.
Ji X M, van den Ende W, van Laere A, et al. Structure, evolution, and expression of the two invertase gene families of rice[J]. Journal of Molecular Evolution, 2005, 60(5): 615-634.
Hirose T, Takano M, Terao T. Cell wall invertase in developing rice Caryopsis: Molecular cloning of OsCIN1 and analysis of its expression in relation to its role in grain filling[J]. Plant and Cell Physiology, 2002, 43(4): 452-459.
Fukuoka N, Miyata M, Hamada T, et al. Histochemical observations and gene expression changes related to internal browning in tuberous roots of sweet potato (Ipomea batatas)[J]. Plant Science, 2018, 274: 476-484.
Hong K Q, Xu H B, Wang J N, et al. Quality change and internal browning development of summer pineapple fruit during storage at different temperature[J]. Scientia Horticulture, 2013, 151: 68-74.

