玉米尾孢菌灰斑病抗性種質鑒定及其抗性基因分析
譚靜 羅吉 王文瑞 王琨 高佳琪

摘要:灰斑病是全球玉米的重要病害,特別對中國西南地區玉米的生產造成了嚴重影響,玉米尾孢菌是中國西南地區玉米灰斑病的主要致病菌種。本研究采用來源廣泛的241份玉米自交系構建關聯群體,在云南玉米灰斑病重病區進行灰斑病的田間自然發病抗性鑒定;利用覆蓋玉米全基因組的單核苷酸多態性(SNP)標記對由241份玉米自交系構建的關聯群體進行基因型分析,在此基礎上通過全基因組關聯分析進行玉米灰斑病抗性基因的定位及其候選基因的預測,為玉米灰斑病抗性育種提供技術支撐。2017-2018年的玉米灰斑病抗性鑒定結果顯示,2年共有109份熱帶/亞熱帶玉米自交系之間和109份溫帶玉米自交系材料之間以及材料與年份互作間的差異均達極顯著水平;在2017-2018年的抗性鑒定結果中均表現為抗病的材料有44份,均表現為高抗的材料僅有5份。用20 586個高質量SNP標記、2年玉米灰斑病表型數據進行全基因組關聯分析,結果顯示,在P≤0.001(-lgP≥3)條件下,共檢測到44個與玉米灰斑病抗性顯著關聯的SNP位點,其中34個SNP位點對應31個基因,分布在除10號染色體外的其他染色體上。結合已有的連鎖定位研究結果可知,在以上31個基因中,除了4個基因外,其余27個基因均分布在已知數量性狀座位(QTL)區間內,將這27個基因在生物信息數據庫中與已有信息進行比對,共獲得8個與抗病相關的候選基因。研究結果可為由玉米尾孢菌引起的玉米灰斑病的抗性育種及其抗性基因的克隆、抗病機制的研究奠定基礎。
關鍵詞:玉米;玉米尾孢菌;灰斑病;抗性種質;抗病基因;關聯分析
中圖分類號:S435.131.4+9文獻標識碼:A文章編號:1000-4440(2020)06-1373-09
Abstract: Gray leaf spot (GLS) is an important disease of maize in the globe, which brings about severe impact on maize production especially in Southwestern China. Cercospora zeina is the main pathogen of GLS in Southwestern China. In this study, 241 maize inbred lines with wide sources were used to construct association population, and the resistance phenotype to GLS under natural condition in the severe disease area of Yunnan was evaluated. Genotypes of the association population constructed by 241 maize inbred lines were analyzed by single nucleotide polymorphism (SNP) markers covering the whole genome. Then the loci of GLS-resistant genes and the candidate genes were predicted to provide technical support for the GLS-resistant breeding of maize by genome-wide association analysis. The two-year (2017 to 2018) identification results of GLS-resistance indicated that there were significant differences among 109 tropical/subtropical maize inbred lines, 109 temperate maize inbred lines and the interaction between materials and years. There were 44 inbred lines with disease resistance and five inbred lines with high resistance in two years of resistant evaluation. The results of genome-wide association analysis by using 20 586 high-quality SNP markers and two-year phenotypic data of GLS indicated that, under the condition of P≤0.001 (-lgP≥3), a total of 44 SNP loci significantly associated with GLS-resistance were detected, among which 34 SNP loci corresponding to 31 genes were distributed on chromosomes except for chromosome 10. Compared with existing research results on linkage location, it could be seen that except for four genes, the remaining 27 genes of the 31 genes were located in the quantitative trait locus (QTL). Eight candidate genes related to diseaseresistance were obtained by comparing the 27 genes in bioinformatics database. The results will lay a foundation for the resistance breeding, the cloning of resistant genes and the resistance mechanism research on maize GLS (Cercospora zeina).
Key words:maize;Cercospora zeina;gray leaf spot;resistant germplasm;resistant gene;correlation analysis
玉米(Zea Mays L.)是全球第一大糧食作物,灰斑病是玉米葉部的主要病害,在世界各玉米產區均有發生,一般會造成玉米產量損失達5%~30%,嚴重時可達60%以上,甚至造成絕收[1-4]。在中國西南高海拔玉米種植區,灰斑病已經成為玉米生產中最重要的病害,在云南地區已經超過玉米大斑病成為玉米生產中的第一大病害[2, 5-6]。長期以來,國內研究者一致認為,玉蜀黍尾孢菌是中國玉米灰斑病的致病菌種[7],直到2013年才有報道指出,玉米尾孢菌是中國西南地區玉米灰斑病的主要致病菌種[8-9]。
培育和種植抗病品種是控制植物病害最經濟有效的途徑,而抗病育種的成效取決于對獲得抗原、抗病遺傳機制的認識。目前,國內外研究者已經開展了大量玉米灰斑病的抗源篩選工作,雖然有研究結果表明,玉米自交系、雜交種對灰斑病的抗性差異明顯,但均未發現對灰斑病免疫的玉米種質,大多數玉米種質對灰斑病表現為感病[3,10-12]。多數研究發現,玉米對灰斑病的抗性主要表現為加性遺傳效應,屬于數量性狀遺傳效應[13-14]。研究者已經用不同群體定位了多個抗玉米灰斑病QTL,這些QTL在玉米的10條染色體上均有分布[15-24]。但是這些研究大多是針對玉蜀黍尾孢菌玉米灰斑病的抗性,加上受連鎖分析自身的局限,不能全面挖掘玉米灰斑病抗性基因,且多數定位精度不高,難以在玉米灰斑病的抗性育種中得以應用。
關聯分析是一種以連鎖不平衡為基礎,鑒定與表型變異緊密聯系的功能性等位基因/基因型的分析方法。具有研究周期短、分辨率高、可同時檢測數十個基因等優點,是復雜數量性狀基因挖掘和驗證的首選方法[25-27]。Mammadov等[28]結合連鎖和關聯分析法,在玉米第1、6、7、8號染色體上獲得了抗玉米灰斑病QTL;Kuki等[29]通過全基因組關聯分析檢測到7個單核苷酸多態性(SNP)位點與玉米灰斑病抗性顯著相關,并發現3個抗玉米灰斑病的候選基因。本研究利用自然發病原理對241份來源廣泛的玉米自交系進行玉米尾孢菌灰斑病抗性鑒定,為西南地區玉米抗灰斑病育種提供材料支撐。同時,本研究利用覆蓋全基因組的SNP標記,通過全基因組關聯分析全面挖掘抗玉米尾孢菌灰斑病的基因及其位點,并對檢測到的顯著性位點與前人研究得到的QTL區間進行比較,結合生物信息學分析方法,從一致性位點中預測候選基因,為玉米尾孢菌灰斑病抗性基因的克隆和抗病機制的研究奠定基礎。
1材料與方法
1.1試驗材料
參考已有表型數據和系譜關系,從來源廣泛的630份玉米自交系中優先選擇沒有直接親緣關系、抗灰斑病差異大的241份玉米自交系構建關聯群體,其中111份來自CIMMYT(國際玉米小麥改良中心),30份來自美國,6份來自泰國,其余94份來自國內不同玉米生態區,其中包括在中國玉米產業中大面積推廣使用的一些重要雜交種的親本。
1.2田間試驗與抗性鑒定
利用重病區自然發病原理進行玉米灰斑病的抗性鑒定,于2017-2018年在云南保山市郊進行。根據系譜將研究材料分為熱帶/亞熱帶、溫帶2組,組內采用隨機區組設計,設2次重復,同時選取4個典型材料(抗病自交系Y32、感病自交系Ye478、抗病雜交種海禾2號、感病雜交種會單四號)作為對照,每40行設置1組對照(含2個抗病對照材料、2個感病對照材料),在試驗地外圍種植2行感病材料作為保護行。種植規格參照當地習慣,加強田間水肥管理,試驗期間防蟲但不防病,在開花后第2周參照王曉鳴等[30]的玉米灰斑病分級標準對植株的抗病性進行鑒定,按照抗病性由強到弱分為1級、3級、5級、7級、9級(其中1級為高抗,9級為高感),以后每隔1周調查1次,共調查3次,取病級最符合正態分布的1次調查結果。每次調查均由2人進行獨立評價,每個小區最終的病害級別為2人評價值的平均值。
1.3基因型鑒定
用Affymetrix SNP 56K芯片(包含56 110個SNP標記)對上述自交系進行基因型分析,對芯片檢測結果進行嚴格的質量控制,最終選取20 586個高質量SNP標記用于后續的數據分析。
1.4數據分析
用SPSS 25.0軟件對表型數據進行描述性統計和方差分析,用Structure(V 2.3.4)軟件進行群體結構分析,再利用TASSEL 5.0軟件中的混合線性模型(Mixed-linear model,MLM),在考慮群體結構和親緣關系的條件下進行SNP標記與玉米灰斑病表型之間的關聯分析,參照P≤0.001(-lgP≥3)的標準進行顯著性位點檢測,并對檢測到的顯著性位點與前人研究得到的QTL區間進行比較,結合生物信息學方法,預測與前人研究得到的QTL一致性位點中的候選基因。
2結果與分析
2.1抗性鑒定
由于田間出苗、生長等因素而使部分材料缺失,2017年獲得了232份玉米自交系的灰斑病抗性鑒定結果,2018年獲得了225份玉米自交系的灰斑病抗性鑒定結果。2017年的玉米灰斑病抗性鑒定結果顯示,抗病自交系Y32的平均病級為1.50,抗病雜交種海禾2號的平均病級為2.19;感病自交系Ye478的平均病級為6.88,感病雜交種會單四號的平均病級為6.31。2018年的玉米灰斑病抗性鑒定結果顯示,抗病自交系Y32的平均病級為1.00,抗病雜交種海禾2號的平均病級為3.25;感病自交系Ye478的平均病級為7.63,感病雜交種會單四號的平均病級為7.94。由此可見,在鑒定試驗中抗病對照、感病對照的發病病級適宜且二者間差異明顯,說明在本試驗條件下得出的玉米灰斑病發病程度和鑒定效果可以用來區分不同玉米材料的抗性差異。
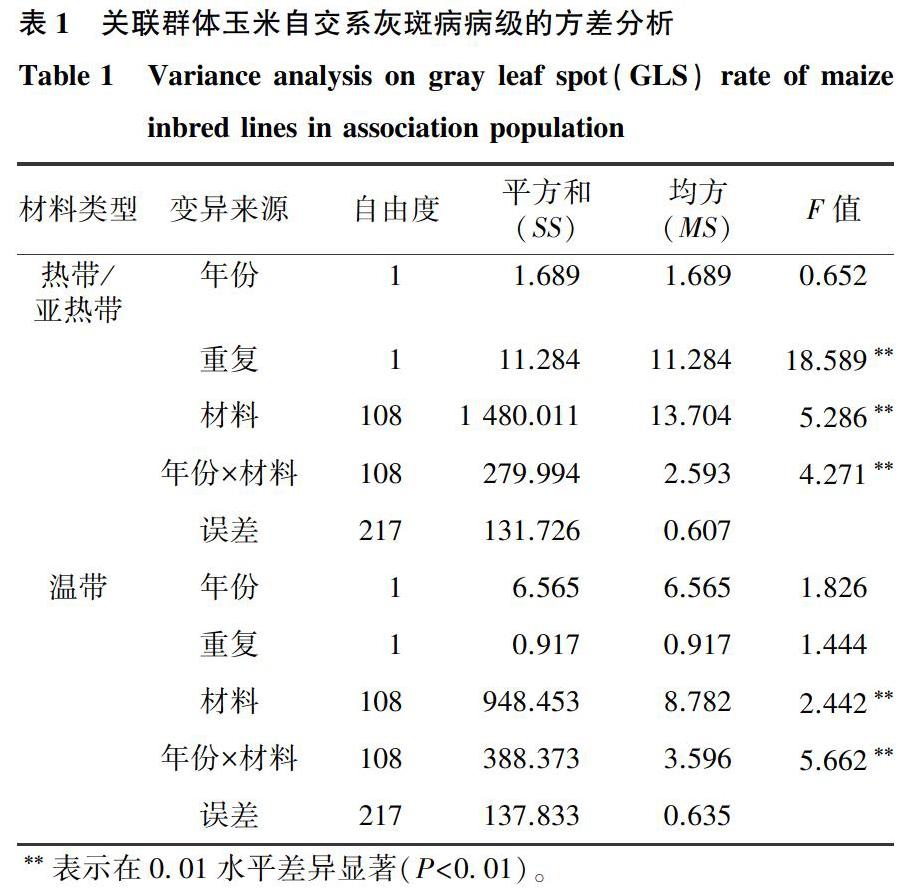
對2017-2018年共有的218份玉米自交系的灰斑病抗性鑒定結果進行方差分析,由表1可見,材料間以及年份與材料間互作的差異均達極顯著水平,說明玉米灰斑病表型與環境之間存在極顯著互作,109份熱帶/亞熱帶玉米自交系和109份溫帶玉米自交系對玉米灰斑病的抗性均存在極顯著差異。正態分布檢驗結果表明,2017-2018年玉米灰斑病表型的偏度、峰度絕對值均小于1,符合正態分布,2017-2018年玉米灰斑病病級的頻率分布直方圖見圖1。
在2017年,232份玉米自交系的灰斑病病級在1.00~9.00級均有分布,平均病級為4.79級,其中高感材料(病級>7.00)37份,感病材料(5.00<病級≤7.00)63份,中抗材料(3.00<病級≤5.00)59份,抗病材料(1.00<病級≤3.00)61份,高抗材料(病級≤1.00)12份。在2018年,225份玉米自交系的灰斑病病級在1.00~9.00級均有分布,平均病級為4.96級,其中高感材料33份,感病材料61份,中抗材料55份,抗病材料57份,高抗材料19份。綜合2017-2018年的玉米灰斑病抗性鑒定結果可知,2年都表現為抗病的材料有44份,2年都表現為高抗的材料有5份(分別為DTMA25、CIMBL32、CIMBL70、GEMS19、PS61-20),可以在玉米灰斑病抗病育種中應用這5份高抗材料。
2.2全基因組分析
對241份玉米自交系的群體結構分析可知,△K在K=2時出現第1個峰值(圖2a、圖2b),將241份玉米自交系劃分成2個亞群,與系譜信息進行比對后發現,第1個亞群對應育種實踐中的熱帶/亞熱帶(Tropical and subtropical, TST)種質,第2個亞群對應育種實踐中的溫帶(Temperate, TEM)種質;△K在K=4時出現第2個峰值(圖2a、圖2c),說明該群體能進一步被劃分為4個亞群,對應系譜中這4個亞群分別為TST群、溫帶堅稈(Stiff stalk)群、溫帶非堅稈(Non-stiff stalk)群和溫帶唐四平頭群。
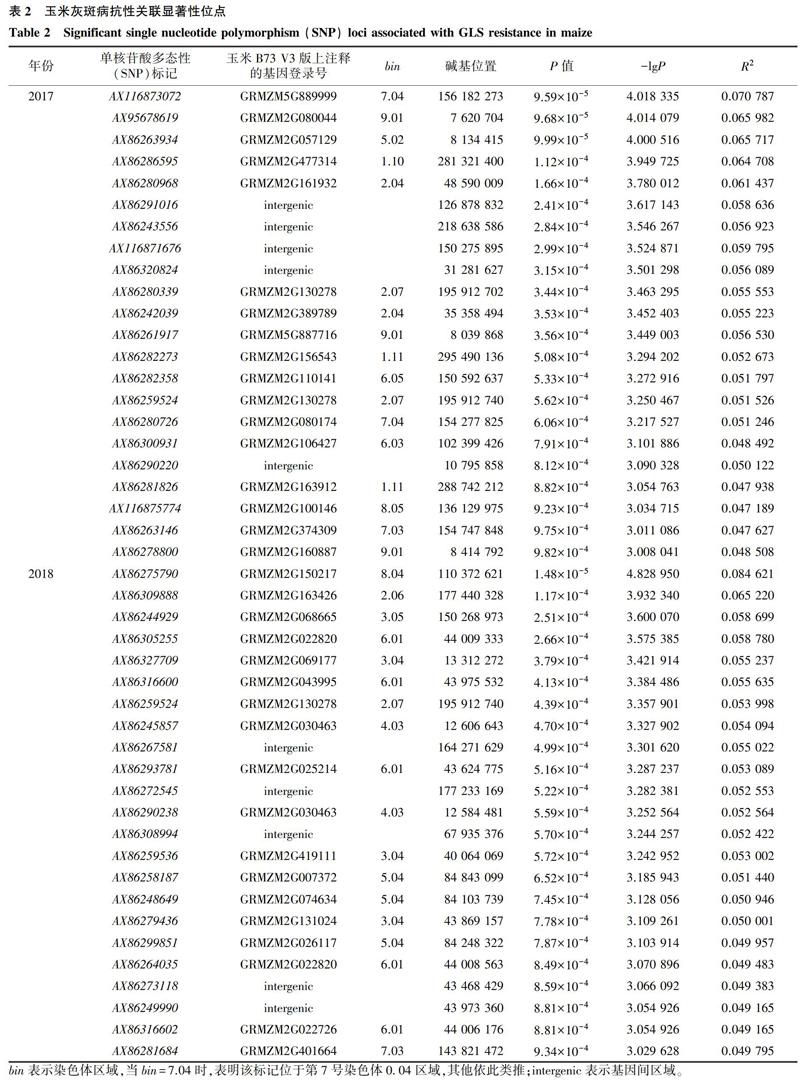
分析結果表明,在P≤0.001(-lgP≥3)條件下,2017年檢測到22個與抗性顯著關聯的SNP位點,2018年檢測到23個與抗性顯著關聯的SNP位點,2年均檢測到的SNP位點僅有1個,對應標記為AX86259524(表2)。通過查閱注釋文件發現,在2年內檢測到的與玉米灰斑病抗性關聯的44個SNP位點中,有10個位點的注釋信息位于基因間區域,其余34個有注釋信息的SNP位點共對應31個基因,這31個基因分布在除10號染色體外的其他染色體上,其中分布在6號染色體上的基因數最多,有6個,分布在4號染色體上的基因數最少,僅有1個,分布在其余染色體上的基因數為2~4個。
2.3抗性基因與已知抗性QTL比較
將本研究檢測到的31個基因與前人研究確定的玉米灰斑病抗性QTL區間進行比較,發現除了位于bin 1.11的2個基因(登錄號:GRMZM2G163912、GRMZM2G156543)和位于bin 2.04的1個基因(登錄號:GRMZM2G161932)、位于bin 5.02的1個基因(登錄號:GRMZM2G057129)外,其余27個基因均分布在前人研究的QTL區間內(表3)。雖然以上4個基因不位于前人研究的QTL區間內,但都與已定位的QTL相距不遠,它們是否屬于新的QTL還有待進一步研究確定。其中1號染色體上登錄號為GRMZM2G163912的基因與Zhang等[20]定位的QTL區間的右標記umc1500在遺傳圖譜上只相距54.20 cM,與閆偉等[31]通過QTL元分析定位的QTL區間右標記ias13a的距離更近,為47.12 cM,登錄號為GRMZM2G156543的基因與閆偉等[31]通過QTL元分析定位的QTL區間右標記ias13a相距99.52 cM;2號染色體上登錄號為GRMZM2G161932的基因與Balint-Kurti等[18]定位的mmp167~umc2249 QTL區間的物理距離最近,為432 kb;5號染色體上登錄號為GRMZM2G057129的基因與Benson等[32]定位的QTL區間右邊界的物理距離只有14 kb。
3討論
3.1玉米灰斑病抗性鑒定與抗性種質培育
準確的抗性鑒定是抗病育種及抗病基因定位的根本前提。人工培養玉米灰斑病的病原菌較難,發病要求的環境較難控制,而利用重病區的自然發病原理是玉米灰斑病抗性鑒定的有效途徑[35]。本試驗地點位于云南省保山市市郊(海拔1 600 m,地理坐標為25°08′N,99°10′E),屬于玉米灰斑病的重災區,當地氣候溫暖潮濕,田間相對濕度較高,并且土壤屬微酸性紅壤,有利于病原菌的存活、侵染和在田間發病流行。目前,許多有關玉米灰斑病的研究都將試驗地點設在云南省保山市市郊[20-21,23],而且已有研究發現,該地區的玉米灰斑病病原菌為玉米尾孢菌[2,8-9]。由此可見,本研究所選試驗地點可以從環境、氣候、病原菌等方面為玉米尾孢菌灰斑病的發生與流行提供條件,從而為本研究得到真實、可靠的表型數據提供重要保障。
為了準確評估研究材料的抗病情況,本研究在田間試驗設計的基礎上采用嚴格的措施控制試驗誤差,一是將關聯群體按照熱帶/亞熱帶、溫帶種質分為2組,組內采用隨機區組設計,2次重復;二是設置大量對照,每40行放1組對照(2個抗病對照材料,2個感病對照材料),以提高試驗數據的準確性。從試驗結果看,對照材料抗病自交系Y32在2017年、2018年這2年的抗性鑒定結果中表現為一致抗病,感病自交系Ye478表現為一致感病;2017年232份玉米自交系的平均病級為4.79級,2018年225份玉米自交系的平均病級為4.96級。方差分析結果顯示,玉米灰斑病表型不僅在玉米材料間表現出極顯著差異,在年份與材料互作間也表現出極顯著差異。分析其原因,一方面由于玉米灰斑病抗性是由許多微效基因控制的數量性狀,易受環境影響[13-14];另一方面,也與玉米灰斑病抗性評價標準有關。在本研究中,評價玉米灰斑病抗性采用的是中國病害鑒定通用的葉斑病病級劃分標準,即根據發病葉片部位及發病面積進行分級,目前大多數玉米灰斑病研究都采用這個方法進行抗性評價[20-21,23],該方法易于掌握和在田間實施,但是通過目測葉片發病面積進行分級可能會存在一定的主觀性,要求調查者能準確識別玉米灰斑病并正確評價其病級。本研究在調查過程中采用2人獨立評價的方法,再取2人評價值的平均值代表該材料的病級,以盡量避免因個人主觀因素帶來的表型誤差。
盡管目前國內外在玉米灰斑病抗性種質鑒定方面進行了大量研究,但是大多數都是針對玉蜀黍尾孢菌灰斑病抗性種質鑒定,而且目前在世界范圍內缺少抗玉米尾孢菌灰斑病的種質資源。本研究通過2年的玉米尾孢菌灰斑病抗性鑒定,篩選出44份抗病材料和5份高抗材料,可以在玉米尾孢菌灰斑病的抗性遺傳改良中加以利用。對這些材料的來源進行分析發現,這些抗病材料大都來源于CIMMYT(82%)。進一步查看241份玉米自交系中所有來源于CIMMYT的材料發現,中抗及以上的材料占比達到了66.7%以上,而CIMMYT種質基本上屬于熱帶/亞熱帶種質,表明來源于熱帶/亞熱帶的玉米種質對于玉米尾孢菌灰斑病普遍具有較好的抗性。吳紀昌等[10]對來源廣泛的915份玉米自交系進行灰斑病抗性鑒定,發現其中的高抗材料多數是從國外引進的具有熱帶/亞熱帶血緣的材料。Shi等[36-37]通過對玉米種質進行抗性鑒定發現,在中國主要的玉米種質中,具有熱帶/亞熱帶血緣的PB種質對灰斑病的抗性表現較好。綜上,今后應加強熱帶/亞熱帶玉米種質的研究和應用,培育優良的抗灰斑病玉米品種。
3.2玉米灰斑病抗性位點與候選基因預測
雖然本研究檢測到的與玉米灰斑病抗性顯著關聯的44個SNP位點中只有1個位點在2年內均被檢測到,但與他人的研究結果進行比較可以發現,本研究檢測到的44個SNP位點中有34個SNP位點對應31個基因,分布在除10號染色體外的其余染色體上。由此可以推測,本研究通過關聯分析得到的玉米灰斑病抗性位點是真實有效的,同時也進一步證明,玉米灰斑病抗性是由許多微效基因控制的數量性狀[13-14]。本研究檢測到的44個與玉米灰斑病抗性顯著關聯的SNP位點的表型貢獻率都較低(4.72%~8.46%),其中2017年、2018年重復檢測到的SNP標記AX86259524的表型貢獻率分別僅為5.15%、5.40%。正是因為這些位點的表型貢獻率較小、極易受外界環境的影響,因此它們被重復檢驗的難度較大,說明表型鑒定對于受微效基因控制的數量性狀研究極為重要。
將本研究檢測到的位于已知玉米灰斑病QTL區間內的27個基因在生物信息數據庫中進行比對,共找到8個與植物抗病相關的基因。其中登錄號為GRMZM2G163426基因(TRAM/LAG/CRN8 5基因,簡稱TLC5)、登錄號為GRMZM2G130278基因(內腔蛋白保留受體家族蛋白編碼基因)和登錄號為GRMZM2G069177基因(自噬相關蛋白18編碼基因)都可以通過調控細胞程序性死亡來參與植物免疫反應[38-39]。Pei等[40]研究發現,自噬相關蛋白編碼基因在應對小麥白粉病的免疫反應中起著積極作用。登錄號為GRMZM5G889999基因(激酶-相互作用激酶1編碼基因)和登錄號為GRMZM2G374309基因(富半胱氨酸受體樣蛋白激酶10編碼基因)都包含絲氨酸/蘇氨酸激酶結構域(STK),在植物免疫系統中充當細胞表面受體并轉導信號,以觸發植物的先天性免疫反應[41-42]。此外,許多研究都發現,絲氨酸/蘇氨酸蛋白激酶在植物抗病方面有著重要作用[43-44]。已有的研究結果也多次將絲氨酸/蘇氨酸激酶基因作為玉米灰斑病抗性的候選基因[36, 45-46]。登錄號為GRMZM2G068665基因(吡咯啉-5-羧酸還原酶基因)參與植物脯氨酸合成代謝途徑,而游離脯氨酸可能在脅迫耐受和滲透調節中起作用[47-48]。郭紅蓮等[49]研究發現,游離脯氨酸含量與玉米品種對灰斑病的抗性間呈正相關。登錄號為GRMZM2G007372基因(五肽重復序列蛋白編碼基因)和登錄號為GRMZM2G100146基因(組蛋白脫乙酰酶HDT2基因)都通過調控基因表達進而參與到植物免疫防御過程中[50-51],在擬南芥、水稻中都有這2個基因與抗病性相關的報道[52-53]。雖然有報道表明,以上8個基因在植物中都有抗病防御的功能,但是它們是否對玉米灰斑病具有抗性還需進行相關基因的功能驗證。這8個候選基因不僅分別位于不同染色體及其區段上,其抗病機制也各不相同,并且其基因功能涉及信號轉導、轉錄調控、物質代謝和結構蛋白功能,暗示玉米灰斑病的抗病反應是一個非常復雜的過程,可能涉及多種調控途徑的相互作用,因此在研究抗玉米灰斑病的過程中,還需要挖掘更多抗性基因和抗性機制。
參考文獻:
[1]盧宗志,李艷君,李海春,等. 玉米灰斑病對玉米產量及產量特性的影響研究[J]. 玉米科學, 2008, 16(6): 126-129.
[2]趙立萍,王曉鳴,段燦星,等. 中國玉米灰斑病發生現狀與未來擴散趨勢分析[J]. 中國農業科學, 2015, 48(18): 3612-3626.
[3]HILTY J W, HADDEN C H, GARDEN F T. Response of maize hybrids and inbred lines to gray leaf spot disease and the effects on yield in Tennessee[J]. Plant Disease Reporter, 1979, 63(6): 515-518.
[4]KINYUA Z M, SMITH J J, KIBATA G N, et al. Status of grey leaf spot disease in Kenyan maize production ecosystems[J]. African Crop Science Journal, 2010, 18(4): 183-194.
[5]李曉,張小飛,崔麗娜,等. 警惕四川玉米灰斑病的發生危害[J]. 四川農業科技, 2011(12): 37.
[6]周惠萍,吳景芝,李月秋,等. 云南省玉米灰斑病發生規律研究[J]. 西南農業學報, 2011, 24(6): 2207-2212.
[7]張益先,呂國忠,梁景頤,等. 玉米灰斑病菌生物學特性研究[J]. 植物病理學報, 2003, 33(4): 292-295.
[8]劉慶奎,秦子惠,張小利,等. 中國玉米灰斑病病原菌的鑒定及其基本特征研究[J]. 中國農業科學, 2013, 46(19): 4044-4057.
[9]LIU K J, XU X D. First report of gray leaf spot of maize caused by Cercospora zeina in China[J]. Plant Disease, 2013, 97(12): 1656.
[10]吳紀昌,馬麗君,王作英. 玉米抗尾孢菌葉斑病鑒定與抗病材料利用[J]. 遼寧農業科學, 1997(5): 25-28.
[11]董懷玉,姜鈺,王麗娟,等. 玉米種質資源抗灰斑病鑒定與評價[J]. 植物遺傳資源學報, 2005, 6(4): 441-443.
[12]呂香玲,李新海,陳陽,等. 玉米種質抗灰斑病鑒定與評價[J]. 玉米科學, 2011, 19(6): 125-128.
[13]李世強,陳威,譚靜,等. 玉米灰斑病的抗性機理研究進展[J]. 生物技術進展, 2011, 1(2): 112-115.
[14]ABEBE M, MARIA A. Genetic analysis of resistance to gray leaf spot of maize inbred lines[J]. Crop Science, 2005, 45(1): 163-170.
[15]BUBECK D M, GOODMAN M M, BEAVIS W D, et al. Quantitative trait loci controlling resistance to gray leaf spot in maize[J]. Crop Science, 1993, 33: 838-847.
[16]CLEMENTS M J, DUDLEY J W, WHITE D G. Quantitative trait loci associated with resistance to gray leaf spot of corn[J]. Phytopathology, 2000, 90(9):1018-1025.
[17]LEHMENSIEK A, ESTERHUIZEN A M, VAN-STADEN D, et al. Genetic mapping of gray leaf spot (GLS) resistance genes in maize [J]. Theoretical and Applied Genetics, 2001, 103: 797-803.
[18]BALINT-KURTI P J, WISSER R, ZWONITZER J C. Use of the IBM population for precise mapping of quantitative trait loci for gray leaf spot resistance in maize[J]. Crop Science, 2008, 48(5): 1696-1704.
[19]POZAR G, BUTRUILLE D, SILVA H D, et al. Mapping and validation of quantitative trait loci for resistance to Cercospora zea-maydis infection in tropical maize (Zea mays L.)[J]. Theoretical and Applied Genetics, 2009, 118(3): 533-564.
[20]ZHANG Y, XU L, FAN X M, et al. QTL mapping of resistance to gray leaf spot in maize[J]. Theoretical and Applied Genetics, 2012, 125(8): 1797-1808.
[21]XU L, ZHANG Y, SHAO S Q, et al. High-resolution mapping and characterization of qRgls2, a major quantitative trait locus involved in maize resistance to gray leaf spot[J]. BMC Plant Biology, 2014, 14: 230-240.
[22]BERGER D K, CARSTENS M, KORSMAN J N, et al. Mapping QTL conferring resistance in maize to gray leaf spot disease caused by Cercospora zeina[J]. BMC Genetics, 2014, 15: 60.
[23]LIU L, TAN J, ZHANG Y D, et al. QTL mapping for gray leaf spot resistance in a tropical maize population[J]. Plant Disease, 2016, 100(2): 304-312.
[24]HE W Z, YANG L, LENG Y F, et al. QTL mapping for resistance of maize to grey leaf spot[J]. Journal of Phytopathology, 2018, 166(3): 167-176.
[25]WANG W Y, BARRATT B J, CLAYTON D G, et al. Genome-wide association studies: theoretical and practical concerns[J]. Nature Review Genetics, 2005, 6: 109-118.
[26]WITTE J S. Genome-wide association studies and beyond[J]. Annual Review of Public Health, 2010, 31(1): 9-20.
[27]ZHU C S, GORE M, BUCKLER E S, et al. Status and prospects of association mapping in plants[J]. The Plant Genome, 2008, 1(1): 5-20.
[28]MAMMADOV J A, SUN X C, GAO Y X, et al. Combining powers of linkage and association mapping for precise dissection of QTL controlling resistance to gray leaf spot disease in maize (Zea mays L.)[J]. BMC Genomics, 2015, 16(1): 916-931.
[29]KUKI M C, SCAPIM C A, ROSSI E S, et al. Genome wide association study for gray leaf spot resistance in tropical maize core[J]. PLoS One, 2018, 13(6): e0199539.
[30]王曉鳴,石潔,晉齊鳴,等. 玉米病蟲害田間手冊——病蟲害鑒別與抗性鑒定[M]. 北京: 中國農業科學技術出版社, 2010: 8.
[31]閆偉,李元,宋茂興,等. 玉米抗灰斑病QTL元分析及其驗證[J]. 作物學報, 2016, 42(5): 758-767.
[32]BENSON J M, POLAND J A, BENSON B M, et al. Resistance to gray leaf spot of maize: genetic architecture and mechanisms elucidated through nested association mapping and near-isogenic line analysis[J]. PLoS Genetics, 2015, 11(3): e1005045.
[33]ZWONITZER J C, COLES N D, KRAKOWSKY M D, et al. Mapping resistance quantitative trait loci for three foliar diseases in a maize recombinant inbred line population-evidence for multiple disease resistance?[J]. Phytopathology, 2010, 100(1): 72-79.
[34]JINES M P. Identification of quantitative trait loci (QTL) for gray leaf spot resistance, maturity, and grain yield in a semi-tropical recombinant inbred population of maize[D]. North Carolina, USA: North Carolina State University, 2004:55-69.
[35]譚靜,羅吉,孫彩梅,等. 玉米灰斑病抗性種質與基因位點的研究進展[J]. 種子, 2019, 38(8): 57-60,64.
[36]SHI L Y, LV X L, WENG J F, et al. Genetic characterization and linkage disequilibrium mapping of resistance to gray leaf spot in maize (Zea mays L.)[J].The Crop Journal, 2014(Z1): 132-143.
[37]劉可杰,董懷玉,姜鈺,等. 300份玉米種質對兩種灰斑病菌的抗性評價[J]. 玉米科學, 2018, 26(4): 162-165.
[38]TAKAHASHI Y, BERBERICH T, KANZAKI H, et al. Serine palmitoyltransferase, the first step enzyme in sphingolipid biosynthesis, is involved in non-host resistance[J]. Molecular Plant-Microbe Interactions, 2009, 22(1): 31-38.
[39]XU G Y, LI S Z, XIE K, et al. Plant ERD2‐like proteins function as endoplasmic reticulum luminal protein receptors and participate in programmed cell death during innate immunity[J]. The Plant Journal, 2012, 72(1): 57-69.

