氨基酸態氮對禾谷鐮刀菌生長及DON毒素產生的影響
張升 張偉 王麗 李孝軍 崔俊濤

摘要:為闡明土壤不同氮素形態尤其是有機氮形態與土壤有害生物種群發生、發展的關系,以禾谷鐮刀菌供試菌株,初步研究了5種氨基酸態氮對其生長及DON毒素產生的影響。結果表明:0.20%氮源添加量下的100 ml液體培養基中,各培養基中菌絲干質量差異顯著,培養基中菌絲干質量從大到小的順序為賴氨酸培養基(1.27 g)>硝酸鈉培養基(0.88 g)>谷氨酸培養基(0.84 g)>酪氨酸培養基(0.52 g)>纈氨酸培養基(0.45 g)>蛋氨酸培養基(0.36 g)。賴氨酸培養基發酵液中DON毒素含量最高,達到2 951 μg/L,其他不同氮源培養基發酵液中DON毒素含量大小順序為酪氨酸(1 418 μg/L)>谷氨酸(240 μg/L)>硝酸鈉(224 μg/L)>纈氨酸(214 μg/L)>蛋氨酸(50 μg/L),毒素含量與氮源添加量呈正相關關系。生物測定結果顯示,賴氨酸液體培養基發酵液的抑制效果最為明顯,種子萌發抑制率、胚根抑制率、胚芽抑制率分別達到了63.0%、60.9%、63.0%,其次為酪氨酸(41.0%、34.4%、34.8%)、谷氨酸(26.0%、18.8%、23.9%)、硝酸鈉(25.0%、15.6%、21.7%)、纈氨酸(25.0%、14.1%、21.7%)和蛋氨酸(7.0%、9.4%、17.4%)。對比5種氨基酸,當賴氨酸作為唯一氮源時,對禾谷鐮刀菌的生長和產毒作用顯著,可提高病原菌的侵染、定殖寄主植物的能力,從而誘導莖腐病的發生。
關鍵詞:禾谷鐮刀菌;氨基酸態氮;賴氨酸;DON毒素
中圖分類號:S154.34文獻標識碼:A文章編號:1000-4440(2020)06-1403-08
Abstract:To elucidate the relationship between different nitrogen forms, especially organic nitrogen forms, and the occurrence and development of soil pest, the effects of five amino acid nitrogen on the growth of Fusarium graminearum and the production of DON toxin were studied by using Fusarium graminearum strains. The results showed that the mycelial dry weight in each medium was significantly different when 100 ml liquid medium was added with 0.20% nitrogen source, and the mycelial dry weight in mediums followed the order of lysine medium (1.27 g)> sodium nitrate medium (0.88 g)> glutamic acid medium (0.84 g)> tyrosine medium(0.52 g)> valine medium(0.45 g)> methionine medium(0.36 g). The content of DON toxin was the highest in the fermentation broth of lysine medium, which reached 2 951 μg/L. The content of DON toxin in the fermentation broth of different nitrogen sources followed the order of tyrosine medium(1 418 μg/L)> glutamic acid medium(240 μg/L)> sodium nitrate medium (224 μg/L)> valine medium(214 μg/L)> methionine medium(50 μg/L). Toxin content was positively correlated with nitrogen source addition. The results of bioassay showed that lysine liquid medium had the most obvious inhibitory effect on seed germination, radicle and germ, inhibition rates were 63.0%, 60.9% and 63.0% , respectively, followed by tyrosine medium(41.0%, 34.4%, 34.8%), glutamate medium (26.0%, 18.8%, 23.9%) , sodium nitrate medium (25.0%, 15.6%, 21.7%), valine medium (25.0%, 14.1%, 21.7%), methionine medium(7.0%, 9.4%, 17.4%). When lysine was used as the only nitrogen source, it had significant effect on the growth and toxin production of Fusarium Graminearum, which could increase the ability of pathogen to infect and colonize the host plant, and induce stem rot.
Key words:Fusarium graminearum;amino acid nitrogen;lysine;DON toxin
土壤有機態氮是土壤氮素的主要存在形式,占土壤全氮的90%以上 [1],其中氨基酸態氮占全氮的40%,直接影響著土壤肥力和供氮能力[2]。因此,以往有關土壤氮素的研究主要集中在2個方面:一是土壤不同形態氮肥對作物產量和品質的影響[3];二是土壤微生物在土壤氮素轉化中的作用以及如何提高土壤氮肥利用率[4]。但有關土壤氮素種類及其轉化對土壤有害微生物的影響卻鮮見報道,因此,闡明土壤不同氮素形態尤其是有機氮形態與土壤有害生物種群發生、發展的關系及其對有害生物代謝的影響,無論在理論上豐富耕地地力培肥理論及土壤有害生物防治理論,還是在實踐上提出和采取切實可行的措施,將耕地地力培肥與土壤有害生物防治有機地結合起來都具有重要意義。
由于禾谷鐮刀菌(Fusarium graminearum)廣泛分布于世界各地,習居于各種不同類型土壤中,是小麥、玉米、水稻三大禾谷類作物土傳病害的主要病原菌,每年不僅直接導致農作物減產,而且還導致農產品失去食用價值[5-7]。因此,為了探明東北玉米主產區玉米莖腐病逐年加重趨勢是否與玉米根際分泌的主要氨基酸種類和濃度有關[8-9],本試驗初步研究5種氨基酸態氮對禾谷鐮刀菌生長及DON毒素產生的影響,以此為闡明土傳病害的發生機制及其防治提供依據。
1材料與方法
1.1供試材料和培養基
禾谷鐮刀菌(Fusarium graminearum):在試驗田玉米莖腐病的病變組織中分離得到。谷氨酸、賴氨酸、纈氨酸、蛋氨酸、酪氨酸,北京索來寶生物科技有限公司產品。玉米品種為吉農大58。Czapek培養基[10]:硝酸鈉2 g,磷酸氫二鉀1 g,硫酸鎂(MgSO4·7H2O)0.5 g,氯化鉀0.5 g,硫酸亞鐵0.01 g,蔗糖30 g,蒸餾水1 000 ml,高溫高壓滅菌(121 ℃,2.4×105 Pa,20 min)后使用。固體培養基:每1 000 ml培養基加入20 g瓊脂。禾谷鐮刀菌產孢培養基[11]:1 g/L NH4NO3,1 g/L KH2PO4,15 g/L羧甲基纖維素鈉,1 g/L酵母粉,0.5 g/L MgSO4·7H2O。
1.2不同氨基酸對禾谷鐮刀菌生長的影響試驗
在無氮的Czapek基礎培養基中分別添加質量濃度梯度為0.05 g/L、0.10 g/L、0.20 g/L、0.40 g/L 5種氨基酸(谷氨酸、賴氨酸、纈氨酸、蛋氨酸、酪氨酸),作為氨基酸培養基,對照為Czapek培養基,3次重復。
液體培養:100 ml不同氨基酸培養基接種0.5 ml禾谷鐮刀菌孢子懸液[11](1×106CFU/ml的孢子懸液),25 ℃,120 r/min振蕩培養7 d,整瓶采樣,進行抽濾。抽濾后放置于105 ℃的烘箱中4 h,菌絲烘干,稱質量,菌絲質量=總質量-濾紙質量。
固體培養:上述各不同氮源添加量的液體培養基中加入瓊脂,制成固體培養基。用滅菌后的打孔器,在禾谷鐮刀菌平板上打取5 mm菌碟[12],放置于各種氮源固體培養基中,恒溫培養箱中25 ℃培養,在1 d、2 d、3 d、4 d、5 d、6 d、7 d的同一時間,采用十字交叉法[13],測量菌落直徑。
1.3不同氨基酸對DON毒素產生的影響試驗
采用FD-600型嘔吐毒素快速檢測儀[14](上海飛測生物科技有限公司)檢測液體培養基發酵液中的DON毒素。
液體搖床培養階段完成后的6組發酵液,經過濾滅菌后取(1.00±0.02) ml于10 ml離心管中,加入5 ml提取液(V甲醇∶V水=4∶1),使用漩渦混勻器振蕩5 min后,4 000 r/min離心1 min,取上清液。取100 μl離心上清液加入1 000 μl樣品稀釋液中,用漩渦混勻器混勻3~5 s,然后取100 μl加入到嘔吐毒素熒光定量檢測試紙條的加樣孔中。置于37 ℃恒溫孵育器中溫育8 min,8 min后將試紙條插入熒光免疫定量分析儀中讀數,讀數值即為樣品的實際檢測濃度。每組重復3次,取平均值。
1.4代謝產物毒性測定
挑取長勢均勻、顆粒飽滿的玉米種子,放入2%次氯酸鈉溶液中浸泡10 min,然后無菌水沖洗3次。將已經滅菌的雙層濾紙放入培養皿中,取出完成培養后的液體培養基發酵液,過濾掉菌絲后,高溫高壓滅菌(121 ℃,2.4×105 Pa,20 min),取15 ml發酵液倒入培養皿中,以加入不含氮源的Czapek液體培養基作為對照,將已消毒的玉米種子放入培養基中,每個培養基中放10粒種子,3次重復,置于光照培養箱中,培養7 d,取樣。記錄玉米種子萌發狀況、胚芽長度、胚根長度。計算種子萌發抑制率和對胚根、胚芽的生長抑制率[15],萌發抑制率=[(對照萌發率-處理萌發率)/對照萌發率]×100%,胚根(胚芽)生長抑制率=[(對照平均長度-處理平均長度)/對照平均長度]×100%。
1.5數據分析
運用Excel、IBM Spss Statistic 24進行統計分析。
2結果與分析
2.1不同氨基酸對禾谷鐮刀菌生長的影響
培養基中菌絲干質量變化如圖1所示,氮源添加量為0.40%時,以賴氨酸為氮源的菌絲干質量顯著高于其他氮源,培養基中菌絲干質量23.5 g/L,大于硝態氮氮源的硝酸鈉培養基中菌絲干質量,硝酸鈉培養基中菌絲干質量為16.5g/L,因此賴氨酸對禾谷鐮刀菌的生長促進作用最強,其次為硝酸鈉,蛋氨酸對禾谷鐮刀菌的生長促進作用較小。在氮源添加量為0.20%時,賴氨酸培養基中菌絲干質量最大,為12.7 g/L,對禾谷鐮刀菌的生長促進作用最強,其次為硝酸鈉和谷氨酸,其培養基中菌絲干質量分別到達了8.8 g/L和8.4g/L,蛋氨酸對禾谷鐮刀菌的生長促進作用最小。在氮源添加量為0.10%時,賴氨酸對禾谷鐮刀菌的生長促進作用最強,菌絲干質量達到了7.0 g/L,其次為硝酸鈉和谷氨酸,其培養基中菌絲干質量分別為5.8 g/L和5.5g/L,蛋氨酸培養基的菌絲干質量最小。在0.05%氮源添加量下,賴氨酸對禾谷鐮刀菌的生長促進作用最強,培養基中菌絲干質量4.1 g/L,蛋氨酸對禾谷鐮刀菌的生長促進作用最小。綜上所述,培養基中菌絲干質量與氮源添加量呈正相關關系,不同氨基酸對禾谷鐮刀菌的生長促進作用存在差異,其大小順序為,賴氨酸>硝酸鈉>谷氨酸>酪氨酸>纈氨酸>蛋氨酸。
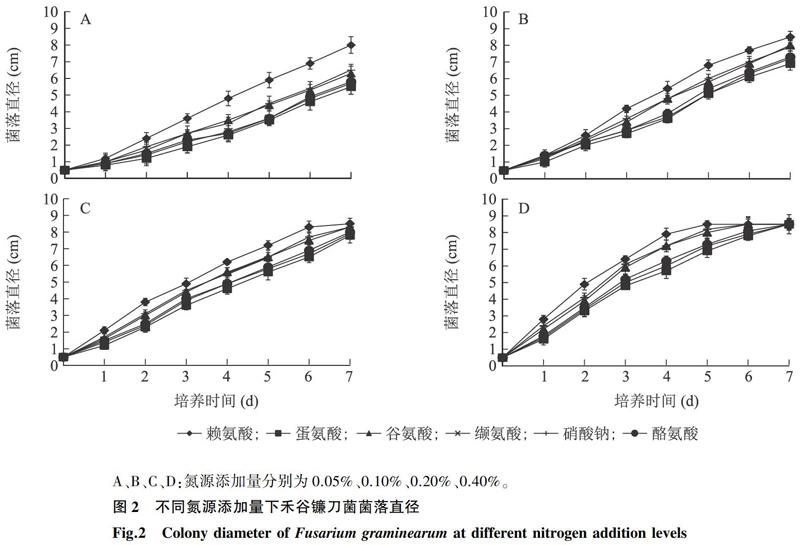
在0.05%氮源添加量下,不同氮源賴氨酸、硝酸鈉、谷氨酸、酪氨酸、纈氨酸、蛋氨酸對禾谷鐮刀菌菌落生長的促進作用不同(圖2),其促進作用順序為賴氨酸>硝酸鈉>谷氨酸>酪氨酸>纈氨酸>蛋氨酸。與液體培養試驗結果相一致。0.10%氮源添加量下,與0.05%氮源添加量的菌落相比,菌落直徑明顯增加,培養7 d時賴氨酸培養基中菌落直徑達到8.5 cm。0.20%氮源添加量下,相對于0.05%、0.10%氮源添加量,培養基中菌落生長速度較快,不同氮源對禾谷鐮刀菌菌落的生長促進作用表現出差異性。0.40%氮源添加量下,各培養基中菌落生長速度較快,7 d時菌落直徑都到達培養皿直徑。賴氨酸對于禾谷鐮刀菌菌落的生長促進作用最強,蛋氨酸對禾谷鐮刀菌菌落的生長促進作用最弱,其促進順序為賴氨酸>硝酸鈉>谷氨酸>酪氨酸>纈氨酸>蛋氨酸。根據菌落直徑的變化趨勢,將不同氮源對禾谷鐮刀菌菌落的生長促進作用分為3個等級:第1等級,賴氨酸;第2等級,硝酸鈉、谷氨酸;第3等級,酪氨酸、纈氨酸、蛋氨酸。
無論是液體培養試驗還是固體培養試驗,都驗證了不同氨基酸對禾谷鐮刀菌的生長存在不同的促進作用,不同氮源對禾谷鐮刀菌生長的促進作用順序為賴氨酸>硝酸鈉>谷氨酸>酪氨酸>纈氨酸>蛋氨酸。
2.2不同氨基酸對禾谷鐮刀菌產生DON毒素的影響
不同培養基發酵液的DON毒素含量如表1所示,0.40%氮源添加量下,賴氨酸培養基發酵液中毒素含量最高,達到4 524 μg/L,其次為酪氨酸培養基發酵液,其DON含量為2 271 μg/L,蛋氨酸培養基發酵液中DON毒素含量為91 μg/L,蛋氨酸對禾谷鐮刀菌產DON毒素的促進作用最低;在0.20%氮源添加量下,賴氨酸培養基發酵液中毒素含量最高,其培養基發酵液中DON含量為2 951 μg/L,其次為酪氨酸培養基發酵液,蛋氨酸培養基發酵液中DON毒素含量為50 μg/L;在0.10%氮源添加量下,賴氨酸培養基發酵液中毒素含量最高,DON含量為1 752 μg/L,其次為酪氨酸培養基發酵液,蛋氨酸培養基發酵液中DON毒素含量為31 μg/L;在0.05%氮源添加量下,賴氨酸培養基發酵液中毒素含量最高,DON含量為799 μg/L,其次為酪氨酸培養基發酵液,蛋氨酸培養基發酵液中DON毒素含量為11 μg/L。綜上所述,不同氮源對禾谷鐮刀菌產DON毒素的促進作用存在差異,大小順序為賴氨酸>酪氨酸>谷氨酸>硝酸鈉>纈氨酸>蛋氨酸,并且谷氨酸、硝酸鈉、纈氨酸對禾谷鐮刀菌產DON毒素的促進作用相互之間差異不顯著。促進禾谷鐮刀菌生長的氨基酸,不一定促進禾谷鐮刀菌產DON毒素的能力,反之亦然。
2.3不同氮源添加量的培養基發酵液對玉米種子萌發的影響
在0.05%氮源添加量下,培養基發酵液對玉米種子萌發的影響如表2所示。賴氨酸培養基發酵液對玉米種子萌發的抑制效果顯著,其萌發抑制率達到了38.0%,胚根抑制率35.9%,胚芽抑制率26.1%;酪氨酸培養基發酵液的抑制效果低于賴氨酸培養基發酵液,萌發抑制率23.0%,胚根抑制率21.9%,胚芽抑制率19.6%。谷氨酸、硝酸鈉、纈氨酸培養基發酵液對玉米種子萌發的抑制效果差異不明顯,蛋氨酸培養基發酵液對玉米種子萌發的抑制效果最弱。
在0.10%氮源添加量下,各氨基酸培養基發酵液對玉米種子萌發的影響如表3所示。賴氨酸培養基發酵液對玉米種子萌發的抑制效果明顯,萌發抑制率達到了48.0%,胚根抑制率45.3%,胚芽抑制率41.3%;酪氨酸培養基發酵液的抑制效果低于賴氨酸培養基發酵液,萌發抑制率27.0%,胚根抑制率26.6%,胚芽抑制率23.9%。谷氨酸、硝酸鈉、纈氨酸培養基發酵液對玉米種子萌發的抑制效果差異不明顯,蛋氨酸培養基發酵液對玉米種子萌發的抑制效果最弱。
在0.20%氮源添加量下,各氨基酸培養基發酵液對玉米種子萌發的影響如表4所示。賴氨酸培養基發酵液對玉米種子的萌發抑制效果明顯,萌發抑制率達到了63.0%,胚根抑制率60.9%,胚芽抑制率63.0%;酪氨酸培養基發酵液的抑制效果低于賴氨酸培養基發酵液,萌發抑制率41.0%,胚根抑制率34.4%,胚芽抑制率34.8%。谷氨酸、硝酸鈉、纈氨酸培養基發酵液對玉米種子萌發的抑制率效果差異不明顯,蛋氨酸培養基發酵液對玉米種子萌發的抑制效果最弱。
在0.40%氮源添加量下,各氨基酸培養基發酵液對玉米種子萌發的影響如表5所示。賴氨酸培養基發酵液對玉米種子萌發的抑制效果顯著,萌發抑制率達到了81.0%,胚根抑制率84.4%,胚芽抑制率83.0%;酪氨酸培養基發酵液的抑制效果低于賴氨酸培養基發酵液,萌發抑制率50.0%,胚根抑制率41.0%,胚芽抑制率47.8%。谷氨酸、硝酸鈉、纈氨酸培養基發酵液對玉米種子萌發的抑制效果差異不明顯,蛋氨酸培養基發酵液對玉米種子萌發的抑制效果最弱。
氨基酸培養基發酵液對玉米種子萌發存在一定的抑制效果,抑制玉米種子萌發的培養基氮源順序為賴氨酸>酪氨酸>谷氨酸>硝酸鈉>纈氨酸>蛋氨酸,這與DON毒素試驗的結果一致,說明禾谷鐮刀菌所產的DON毒素會直接作用于種子,從而影響種子的萌發及胚根、胚芽的生長。
2.4DON毒素與玉米種子萌發的皮爾森相關性分析
0.05%氮源添加量下,培養基發酵液中毒素含量與玉米種子萌發抑制率、胚根抑制率、胚芽抑制率的相關性分析結果顯示,毒素含量與萌發抑制率的相關系數r=0.972,毒素含量與胚根抑制率的相關系數r=0.986,毒素含量與胚芽抑制率的相關系數r=0.946,毒素含量與種子萌發抑制率、胚根抑制率、胚芽抑制率均呈極顯著正相關關系(表6)。0.10%氮源添加量下,培養基發酵液中DON毒素含量與玉米種子萌發抑制率的相關系數r=0.978,毒素含量與胚根抑制率的相關系數r=0.985,毒素含量與胚芽抑制率的相關系數r=0.990,毒素含量與種子萌發抑制率、胚根抑制率、胚芽抑制率均呈極顯著正相關關系(表7)。0.20%氮源添加量下,培養基發酵液中DON毒素含量與玉米種子萌發抑制率的相關系數r=0.947,毒素含量與胚根抑制率的相關系數r=0.994,毒素含量與胚芽抑制率的相關系數r=0.991,毒素含量與種子萌發抑制率、胚根抑制率、胚芽抑制率均呈極顯著正相關關系(表8)。0.40%氮源添加量下,培養基發酵液中DON毒素含量與玉米種子萌發抑制率的相關系數r=0.923,毒素含量與胚根抑制率的相關系數r=0.924,毒素含量與胚芽抑制率的相關系數r=0.982,毒素含量與種子萌發抑制率、胚根抑制率、胚芽抑制率均呈極顯著正相關關系(表9)。
3討論
本試驗證明促進禾谷鐮刀菌生長的氮源順序為賴氨酸>硝酸鈉>谷氨酸>酪氨酸>纈氨酸>蛋氨酸,促進禾谷鐮刀菌產DON毒素的氮源順序為賴氨酸>酪氨酸>谷氨酸>硝酸鈉>纈氨酸>蛋氨酸。相對于酪氨酸,谷氨酸更能促進禾谷鐮刀菌的生長,但對于禾谷鐮刀菌產DON毒素的促進作用卻低于酪氨酸。可見,促進禾谷鐮刀菌生長的氨基酸,不一定促進禾谷鐮刀菌產生DON毒素,反之亦然。相對于硝態氮,賴氨酸不僅能促進禾谷鐮刀菌的生長,而且可以促進禾谷鐮刀菌DON毒素的產生,而谷氨酸、酪氨酸、纈氨酸、蛋氨酸對禾谷鐮刀菌生長的促進作用低于硝態氮;賴氨酸、酪氨酸、谷氨酸對禾谷鐮刀菌產DON毒素的促進作用強于硝態氮,纈氨酸、蛋氨酸弱于硝態氮。纈氨酸、蛋氨酸對于禾谷鐮刀菌的生長和產DON毒素的作用較小。試驗中賴氨酸促進產毒這一現象,與Gardiner等 [16-17]結論不一致。馬躍亭[18]使用多種氨基酸作為氮源培養禾谷鐮刀菌,發現賴氨酸作為氮源時,對禾谷鐮刀菌產生DON毒素有刺激作用,由此推測與Gardiner等 [16-17]結論不一致的原因是地域因素。氨基酸作為氮源,可以強烈刺激禾谷鐮刀菌中Tri5基因的表達,從而促使禾谷鐮刀菌增加DON毒素的產生[19]。氨基酸作為氮源可以刺激禾谷鐮刀菌產DON毒素,本試驗中硝酸鈉作為禾谷鐮刀菌的氮源時,對禾谷鐮刀菌生長的促進作用強于谷氨酸、酪氨酸,但對禾谷鐮刀菌產毒性的促進作用卻弱于二者。
單端孢霉烯毒素是最常見的禾谷鐮刀菌毒素,單端孢霉烯產物的丟失不會影響病菌侵染小麥或玉米的能力,但它會影響病菌對寄主植物的整個侵染過程,說明單端孢霉烯族毒素在小麥和玉米上是影響侵染進程的致病力因子[20-24]。本試驗結果表明賴氨酸作為禾谷鐮刀菌的生長氮源時,可以促進其DON毒素的產生,而DON毒素為莖腐病的致病性因子,DON毒素含量增加,會導致禾谷鐮刀菌的致病性增強,從而誘導莖腐病病害發生。
禾谷鐮刀菌的主要產毒類群有3類:3-AcDON型、15-AcDON型、NIV型。3-AcDON型、15-AcDON型可產生DON毒素,NIV型可以產生雪腐鐮刀菌烯醇(NIV)。DON型群體比NIV型群體產生的毒素多,對寄主植物的侵染率高,致病力強;3-AcDON型群體比15-AcDON型產生的毒素多[25-29]。在侵染植物寄主時,DON毒素的毒力強于NIV毒素,說明DON毒素是導致植株感病的主要毒素。本試驗結果證明賴氨酸不僅能促進禾谷鐮刀菌生長,而且促使其DON毒素產生。如果土壤環境中存在過多的賴氨酸,會加快禾谷鐮刀菌的生長及其DON毒素的產生。DON毒素作為莖腐病的主要致病因子,在土壤環境下過多的存在,會提高病原菌侵染植株、定殖寄主植物的能力,從而誘導莖腐病發生。
本試驗結果證明,5種氨基酸作為唯一氮源時,對禾谷鐮刀菌生長的作用順序為賴氨酸>谷氨酸>酪氨酸>纈氨酸>蛋氨酸,對禾谷鐮刀菌產DON毒素的作用順序為賴氨酸>酪氨酸>谷氨酸>纈氨酸>蛋氨酸,并且促進效果隨著氨基酸添加量的增加而增大。賴氨酸作為唯一氮源時,對禾谷鐮刀菌的生長和產毒作用顯著,能提高病原菌的侵染、定殖寄主植物的能力,從而誘導莖腐病的發生。
參考文獻:
[1]寇恒. 土壤氮素及其研究方法綜述[J].亞熱帶水土保持,2018,30(2):64-67,70.
[2]STEVENSON F J. Organic forms of soil nitrogen[M]//STEVENSON F J. Nitrogen in Agricultural Soils. Madison,Wis USA:Am Soc of Agron Inc, 1982.
[3]尹彩霞,左竹,李桂花. 不同形態氮肥對玉米產量和土壤浸提性有機質的影響[J].中國土壤與肥料,2011(3):27-30,86.
[4]仇少君,彭佩欽,劉強,等. 土壤微生物生物量氮及其在氮素循環中作用[J].生態學雜志,2006(4):443-448.
[5]張悅,施維,李丹,等.禾谷鐮刀菌全基因組候選效應因子預測與分析[J]. 江蘇農業科學,2019,47(6):81-84.
[6]王芝涵,王春偉,高海馨,等. 引起玉米穗腐病的禾谷鐮刀菌LAMP快速檢測方法的建立[J]. 江蘇農業學報,2019,35(3):581-585.
[7]曹坤,管明,陳康,等. 一株拮抗禾谷鐮刀菌和降解嘔吐毒素解淀粉芽孢桿菌的篩選及在飼料貯存中的應用[J]. 江蘇農業科學,2019,47 (8):179-183,190.
[8]王建林,陸翠珍,檀華蓉,等. 磁場處理對玉米種子中氨基酸含量的影響[J].安徽農業科學,2010,38(35):19965-19970.
[9]程耀愷. 玉米中的氨基酸[J].國外畜牧學(飼料),1988(1):44.
[10]王紹萍,鮑文生,唐曉波,等. 黃綠青霉菌不同培養基上產毒能力差異的試驗研究[J]. 黑龍江醫學, 2002, 26(7):498.
[11]云英子,周欣,郭譜勝,等. 禾谷鐮刀菌中磷脂酰肌醇轉運蛋白功能分析[J].植物病理學報,2017,47(6):747-755.
[12]秦涵淳,楊臘英,李松偉,等. 培養基營養成分對香蕉枯萎病尖孢鐮刀菌生長的影響[J].熱帶作物學報,2009,30(12):1852-1857.
[13]孟程程. 小麥-玉米輪作模式下兩種作物莖基腐病的病原鑒定[D].泰安:山東農業大學,2019.
[14]肖理文,徐秀,趙皖,等. 基于時間分辨熒光納米微球的嘔吐毒素快速定量檢測試紙條的研制及性能研究[J].糧食加工,2017,42(3):36-39.
[15]徐晗,閆晗,褚晉,等. 尖孢鐮刀菌粗毒素對水稻種子萌發及根系生長的影響[J].遼寧農業科學,2017(4):83-85.
[16]GARDINER D M,KAZAN K,MANNERS J M. Nutrient profiling reveals potent inducers of trichothecene biosynthesis in Fusarium graminearum[J]. Fungal Genet Biol,2009,46(8): 604-613.
[17]GARDINER D M,KAZAN K,PRAUD S,et al.Early activation of wheat polyamine biosynthesis during Fusarium head blight implicates putrescine as an inducer of tricho -thecene mycotoxin production [J]. BMC Plant Biology,2010,10(6): 289-301.
[18]馬躍亭. 小麥籽粒DON含量影響因素相關性分析及氨基酸對赤霉菌產毒的影響[D].鎮江:江蘇科技大學, 2019.
[19]侯瑞,金巧軍. 禾谷鐮刀菌真菌毒素DON生物合成途徑及調控機制研究進展[J].江蘇農業科學,2018,46(17):9-13.
[20]DESJARDINS A E,HOHN T M,MCCORMICK S P. Trichothecene biosynthesis in Fusarium species: chemistry, genetics, and significance.[J]. Microbiological Reviews,1993,57(3): 595-604.
[21]DESJARDINS A E, PLATTNER R D,PROCTOR R H. Genetic and biochemical aspects of fumonisin production.[J]. Advances in Experimental Medicine and Biology,1996,392: 165-173.
[22]DESJARDINS A E,PLATTNER R D,PROCTOR R H. Linkage among genes responsible for fumonisin biosynthesis in Gibberella fujikuroi mating population A[J]. Applied and Environmental Microbiology,1996,62(7): 2571-2576.
[23]BAI G H,DESJARDINS A E,PLATTNER R D. Deoxynivalenol-nonproducing fusarium graminearum causes initial infection, but does not cause disease spread in wheat spikes[J]. Mycopathologia,2002,153(2): 91-98.
[24]HARRIS L J,DESJARDINS A E,PLATTNER R D, et al. Possible role of trichothecene mycotoxins in virulence of Fusarium graminearum on maize[J]. Plant Dsease,1999,83(10) :954.
[25]TODD J W, RANDALL M C, ALEJANDRO P R, et al. An adaptive evolutionary shift in Fusarium head blight pathogen populations is driving the rapid spread of more toxigenic Fusarium graminearum in North America[J]. Fungal Genetics and Biology, 2008, 45(4):473-484.
[26]李偉,胡迎春,陳瑩,等. 長江流域禾谷鐮孢菌群部分菌株系統發育學、產毒素化學型及致病力研究[J].菌物學報,2010,29(1):51-58.
[27]GALE L R, HARRISON S A, WARD T J,et al.Nivalenol-type populations of Fusarium and F. asiaticum are prevalent on wheat in southern Louisiana[J]. Phytopathology, 2011,101(1):124-134.
[28]張昊. 中國麥類赤霉病菌群體遺傳多樣性及生態適應性研究[D].北京:中國農業科學院,2011.
[29]DESJARDINS A E,MANANDHAR G,PLATTNER R D,et al. Occurrence of Fusarium species and mycotoxins in nepalese maize and wheat and the effect of traditional processing methods on mycotoxin levels[J]. Journal of Agricultural and Food Chemistry,2000,48(4): 1377-1383.
(責任編輯:張震林)

