芍藥PlSPL3基因的克隆與表達分析
張佼蕊 賀丹 何松林 謝棟博 李朝梅 王政 劉藝平

摘要:為了探究芍藥屬不同種間遠緣雜交不親和的分子作用機制,以粉玉奴芍藥自交授粉后24 h、36 h和粉玉奴芍藥×鳳丹白牡丹雜交授粉后24 h、36 h的柱頭為材料,根據柱頭轉錄組差異基因序列,采用逆轉錄(RT)-PCR技術,克隆得到SPL3基因的cDNA序列,將其命名為PlSPL3(GenBank登錄號:MN842720),隨后對其進行生物信息學分析和表達特性分析。結果表明,PlSPL3基因的編碼區(Coding sequence,CDS)全長1 305 bp,共編碼434個氨基酸。分析結果顯示,PlSPL3蛋白是一種帶負電荷的不穩定的親水性蛋白質,無跨膜結構。蛋白質進化樹顯示,芍藥PlSPL3蛋白的氨基酸序列與擬南芥AtSPL7蛋白的氨基酸序列具有較高的同源性,同時芍藥PlSPL3蛋白與木瓜、向日葵和無花果SPL3蛋白的氨基酸序列同源性也較高。實時熒光定量PCR(RT-qPCR)結果顯示,在自交、雜交授粉后不同時期的柱頭中,PlSPL3基因在雜交授粉后36 h的相對表達量最高。研究結果為進一步闡明PlSPL3基因在芍藥與牡丹遠緣雜交不親和中的生物學功能提供了理論依據。
關鍵詞:牡丹;芍藥;PlSPL3基因;基因克隆;基因表達
中圖分類號:S682.1+2文獻標識碼:A文章編號:1000-4440(2020)06-1537-06
Abstract:In order to explore the molecular mechanism of distant hybridization incompatibility in Paeonia, the stigmas from P. lactiflora Fenyunu × P. lactiflora Fenyunu and P. lactiflora Fenyunu × P. ostii Fengdanbai were harvested as the materials after 24 h and 36 h of pollination. The cDNA sequence of SPL3 gene was cloned by reverse transcription (RT)-PCR technique based on differential gene sequence of transcriptome in stigma, and was named as PlSPL3 (GenBank accession No: MN842720), the bioinformatics and expression characteristics of PlSPL3 were then analyzed. The results showed that 434 amino acids were encoded by the coding sequence of PlSPL3 gene with a length of 1 305 bp. Analysis results showed that PlSPL3 protein was a kind of unstable, hydrophilic protein with negative charges and without transmembrane structure. The results of phylogenetic tree indicated that the amino acid sequence of PlSPL3 protein from P. lactiflora had high homology with that of AtSPL7 protein from Arabidopsis thaliana, and the amino acid sequences of PlSPL3 protein in P. lactiflora were also highly homologous with those of SPL3 protein in Chaenomeles sinensis, Helianthus annuus and Ficus carica. Real-time quantitative PCR (RT-qPCR) results indicated that the relative expression level of PlSPL3 gene was the highest in stigmas at 36 h after hybridization. These results provide a theoretical basis in further elucidating the biological functions of PlSPL3 gene in distant hybridization incompatibility between P. lactiflora and P. ostii.
Key words:Paeonia lactiflora;Paeonia ostii;PlSPL3 gene;gene cloning;gene expression
牡丹(Paeonia ostii)與芍藥(Paeonia lactiflora)同屬于芍藥科芍藥屬,具有很高的園林觀賞價值和經濟價值[1]。芍藥花色艷麗、花型豐富、花期長,與牡丹并稱為“花中二杰”[2]。芍藥屬的品種改良和育種工作一直是該領域科研和生產的主要內容,而雜交育種是芍藥屬育種工作采用的主要方法[3]。遠緣雜交不僅可以豐富物種、提高植物的抗病性和抗逆性,還對花色等性狀具有改良作用[4]。1948年,國際上首次成功獲得了牡丹、芍藥的組間雜種,并將其命名為Itoh雜種,具有觀賞價值高、抗性強等特點[5-6]。目前國內的芍藥屬遠緣雜交研究還處于初級階段[7]。花粉管的不正常生長、受精過程失敗是影響芍藥屬遠緣雜交的主要障礙[8]。王文和等[9-10]在百合遠緣雜交的過程中觀察到花粉管形態異常現象,并且發現在花粉管生長過程中伴隨著胼胝質反應;郝津藜等[11]在黃牡丹遠緣雜交親和性研究中同樣發現,不親和花粉會導致花粉管及柱頭組織中胼胝質沉積,從而阻礙花粉管生長。牡丹與芍藥遠緣雜交的主要障礙是雜交不親和,授粉后柱頭對異源花粉的特異性排斥產生強烈的胼胝質反應,并且大部分花粉不能萌發,花粉管出現扭曲、腫脹等現象[3,12-13]。
SPL(SQUAMOSA promoter-binding protein-like)轉錄因子是花發育過程中一個重要的調控樞紐[14],它參與花的早期發育、成花轉變等,并調控植物大小孢子的發生和雌雄配子體發育以及花粉囊發育、花藥開裂等[15-18]。SPL家族基因廣泛存在于玉米、番茄、葡萄、牡丹等植物中[19-22]。在擬南芥的SPL轉錄因子中,氨基酸序列最短的是AtSPL3蛋白,由131個氨基酸組成。AtSPL3基因參與調控下游基因的表達,從而促進擬南芥開花[17,23]。SPL3基因主要在花序中表達,在適當條件下過量表達會導致花和花序發育異常[24];在擬南芥中,SPL2基因可以影響花粉的產量及生育力[25-26];SPL8基因可以影響大小孢子的發生、雄蕊花絲的延長、小孢子囊壁的形成及花藥開裂,SPL8基因功能缺失會影響花粉囊發育,導致植株花序縮短并且影響植株的生育力[16,27]。
筆者所在課題組前期對芍藥屬雜交育種進行了大量研究,發現粉玉奴芍藥(P. lactiflora ‘Fenyunu)自交親和,粉玉奴芍藥與鳳丹白牡丹(P. ostti ‘Fengdanbai)遠緣雜交不親和,并且發現遠緣雜交不親和的關鍵時期為雜交后24 h、36 h[3,12,28]。在前期試驗中,筆者以芍藥自交授粉親和處理為對照,通過轉錄組研究,篩選了相關差異表達基因,得出顯著上調表達的SPL基因。本研究以芍藥柱頭為材料,分析其PlSPL3基因的cDNA全長序列,并對其基因及編碼蛋白質的序列特征進行分析,檢測芍藥屬自交親和與雜交不親和在授粉后不同時期該基因表達情況,以期進一步探索芍藥PlSPL3基因的功能與生物學信息,同時為進一步探究芍藥屬遠緣雜交不親和的分子機制提供理論依據。
1材料與方法
1.1試驗材料
供試材料母本芍藥品種粉玉奴、父本牡丹品種鳳丹白均由河南省優質花卉蔬菜種苗工程研究中心提供。在母本松蕾期進行去雄、套袋處理,去雄2 d后連續3 d進行3次人工授粉。隨后取粉玉奴自交授粉后24 h、36 h的柱頭與粉玉奴×鳳丹白雜交授粉后24 h、36 h的柱頭。將柱頭用液氮速凍后于-80 ℃冰箱中保存,隨后進行RNA的提取。
1.2試驗方法
1.2.1柱頭總RNA的提取和cDNA的合成基于植物RNA提取的常規方法,使用天根生化科技(北京)有限公司的試劑盒進行柱頭總RNA提取,用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)試劑盒(TaKaRa)將RNA反轉錄成cDNA第一鏈,然后將產物于-20 ℃貯存。
1.2.2PlSPL3基因的分離克隆根據轉錄組結果獲得的PlSPL3基因片段,從美國國家生物技術信息中心(National Center for Biotechnology Information, NCBI)網站下載同源序列,進行基因比對分析,并在比對結果中尋找同源性較高的序列用于設計特異性引物。以cDNA第一鏈為模板,進行PCR擴增。使用20 μl反應體系,組成如下:10 μl 2×fast Pfu master mix,1 μl Primer F,1 μl Primer R,1 μl cDNA,加ddH2O至總體積為20 μl。PCR反應程序:94 ℃預變性3 min;94 ℃變性30 s,58 ℃退火45 s,72 ℃延伸90 s,33個循環;72 ℃延伸10 min。所用引物與用途見表1。PCR擴增產物經1%瓊脂糖凝膠電泳檢測后,用試劑盒(北京百泰克生物技術公司產品)回收目的條帶,連接T載體后在感受態細胞中擴增,挑選陽性菌落進行測序,獲得擴增的目的條帶序列。
1.2.3生物信息學分析使用在線Nucleotide BLAST軟件對PlSPL3基因的同源性關系進行分析。使用DNAMAN 8.0軟件對PlSPL3基因編碼蛋白質的氨基酸序列進行預測。用ProtParam、TMpred、SignalP 5.0 Server在線軟件分析PlSPL3蛋白的理化性質、跨膜結構和信號肽信息。利用CDD在線軟件分析PlSPL3基因編碼蛋白質的結構域。利用GOR4軟件預測PlSPL3蛋白的二級結構。使用MEGA 7.0構建系統發育樹,Bootstrap值設置為1 000[29-30]。
1.2.4PlSPL3基因的表達分析分別以粉玉奴自交授粉后24 h、36 h和粉玉奴×鳳丹白雜交授粉后24 h、36 h的柱頭cDNA為模板,以β-Tubulin為內參基因(表1),使用SYBR Premix ExTaqTM試劑盒[寶日醫生物技術(北京)有限公司產品],在ABI 7900 Real-Time PCR System儀(美國應用生物系統中國公司產品)上進行實時熒光定量PCR,引物序列見表1。實時定量反應體系及反應程序參照He等[12]的方法進行,每個反應包括3個生物學重復。用2-△△Ct法計算基因的相對表達量[31]。
2結果與分析
2.1PlSPL3基因全長序列的克隆與分析
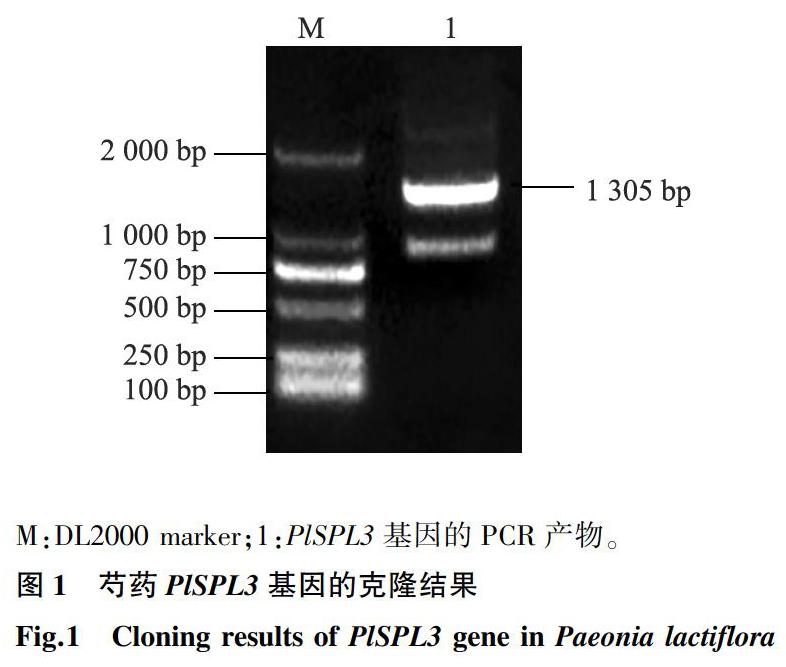
用轉錄組的差異基因片段設計的上下游引物進行擴增,測序結果表明,擴增得到了大小為1 305 bp的堿基片段,詳見圖1。
對芍藥PlSPL3基因編碼氨基酸序列進行BLAST比對分析,結果顯示,其與向日葵、藜麥、葡萄、胡桃、木瓜等的SPL基因編碼氨基酸序列的相似度達到72.0%~77.3%。隨后,用DNAMAN 8.0軟件推測芍藥PlSPL3基因編碼蛋白質的氨基酸序列。
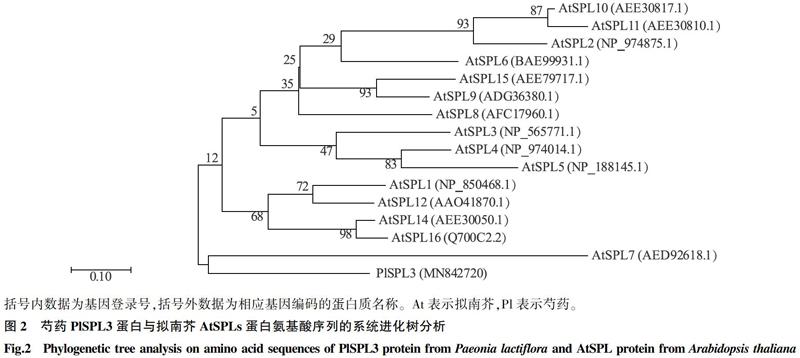
用MEGA 7.0將芍藥PlSPL3基因編碼蛋白質的氨基酸序列與擬南芥SPLs基因編碼蛋白質的氨基酸序列進行對比。由圖2可以看出,芍藥PlSPL3基因編碼蛋白質與擬南芥AtSPL7基因編碼蛋白質聚類到一起,表明該片段對應的基因為芍藥的SPL基因,GenBank登錄號為MN842720。
2.2PlSPL3基因編碼蛋白質理化性質與結構預測
通過在線軟件ProtParam分析發現,PlSPL3基因編碼434個氨基酸,其編碼蛋白質的相對分子質量約為50 110.77,總原子數為13 266個,預測其分子式為C2 123H3 361N623O715S33,理論等電點(pI)為4.90,說明其為酸性蛋白。此外,PlSPL3基因編碼蛋白質由20種氨基酸組成,其中谷氨酸(Glu)含量最豐富,占比為13.8%;其次為精氨酸(Arg),占比為8.3%;色氨酸(Trp)含量最低,占比為0.2%。PlSPL3基因編碼蛋白質的帶負電荷氨基酸殘基(Asp+Glu)總電荷數為90個,帶正電荷氨基酸殘基(Arg + Lys)總電荷數為65個,該蛋白質的不穩定系數為70.94,半衰期為30 h,脂肪系數為57.90,平均親水性系數為-0.949。根據以上數據可以推測,這是一種帶負電荷的不穩定親水性蛋白質。用TMpred進行預測可知,該蛋白質無跨膜螺旋區。將該蛋白質序列輸入SignalP 5.0,結果顯示,該蛋白質可能具有信號肽切割位點,位于第27位與第28位氨基酸之間的概率較高。
在NCBI上分析PlSPL3基因編碼蛋白質的保守結構域發現,該蛋白質具有SBP-box保守結構域,該結果符合典型的SBP-box基因家族的結構特征,說明該基因屬于其中一員。SBP結構域由SBP-box編碼,所有陸生植物的SBP結構域均較相似[32]。用在線軟件GOR4預測PlSPL3基因編碼蛋白質的二級結構,結果顯示,α-螺旋(Alpha helix, h)占32.72%,延伸鏈(Extended strand, e)占20.28%,而最大的結構元件是不規則卷曲(Random coil, c),占47.00%。
2.3PlSPL3同源基因編碼蛋白質的氨基酸序列對比與進化樹的構建
利用NCBI的BlastP對芍藥SPL基因編碼蛋白質的氨基酸序列進行比對,選取同源性排在前17位的植物,用MEGA 7.0軟件構建系統發育樹。由圖3可以看出,芍藥PlSPL3蛋白與其他物種SPL蛋白的系統進化樹共分為2個大分支,其中芍藥SPL蛋白(PlSPL3)、木瓜SPL蛋白(CpSPL3)、向日葵SPL蛋白(HaSPL3)、無花果SPL蛋白(LnSPL3)屬于1個分支,其他14種植物的SPL蛋白屬于另1個分支。
2.4PlSPL3基因的表達分析
對比粉玉奴×鳳丹白雜交授粉后24 h、36 h與粉玉奴自交授粉后24 h、36 h PlSPL3基因的表達水平。熒光定量試驗結果顯示,PlSPL3基因的相對表達量在雜交授粉后24 h高于自交授粉后24 h;在雜交授粉后36 h高于自交授粉后36 h;自交授粉后36 h的相對表達量高于自交授粉后24 h的相對表達量,雜交授粉后36 h的相對表達量高于雜交授粉后24 h的相對表達量(圖4)。對比雜交與自交結果可以看出,雜交柱頭的相對表達量均高于同時期的自交柱頭,對雜交處理不同時間的相對表達量進行對比發現,雜交授粉后36 h的相對表達量比雜交授粉后24 h更高,目的基因表達量明顯上調。
3討論
遠緣雜交不親和性主要表現為受精前障礙與胚敗育,而牡丹、芍藥遠緣雜交不親和的主要原因是受精前障礙[33-34]。SPL轉錄因子是花發育過程中一個重要的調控樞紐[14]。有研究結果已經明確,SPL基因會影響花粉囊發育及花藥開裂[35-37]。SPL基因還可以通過調控植物大小孢子發生和雌雄配子體發育來維持植物的育性[16]。由此可見,SPL基因可能參與了雜交后的生殖發育過程。
自交和雜交后不同時期的熒光定量檢測結果表明,雜交授粉后36 h,PlSPL3基因的相對表達量最高,并且在雜交授粉后的2個時段的相對表達量均高于自交,這與之前所測的轉錄組數據相符合。筆者在前期試驗中觀察發現,在自交授粉過程中粉玉奴的花粉管發育正常;在雜交授粉過程中,粉玉奴的花粉萌發較少,萌發的花粉管出現扭曲,胼胝質增多,并且在雜交授粉后36 h時表現得較明顯[3]。由于雜交不親和與胼胝質的積累關系密切[38],因此推測PlSPL3基因可能與雜交不親和有關。曹雪等[39]研究發現,葡萄VvSPL9基因和VvSPL10基因可能參與葡萄營養器官與生殖器官的發育。Unte等[27]研究發現,擬南芥SPL8基因的突變體由于小孢子囊發育異常而生育力低下,敲除SPL8基因后則會影響大孢子發生及雄蕊花絲的延長。Xing等[16]研究發現,SPL基因影響小孢子囊壁的形成,SPL基因功能缺失突變形成了異常花粉囊,進而減少了每個花藥內的花粉量,過量表達SPL8基因會引起花藥不開裂,最終影響植物的生育力。在本研究中,花粉囊發育及花藥開裂均正常,因此推測該基因可能與花粉的進一步發育有關。此外,有研究發現,SPL基因也會影響雌蕊的發育[16],因此推測,授粉后由于異源花粉的刺激,使得花的柱頭發育受到影響,從而使花粉在柱頭上無法正常萌發或者花粉管無法正常生長,導致牡丹與芍藥出現遠緣雜交不親和現象。本試驗通過克隆PlSPL3基因的cDNA序列全長,分析其生物信息學功能并檢測芍藥屬自交親和授粉與雜交不親和授粉后不同時期PlSPL3基因表達情況,發現該基因在雜交授粉后上調明顯,推測其在芍藥屬遠緣雜交不親和過程中發揮著重要作用,這為從分子水平上探究芍藥屬遠緣雜交不親和機制提供了理論基礎。
參考文獻:
[1]白金娟,沈瑞娟,吳月琴,等. 百合遠緣雜交子房培養和胚珠培養[C]//中國園藝學會. 花卉優質、高產、高效標準化栽培技術交流會論文集. 昆明:中國園藝學會, 2014: 4-9.
[2]蔣昌華,葉康,高燕,等. 鹽脅迫對13種芍藥品種部分生理指標的影響研究[J]. 西北林學院學報, 2018, 33(2): 70-74.
[3]賀丹,解夢珺,呂博雅,等. 牡丹與芍藥的授粉親和性表現及其生理機制分析[J]. 西北農林科技大學學報(自然科學版), 2017, 45(10): 129-136.
[4]郝津藜,董曉曉,袁濤, 等. 四種藥劑柱頭處理對芍藥屬遠緣雜交授粉結實率的影響[J]. 中國農業大學學報, 2019, 24(1): 40-45.
[5]侯祥云,郭先鋒. 芍藥屬植物雜交育種研究進展[J]. 園藝學報, 2013, 40(9): 1805-1812.
[6]馬翔龍,吳敬需,劉少華. 伊藤牡丹發展現狀與展望[J]. 中國花卉園藝, 2018(16): 28-31.
[7]郝青,劉政安,舒慶艷,等. 中國首例芍藥牡丹遠緣雜交種的發現及鑒定[J]. 園藝學報, 2008, 35(6): 853-858.
[8]HAO Q, AOKI N, KATAYAMA J, et al. Crossability of American tree peony ‘High Noon′ as seed parent with Japanese cultivars to breed superior cultivars[J]. Euphytica, 2013, 191: 35-44.
[9]王文和,王樹棟,趙祥云,等. 百合遠緣雜交花粉萌發及花粉管生長過程觀察[J]. 西北植物學報, 2007, 27(9): 1790-1794.
[10]郭朋輝,吳景芝,王玉英,等. 紫斑百合遠緣雜交親和性分析及雜交障礙克服[J]. 南方農業學報, 2019, 50(9): 1903-1912.
[11]郝津藜,趙娜,石顏通,等. 黃牡丹遠緣雜交親和性及雜交后代形態分析[J]. 園藝學報, 2014, 41(8): 1651-1662.
[12]HE D, LOU X Y, HE S L, et al. Isobaric tags for relative and absolute quantitation-based quantitative proteomics analysis provides novel insights into the mechanism of cross-incompatibility between tree peony and herbaceous peony[J]. Functional Plant Biology, 2019, 46(5): 417-427.
[13]KERHOAS C, KNOX R B, DUMAS C. Specificity of the callose response in stigmas of Brassica[J]. Annals of Botany, 1983, 52(4): 597-602.
[14]田晶,趙雪媛,謝隆聖,等. SPL轉錄因子調控植物花發育及其分子機制研究進展[J]. 南京林業大學學報(自然科學版), 2018, 42(3): 159-166.
[15]KLEIN J, SAEDLER H, HUIJSER P. A new family of DNA binding proteins includes putative transcriptional regulators of the Antirrhinum majus floral meristem identity gene SQUAMOSA[J]. Molecular and General Genetics, 1996, 250(1): 7-16.
[16]XING S P, SALINAS M, GARCIA-MOLINA A, et al. SPL8 and miR156-targeted SPL genes redundantly regulate Arabidopsis gynoecium differential patterning[J]. The Plant Journal, 2013, 75(4): 566-577.
[17]YAMAGUCHI A, WU M F, YANG L, et al. The MicroRNA-regulated SBP-box transcription factor SPL3 is a direct upstream activator of LEAFY, FRUITFULL, and APETALA1[J]. Developmental Cell, 2009, 17(2): 268-278.
[18]李明,李長生,趙傳志,等. 植物SPL轉錄因子研究進展[J]. 植物學報, 2013, 48(1): 107-116.
[19]HULTQUIST J F, DORWEILER J E. Feminized tassels of maize mop1 and ts1 mutants exhibit altered levels of miR156 and specific SBP-box genes[J]. Planta, 2008, 229(1): 99-113.
[20]FERREIRA G F, SILVA E M, AZEVEDO M S, et al. microR-NA156-targeted SPL/SBP box transcription factors regulate tomato ovary and fruit development[J]. The Plant Journal, 2014, 78(4): 604-618.
[21]HOU H M, LI J, GAO M, et al. Genomic organization,phylogenetic comparison and differential expression of the SBP-box family genes in grape[J]. PLoS One, 2013, 8(3): e59358.
[22]戰新梅,管世銘,張玉喜. 牡丹PsSPL3基因的克隆和表達特性分析[J]. 華北農學報, 2017, 32(4): 13-18.
[23]JUNG J H, LEE H J, RYU J Y, et al. SPL3/4/5 integrate development aging and photoperiod signals into the FT-FD module in Arabidopsis flowering[J]. Molecular Plant, 2016, 9(12): 1647-1659.
[24]GANDIKOTA M, BIRKENBIHL R P, HHMANN S, et al. The miRNA156/157 recognition element in the 3' UTR of the Arabidopsis SBP box gene SPL3 prevents early flowering by translational inhibition in seedlings[J]. The Plant Journal, 2007, 49(4): 683-693.
[25]WANG Z S, WANG Y,KOHALMI S E, et al. SQUAMOSA PROMOTER BINDING PROTEIN-LIKE 2 controls floral organ development and plant fertility by activating ASYMMETRIC LEAVES 2 in Arabidopsis thaliana[J]. Plant Molecular Biology, 2016, 92(6): 661-674.
[26]WEIGEL D, NILSSON O. A developmental switch sufficient for flower initiation in diverse plants[J]. Nature, 1995, 377: 495-500.
[27]UNTE U S, SORENSEN A M, PESARESI P, et al. SPL8, an SBP-box gene that affects pollen sac development in Arabidopsis[J]. The Plant Cell, 2003, 15(4): 1009-1019.
[28]賀丹,王雪玲,高曉峰,等. 牡丹芍藥遠緣雜交親和性[J]. 東北林業大學學報, 2014, 2(7): 65-68.
[29]林榕燕,樊榮輝,陳裕德,等. 雞爪槭ApPSY和ApPDS基因克隆及其表達分析[J].核農學報,2019, 33(12): 2338-2346.
[30]賴呈純,潘紅,黃賢貴,等. 刺葡萄愈傷組織UFGT基因克隆及表達分析[J].核農學報,2019, 33(9): 1677-1685.
[31]THOMAS D S, KENNETH J L. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
[32]GUO J,SONG J,WANG F, et al. Genome-wide identification and expression analysis of rice cell cycle genes[J]. Plant Molecular Biology, 2007, 64(4): 349-360.
[33]賀丹,高小峰,呂博雅,等. 牡丹、芍藥花芽分化的形態學研究[J]. 河南農業科學, 2014, 43(12): 117- 120.
[34]律春燕,王雁,朱向濤,等. 黃牡丹花粉生活力測定方法的比較研究[J]. 林業科學研究, 2010, 23(2): 272-277.
[35]NODINE M D, BARTEL D P. MicroRNAs prevent precocious gene expression and enable pattern formation during plant embryogenesis[J]. Genes and Development, 2010, 24(23): 2678-2692.
[36]LIU N, TU L L, WANG L C, et al. MicroRNA 157-targeted SPL genes regulate floral organ size and ovule production in cotton[J]. BMC Plant Biology, 2017, 17(1): 7.
[37]SHIKATA M, KOYAMA T, MITSUDA N, et al. Arabidopsis SBP-box genes SPL10,SPL11 and SPL2 control morphological change in association with shoot maturation in the reproductive phase[J]. Plant and Cell Physiology, 2009, 50(12): 2133-2145.
[38]張姣,朱啟迪,巨嵐,等. 小麥生理型雄性不育系微絲骨架和胼胝質的變化與其相關基因的表達分析[J]. 中國農業科學, 2015, 48(14): 2687-2696.
[39]曹雪,王晨,房經貴,等. 葡萄SPL9和SPL10基因全長cDNA克隆、亞細胞定位和表達分析[J]. 園藝學報, 2011, 38(2): 240-250.
(責任編輯:徐艷)

