心臟Nmnat過表達聯(lián)合耐力運動對果蠅高脂膳食誘發(fā)脂毒性心肌癥的影響
文登臺 鄭瀾 陸凱 劉憲楚 后文其
摘? ? 要:利用UAS/hand-gal4系統(tǒng)構(gòu)建果蠅心臟Nmnat基因特異性過表達,研究心臟Nmnat基因過表達聯(lián)合耐力運動對高脂膳食誘發(fā)脂毒性心肌癥的影響,并分析其分子機制。方法:雄性w1118和Nmnat-UAS系果蠅分別與雌性hand-Gal4雜交,收集F1代心臟Nmnat正常表達(hand>w1118)和過表達 (hand>Nmnat)處女蠅,飼養(yǎng)至15 d后開始進行耐力運動(E)和高脂膳食(HFD),并分為hand>w1118、hand>w1118+E、hand>w1118+HFD、hand>w1118+HFD+E、hand>Nmnat、hand>Nmnat+E、hand>Nmnat+HFD、hand>Nmnat+HFD+E共8組,每組410只。ELISA檢測心臟TAG、NAD+、SIR2蛋白去乙酰化、SOD活力和MDA水平,qRT-PCR檢測心臟相關(guān)基因mRNA表達,M-mode檢測心臟功能情況。結(jié)果:hand>w1118+HFD+E果蠅心臟的Nmnat、dFoxo、bmm表達、NAD+水平、SIR2去乙酰化、SOD活力、縮短分數(shù)高于hand>w1118+HFD(P<0.05或P<0.01),且dFAS和Col4al表達、TAG和MDA水平、心率和纖維性振顫低于hand>w1118+HFD(P<0.05或P<0.01); hand>Nmnat果蠅心臟各指標(biāo)與hand>Nmnat+HFD相比較未見顯著差異(P>0.05);hand>Nmnat+HFD+E果蠅心臟的Nmnat、dFoxo、bmm表達、心臟NAD+水平、SIR2去乙酰化、SOD活力、心臟縮短分數(shù)高于hand>Nmnat+HFD(P<0.05或 P<0.01),且dFAS和Col4al表達\TAG和MDA水平、心率和纖維性振顫低于hand>Nmnat+ HFD(P<0.05或P<0.01)。結(jié)論:心臟Nmnat過表達和耐力運動均能抵抗果蠅高脂膳食誘發(fā)的心臟脂質(zhì)過度堆積、氧化損傷、減弱心臟收縮能力和增加纖維性振顫,其分子機制與心臟Nmnat/NAD+/SIR2/dFoxo通路活性增強有關(guān)。心臟Nmnat基因過表達聯(lián)合耐力運動能更好地降低脂毒性心肌癥的發(fā)生概率,其機制與二者聯(lián)合對心臟Nmnat/NAD+/SIR2/dFoxo通路活性上調(diào)的疊加作用有關(guān)。
關(guān)鍵詞:耐力運動;高脂膳食;脂毒性心肌癥;Nmnat
中圖分類號:G 804.2? ? ? ? ? 學(xué)科代碼:040302? ? ? ? ? ?文獻標(biāo)識碼:A
Abstract:Objective: Constructing the specific overexpression of Nmnat gene in the heart of fruit flies using UAS/ hand-gal4 system to study the effect of the overexpression of Nmnat gene in the heart combined with endurance exercise on lipid toxicity induced by high-fat diet, and to analyze the molecular mechanism. Methods: Male w1118 and Nmnat-UAS fruit flies were respectively hybridized with female hand-gal4. Collecting the normal expression of heart Nmnat (hand>w1118) and the overexpression (hand>Nmnat) of F1 generation female flies. After feeding for 15 days, they began to perform endurance exercise (E) and high-fat diet (HFD). They were divided into hand>w1118, hand>w1118+E, hand>w1118+HFD, hand>w1118+HFD+E, hand>Nmnat, hand>Nmnat +E, hand>Nmnat+HFD, hand>Nmnat+HFD+E, 410 flies in each group. The levels of cardiac TAG, NAD+, SIR2 protein deacetylation, SOD activity and MDA were detected by ELISA. The expression of cardiac related genes by RT-PCR; M-mode detects cardiac function. Results: the expression of Nmnat, dFoxo, bmm, NAD+ level, SIR2 deacetylation, SOD activity and shortened fraction of hand>w1118+HFD+E group were significantly higher than that of hand>w1118+HFD group (P<0.05 or P<0.01), but the expression of dFAS, Col4al, TAG and MDA level, heart rate and fibrillation were significantly lower than that of hand>w1118+HFD group (P<0.05 or P<0.01). There was no significant difference between the heart hand>Nmnat group and hand>Nmnat+HFD group (P>0.05). The expression of Nmnat, dFoxo, bmm, NAD+, SIR2 deacetylation, SOD activity and shortened heart fraction in the hand>Nmnat+HFD+E group were significantly higher than those in the hand>Nmnat+HFD group (P<0.05 or P<0.01), but the expression of dFAS, Col4al, TAG and MDA levels, heart rate and fibrillation were significantly lower than those in the hand>Nmnat+HFD group (P<0.05 or P<0.01). Conclusion: both overexpression of cardiac Nmnat and endurance exercise can prevent excessive accumulation of cardiac lipids, oxidative damage, decreased cardiac contractility and increased fibrillation induced by high-fat diet. The molecular mechanism is related to the fact that both of them can up-regulate the activity of cardiac Nmnat/NAD+/SIR2/dFoxo pathway. The overexpression of cardiac Nmnat gene combined with endurance exercise can better reduce the occurrence of lipid toxic cardiomyopathy, which is related to the superposition effect of the combination on the up-regulation of cardiac Nmnat/NAD+/SIR2/dFoxo pathway activity.
Keywords:endurance exercise; high-fat-diet; lipotoxic cardiomyopathy; Nmnat
在哺乳動物和果蠅中,長期高脂膳食能誘發(fā)脂毒性心肌癥,導(dǎo)致心力衰竭和心臟驟亡風(fēng)險增加[1-2]。脂毒性心肌癥表現(xiàn)出4個主要特征:心臟的脂質(zhì)堆積過度、脂毒性損傷嚴(yán)重、收縮功能障礙及纖維性振顫增加[3]。果蠅是唯一有心臟的無脊椎動物,在其正常食物中加入30%的椰子油即可制成高脂食物,連續(xù)喂食果蠅5 d高脂食物即可誘發(fā)脂毒性心肌癥[4]。研究表明,將果蠅心臟dFoxo基因特異性過表達能有效抵抗高脂膳食誘發(fā)脂毒性心肌癥;相反,心臟dFoxo基因敲減能導(dǎo)致正常飲食果蠅的心臟產(chǎn)生脂毒性心肌癥[4],這提示心臟dFoxo基因是調(diào)控果蠅脂毒性心肌癥的關(guān)鍵基因。煙酰胺單核苷酸腺苷轉(zhuǎn)移酶(Nicotinamide mononucleotide adenylyltransferase,Nmnat)是煙酰胺腺苷二核苷酸(NAD)生物合成途徑中的關(guān)鍵酶蛋白,在細胞內(nèi)Nmnat蛋白對NAD合成有重要調(diào)控作用[5]。NAD+不僅參與能量代謝,還參與SIR2蛋白去乙酰化,這種去乙酰化有后天修飾和轉(zhuǎn)錄因子調(diào)控的作用,而且被認為是細胞內(nèi)代謝狀態(tài)與自適應(yīng)轉(zhuǎn)錄反應(yīng)之間聯(lián)系的分子機制[6]。而在細胞中,SIR2蛋白與NAD+的去乙酰化對Foxo蛋白有上游調(diào)節(jié)作用[7]。研究還證實在哺乳動物和果蠅中,耐力運動能有效預(yù)防和改善脂毒性心肌癥,如耐力運動能大量動員脂肪分解和供能,防止心臟脂質(zhì)堆積[7-8]。此外,運動訓(xùn)練能積極調(diào)節(jié)心肌細胞內(nèi)Foxo蛋白,提高心臟的抗氧化能力,減少氧化損傷[9]。耐力運動還能提高骨骼肌和心肌的NAD+水平,以促進電子的傳遞和能量代謝[10]。因此,這些研究提示Nmnat/NAD+/SIR2/dFoxo通路可能介導(dǎo)耐力運動預(yù)防和改善脂毒性心肌癥。
為確定Nmnat/NAD+/SIR2/dFoxo通路是介導(dǎo)運動抵抗脂毒性心肌癥的關(guān)鍵通路,本研究選用遺傳學(xué)的經(jīng)典模式生物果蠅作為研究對象,首先對心臟Nmnat基因正常表達果蠅進行耐力運動和高脂膳食干預(yù),觀察其心臟Nmnat/NAD+/SIR2/dFoxo通路、心臟氧化應(yīng)激、脂質(zhì)代謝及心臟功能的變化,以確定運動抵抗高脂膳食誘發(fā)脂毒性心肌癥是否伴隨心臟Nmnat/NAD+/dFoxo通路活性變化;然后,利用Hand-Gal4/USA系統(tǒng)構(gòu)建心臟Nmnat基因特異性過表達品系果蠅,并對其進行耐力運動和高脂膳食干預(yù),以證實心臟Nmnat/NAD+/SIR2/dFoxo通路是否為介導(dǎo)耐力運動抵抗脂毒性心肌癥的關(guān)鍵分子通路,旨在為脂毒性心肌癥的運動聯(lián)合基因療法提供理論基礎(chǔ)和新思路。
1? ?材料與方法
1.1? 果蠅品系
本實驗所需果蠅品系有:野生型w1118(品系號:3605,來源:Bloomington Drosophila Stock Center)、hand-Gal4(品系號:48396,來源:湖南師范大學(xué)心臟發(fā)育中心)和Nmnat-UAS-overexpression(品系號:39699,來源:Bloomington Drosophila Stock Center),通過對含UAS和GAL4序列不同品系果蠅的雜交,構(gòu)建UAS/GAL4系統(tǒng),對心臟目的基因進行表達調(diào)控。所有果蠅放置在恒溫23 ℃、恒濕50 %、12 h晝夜循環(huán)的環(huán)境下培養(yǎng)。
1.2? 雜交及分組
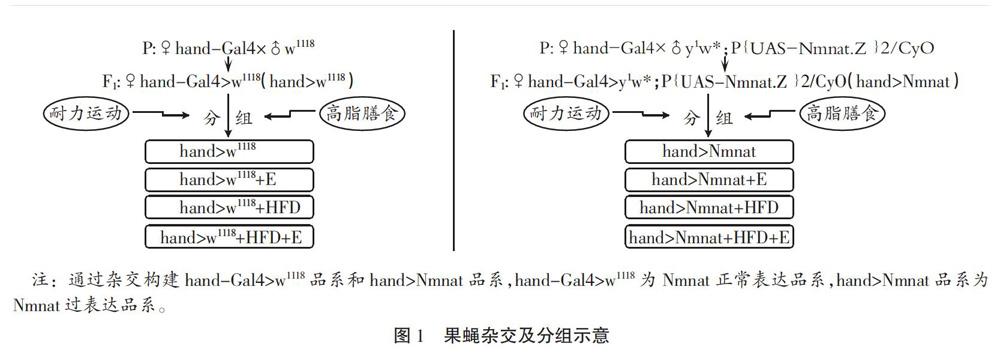
雄性野生系w1118和Nmnat-UAS-overexpression系果蠅分別與雌性hand-Gal4雜交,收集F1代羽化12 h內(nèi)的處女蠅,分為心臟Nmnat正常表達系(hand-Gal4>w1118和hand>w1118)和心臟Nmnat過表達系(hand-Gal4>Nmnat-UAS-overexpression和hand>Nmnat)。然后,運動訓(xùn)練(E)、高脂膳食(HFD)及二者聯(lián)合分別干預(yù)Nmnat正常表達系和心臟Nmnat過表達系,因此,收集的果蠅共分8組,分別為hand>w1118、hand>w1118+E、hand>w1118+HFD、hand>w1118+HFD+E、hand>Nmnat、hand>Nmnat+E、hand>Nmnat+HFD、hand>Nmnat+HFD +E,每組410只,如圖1所示。
1.3? 運動訓(xùn)練和高脂膳食方案
運動訓(xùn)練和高脂膳食均從15 d齡開始(果蠅飼養(yǎng)至3周齡初,心臟生理機能趨于成熟,有利于排除生長發(fā)育或衰老對心臟的影響),均持續(xù)5 d。運動方案為:運動組果蠅均放到運動裝置上,每管20只果蠅,果蠅每次翻轉(zhuǎn)至試管底部后,給予10 s做向上攀爬運動,試管長約8 cm,每天運動1.5 h,持續(xù)5 d,訓(xùn)練完24 h后取材。通過觀察果蠅攀爬過程中能否跟上翻轉(zhuǎn)速度及是否保持逆重力攀爬和趨光特性來判斷是否產(chǎn)生運動疲勞,由于逆重力攀爬果蠅自發(fā)的運動,且運動持續(xù)時間達到1.5 h才產(chǎn)生疲勞現(xiàn)象,稱之為果蠅耐力運動。
1.4? 正常膳食和高脂膳食配制
正常膳食:在鍋中加入水、黃豆粉、酵母粉、玉米粉攪勻,并在加熱過程中加入瓊脂,直至溶液沸騰。沸騰后停止加熱,冷卻過程中加入蔗糖和麥芽糖,待蔗糖和麥芽糖充分溶解后,加入防腐劑丙酸、對羥基苯,充分攪拌后立即分裝于潔凈的培養(yǎng)管中,每管培養(yǎng)基厚度約為0.5 cm。
高脂膳食:正常膳食中加入30%的椰子油,充分溶解混合。先加入正常飲食的培養(yǎng)基上,約0.3 cm厚,然后將30%椰子油與正常飲食的混合物倒在已凝固的培養(yǎng)基上,約0.2 cm厚,使培養(yǎng)基總厚度約為0.5 cm。
1.5? M-mode心動圖檢測心臟功能的變化
將麻醉果蠅在果蠅人工血淋巴(人工血淋巴:果蠅血淋巴配劑、蔗糖、海藻糖按照8∶1∶1的比例制成,4 ℃保存)中暴露心臟,用EM-CCD高速攝像機拍攝果蠅心臟跳動顯微影像,拍攝時長為30 s,頻率為130幀/s,利用HC-Image 軟件記錄并處理視頻數(shù)據(jù),采用半自動光學(xué)心動分析軟件(semi-automatic optical heartbeat analysis software,SOHA)量化分析果蠅心率(heart rate,HR)、縮短分數(shù)(fraction shortening,F(xiàn)S)、舒張直徑(diastolic diameters,DD)、收縮直徑(sysstolic diameters,SD)和纖維性振顫(fibrillations),以反映果蠅心臟收縮能力和心臟振顫情況。每組取30只果蠅檢測心臟功能。
1.6 ELISA檢測果蠅心臟TAG、NAD+、SIR2去乙酰化、SOD活力和MDA水平
每組取60只果蠅心臟放入150 μL PBS+1% Triton-x 中,用以檢測心臟TAG水平;每組每個指標(biāo)取80只果蠅心臟放入150 μL PBS中,用以檢測心臟NAD+水平、SOD活力水平和MDA水平。ELISA檢測步驟如下:用細胞破碎儀使果蠅心肌細胞破裂,將勻漿液離心:4 000 r/min,15 min,4 ℃,取上清備用;標(biāo)準(zhǔn)品孔各加不同濃度的標(biāo)準(zhǔn)品50 μL,樣本孔中加入待測樣本50 μL,3孔重復(fù);空白孔不加;除空白孔外,標(biāo)準(zhǔn)品孔和樣本孔中每孔加入辣根過氧化物酶(HRP)標(biāo)記的檢測抗體100 μL,用封板膜封住反應(yīng)孔,37 ℃水浴鍋或恒溫箱溫育60 min;棄去液體,吸水紙上拍干,每孔加滿洗滌液(350 μL),靜置1 min,甩去洗滌液,吸水紙上拍干,如此重復(fù)洗板5次;每孔加入底物A、B各50 μL,37 ℃避光孵育15 min;每孔加入終止液50 μL,15 min內(nèi),在450 nm波長處測定各孔的OD值。以所測標(biāo)準(zhǔn)品的OD值為橫坐標(biāo),標(biāo)準(zhǔn)品的濃度值為縱坐標(biāo),用相關(guān)軟件繪制標(biāo)準(zhǔn)曲線,并得到直線回歸方程(如圖2所示),將樣品的OD值代入方程,計算出樣品的濃度。
1.7? qRT-PCR檢測心臟相關(guān)基因 mRNA表達情況
每組取80只果蠅心臟放入1 mL的trizol reagen中,加0.25 mL氯仿,離心,條件4 ℃,12 000 g,15 min,吸取上層水至另一離心管中并加入等體積100%異丙醇,-20 ℃放過夜,4 ℃下12 000 g離心10 min,留下RNA沉淀,保存在-70 ℃的75%酒精中。
mRNA逆轉(zhuǎn)錄:離心管在冰上依次加入5×gDNA Eraser Buffer 2? μL、gDNA Eraser 1 μL、RNase Free dH2O 5 μL,共10 mL混合液,42 ℃反應(yīng)5 min,去除基因組DNA。在冰上加入5×PrimeScript Buffer2 4 μL、PrimeScript RT Enzyme Mix I 1 μL、RT Primer Mix 1 μL、RNase Free dH2O 4 μL,輕柔混合后立即進行反轉(zhuǎn)錄反應(yīng)。水浴37 ℃反應(yīng)30 min,85 ℃反應(yīng)1 min,并將產(chǎn)物稀釋到100 μL,-20 ℃保存。
Real time PCR:儀器:Bio-Rad96孔熒光定量RT-PRC儀,試劑:SYBR?誖Premix Ex TaqTM(Takara RR820A)。體系:SYBR?誖Premix Ex Taq(2×)15 μL、PCR Forward Primer(10 μM)0.5 μL、PCR Reverse Primer(10 μM)0.5 μL、ROX 0.6 μL、Template 5 μL、ddH2O 8.4 μL,總體系 30 μL,分三重復(fù)孔,每孔10 μL,程序:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s, 總循環(huán)40次。
引物使用Premiers5.0軟件設(shè)計,并經(jīng)NCBI BLAST基因庫檢索驗證,與其他基因無高度同源性,以Rp49 基因為內(nèi)參。引物由上海生物工程生物制品有限公司合成、純化,其序列為:Nmnat:F:5- AGACGATCTGGTGCTGGAGT-3,R:5- GTTGTCCGTATAGGCGTGGT-3;dFoxo:F:5-AACAACAGCAGCATCAGCAG-3, R:5-CTGAACCC GAGCAT TCAGAT-3; bmm:F:5-ACTGCACATTTCGCTTACCC-3, R:5-GAGAATCCG GGTATG AAGCA-3;dFAS:F:5-GGTGAGACCATCGTGGAAGT-3,R:5AAT
GTCTGCCAAGCCAGAGT-3;Col4a1:F:5-CCTGGCTTAAATGGAAACGA-3,R:5-TCCTGGTTCACCCTTCTGTC-3;Rp49:F:5-CTAAGCTGTCGCACAAATGG-3,R:5-AACTTCTTGAATCCG
GTGGG-3。取2μL RNA,逆轉(zhuǎn)錄為 cDNA,PCR 擴增后用 2% 的瓊脂糖電泳鑒定(如圖3所示)。計算基因相對表達量及過表達率。
1.8? 統(tǒng)計學(xué)分析
所有數(shù)據(jù)均用SPSS 17.0統(tǒng)計學(xué)軟件進行分析,采用多因素方差分析運動、高脂膳食、Nmnat過表達之間是否存在交互作用,并分析其主效應(yīng);用LDS比較分析各組指標(biāo)間差異,所有的數(shù)據(jù)用平均值±標(biāo)準(zhǔn)差(X±S)表示,P<0.05為差異顯著,P<0.01為差異非常顯著。
2? ? 結(jié)果
2.1? 心臟Nmnat過表達、運動訓(xùn)練和高脂膳食對果蠅心臟功能的影響
多因素方差分析結(jié)果顯示:運動、高脂膳食、Nmnat基因過表達對果蠅心率、縮短分數(shù)、舒張直徑、纖維性振顫和Col4a表達有顯著影響(P<0.05或P<0.01);運動×高脂、運動× Nmnat、運動×高脂×Nmnat對果蠅心率、縮短分數(shù)、舒張直徑、纖維性振顫和Col4a表達均未見交互作用(P>0.05);高脂×Nmnat對果蠅心率、縮短分數(shù)、舒張直徑、纖維性振顫和Col4a表達存在交互作用(P<0.05或P<0.01)。
LSD比較結(jié)果:與hand>w1118相比,hand>w1118+E果蠅心率減慢(P<0.05),縮短分數(shù)增加(P<0.05),收縮直徑、舒張直徑和纖維性振顫未見顯著變化(P>0.05),Col4a表達減少(P<0.05),表達率減少10%;hand>w1118+HFD果蠅心率加快(P<0.01),縮短分數(shù)減少(P<0.01),收縮直徑未見顯著變化(P>0.05),舒張直徑減少(P<0.05),纖維性振顫和Col4a表達增加(P<0.05,P<0.01),Col4a過表達率25%;hand>w1118+E+HFD果蠅心臟TAG水平降低(P<0.05),其余各指標(biāo)未見顯著變化。與hand>w1118+HFD相比,hand>w1118+E+HFD果蠅心臟心率加快、縮短分數(shù)增加(P<0.01,P<0.05),收縮直徑、舒張直徑、纖維性振顫和Col4a表達均未見顯著變化(P>0.05)。如表1、表2和圖4所示。
與hand>w1118相比,hand>Nmnat果蠅心臟心率減慢(P<0.05),縮短分數(shù)增加(P<0.01),收縮直徑未見顯著變化(P>0.05),舒張直徑增加(P<0.01),纖維性振顫和Col4a表達減少(P<0.05),表達率減少11%。如表1、表2和圖4所示。
與hand>Nmnat相比,hand>Nmnat+E果蠅心率減慢(P<0.05),縮短分數(shù)增加(P<0.05),收縮直徑和舒張直徑未見顯著變化(P>0.05),纖維性振顫和Col4a表達減少(P<0.05),表達率減少22%;hand>Nmnat+HFD果蠅心臟心率加快、縮短分數(shù)、收縮直徑、舒張直徑、纖維性振顫和Col4a表達均未見顯著變化(P>0.05);hand>Nmnat+E+HFD果蠅心率減慢(P<0.05),縮短分數(shù)增加(P<0.05),收縮直徑和舒張直徑未見顯著變化(P>0.05),纖維性振顫和Col4a表達減少(P<0.05),表達率減少19%;與hand>Nmnat+HFD相比,hand>Nmnat+E+HFD果蠅心率減慢(P<0.01),縮短分數(shù)增加(P<0.05),收縮直徑和舒張直徑未見顯著變化(P>0.05),纖維性振顫和Col4a表達減少(P<0.05)。如表1、表2和圖4所示。
與hand>w1118相比,hand>w1118+E和hand>w1118+HFD的心臟外徑增加(P<0.05),其余各組均未見顯著變化(P>0.05),見表3。如圖5所示:高脂膳食能明顯誘發(fā)hand>w1118果蠅心臟外徑增大和脂質(zhì)堆積增多,提示病理性心臟肥大;運動訓(xùn)練和Nmnat過表達同樣能使心臟外徑增大,但沒有出現(xiàn)脂質(zhì)堆積的現(xiàn)象,提示心臟生理性增大。
2.2? 心臟Nmnat過表達、運動訓(xùn)練和高脂膳食對果蠅心臟脂質(zhì)代謝和氧化應(yīng)激的影響
多因素方差分析結(jié)果顯示:運動、高脂膳食、Nmnat過表達對心臟TAG、bmm表達、dFAS表達、SOD活力、MDA水平、dFoxo表達均存在顯著影響(P<0.05或P<0.01)。運動×高脂、運動× Nmnat、運動×高脂×Nmnat對心臟TAG、bmm表達、dFAS表達、SOD活力、MDA水平、dFoxo表達均未見交互作用(P>0.05);高脂×Nmnat對心臟TAG、bmm表達、dFAS表達、SOD活力、MDA水平、dFoxo表達存在交互作用(P<0.05或P<0.01)。
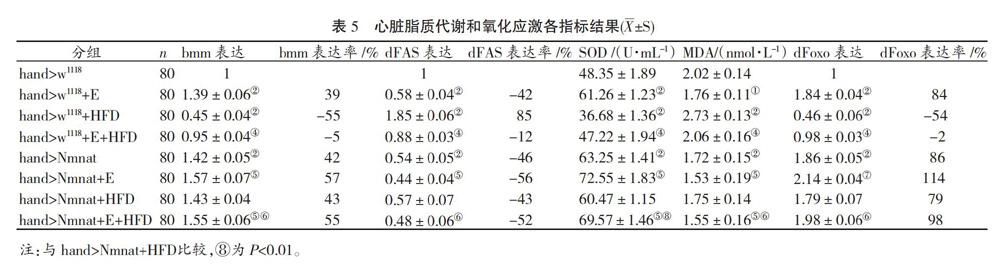
LSD比較結(jié)果顯示:與hand>w1118相比,hand>w1118+E果蠅心臟TAG水平、dFAS表達和MDA水平均降低(P<0.05或P<0.01),dFAS表達率減少42%,心臟bmm表達、SOD活力和dFoxo表達升高(P<0.01),bmm過表達率39%,dFoxo過表達率84%;hand>w1118+HFD組果蠅心臟TAG水平、dFAS表達和MDA水平均升高(P<0.01),dFAS過表達率85%,心臟bmm表達、SOD活力和dFoxo表達均降低(P<0.01),bmm表達率減少55%,dFoxo表達率減少54%;hand>w1118+E+HFD果蠅心臟TAG水平降低(P<0.05),其余各指標(biāo)未見顯著變化。與hand>w1118+HFD相比,hand>w1118+E+HFD果蠅心臟TAG水平、dFAS表達和MDA水平均降低(P<0.01),心臟bmm表達、SOD活力和dFoxo表達升高(P<0.01),見表4和表5。
與hand>w1118相比,hand>Nmnat果蠅心臟TAG水平、dFAS表達和MDA水平均降低(P<0.01),dFAS表達率-46%,心臟bmm表達、SOD活力和dFoxo表達升高(P<0.01),bmm過表達率42%,dFoxo過表達率86%,見表4和表5。
與hand >Nmnat相比,hand>Nmnat+E果蠅心臟TAG水平、dFAS表達和MDA水平均降低(P<0.05),dFAS表達率減少56%,心臟bmm表達、SOD活力和dFoxo表達升高(P<0.05或P<0.01),bmm過表達率57%,dFoxo過表達率114%;hand>Nmnat+HFD果蠅心臟TAG水平、dFAS表達、MDA水平、bmm表達、SOD活力和dFoxo表達均未見顯著變化(P>0.05);hand>Nmnat+E+HFD果蠅心臟TAG水平、dFAS表達和dFoxo表達未見顯著變化(P>0.05),MDA水平減少(P<0.05),bmm表達和SOD活力升高(P<0.05)。與hand>Nmnat+HFD相比,hand>Nmnat+E+HFD果蠅心臟TAG水平、dFAS表達和MDA水平均降低(P<0.05),dFAS表達率減少52%,心臟bmm表達、SOD活力和dFoxo表達升高(P<0.05或P<0.01),bmm過表達率55%,dFoxo過表達率98%,見表4和表5。
2.3? 心臟Nmnat過表達、運動和高脂膳食對心臟Nmnat/NAD+/SIR2通路的影響
多因素方差分析結(jié)果顯示:運動、高脂膳食、Nmnat過表達對心臟Nmnat表達量、NAD+水平和SIR2去乙酰化水平存在顯著影響(P<0.05或P<0.01)。運動×高脂、運動×Nmnat、運動×高脂×Nmnat對心臟Nmnat表達量、NAD+水平和SIR2去乙酰化水平均未見交互作用(P>0.05);高脂×Nmnat對心臟Nmnat表達量、NAD+水平和SIR2去乙酰化水平存在交互作用(P<0.05或P<0.01)。
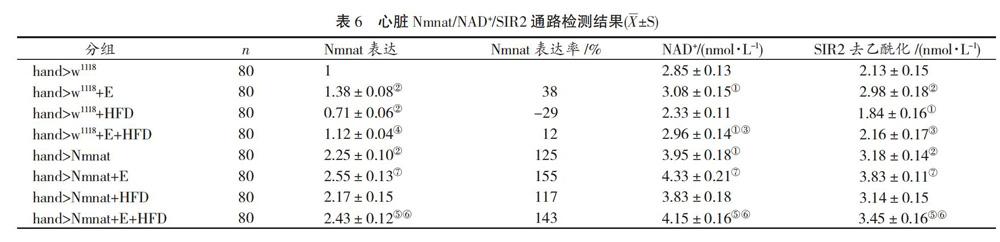
LSD比較結(jié)果顯示:與hand>w1118相比,hand>w1118+E果蠅心臟Nmnat表達增加(P<0.01),過表達率38%,心臟NAD+水平和SIR2去乙酰化水平均升高(P<0.05,P<0.01);hand>w1118+HFD組心臟Nmnat表達降低(P<0.01),表達率減少29%,心臟NAD+水平和SIR2去乙酰化水平均減少(P<0.01,P<0.05);hand>w1118+E+HFD果蠅心臟Nmnat表達、NAD+水平和SIR2去乙酰化水平均未見顯著差異(P>0.05)。與hand>w1118+HFD相比,hand>w1118+E+HFD果蠅心臟Nmnat表達增加(P<0.01),NAD+水平和SIR2去乙酰化水平升高(P<0.01,P<0.05)。見表6。
與hand>w1118相比,hand >Nmnat果蠅心臟Nmnat表達增加(P<0.01),過表達率125%,心臟NAD+水平和SIR2去乙酰化水平均升高(P<0.01)。與hand >Nmnat相比,hand>Nmnat+E組果蠅心臟Nmnat表達增加(P<0.01),過表達率155%,心臟NAD+水平和SIR2去乙酰化水平均升高(P<0.05,P<0.01);與hand>Nmnat+HFD相比,hand>Nmnat+E+HFD果蠅心臟Nmnat表達增加(P<0.01),過表達率143%,心臟NAD+水平未見顯著變化(P>0.05),SIR2去乙酰化水平均升高(P<0.05)。與hand>Nmnat+HFD相比,hand>Nmnat+E+HFD果蠅心臟Nmnat表達增加(P<0.01),心臟NAD+水平無顯著變化(P>0.05),SIR2去乙酰化水平均升高(P<0.05)。見表6。
3? ?討論
3.1? 高脂膳食對果蠅心臟Nmnat/NAD+/SIR2/dFoxo通路的影響
正常飲食中混入30%的椰子油,連續(xù)喂食果蠅5 d,就能誘發(fā)其明顯可重復(fù)的肥胖表型,并造成機體內(nèi)脂質(zhì)代謝紊亂,這與哺乳類動物長期高脂膳食的結(jié)果類似[1-2]。進一步研究發(fā)現(xiàn),高脂膳食能使果蠅心臟結(jié)構(gòu)和功能異常,例如心臟TAG水平增多,心臟收縮功能減弱等[3],提示脂毒性心肌癥產(chǎn)生。此外,高脂膳食還能導(dǎo)致果蠅心臟dFoxo、PGC-1、甘油三酯水解脂肪酶基因bmm表達下調(diào),心臟TOR、心臟脂肪酸合酶1基因dFAS表達上調(diào)等[2-3,11-12]。本研究結(jié)果與前人基本一致。此外,筆者還發(fā)現(xiàn)高脂膳食導(dǎo)致果蠅的心肌細胞更易遭受氧化毒性損傷,例如抗氧化酶SOD活力減少、脂質(zhì)氧化毒性物質(zhì)MDA增加。另外,高脂膳食能引起心臟Nmnat基因表達下調(diào)、NAD+水平下降、SIR2去乙酰化水平減少,這可能是高脂膳食導(dǎo)致心臟dFoxo表達下調(diào)的重要原因。而高脂膳食能導(dǎo)致心臟膠原蛋白基因Col4a異常上調(diào),則可能是引起心臟纖維性振顫增加的主要機制。
在哺乳動物中,長期高脂膳食能破壞脂肪酸代謝平衡,導(dǎo)致未充分氧化的脂質(zhì)不斷沉積于心臟,從而形成脂毒性心肌癥[13]。同樣,果蠅高脂膳食能誘發(fā)心臟TAG水平明顯升高,這與脂質(zhì)代謝平衡破壞有關(guān)。一方面心臟甘油三酯水解脂肪酶基因bmm表達下調(diào),減弱脂肪動員和分解[14];另一方面心臟脂肪酸合酶1基因dFAS表達增加,加快心臟內(nèi)脂質(zhì)的合成代謝[15]。因此,不斷沉積的脂質(zhì)導(dǎo)致心臟肥大,加重心臟收縮和舒張負擔(dān),減弱心臟泵血能力(如圖5B和圖6C所示),導(dǎo)致心臟需通過增加心率代償輸出量[8,16]。此外,脂質(zhì)未充分氧化導(dǎo)致脂質(zhì)毒性損傷,例如抗氧化酶SOD活力減弱,毒性產(chǎn)物MAD水平增加,這可能使心肌細胞膜和線粒體膜的破壞增加,造成心肌細胞收縮能力減弱、泵血功能下降[13,17]。有研究表明,高脂膳食和衰老均能導(dǎo)致心臟膠原蛋白堆積,心肌細胞纖維程度增加,使心臟衰竭風(fēng)險增加[18]。膠原蛋白是組成各種細胞外間質(zhì)的聚合物,適量的膠原蛋白有利于細胞的功能,而過量堆積,將使細胞纖維程度增加,果蠅心臟的膠原蛋白合成由Col4a1基因調(diào)控[19]。此外,還有研究表明,膠原蛋白表達與脂肪細胞增生有關(guān),脂肪組織分化的一個特點是膠原蛋白積累,而分化成熟時膠原蛋白會停止積累。在發(fā)生胰島素抵抗和代謝相關(guān)疾病時,膠原蛋白會選擇性增生,而膠原蛋白積累經(jīng)常被認為是一個病理過程[20];因此,高脂膳食導(dǎo)致果蠅心臟周圍脂肪組織分化增加和Col4a1基因表達上調(diào),可能是心臟纖維性振顫增加的主要分子機制[21]。
在細胞內(nèi)NAD+不僅參與能量代謝[10],還參與脂肪酸氧化的修復(fù)[22],高脂膳食可能促進NAD+參與心肌細胞脂肪酸氧化的修復(fù),加快心肌細胞內(nèi)NAD+消耗。此外,高脂膳食能使細胞內(nèi)脂質(zhì)毒性物質(zhì)MDA增加,使線粒體結(jié)構(gòu)和功能遭到破壞,這也將導(dǎo)致NAD+水平減少,因為線粒體含有豐富的NAD+? ?[23]。Nmnat作為NAD+合成酶基因,隨著心肌細胞內(nèi)NAD+水平不斷減少,其表達適應(yīng)性下調(diào)。另外,NAD+作為催化物和底物參與SIR2去乙酰化作用,NAD+水平減少降低SIR2的去乙酰化,最終導(dǎo)致dFoxo蛋白活性減少[7],并使dFoxo基因適應(yīng)性下調(diào)。dFoxo是SOD上游調(diào)控因子[24],dFoxo活性減少能造成SOD水平降低,這將使心肌細胞遭受氧化損傷的風(fēng)險增加。研究表明,dFoxo基因?qū)χ拘孕募“Y形成起著關(guān)鍵性作用[4];因此,高脂膳食誘發(fā)的脂毒性心肌癥與心臟Nmnat/NAD+/SIR2/dFoxo通路活性水平降低密切相關(guān),但仍不能確定該通路是調(diào)控脂毒性心肌癥的關(guān)鍵通路。
3.2? 心臟Nmnat基因過表達對高脂膳食果蠅心臟的影響
有研究表明,特異性下調(diào)果蠅心臟Nmnat基因表達,能引起心臟功能紊亂,例如收縮能力減弱,泵血能力下降等[25],與脂毒性心肌癥特征類似,但心臟Nmnat基因是否參與調(diào)控脂毒性心肌癥形成。研究已證實果蠅高脂膳食能誘發(fā)脂毒性心肌癥[2-3,11-12]尚未知,心臟Nmnat/NAD+/SIR2/dFoxo通路活性水平降低。為了進一步證實心臟Nmnat基因和心臟Nmnat/NAD+/SIR2/dFoxo通路與脂毒性心肌癥的關(guān)系,果蠅心臟Nmnat基因被進行特異性過表達。通過檢測心臟Nmnat基因表達,即hand>Nmnat果蠅心臟Nmnat表達明顯高于hand>w 1118果蠅,可以判斷心臟Nmnat基因特異性過表達構(gòu)建成功。此外,本研究還發(fā)現(xiàn)心臟Nmnat基因特異性過表達能提高果蠅心臟NAD+水平、SIR2去乙酰化水平及dFoxo表達,提示心臟Nmnat/NAD+/SIR2/dFoxo通路活性增強。
Nmnat是NAD+合成酶基因,是NAD+從頭合成途徑的關(guān)鍵酶基因,心臟Nmnat基因表達增加,有利于促進NAD+從頭合成[5],從而使心臟NAD+適應(yīng)性增加。有研究表明,Nmnat過表達能促使NAD+水平適應(yīng)性增加[26],而細胞內(nèi)NAD+對SIR2有上游調(diào)節(jié)作用,適當(dāng)提高NAD+水平能上調(diào)SIR2表達和提高SIR2蛋白水平[27],這可能是果蠅心臟內(nèi)SIR2去乙酰化水平增加的主要原因。心臟內(nèi)NAD+與SIR2去乙酰化作用能增強Foxo活性水平,導(dǎo)致心臟dFoxo基因表達適應(yīng)性上調(diào),從而減少氧化損傷[24]。此外,通過檢測心臟脂質(zhì)代謝、氧化應(yīng)激及心臟功能相關(guān)指標(biāo),發(fā)現(xiàn)心臟Nmnat基因過表達能明顯降低心臟TAG水平,這與bmm基因表達上調(diào)和dFAS表達下調(diào)有關(guān);心臟Nmnat基因過表達能明顯增加SOD活力水平,并減少脂質(zhì)毒性產(chǎn)物MAD水平,提示心肌細胞抗氧化能力增加,細胞膜和線粒體膜遭受氧化損傷風(fēng)險降低[23-24],有利于維持心臟收縮功能的穩(wěn)定。M-mode檢測心臟功能發(fā)現(xiàn),心臟Nmnat基因過表達能明顯減慢心率,提高縮短分數(shù)和增加舒張直徑,這反映出心臟泵血能力增強。同時,還發(fā)現(xiàn)心臟Nmnat基因過表達能明顯降低心臟纖維性振顫,這與心臟Col4a1基因表達和脂質(zhì)堆積減少有關(guān)[21]。果蠅心臟dFoxo基因已被證實是調(diào)控脂毒性心肌癥的關(guān)鍵基因,因此,心臟Nmnat基因過表達能通過激活心臟Nmnat/NAD+/SIR2/dFoxo通路來降低脂毒性心肌癥發(fā)生的風(fēng)險,但心臟Nmnat基因過表達是否能抵抗果蠅高脂膳食誘發(fā)脂毒性心肌癥仍未知。
為了確定心臟Nmnat基因過表達對果蠅高脂膳食誘發(fā)脂毒性心肌癥的影響,心臟Nmnat基因過表達果蠅給予高脂膳食。正常情況下,果蠅連續(xù)5 d高脂膳食能誘發(fā)脂毒性心肌癥及心臟分子機制異常改變[1-2]。而在心臟某些基因特異性改變情況下,心臟對高脂膳食誘發(fā)脂毒性心肌癥的耐受性增強,例如有研究證實,果蠅心臟dFoxo、PGC-1、bmm基因特異性過表達或TOR、dFAS特異性敲減或突變均能抵抗高脂膳食誘發(fā)脂毒性心肌癥[2-3,11-12]。因此,這些基因均是參與脂毒性心肌癥形成的重要基因。本研究發(fā)現(xiàn),高脂膳食不能造成心臟Nmnat基因過表達果蠅心臟脂質(zhì)堆積和脂肪酸代謝平衡破壞,也未誘發(fā)心臟氧化應(yīng)激增加和心臟收縮能力減弱,纖維性振顫也未見明顯改變,相關(guān)基因bmm、dFAS、Col4a1、dFoxo也不會出現(xiàn)明顯表達異常,心臟Nmnat/NAD+/SIR2/dFoxo通路活性維持正常水平。這提示心臟Nmnat基因過表達能提高果蠅心臟對高脂膳食誘發(fā)脂質(zhì)毒性損傷的抵抗能力。心臟Nmnat基因過表達導(dǎo)致NAD+合成適應(yīng)性增加,一方面充足的NAD+具有還原性能減少脂質(zhì)氧化不充分導(dǎo)致的脂毒性損傷和保證正常有氧能量代謝,預(yù)防脂質(zhì)堆積[10,22];另一方面充足的NAD+與SIR2去乙酰化能提高Foxo活性,提高SOD水平[24],提高細胞的氧自由基清除能力,從而減少氧化損傷,維持心肌正常收縮功能[24]。這可能是心臟Nmnat基因過表達通過激活心臟Nmnat/NAD+/SIR2/dFoxo通路,抵抗高脂膳食誘發(fā)脂毒性心肌癥的主要原因。
3.3? 耐力運動聯(lián)合心臟Nmnat基因過表達對高脂膳食果蠅心臟的影響
在哺乳動物和果蠅中,大量研究證實,耐力運動能改善高脂膳食誘發(fā)的脂毒性心肌癥,包括減少心臟脂質(zhì)堆積、提高心臟功能、減少氧化應(yīng)激和增強有氧能量代謝等,其生理機制主要與耐力運動能加快動員心臟內(nèi)的脂肪,促進脂肪酸氧化分解和供能有關(guān)[28]。當(dāng)然,心臟對耐力運動的適應(yīng)也有分子水平的變化,例如心臟NAD+水平增加、SOD活力水平升高、dFoxo表達和SIR2表達上調(diào)等[8,29],但心臟Nmnat/NAD+/SIR2/dFoxo通路是否為耐力運動抵抗脂毒性心肌癥的關(guān)鍵通路還未見有研究。
為弄清這一問題,本研究對果蠅進行運動干預(yù),發(fā)現(xiàn)無論是正常膳食,還是高脂膳食果蠅,進行1周耐力運動后,心臟Nmnat和dFoxo表達顯著上調(diào)、NAD+水平和SIR2去乙酰化水平明顯升高,提示心臟Nmnat/NAD+/SIR2/dFoxo通路活性增加。此外,心臟TAG水平下降,bmm基因表達上調(diào),dFAS表達下調(diào),提示心臟內(nèi)脂肪分解代謝可能大于合成代謝,有利于防止脂質(zhì)堆積。心臟SOD活力水平增加,MDA水平降低提示心肌細胞抗氧化能力增強,脂質(zhì)毒性損傷減少。心臟功能方面,心率顯著下降,縮短分數(shù)和舒張直徑增加,提示心臟收縮能力增強;心臟纖維性振顫減少,其生理機制與心臟膠原蛋白合成和脂質(zhì)減少有關(guān)。
在進行耐力運動時,心臟對能量的需求非常高,這種刺激可能使運動后的心臟產(chǎn)生適應(yīng)性變化[30]。NAD+是呼吸鏈中電子的傳遞物,NAD+水平高低決定線粒體內(nèi)外電子傳遞的速率[23]。運動時,由于心肌細胞氧氣供應(yīng)不足,NAD+不斷轉(zhuǎn)化為NADH,NAD+水平不斷降低,導(dǎo)致能量代謝效率減低[31]。此外,運動時還會產(chǎn)生氧自由基,由于NAD+具有還原性,因此,NAD+還能消耗自身來抵抗氧化損傷[32]。因此,運動后NAD+水平有可能產(chǎn)生超量恢復(fù),導(dǎo)致心臟NAD+水平適應(yīng)性增加[33]。NAD+的合成包括從頭合成和拯救合成,Nmnat是拯救合成途徑中的關(guān)鍵酶基因,CG9940是從頭合成的關(guān)鍵酶基因。有研究證實,耐力運動能提高果蠅全身CG9940基因表達[34]。本研究發(fā)現(xiàn)耐力運動能上調(diào)心臟Nmnat基因表達,這可能是運動后NAD+水平需超量恢復(fù)造成的結(jié)果。NAD+水平升高不僅使心臟Nmnat基因表達上調(diào),同時還能引起SIR2去乙酰化水平和Foxo活性水平增加,因為NAD+對SIR2有上游調(diào)節(jié)作用[27],而SIR2去乙酰化對Foxo活性有上游調(diào)節(jié)作用[24],這提示耐力運動可能通過增加NAD+水平上調(diào)心臟Nmnat/NAD+/SIR2/dFoxo通路活性。進行耐力運動時,脂肪是能量代謝主要物質(zhì),這使得脂肪分解代謝相關(guān)的酶基因適應(yīng)性增強,如果bmm表達上調(diào),有利于脂肪動員;同時,脂肪的合成會因為游離甘油三酯水平降低而減少,導(dǎo)致脂肪合成代謝相關(guān)的酶基因適應(yīng)性下調(diào),如果dFAS表達下調(diào)[4,35],這是心臟甘油三酯水平減少的主要機制。耐力運動使心臟Nmnat/NAD+/SIR2/dFoxo通路活性增加,還提高了心臟的抗氧化能力,因為Foxo對SOD有上游調(diào)節(jié)作用[24],這能減少氧化損傷,使脂毒性產(chǎn)物MDA減少。此外,本研究還發(fā)現(xiàn)高脂膳食果蠅進行耐力運動干預(yù)后,與正常膳食果蠅相比,心臟Nmnat和dFoxo表達、NAD+水平、SIR2去乙酰化水平、心臟TAG、bmm基因表達、dFAS表達、心臟SOD活力水平、MDA水平降低,心率、縮短分數(shù)、舒張直徑、心臟纖維性振顫等均未見顯著變化。結(jié)果提示,耐力運動能有效抵抗高脂膳食誘發(fā)的脂毒性心肌癥,心臟Nmnat/NAD+/SIR2/dFoxo通路的激活是其重要機制。
不同遺傳因素極有可能造成運動效果的差異,例如在果蠅全身CG9940基因過表達、正常表達和敲減的條件下,規(guī)律運動對生命周期有促進作用,但在CG9940基因突變的情況下,規(guī)律運動能對果蠅壽命產(chǎn)生不利影響[36]。盡管前面已經(jīng)論證心臟Nmnat基因過表達和耐力運動均能有效抵抗高脂膳食誘發(fā)脂毒性心肌癥,其機制均與心臟Nmnat/NAD+/SIR2/dFoxo通路的激活有關(guān),但還不清楚在心臟Nmnat基因過表達條件下,耐力運動對高脂膳食誘發(fā)脂毒性心肌癥和心臟Nmnat/NAD+/SIR2/dFoxo通路的影響。本研究結(jié)果顯示,在心臟Nmnat基因過表達果蠅中,不管是正常膳食還是高脂膳食,耐力運動均能提高果蠅心臟Nmnat/NAD+/SIR2/dFoxo通路活性,降低心臟TAG水平,增強心臟抗氧化能力和提高心臟收縮能力,減少纖維性振顫。前面已經(jīng)闡明心臟Nmnat基因過表達能有效地抵抗高脂膳食誘發(fā)脂毒性心肌癥,在其聯(lián)合耐力運動的情況下,這種抵抗性明顯增強,其分子機制也與心臟NAD+水平進一步升高、心臟Nmnat/NAD+/SIR2/dFoxo通路活性進一步增強有關(guān)。
4? ?結(jié)論
心臟Nmnat基因過表達和耐力運動均能防止果蠅高脂膳食誘發(fā)脂毒性心肌癥的形成,包括減少高脂膳食果蠅心臟的脂質(zhì)過度堆積、氧化損傷、心臟收縮能力減弱和纖維性振顫增加,其分子機制與二者均能上調(diào)心臟Nmnat/NAD+/SIR2/dFoxo通路活性有關(guān)。心臟Nmnat基因過表達聯(lián)合耐力運動時能更好地抵抗脂毒性心肌癥的發(fā)生,這與二者聯(lián)合對心臟Nmnat/NAD+/SIR2/dFoxo通路活性上調(diào)的疊加作用有關(guān)。
參考文獻:
[1]? KUWABARA Y, HORIE T, BABA O, et al. MicroRNA-451 exacerbates lipotoxicity in cardiac myocytes and high-fat diet-induced cardiac hypertrophy in mice through suppression of the LKB1/AMPK pathway[J].? Circulation Research, 2015, 116(2): 279.
[2]? DIOP S B, BISHARAT-KERNIZAN J, BIRSE R T, et al. PGC-1/Spargel counteracts high-fat-diet-induced obesity and cardiac lipotoxicity downstream of TOR and brummer ATGL lipase[J]. Cell Reports, 2015, 16(3): 1.
[3]? ZLOBINE I, GOPAL K, USSHER J R. Lipotoxicity in obesity and diabetes-related cardiac dysfunction[J]. Biochimica Et Biophysica Acta, 2016, 1861(10):1555.
[4]? BIRSE R T, CHOI J, REARDON K, et al. High-fat-diet-induced obesity and heart dysfunction are regulated by the TOR pathway in drosophila[J]. Cell Metabolism, 2010, 12(5): 533.
[5]? PAN L Z, AHN D G, SHARIF T, et al. The NAD+ synthesizing enzyme nicotinamide mononucleotide adenylyltransferase 2 (NMNAT-2) is a p53 downstream target[J]. Cell Cycle, 2014, 13(6): 1041.
[6]? DEMAREST T G, TRUONG G T D, LOVETT J, et al. Assessment of NAD+ metabolism in human cell cultures, erythrocytes, cerebrospinal fluid and primate skeletal muscle[J]. Analytical Biochemistry, 2019, 97(18): 3.
[7]? WANG Y, XU D. Effects of aerobic exercise on lipids and lipoproteins [J]. Lipids in Health and Disease, 2017, 16(1): 130.
[8] DENGTAI W, LAN Z, FAN Y, et al. Endurance exercise prevents high-fat-diet induced heart and mobility premature aging and dSir2 expression decline in aging drosophila[J]. Oncotarget, 2018(9): 7298.
[9]? MOUCHIROUD L, HOUTKOOPER R H, MOULLAN N, et al. The NAD(+)/sirtuin pathway modulates longevity through activation of mitochondrial UPR and FOXO signaling [J]. Cell, 2013, 152(2): 430.
[10]? ZHANG H, RYU D, WU Y, et al. NAD+ repletion improves mitochondrial and stem cell function and enhances life span in mice[J]. Science, 2016, 352(6292): 1436.
[11]? GUIDA M C, BIRSE R T, DALLAGNESE A, et al. Intergenerational inheritance of high fat diet-induced cardiac lipotoxicity in drosophila[J]. Nature Communication, 2019, 10(1): 185.
[12]? NA J, MUSSELMAN L P, PENDSE J, et al. A drosophila model of high sugar diet-induced cardiomyopathy[J]. PLoS Genetics, 2013, 9(1): 71.
[13]? PARK T S, YAMASHITA H, BLANER W S, et al. Lipids in the heart: a source of fuel and a source of toxins[J]. Current Opinion in Lipidology, 2007, 18(3): 277.
[14]? GR?魻NKE S, MILDNER A, FELLERT S, et al. Brummer lipase is an evolutionary conserved fat storage regulator in drosophila [J]. Cell Meta-
bolism, 2005, 1(5): 323.
[15]? PARISI F, RICCARDO S, ZOLA S, et al. Dmyc expression in the fat body affects DILP2 release and increases the expression of the fat desaturase Desat1 resulting in organismal growth[J]. Developmental Biology, 2013, 379(1): 64.
[16]? CARBONE S, MAURO A G, MEZZAROMA E, et al. A high-sugar and high-fat diet impairs cardiac systolic and diastolic function in mice[J]. International Journal of Cardiology, 2015, 198(5): 66.
[17]? MAYYAS F, ALZOUBI KH, AL-TALEB Z. Impact of high fat/high salt diet on myocardial oxidative stress[J]. Clinical and Experimental Hypertension, 2017, 39(2): 126.
[18]? LI S J, LIU C H, CHU H P, et al. The high-fat diet induces myocardial fibrosis in the metabolically healthy obese minipigs-The role of ER stress and oxidative stress[J]. Clinical Nutrition, 2017, 36(3): 760.
[19]? KELEMEN-VALKONY I, KISS M, CSIHA J, et al. Drosophila basement membrane collagen col4a1 mutations cause severe myopathy[J]. Matrix Biology, 2012, 31(1): 29.
[20]? SUN K, TORDJMAN J, CL?魪MENT K, et al. Fibrosis and adipose tissue dysfunction[J]. Cell Metabolism, 2013, 18(4): 470.
[21]? FUKUI A, IKEBE-EBATA Y, KONDO H, et al. Hyperleptinemia exacerbates high-fat diet-mediated atrial fibrosis and fibrillation[J]. Journal of Cardiovascular Electrophysiology, 2017, 28(6): 702.
[22]? AKIE T E, LIU L, NAM M, et al. OXPHOS-Mediated induction of NAD+ promotes complete oxidation of fatty acids and interdicts non-alcoholic fatty liver disease[J]. PLoS One, 2015, 10(5): 125.
[23]? LI W, SAUVE A A. NAD+ content and its role in mitochondria[J]. Methods in Molecular Biology, 2015(1241): 39.
[24]? HONG Y A, LIM J H, KIM M Y, et al. Extracellular superoxide dismutase attenuates renal oxidative stress through the activation of adenosine monophosphate-activated protein kinase in diabetic nephropathy[J]. Antioxid Redox Signal, 2018, 28(17): 1543.
[25]? 夏曉璇,鄭瀾,田旭,等.規(guī)律運動對心肌Nmnat基因敲減果蠅心臟收縮功能和節(jié)律的影響[J].中國運動醫(yī)學(xué)雜志,2015,34(8):757.
[26]? JAYARAM H N, KUSUMANCHI P, YALOWITZ J A. NMNAT expression and its relation to NAD metabolism[J]. Current Medicinal Chemistry, 2011, 18(13): 1962.
[27]? ZHANG T, KRAUS W L. SIRT1-dependent regulation of chromatin and transcription: linking NAD(+) metabolism and signaling to the control of cellular functions [J]. Biochimica Et Biophysica Acta, 2010, 1804(8): 1666.
[28]? CHICCO A J, MCCUNE S A, EMTER C A, et al. Low-intensity exercise training delays heart failure and improves survival in female hypertensive heart failure rats [J]. Hypertension, 2008, 51(4): 1096.
[29]? KAVAZIS A N, SMUDER A J, POWERS S K, et al. Effects of short-term endurance exercise training on acute doxorubicin-induced FoxO transcription in cardiac and skeletal muscle [J]. Journal of Applied Physiology, 2014, 117(3): 223.
[30]? SANTA-CLARA H, MELO X, WILLI R, et al. Energy expenditure during an exercise training session for cardiac patients[J]. Medicine & Science in Sports & Exercise, 2018, 43(3): 292.
[31]? LI W,? SAUVE A A. NAD+ content and its role in mitochondria[J]. Mitochondrial Regulation, 2015(1241): 39.
[32]? XIAO W, WANG R S, HANDY D E, et al. NAD+ as the link between oxidative stress, inflammation, caloric restriction, exercise, dna repair, longevity, and health span[J]. Rejuvenation Research, 2016, 19(5): 406.
[33]? WHITE A T, SCHENK S. NAD(+)/NADH and skeletal muscle mitochondrial adaptations to exercise[J]. American Journal of Physiology-Endocrinology and Metabolism, 2012, 303(3): 8.
[34]? 文登臺,鄭瀾,奉悅,等.CG9940基因過表達對幼齡和中齡果蠅心臟功能、攀爬能力運動應(yīng)激敏感性的影響[J].上海體育學(xué)院學(xué)報,2016,40(3):80.
[35]? RIAHI S, MOHAMMADI M T, SOBHANI V, et al. Chronic effects of aerobic exercise on gene expression of LOX-1 receptor in the heart of rats fed with high fat diet [J]. Iranian Journal of Basic Medical Sciences, 2015, 18(8): 805.
[36]? 文登臺,鄭瀾,李秋芳,等. 不同年齡段規(guī)律運動聯(lián)合 NAD 合成酶基因 CG9940表達改變對果蠅生命周期和運動能力的影響[J]. 天津體育學(xué)院學(xué)報, 2016, 31(4): 340.

