純磨玻璃結節肺腺癌臨床及影像學特征與病理分類的相關性
武衛杰,岳松偉,王會霞,呂東博,高劍波
(鄭州大學第一附屬醫院 放射科,河南 鄭州 450052 )
隨著MDCT技術的廣泛應用,肺部純磨玻璃結節(pure ground-glass nodule,pGGN)的檢出率也日益增高。pGGN病變可由多種原因引起,其中腫瘤性病變病理分類多為不典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinomainsitu,AIS)、微浸潤性腺癌(minimally invasive adenocarcinoma,MIA),但也可為浸潤性腺癌(invasive adenocarcinoma,IAC)[1]。對病理分類為AAH、AIS、MIA的pGGN多采取肺段或楔形切除術,對IAC多采取肺葉切除治療[2-4]。因此,術前對肺惡性pGGN進行病理分類,判斷病灶浸潤程度,對指導臨床醫生采取合理的治療方案有重大意義。本研究探討pGGN肺腺癌臨床及影像學特征與病理分類的相關性,以期指導臨床醫生采用合理的治療方案。
1 資料與方法
1.1 研究對象回顧性分析2017年10月至2019年5月鄭州大學第一附屬醫院收治的胸部CT表現為pGGN的患者的臨床資料。納入標準:(1)通過手術病理或經皮穿刺活檢病理證實為肺腺癌,有完整病理報告,病理亞型經病理證實;(2)術前完成常規胸部CT。排除標準:(1)CT圖像有嚴重偽影,導致病灶不易觀察和測量者;(2)肺內多發GGN或為mGGN。最終納入102例pGGN肺腺癌患者,依據病灶浸潤程度分為A組50例(AIS 22例,MIA 28例)和B組52例(IAC 52例,包括腺泡為主型16例,貼壁為主型22例,乳頭為主型14例)。收集的臨床資料包括年齡、性別、腫瘤史、吸煙史、高血壓史、糖尿病史。
1.2 掃描方法采用GE Discovery CT掃描。掃描范圍為自胸廓入口處至肺底。管電壓為120 kVp,管電流為100~600 mAs,旋轉速度為0.5 s,掃描層厚和層間距為5 mm,螺距為1.375∶1。重建層厚及層間距均為1.25 mm。
1.3 圖像分析
1.3.1結節的影像學定性指標 將所有圖像導入GE HealthCare ADW 4.7工作站進行分析及測量。由兩名具有10 a以上豐富胸部影像診斷經驗的放射科醫生獨立閱片,當診斷意見不一致時再共同商討決策。評估指標:結節的位置(左肺上葉、左肺下葉、右肺上葉、右肺中葉、右肺下葉),密度均勻度(均勻、欠均勻、不均勻),形狀(圓形、橢圓形、多角形、不規則形),瘤肺界面(清晰、不清晰),邊緣(光滑、分葉、毛刺、分葉+毛刺),內部及周邊征象(空泡征、空氣支氣管征、胸膜凹陷征、異常血管征)。密度均勻指病變內無任何透亮區。密度不均勻指的是病變內有3個以上透亮區。介于兩者之間為密度欠均勻。
1.3.2結節的影像學定量指標 分析方法與結節的影像學定性指標一致。(1)最大徑:測量病灶最大軸面的最長徑,連續測量3次取平均值。(2)平均CT值、體積、質量:將圖像導入GE Lung VCAR AW 4.7軟件進行測量,啟動Lung VCAR Single模塊,選出病灶層面,對GGN進行自動分段,顯示分段的pGGN以及在VR分段視圖上自動算出的結節體積(mm3)和平均CT值(HU),然后將平均CT值轉換為假定物理密度ρ(mg·mm-3)即CT值+1 000,根據公式m=ρ·V·10-3(mg)得出pGGN質量[5]。
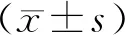
2 結果
2.1 一般資料A組和B組平均年齡分別為(52.18±9.61)、(55.92±11.33)歲。兩組年齡比較,差異無統計學意義(t=1.795,P=0.076>0.05)。兩組性別、呼吸道癥狀、腫瘤史、吸煙史、高血壓史、糖尿病史情況比較,差異無統計學意義(均P>0.05)。見表1。

表1 兩組一般資料比較[n(%)]
2.2 病灶影像學定性指標B組病灶出現密度不均勻、瘤肺界面清晰、異常血管征的比例均高于A組,差異有統計學意義(均P<0.05)。兩組病灶的部位、形狀、邊緣、空泡征、空氣支氣管征、胸膜凹陷征分布情況比較,差異無統計學意義(均P>0.05)。見表2。

表2 兩組病灶影像學定性指標比較
2.3 病灶影像學定量指標B組病灶的體積、質量大于A組,差異有統計學意義(均P<0.05)。兩組病灶的最大徑、平均CT值比較,差異無統計學意義(均P>0.05)。見表3。

表3 兩組病灶影像學定量指標比較
2.4 病灶體積及質量的ROC曲線分析結果通過病灶體積、病灶質量診斷pGGN肺腺癌病理亞型的最佳閾值分別為843 mm3、289 mg。所對應的AUC、敏感度、特異度見表4。

表4 兩組病灶體積及質量ROC曲線分析結果
3 討論
pGGN不含實性成分,在縱隔窗上不顯影,在肺窗上表現為局灶性密度增高影,且不掩蓋其內走行的血管及支氣管影。pGGN肺腺癌病理分類不同,治療方式及預后也不同。目前,MDCT檢查是篩查與診斷pGGN肺腺癌的主要手段。因此,依據其影像學特征對pGGN肺腺癌進行正確的病理分類,有助于指導個體化治療。
本研究結果顯示,兩組患者性別、年齡、呼吸系統疾病史等臨床資料無明顯差異,但由于本研究未納入mGGN患者且病灶數量較少,病灶的病理分類與患者的一般資料是否有關有待于進一步研究。本研究顯示,B組病灶出現密度不均勻的比例高于A組,與金鑫等[6]研究結果基本一致。考慮原因為B組病灶相較于A組浸潤程度增加,對支氣管活瓣作用的影響更大,導致病灶內部出現多個小透亮區。在本研究中,B組病灶出現瘤肺界面清晰的比例高于A組。吳芳等[7]研究發現,瘤肺界面清晰是提示pGGN浸潤性的一個重要CT征象。導致IAC瘤肺界面清晰的病理機制可能為病灶內部浸潤成分增加,呈堆積式生長,或腫瘤生長迅速推壓鄰近肺組織形成假包膜。AAH及MIA由于浸潤成分相對較少,瘤組織排列稀疏,生長范圍較松散,導致出現模糊的瘤肺界面。異常血管征是指穿通于pGGN中的血管扭曲擴張,管壁僵硬,走形僵直及血管集聚等異常征象。異常血管征可以預測病變浸潤性[8-9]。B組病灶出現異常血管征的比例高于A組。推測原因可能為病灶浸潤程度的增加導致病灶內部微環境改變、瘤組織高代謝和高血供,從而出現供血血管的異常改變。
pGGN的大小與其浸潤性有關,pGGN越大,提示惡性等級越高[10]。葛歡等[11]研究發現,病變大小不是鑒別pGGN病理分類的獨立影響因素。分析原因可能為pGGN大小的測量方法不同。本研究選擇了最大徑及體積反映pGGN病灶的大小,結果顯示,兩組最大徑無明顯差異,而B組病灶體積大于A組。最大徑為人工測量所得,存在一定的測量誤差,且只考慮了結節最大截面的最長徑,不能全面反映結節在三維空間的大小,存在一定的評估偏差。體積參數是由軟件對pGGN進行自動分割測量并顯示三維圖像所得,排除了人工測量參數所致的誤差,能更真實地反映結節在三維空間的大小,準確性、可重復性更高。兩組平均CT值無明顯差異。這可能是因為pGGN多為早期肺腺癌,體積小,密度低。綜合結節體積和CT值參數計算質量后比較,B組病灶質量大于A組。其鑒別兩組病灶的最佳閾值為289 mg。Hwang等[12]研究顯示,質量參數是鑒別IAC的獨立危險因素。Lim等[13]研究表明,結節的質量甚至可以判斷患者預后。這可能是因為計算結節的質量時,在考慮pGGN大小的同時,也兼顧了結節CT值的變化。相比于體積和CT值參數,質量測量能夠更加全面地反映結節的整體情況。
綜上所述,結合pGGN的體積、質量、密度均勻度、瘤肺界面、異常血管征進行綜合分析,有助于pGGN肺腺癌病理分類的鑒別診斷,從而指導臨床醫生選擇合適的治療方案。本研究為單中心研究,樣本數量較少,所選取的病例只局限于惡性pGGN,需要進一步研究多中心病例或擴大樣本量。

