紫檀芪對3T3-L1前脂肪細胞分化的影響
王 騰,孫華磊,葛惠娜,劉欣欣,李 星,李文杰
鄭州大學公共衛生學院營養與食品衛生學教研室 鄭州 450001
肥胖是一種復雜的多因素疾病,它是由脂肪過度堆積所引起,而隨著經濟發展和生活方式的改變,全球肥胖和超重人口已經從1980年的8.6億上漲至2013年的21億[1],國內情況也不容樂觀[2]。目前所使用的治療肥胖的藥物,都存在一定的不良反應[3]。紫檀芪(pterostilbene,PTE)是一種天然多酚化合物,主要存在于藍莓、葡萄等漿果中,具有抗炎、抗氧化、抑制腫瘤細胞增殖和轉移等多種功能,有研究[4]證實PTE能夠抑制前脂肪細胞增殖和脂質的堆積,從而減少脂肪組織,但PTE干預是否能夠影響前脂肪細胞分化尚未明確。因此,本研究通過建立3T3-L1前脂肪細胞分化模型,在細胞分化過程中進行PTE干預,探討PTE對前脂肪細胞分化的影響以及可能的機制。
1 材料與方法
1.1試劑和儀器PTE(純度98%,上海士鋒生物科技有限公司),DMEM培養液(美國HyClone公司),胎牛血清(美國Gibco公司),羧甲基纖維素鈉、青霉素、鏈霉素、胰蛋白酶、3-異丁基-1-甲基-黃嘌呤(IBMX)、地塞米松、胰島素、油紅O(北京索萊寶生物科技有限公司),全細胞蛋白提取裂解液、BCA蛋白濃度測定試劑盒(武漢賽維爾生物科技有限公司),SDS-PAGE凝膠配制試劑盒(北京鼎國昌盛生物科技有限公司),葡萄糖檢測試劑盒、游離脂肪酸測定試劑盒(南京建成生物工程研究所),β-actin、過氧化物酶體增殖物激活受體(PPAR)γ、CCAAT增強子結合蛋白(C/EBP)α多克隆抗體(武漢三鷹生物技術有限公司),恒溫CO2培養箱(日本SANYO公司),超凈工作臺(山東博科生物產業有限公司),酶標儀(美國BioTek公司),蛋白凝膠成像儀(美國通用電氣儀器公司)。
1.2培養基配制基礎培養基:量取DMEM培養液90 mL、胎牛血清10 mL于容量瓶中,加入1 mL青鏈霉素混合液(含青霉素10 kU/mL、鏈霉素10 g/L),混勻后用0.22 μm微孔過濾器過濾,4 ℃儲存待用。
誘導培養基A:準確量取2 mmol/L地塞米松貯存液50 μL、2 g/L胰島素貯存液0.5 mL、50 mmol/L IBMX貯存液1 mL,溶入98.5 mL基礎培養基中,混勻。現用現配。
誘導培養基B:準確量取2 g/L胰島素貯存液0.5 mL,溶入99.5 mL基礎培養基中,混勻。現用現配。
1.3細胞分化及干預3T3-L1前脂肪細胞購自中科院上海細胞庫。①細胞分化:待細胞在基礎培養基中生長至90%~100%融合時,更換新的培養基,繼續培養。48 h后更換為誘導培養基A,繼續培養48 h后更換為誘導培養基B,48 h后更換為基礎培養基,后每2 d更換1次基礎培養基,10~12 d后3T3-L1前脂肪細胞即可分化為成熟脂肪細胞。②干預:實驗設置PTE低(15 μmol/L)、中(30 μmol/L)、高(60 μmol/L)劑量組[4-5]和對照組。細胞分化過程中,在更換誘導培養基A的同時,干預組分別加入相應濃度的PTE溶液,對照組加入等體積溶劑羧甲基纖維素鈉,48 h后停止干預,并按照誘導細胞分化步驟繼續誘導細胞分化。
1.4細胞分化程度和脂質堆積測定誘導細胞分化成熟后,吸棄培養基,加入100 g/L多聚甲醛固定細胞20 min,加入適量新配制的油紅O染液室溫染色20 min,洗去背景色,顯微鏡下觀察細胞染色情況。然后使用異丙醇洗去油紅O染液,收集洗脫染液的異丙醇,使用酶標儀在510 nm處測量光密度(OD)值,以此間接反映細胞的分化程度。每組設6個復孔,實驗重復3次。
1.5細胞糖消耗量測定細胞誘導分化后,吸棄舊的培養基,用新的基礎培養基繼續培養。24 h后收集各組細胞的培養基,使用葡萄糖檢測試劑盒采用葡萄糖氧化酶-過氧化物酶法測定其中葡萄糖含量,操作步驟嚴格按照試劑盒說明書進行。后用無細胞培養基中葡萄糖含量減去所測的葡萄糖含量,即為細胞的糖消耗量。每組設6個復孔,實驗重復3次。
1.6游離脂肪酸生成量測定細胞誘導分化后,更換新的基礎培養基繼續培養。24 h后收集各組細胞的培養基,使用游離脂肪酸測定試劑盒測定其中游離脂肪酸含量,測量過程嚴格按照試劑盒說明書進行。每組設6個復孔,實驗重復3次。
1.7細胞中PPARγ、C/EBPα蛋白表達的Western blot測定誘導細胞分化成功后,細胞裂解液處理細胞3~5 min,提取細胞蛋白,采用BCA試劑盒測定蛋白濃度,調整上樣蛋白量,并加入上樣緩沖液。60 V電壓電泳30 min,然后120 V電泳至溴酚藍指示劑距分離膠底部 1 cm,300 mA恒流2 h轉移蛋白印跡至PVDF膜上,50 g/L脫脂奶粉液封閉90 min,加入一抗(PPARγ 抗體1∶3 000、C/EBPα 抗體1∶1 000稀釋),4 ℃封閉過夜。洗滌后,與二抗室溫搖床孵育2 h,ECL顯色。使用Alpha軟件進行灰度值分析,以β-actin(1∶3 000稀釋)為內參,目的蛋白與內參蛋白條帶灰度值的比值即為目的蛋白的相對表達量。實驗重復3次。
1.8統計學處理采用SPSS 21.0對數據進行統計分析。不同組間油紅O染色OD值、糖消耗量、游離脂肪酸以及PPARγ、C/EBPα蛋白相對表達量的比較均采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1PTE對3T3-L1前脂肪細胞分化的影響結果見圖1、表1。鏡下可見未分化的3T3-L1前脂肪細胞呈梭形,分化后的成熟脂肪細胞則變為圓形或者近似圓形,且胞質內有脂滴聚集,經油紅O染色可以觀察到成熟脂肪細胞內的脂滴被染色。
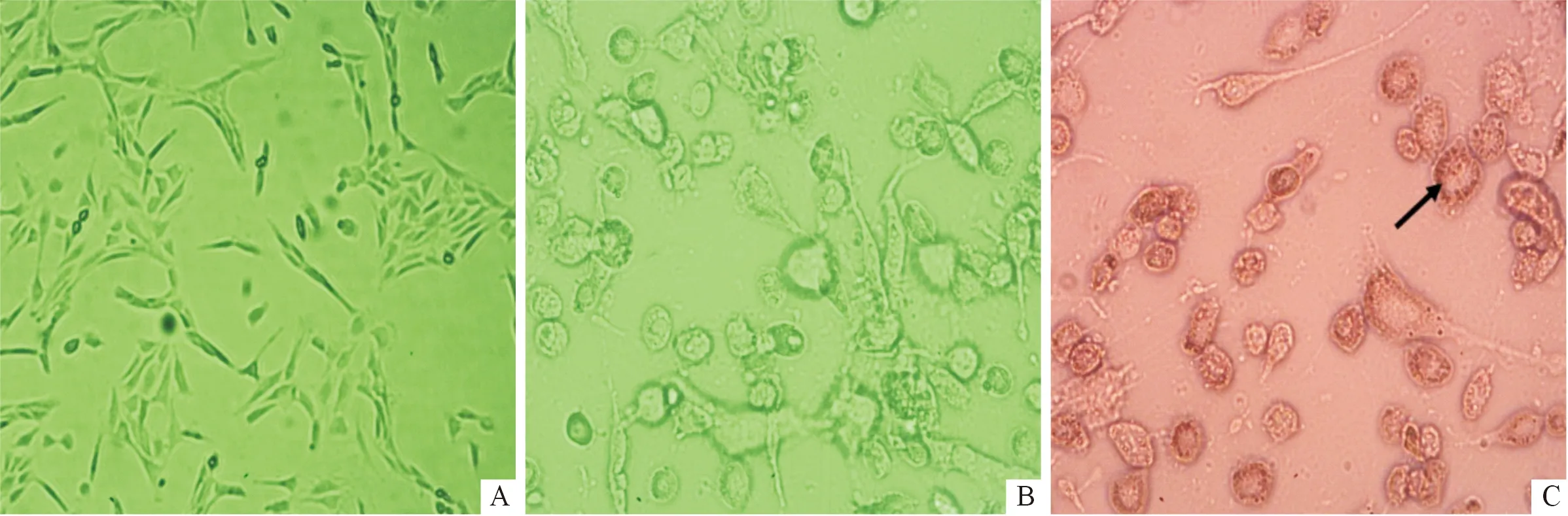
A:前脂肪細胞(×100);B:誘導分化12 d后的脂肪細胞(×200);C:油紅O染色的脂肪細胞,箭頭所示為脂滴堆積(×200)
2.2各組細胞糖脂代謝的比較結果見表1。與對照組相比,各PTE劑量組細胞糖消耗量升高;高劑量組細胞的糖消耗量高于PTE低和中劑量組。與對照組相比,各PTE劑量組細胞游離脂肪酸生成量均降低,并且PTE高劑量組低于低和中劑量組。
2.3各組細胞中PPARγ和C/EBPα蛋白表達的比較結果見圖2、表2。除PTE低劑量組C/EBPα外,與對照組相比,各PTE劑量組的PPARγ和C/EBPα蛋白表達水平均下降,并且PTE高劑量組降低最明顯。
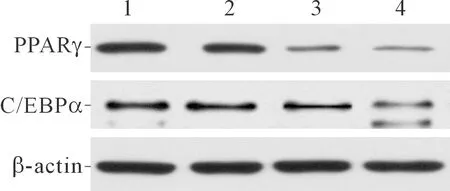
1:對照組;2:PTE低劑量組;3:PTE中劑量組;4:PTE高劑量組
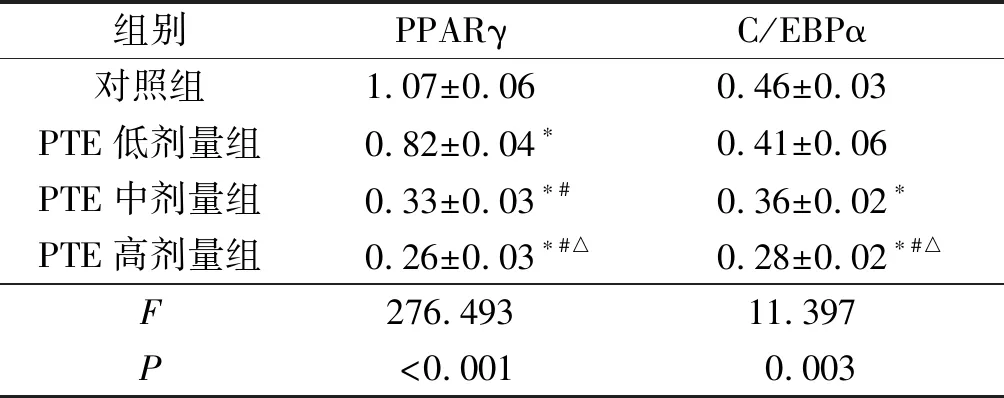
表2 各組細胞中PPARγ、C/EBPα蛋白相對表達量的比較(n=3)
3 討論
正常脂肪細胞分化過程為多功能干細胞→脂肪母細胞→前脂肪細胞→成熟脂肪細胞[6],前脂肪細胞儲存在人體各個脂肪庫中,能夠吸收、聚集脂質,從而分化為成熟脂肪細胞,成熟脂肪細胞中脂質的過度堆積會導致肥胖。有研究[7]證實前脂肪細胞的過度分化與肥胖的發生、發展密切相關,因此抑制前脂肪細胞分化可能會成為肥胖控制和治療的有效手段。本研究通過“經典雞尾酒法”誘導3T3-L1前脂肪細胞向成熟脂肪細胞分化[8],并在細胞分化的過程中進行PTE干預,探討PTE對前脂肪細胞分化的影響。
前脂肪細胞分化為成熟脂肪細胞后,有兩個主要的特征:一是細胞形態的變化,由梭形轉變為圓形或橢圓形;二是成熟脂肪細胞開始合成甘油三酯,以脂滴的形式儲存在胞質內,并且脂滴的數量和大小能夠間接反映脂肪細胞的分化程度[9]。本研究通過雞尾酒法誘導細胞分化后,細胞形態變化符合以上描述,表明誘導細胞分化成功。油紅O染液可對成熟脂肪細胞中的甘油三酯進行特異性染色,OD值檢測結果提示PTE干預能夠減少脂肪細胞分化過程中脂質的堆積,從而間接表明PTE干預能夠抑制前脂肪細胞分化。
肥胖會引起機體糖脂代謝紊亂,而糖、脂毒性往往相互影響,相互促進,形成惡性循環。脂代謝異常會抑制細胞中糖原的合成,促進糖異生,引起脂肪氧化缺陷,過量游離脂肪酸會抑制胰島素的分泌,導致糖代謝紊亂;同時長期的糖脂代謝紊亂會刺激脂肪細胞釋放多種炎性因子,妨礙胰島信號的傳導,進而加重了脂肪細胞對葡萄糖的轉運和利用障礙[10]。本研究結果顯示,PTE干預能提高脂肪細胞的糖消耗能力,同時減少游離脂肪酸的生成,提示PTE能夠改善脂肪細胞的糖脂代謝。
前脂肪細胞分化需要多種核轉錄因子的參與,其中C/EBP家族和PPAR家族是目前公認最重要的轉錄因子[11]。PPARγ是PPAR家族中最具有脂肪細胞專一性的成員,主要在脂肪細胞中表達,PPARγ在前脂肪細胞誘導分化的第2天開始轉錄,目前已有研究[12]證實PPARγ能夠調控前脂肪細胞分化,并且PPARγ基因敲除的前脂肪細胞會喪失分化能力;C/EBPα在前脂肪細胞分化過程中與PPARγ具有協同作用[13],C/EBPα在誘導分化的第2天開始表達,但C/EBPα的表達較PPARγ晚,能使前脂肪細胞進入分化的終末階段,誘導細胞中脂滴的形成[14-15]。本研究結果提示,在一定濃度范圍內,PTE干預能夠抑制前脂肪細胞分化過程中PPARγ和C/EBPα蛋白的表達,表明PTE能夠抑制前脂肪細胞的分化。
綜上所述,PTE能夠抑制3T3-L1前脂肪細胞分化,減少分化過程中的脂質堆積,并改善脂肪細胞的糖脂代謝,其機制可能與抑制PPARγ和C/EBPα蛋白表達有關。該研究結果為肥胖的控制和預防提供了新的思路和理論依據。

