急性食管胃底靜脈曲張破裂出血行急診經(jīng)頸靜脈肝內(nèi)門體分流術(shù)后發(fā)生肝性腦病的危險(xiǎn)因素分析
姚運(yùn)海, 羅 艷, 朱京樂(lè), 甘建和, 趙衛(wèi)峰
1 蘇州大學(xué)附屬第一醫(yī)院 感染科/肝病ICU, 江蘇 蘇州 215006;2 湖南省婦幼保健院 醫(yī)務(wù)部, 長(zhǎng)沙 410007
肝硬化失代償主要臨床表現(xiàn)為肝功能減退和門靜脈高壓所致的并發(fā)癥[1-2]。其中食管胃底靜脈曲張破裂出血是當(dāng)肝靜脈壓力梯度(hepatic venous pressure gradient,HVPG)達(dá)到12 mm Hg后發(fā)生的嚴(yán)重且致死性的并發(fā)癥,具有高發(fā)病率、高病死率的特點(diǎn)[3]。經(jīng)頸靜脈肝內(nèi)門體分流術(shù)(transjugular intrahepatic portosystemic shunt, TIPS)近年來(lái)廣泛應(yīng)用于門靜脈高壓相關(guān)性并發(fā)癥的治療,較胃鏡下治療及藥物治療防止再出血方面具有優(yōu)勢(shì)[4],但是由于包括術(shù)后肝性腦病(HE)在內(nèi)的一些嚴(yán)重不良事件不可預(yù)測(cè)性,其在各大指南中,一直作為挽救性治療手段。本研究旨在通過(guò)術(shù)前可及性臨床資料回顧性探索急性食管胃底靜脈曲張破裂出血早期TIPS術(shù)后HE發(fā)生的危險(xiǎn)因素。
1 資料與方法
1.1 研究對(duì)象 選擇2013年1月-2018年12月在蘇州大學(xué)附屬第一醫(yī)院因失代償期肝硬化伴急性食管胃底靜脈曲張破裂出血接受內(nèi)鏡或者藥物治療失敗,72 h內(nèi)行覆膜支架TIPS治療的患者為研究對(duì)象。入院常規(guī)收集患者TIPS術(shù)前的臨床資料及TIPS過(guò)程中的臨床指標(biāo)。入選標(biāo)準(zhǔn):符合中華外科學(xué)分會(huì)門靜脈高壓癥學(xué)組制定的《肝硬化門靜脈高壓癥食管胃底靜脈曲張破裂出血的診治共識(shí)(2015版)》[5],且所有入組患者均于術(shù)前12~24 h內(nèi)電子胃鏡檢查明確診斷為食管胃底靜脈曲張破裂出血。排除標(biāo)準(zhǔn):資料不完整的病例、術(shù)前診斷為肝衰竭、胃十二指腸潰瘍出血、消化道惡性腫瘤性出血、不明原因的消化道出血及其他經(jīng)胃鏡排除的非門靜脈高壓性出血等。本研究經(jīng)蘇州大學(xué)附屬第一醫(yī)院倫理委員會(huì)批準(zhǔn)實(shí)施(倫審批第156號(hào)),所有檢測(cè)均獲得患者家屬知情同意。
1.2 分組 對(duì)納入的肝硬化伴食管胃底靜脈曲張破裂出血患者追蹤隨訪24周,排除資料不完整病例及失訪者。根據(jù)術(shù)后發(fā)生HE情況分為HE組和非HE組。HE診斷標(biāo)準(zhǔn)符合2018年中華醫(yī)學(xué)會(huì)肝病學(xué)分會(huì)制定的《肝硬化肝性腦病診療指南》[6],HE的分級(jí)參考West-Haven HE分級(jí)標(biāo)準(zhǔn)[7]。
1.3 治療方法 TIPS治療的目標(biāo)及術(shù)前術(shù)后治療方案:HVPG較基線水平下降至少20%或者下降至12 mm Hg以下[3,8],根據(jù)此目標(biāo)選擇6~12 mm支架建立通路(支架選擇均為e-PTFE-腹膜支架,因8 mm支架既能有效預(yù)防再出血發(fā)生,同時(shí)可降低術(shù)后HE發(fā)生,故為首選;個(gè)別通過(guò)術(shù)中測(cè)定門靜脈壓力梯度選擇使用6、10或12 mm支架。其中予以8 mm支架者86例,占92.47%)。術(shù)后所有患者均需臥床心電監(jiān)護(hù)24 h,常規(guī)護(hù)肝、預(yù)防HE等治療。術(shù)后抗凝方案由皮下低分子肝素注射逐步過(guò)渡至口服利伐沙班片,患者依從性良好,且按醫(yī)囑服藥,定期隨訪。術(shù)后HE預(yù)防方案按照《肝硬化肝性腦病診療指南》[6]進(jìn)行:所有患者術(shù)后均接受預(yù)防感染、通暢腸道防止腸道菌群失調(diào)、維持內(nèi)環(huán)境和電解質(zhì)穩(wěn)定、補(bǔ)充白蛋白及門冬氨酸鳥氨酸等治療。
1.4 數(shù)據(jù)收集 收集患者術(shù)前臨床資料,包括性別、年齡、病因、合并癥,血生化指標(biāo)包括WBC、PLT、紅細(xì)胞比積(Hct)、TBil、AST、Alb、血清肌酐(SCr)、PT等,根據(jù)實(shí)測(cè)值分別計(jì)算每位患者的MELD評(píng)分,記錄TIPS支架植入前測(cè)得的肝靜脈鍥壓與游離壓差值計(jì)算所得HVPG值。
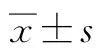
2 結(jié)果
2.1 一般資料 共入組食管胃底靜脈曲張患者93例,一般資料詳見表1,其中HE組36例,非HE組57例,HE發(fā)生率為38.71%。接受TIPS治療前兩組的MELD評(píng)分、HVPG比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05),其余各指標(biāo)差異均無(wú)統(tǒng)計(jì)學(xué)意義(P值均>0.05)。
2.2 HE診斷及分級(jí) 36例HE組患者中0~1級(jí)17例(47.222%),2級(jí)9例(25.000%),3級(jí)6例(16.667%),4級(jí)4例(11.111%)。
2.3 TIPS術(shù)后HE的影響因素 將兩組性別(男=0,女=1)、年齡、WBC、PLT、Hct、TBil、AST、Alb、SCr、PT、MELD評(píng)分、HVPG進(jìn)行比較,單因素分析結(jié)果顯示年齡、PT、MELD評(píng)分、HVPG差異均有統(tǒng)計(jì)學(xué)意義(P值均<0.1)(表2)。進(jìn)一步多因素logistic回歸分析結(jié)果顯示MELD評(píng)分、HVPG是肝硬化合并食管胃底靜脈曲張破裂出血TIPS術(shù)后發(fā)生HE的危險(xiǎn)因素(P值均<0.05)(表3)。

表1 患者接受TIPS支架植入前的一般資料

表2 logistic單因素分析
注:OR,比值比;95%CI,95%可信區(qū)間。

表3 logistic多因素分析
3 討論
TIPS是肝靜脈及門靜脈主要分支之間的人工分流通道,廣泛用于治療門靜脈高壓相關(guān)并發(fā)癥[7,9]。食管胃底靜脈曲張破裂出血是門靜脈高壓嚴(yán)重且致命的并發(fā)癥,TIPS通過(guò)快速降低門靜脈壓力,對(duì)治療急性靜脈曲張破裂出血有益[10]。與內(nèi)鏡下硬化、套扎相比,TIPS可降低再出血率,但并不能提高生存率,并且在1~2.5年內(nèi)增加包括HE在內(nèi)的并發(fā)癥發(fā)生率,因此,不建議將TIPS作為食管胃底靜脈曲張破裂出血的首選治療方法[4,11]。
HE為TIPS術(shù)后的主要并發(fā)癥之一,一直受到廣泛關(guān)注。本研究共納入93例肝硬化急性食管胃底靜脈曲張破裂出血內(nèi)鏡或者藥物治療失敗,并在72 h內(nèi)行覆膜支架TIPS治療的患者,分析TIPS術(shù)后HE危險(xiǎn)因素。術(shù)后HE發(fā)生率為38.710%,以0~1級(jí)為主,占總HE 的47.222%,致死性HE(3~4級(jí))10例,占總HE的27.778%,發(fā)生率與既往研究[8,12]相似。Abraldes等[13]研究顯示TIPS術(shù)后短期明顯HE發(fā)生率為25%~45%,常規(guī)降血氨、通暢大便、改善腸道微生態(tài)等治療HE很快得以緩解[8],但是術(shù)后數(shù)月內(nèi)由于腦神經(jīng)細(xì)胞不能適應(yīng)腸源性毒素影響,術(shù)后HE發(fā)生率可能更高,甚至超過(guò)40%[14-15],主要發(fā)生機(jī)制為TIPS術(shù)后門體分流增加,內(nèi)毒素等含氮代謝產(chǎn)物未經(jīng)肝臟代謝而直接進(jìn)入體循環(huán),對(duì)血腦屏障產(chǎn)生破壞作用,進(jìn)而引起中樞神經(jīng)系統(tǒng)功能紊亂[16]。既往報(bào)道[17]對(duì)TIPS術(shù)后嚴(yán)重且難治性HE,選擇限制支架內(nèi)分流,甚至肝移植治療。本研究統(tǒng)計(jì)了接受TIPS治療術(shù)后24周的HE發(fā)生率,臨床明顯HE發(fā)生率不在少數(shù),其中2例行肝移植治療,1例行支架內(nèi)封堵術(shù),3例因反復(fù)嚴(yán)重HE而放棄治療,其他4例經(jīng)過(guò)內(nèi)科綜合治療好轉(zhuǎn)。
MELD評(píng)分可對(duì)短期、中期病死率進(jìn)行有效的預(yù)測(cè),且其評(píng)價(jià)指標(biāo)獲得簡(jiǎn)單、客觀、易于計(jì)算,在慢性肝病患者肝功能儲(chǔ)備及預(yù)后的評(píng)分系統(tǒng)中,MELD評(píng)分對(duì)終末期肝病患者TIPS術(shù)后的病死率具備良好的預(yù)測(cè)能力[18]。本研究通過(guò)對(duì)比術(shù)前資料發(fā)現(xiàn),兩組患者術(shù)前MELD評(píng)分、HVPG有明顯差異(P值均<0.05),進(jìn)一步單因素及多因素logistic回歸分析顯示,MELD評(píng)分及HVPG是TIPS術(shù)后發(fā)生HE的危險(xiǎn)因素。對(duì)不同病因、不同病情的肝硬化患者3個(gè)月、半年、1年的生存率進(jìn)行了大規(guī)模的統(tǒng)計(jì)分析,證實(shí)MELD評(píng)分對(duì)終末期肝病患者生存率的預(yù)測(cè)是有效的[19-20],多因素分析顯示Child-Pugh評(píng)分及術(shù)前隱性HE均與術(shù)后HE呈獨(dú)立相關(guān)[21]。既往研究[3]顯示HVPG對(duì)肝硬化分期、相關(guān)并發(fā)癥治療預(yù)后均有指導(dǎo)意義,嚴(yán)重門靜脈高壓者,尤其是已出現(xiàn)食管胃底靜脈曲張破裂出血,處于失代償期,HVPG是預(yù)測(cè)失代償期肝硬化患者長(zhǎng)期病死率的良好指標(biāo)[22]。研究[23]顯示,當(dāng)HVPG下降至12 mm Hg或者較基線至少下降20%后,可顯著降低門靜脈高壓性出血發(fā)生。有研究[24]顯示TIPS術(shù)后門靜脈壓力梯度下降60%是術(shù)后HE發(fā)生的預(yù)測(cè)指標(biāo),TIPS術(shù)后門靜脈壓應(yīng)該高于5 mm Hg,若低于此值,會(huì)增加HE發(fā)生率[25]。故而推測(cè)TIPS術(shù)后發(fā)生HE患者,患者肝功能儲(chǔ)備已嚴(yán)重下降,當(dāng)支架植入分流發(fā)生后,為達(dá)到治療目的,HVPG越高,肝臟儲(chǔ)備功能越差,HE發(fā)生風(fēng)險(xiǎn)也越高,預(yù)后亦越差。
綜上所述,失代償期肝硬化合并食管胃底靜脈曲張是常見并發(fā)癥,也是嚴(yán)重并發(fā)癥,TIPS是一種有效且廣泛使用的食管胃底靜脈曲張破裂出血挽救性治療方法,HE是術(shù)后常見的并發(fā)癥,該術(shù)后并發(fā)癥預(yù)測(cè)一直是難點(diǎn)和重點(diǎn),本研究中發(fā)現(xiàn)MELD評(píng)分及HVPG均是良好的預(yù)測(cè)指標(biāo),為臨床術(shù)前優(yōu)選患者提供幫助。

