三種多酚與牛血清蛋白相互作用的初步研究
李慶舒,程琳,鄧紅,張忠,袁莉
(陜西師范大學 食品工程與營養科學學院,陜西 西安,710119)
多酚類化合物是一類苯環上連接多羥基基團結構的天然產物的總稱[1],在植物界中大量存在。多種研究表明,多酚類化合物具有抗氧化、抗變應性、抗菌、抗炎、抗腫瘤、抗糖尿病、抗病毒等一系列生理活性[2],對人體健康有多種益處[3-4]。經研究證實,多酚類化合物中多羥基結構能結合蛋白質、多糖、金屬、微生物、生物堿等多種物質[5-7],通過結合改變其功能性質,從而被廣泛應用于醫藥研究、食品生產、皮革生產、油田化學等研究領域[8]。近年來,多酚與蛋白質的相互作用是多酚化學以及食品化學的核心內容,已有研究發現,多酚與蛋白質的相互作用方式主要包括二硫鍵、疏水相互作用、氫鍵等,相互作用使得多酚與蛋白質都會發生不同程度的結構改變,從而導致多酚生物可利用性、蛋白質功能特性等的改變[9],對兩者在更多領域的應用提供了新的思路和理論基礎。
血清白蛋白是體內的載體蛋白,多酚等生物小分子被人體攝入后, 首先與蛋白結合, 然后再發揮作用[10-11]。因此,了解多酚與蛋白的相互作用對更好發揮兩者的生理活性有著重要意義[12]。近年來,已有多種研究表明,茶多酚能與大豆分離蛋白相結合,從而改善大豆分離蛋白的起泡性與乳化性[13];姜黃素可與血清白蛋白結合從而應用于臨床藥物配制[14];花青素與蛋白質分子結合,可有效減緩自身氧化進程,增加自身穩定性[15]。
異葒草素(isoorientin, ISO),由于從葒草中分離得到而命名,別名為3’,4’,5, 7-四羥基-6-C-吡喃葡萄糖基多酚或木犀草素葡萄糖苷[16],是一種水溶性多酚類物質,存在于山楂、竹茹、葫蘆果、蕎麥芽、黃荊和竹葉[17-18]、滿天星等多種植物中。異葒草素還具有多種生理功效,如:通過清除自由基來抵抗氧化損傷,治療糖尿病[19],抑制炎性疾病,抗腫瘤,抗病毒[20]。
安石榴苷(punicalagin)可從石榴的皮里提取,這種活性成分對人體有諸多益處,例如:抗氧化[21]、抗炎、抗菌等[22]。安石榴苷可在人體內被分解為鞣花酸,鞣花酸具有良好的抗氧化性,另外,鞣花酸(ellagic acid, EA)是一種多酚二內酯,具有抗氧化的作用,以及具有抗變異原性、抑制癌細胞增值的作用[23]。
目前,雖然異葒草素、安石榴苷以及鞣花酸均由于其優良的功能活性而引起學者們廣泛的興趣,但是,并沒有此3種多酚與BSA相互作用的研究。因此,本實驗采用熒光光譜法、同步熒光光譜法、圓二色譜法等多種測量方法,通過計算猝滅常數、結合常數、結合位點和熱力學參數來判斷猝滅類型、作用力類型,研究異葒草素、安石榴苷、鞣花酸與BSA的結合,為更深入研究多酚類物質的體內代謝和轉運提供有價值的信息。
1 材料與方法
1.1 材料與試劑
鞣花酸、異葒草素、安石榴苷牛血清蛋白(純度≥97%),上海永恒生物技術有限公司;多酚儲備液:稱取一定量的多酚,溶解于甲醇溶液并定容,配制成1.0×10 mmol/L的儲備液,置于4 ℃冰箱避光保存,使用時按需要稀釋;BSA儲備液:稱取一定量的BSA,溶于PBS緩沖液中并定容,配制成0.01 mmol/L的母液,并添加終濃度為0.1 mol/L的NaCl 以維持離子強度;PBS(磷酸鹽緩沖液):將PBS粉末溶于水中并定容,用酸度計調節pH至7.4,121 ℃高壓蒸汽滅菌30 min,室溫保存備用。
1.2 儀器與設備
電子分析天平(BS 224 S),賽多利斯科學儀器(北京)有限公司;紫外分光光度計(UV300),上海儀邁儀器科技有限公司;電熱恒溫水浴鍋(HH-S4),北京科偉永興儀器有限公司;熒光分光光度計(RF-6000),島津企業;紅外光譜儀(Tensor27),德國布魯克公司;圓二色譜儀(Chirascan),英國應用光物理公司;熒光分光光度計(RF-7000),島津企業。
1.3 實驗方法
1.3.1 紫外光譜法測定多酚與BSA的相互作用
取3組10 mL離心管,在離心管中分別加入BSA和不同體積的多酚稀釋溶液, 最后以PBS緩沖溶液定容,使多酚的終濃度分別為0、2、3、4 μmol/L,BSA終濃度為1 μmol/L。充分混勻后,將混合溶液置于25 ℃下恒溫水浴20 min,掃描范圍:200~450 nm。
1.3.2 熒光光譜法測定多酚與BSA的相互作用
在10 mL離心管中分別加入BSA和不同體積的多酚稀釋液,以PBS緩沖溶液定容,使多酚的終濃度分別為0、2、3、4、5、6、7、8、9和10 μmol/L,BSA終濃度為1 μmol/L。每種多酚配制2組溶液,充分混勻后,將第1組混合溶液于0 ℃恒溫水浴20 min,將第2組混合溶液于25 ℃恒溫水浴20 min,3種多酚的處理方法均是如此。多酚和BSA的檢測條件如下:激發波長為285 nm,激發和發射光譜狹縫寬度均為10 nm, 掃描范圍:300~450 nm的發射光譜。
1.3.3 圓二色光譜法測定多酚與BSA的相互作用
取3支10 mL的離心管,在離心管中分別添加 BSA溶液中和不同體積的稀釋過的多酚溶液,使多酚溶液的終濃度分別為0、1、10 μmol/L,BSA終濃度為1.0×10 μmol/L,混合充分后靜置20 min。以相應空白溶液為參比,3種多酚的處理方法均是如此,它們的測量條件如下:分辨率1 nm,狹縫1 nm,步長1 nm,靈敏度為5 m°/cm。
1.3.4 紅外光譜法測定多酚與BSA的相互作用
于10 mL離心管中,分別配制1 μmol/L的BSA溶液、10 μmol/L的多酚溶液,以及BSA多酚混合溶液,使混合溶液的BSA終濃度為1 μmol/L、多酚終濃度為10 μmol/L,室溫下靜置20 min,以KBr為空白,利用液膜法分別記錄以上溶液的紅外光譜,分辨率為4 cm-1,采集范圍為1 000~2 000 cm-1,3種多酚的處理方法相同。
1.3.5 同步熒光法測定多酚與BSA的相互作用
BSA和多酚溶液作用的處理方法同1.3.2,測量時需設置激發波長為285 nm,Δλ分別為15和60 nm,激發光譜和發射光譜狹縫寬度均為10 nm,掃描范圍:300~450 nm。
2 結果與分析
2.1 紫外光譜法研究3種多酚與BSA的相互作用
蛋白質的色氨酸和酪氨酸殘基約在280 nm具有吸收峰,蛋白質與小分子物質結合后構象發生改變,可用紫外光譜法研究小分子與BSA如何相互作用[24]。
本試驗固定BSA的濃度,觀察不同濃度多酚與BSA的紫外吸收光譜,結果如圖1所示。隨著異葒草素濃度的增加,BSA的吸收峰分別從273 nm移至267 nm,發生藍移,隨著安石榴苷、鞣花酸濃度的增加,BSA的吸收峰分別從273 nm移至275和274 nm,有微弱紅移,說明3種多酚都改變了BSA的構象。因為動態猝滅不改變蛋白質的吸收光譜,而靜態猝滅可以改變[25]。因此,結果說明異葒草素、安石榴苷、鞣花酸與BSA相互作用后形成了新的復合物,改變了BSA的吸收光譜,且異葒草素、安石榴苷、鞣花酸對BSA的熒光猝滅為靜態猝滅。

a-異葒草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA圖1 異葒草素、安石榴苷、鞣花酸與BSA結合的紫外光譜圖Fig.1 Ultraviolet-visible spectrum of interaction between isoorientin, punicalagin, ellagic acid and BSA
2.2 熒光光譜法研究3種多酚與BSA的相互作用
蛋白質分子中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)3種芳香族氨基酸殘基能夠吸收紫外光并發射熒光,當發生分子相互作用、激發態反應、分子重排、能量轉移、形成基態復合物以及碰撞猝滅時,熒光發色團的熒光強度下降,因此,研究小分子物質與蛋白質之間的相互作用時常用熒光光譜法[26]。本研究對一系列含有相同濃度BSA和不同濃度多酚的溶液進行熒光光譜測定,結果如圖2所示。BSA溶液在約340 nm處有一發射峰,但隨著多酚濃度的增加,BSA發射峰的熒光強度在0 ℃和25 ℃兩種處理溫度下均呈現降低的趨勢,這種熒光猝滅現象,說明3種多酚和BSA均發生相互作用,并形成弱熒光的多酚-BSA復合物。
2.2.1 猝滅類型的確定
靜態猝滅和動態猝滅2種猝滅機制是多酚等小分子物質和蛋白質的主要猝滅機制,二者的區別在于對溫度和黏度的依賴性不同。靜態猝滅是指多酚與BSA形成無熒光或弱熒光的復合物而導致的,猝滅常數隨著溫度的升高而降低;而動態猝滅是多酚和蛋白質分子之間相互碰撞引起的,猝滅常數隨著溫度升高而增大。分析多酚等小分子物質和蛋白質的熒光猝滅機制時采用Stern-Volmer方程[27]:
F0/F=1+KsvQ=1+Kqτ0Q
(1)
式中:F0和F,代表異葒草素等多酚不存在時和濃度為Q時BSA的熒光強度;Ksv,動態猝滅常數;Q,多酚的濃度;Kq,猝滅速率常數;τ0,猝滅劑不存在時生物大分子的平均壽命,約為10-8s[28]。
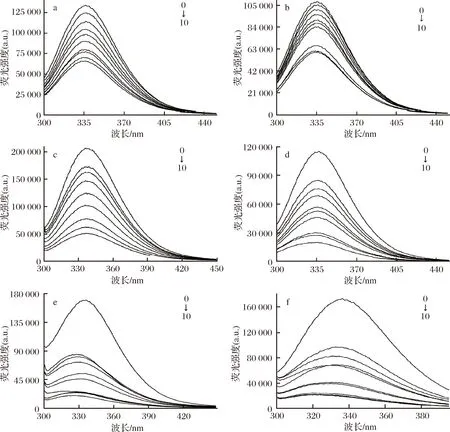
a-異葒草素+BSA(0 ℃);b-異葒草素+BSA(25 ℃); c-安石榴苷+BSA(0 ℃);d-安石榴苷+BSA(25 ℃)e-鞣花酸+BSA(0 ℃);f-鞣花酸+BSA(25 ℃)圖2 三種多酚與牛血清蛋白結合的熒光光譜圖Fig.2 Fluorescence spectra of three polyphenols combined with BSA注:多酚濃度從0到10依次為0、2、3、4、5、6、7、8、9、10 μmol/L,BSA濃度為1 μmol/L
根據數據繪制不同溫度、不同多酚條件下的Stern-Volmer圖,如圖3所示。
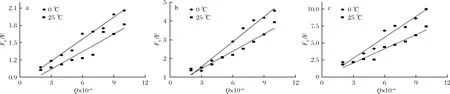
a-異葒草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA圖3 0、25℃下3種多酚和牛血清蛋白相互作用的Stern-Volmer圖Fig.3 Stern-Volmer figures of three polyphenols under 0,25 ℃ and bovine serum albumin interaction
由圖3可見,在3種多酚作用范圍內的曲線具有良好的線性關系。由表1可見,隨著處理溫度的升高,Ksv值卻隨之下降,提示3種多酚和BSA相互作用的猝滅機制可能均是靜態猝滅而不是動態猝滅。另外,各類猝滅劑對生物大分子的最大擴散碰撞猝滅常數2.0×1010mol/(L·s)[29],而表1顯示,0和25 ℃下BSA的猝滅速率常數Kq分別為3.590×1012、1.277×1012、22.241×1012、18.244×1012、58.421×1012和40.605 ×1012L/(mol·s),均遠高于2.0×1010mol/(L·s)。該結果進一步揭示,異葒草素、安石榴苷以及鞣花酸對BSA的熒光猝滅均是靜態猝滅。
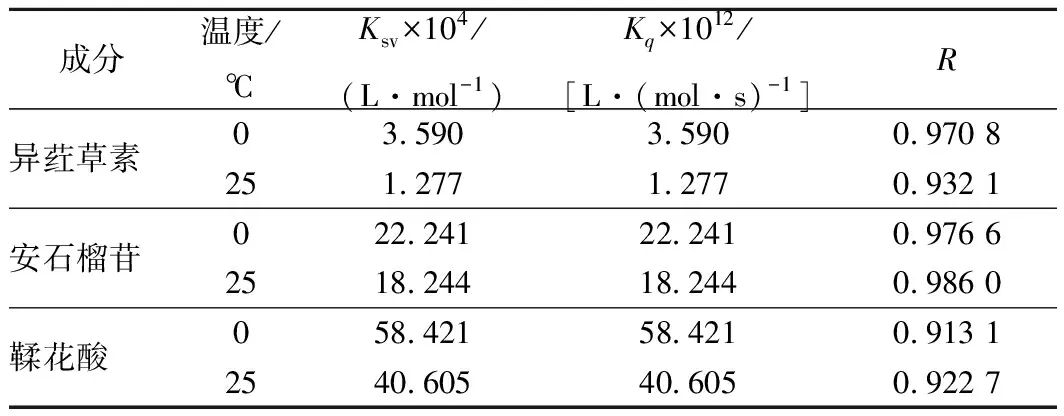
表1 三種多酚和牛血清白蛋白相互作用的Stern-Volmer猝滅常數Table 1 Stern-Volmer quenching constants for theinteraction of ISO, punicalagin, EA with BSA
2.2.2 結合常數和結合位點的計算
上述結果表明異葒草素、安石榴苷、鞣花酸與牛血清蛋白的相互作用機制為靜態猝滅,靜態猝滅現象符合雙對數公式,可通過雙對數公式進一步來分析靜態猝滅:
lg[(F0-F)/F]=lgKa+nlgQ
(2)
式中:Ka,結合常數,n結合位點數[30]。
根據數據繪制雙對數圖,如圖4所示。Ka和n值分別通過圖4中曲線的截距和斜率計算,表2為不同處理溫度下的Ka和n值。由表2可知,異葒草素與BSA的結合位點n接近2,說明在實驗濃度下,它與BSA的結合比例約為 2∶1,安石榴苷、鞣花酸與BSA的結合位點n均接近1,并且幾乎不受溫度的影響,它們與BSA的結合比例約為 1∶1,并且3種多酚與牛血清蛋白作用的結合常數Ka值以108為數量級,均遠大于104數量級,說明異葒草素、安石榴苷、鞣花酸與牛血清蛋白之間均具有較強的結合作用。
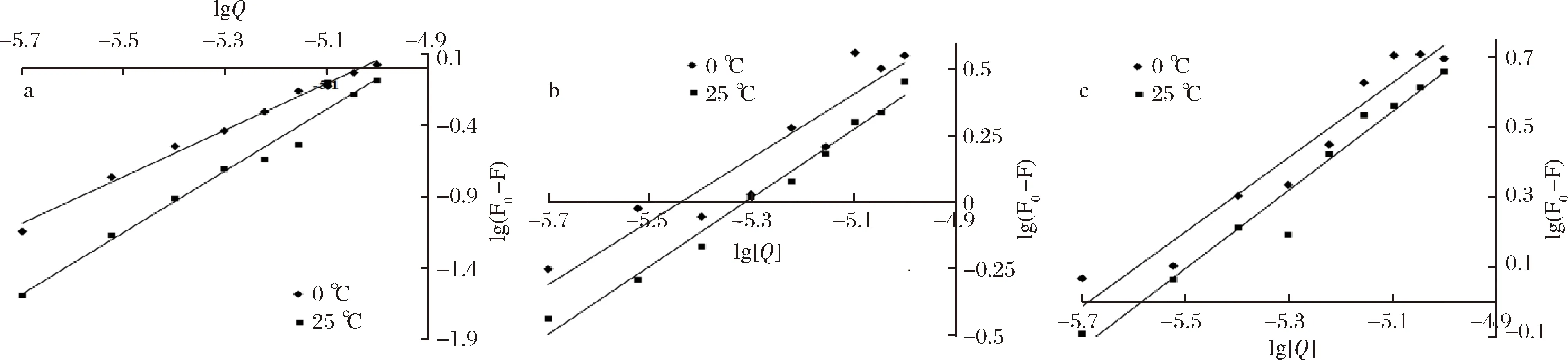
a-異葒草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA圖4 0、25 ℃下3種多酚和牛血清蛋白相互作用的雙對數圖Fig.4 Double logarithmic figures of three polyphenols under 0,25 ℃ and bovine serumalbumin interaction
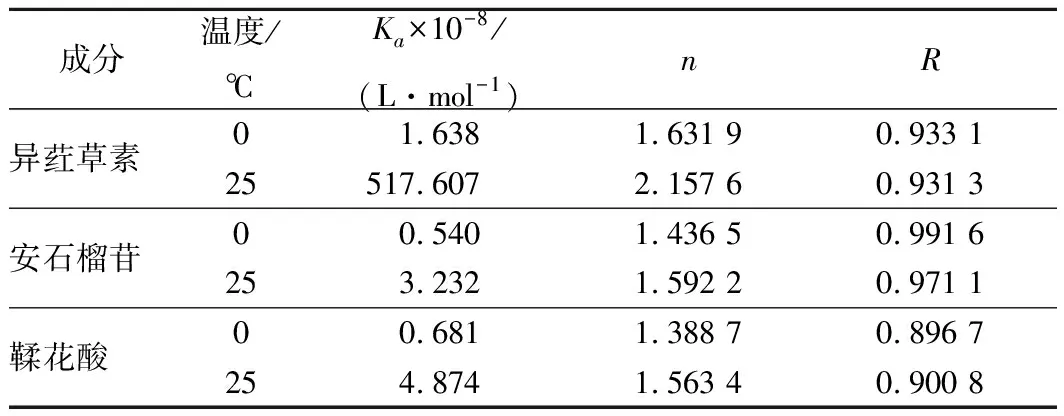
表2 多酚與牛血清白蛋白相互作用的結合常數和結合位點Table 2 Binding constants and binding sites for theinteraction of ISO,punicalagin, EA with BSA
2.2.3 熱力學參數和作用力類型的計算
多酚等小分子物質與蛋白質結合反應的作用力類型主要由自由能變、焓變和熵變等熱力學參數來確定。熱力學參數自由能變(ΔG)、焓變(ΔH)和熵變(ΔS)可通過公式(3)、公式(4)進行計算:
(3)
ΔG=ΔH-TΔS=-RTlnKa
(4)
式中:T1溫度下的結合常數為Ka1;T2溫度下的結合常數為Ka2;R為氣體常數。
由公式(3)、(4)可求出ΔG、ΔH和ΔS,根據數據繪制表3。
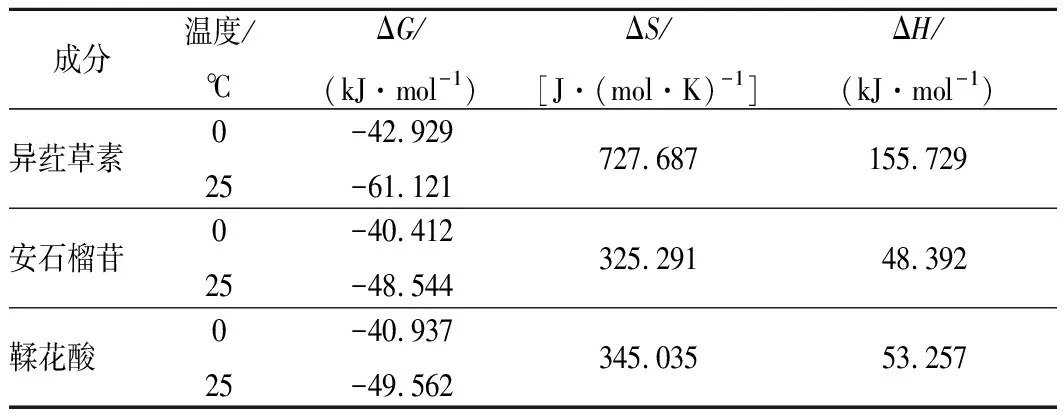
表3 多酚與牛血清白蛋白相互作用的熱力學參數Table 3 Thermodynamic parameters for the interactionof ISO, punicalagin, EA with BSA
研究表明[13],當ΔH>0且ΔS>0時主要作用力為疏水作用力;當ΔH<0且ΔS>0時靜電引力起主要作用;當ΔH<0且ΔS<0時氫鍵和范德華力起主要作用[31-32]。
由表3可見,在同一溫度下,ΔG值由小到大的多酚依次為異葒草素、鞣花酸、安石榴苷;不同溫度下ΔG均小于0,表明異葒草素、安石榴苷、鞣花酸與BSA之間的相互作用均是自發進行的;3種多酚與BSA相互作用的ΔH和ΔS均為正值,提示此3種多酚與BSA之間的結合主要是吸熱和熵驅動的反應,并且主要作用力為疏水作用力。
2.3 圓二色譜法研究3種多酚與BSA的相互作用
圓二色譜常用于研究多酚等小分子與蛋白質相互作用。BSA的紫外區段(190~240 nm)圓二色譜反映了主鏈構象[33]。從圖5可以看出,BSA中加入不同濃度的異葒草素、安石榴苷、鞣花酸后,BSA在208 nm和222 nm 處吸收峰的振幅有不同程度的增大,但兩處負吸收峰的形狀和波峰位置均未發生明顯變化。說明異葒草素、安石榴苷、鞣花酸與BSA的相互作用均可導致BSA結構發生變化。
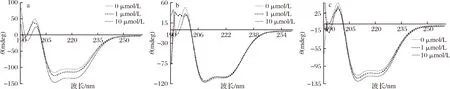
a-異葒草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA圖5 三種多酚分別與BSA相互作用的圓二色譜圖Fig.5 Circular dichroism spectra of three polyphenols interacting with BSA, respectively注:多酚濃度依次為0、1、10 μmol/L,BSA濃度為1 μmol/L
2.4 紅外光譜研究3種多酚與BSA的相互作用


a-異葒草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA圖6 三種多酚與BSA相互作用的紅外光譜圖Fig.6 FTIP spectrum of three polyphenols interacting with BSA注:多酚濃度為10 μmol/L,BSA濃度為1 μmol/L
由圖6可以看出,異葒草素與BSA結合后,酰胺Ⅰ帶的峰位置由1 684 cm-1紅移至1 686 cm-1,酰胺Ⅱ帶的峰位置由1 572 cm-1紅移至1 574 cm-1;安石榴苷與BSA結合后,酰胺Ⅰ帶的峰位置由1 661 cm-1藍移至1 659 cm-1,酰胺Ⅱ帶的峰位置由1 531 cm-1藍移至1 529 cm-1;鞣花酸與BSA結合后,酰胺Ⅰ帶的峰位置由1 661 cm-1藍移至1 657 cm-1,酰胺Ⅱ帶的峰位置由1 531cm-1藍移至1 529cm-1。上述酰胺帶峰位置的變化說明多酚與BSA發生相互作用,導致BSA構象的改變。
2.5 同步熒光光譜法研究3種多酚與BSA的相互作用
BSA的構象和發色團微環境的變化可以通過同步熒光光譜來反映。當激發和發射波長差Δλ分別為15、60 nm時,分別表示的是酪氨酸(Tyr)、色氨酸(Trp)殘基的熒光特征。同時,最大發射波長向長波方向或者短波方向移動,即紅移或者藍移,說明氨基酸殘基周圍微環境極性增強或疏水性增強[35]。
根據數據繪制異葒草素等多酚與BSA的同步熒光光譜圖,如圖7所示。由圖7可見,隨著異葒草素、安石榴苷、鞣花酸濃度的增大,Tyr和Trp殘基的熒光強度均有不同程度的下降。加入異葒草素后,Δλ為15 nm的這組最大發射波長從 285 nm移至286 nm,Δλ為60 nm的這組最大發射波長沒有發生明顯改變,說明異葒草素更接近Tyr 殘基,并導致Tyr殘基周圍極性增加,疏水性降低;加入安石榴苷、鞣花酸后,Tyr殘基的最大發射波長沒有發生明顯改變,說明其對Tyr殘基的影響不大,Trp殘基的最大發射波長分別從278 nm移至281 nm、280 nm移至281nm,發生微弱紅移,表明安石榴苷、鞣花酸更接近于Trp殘基,并導致Trp殘基周圍極性增加,疏水性降低。本試驗結果表明,與3種多酚結合后BSA的構象發生了變化。
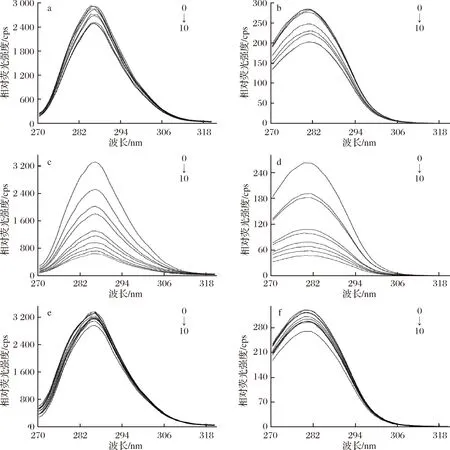
a-BSA+異葒草素(Δλ=15 nm); b-BSA+異葒草素(Δλ=60 nm); c-BSA+安石榴苷(Δλ=15 nm);d-BSA+安石榴苷(Δλ=60 nm); e-BSA+鞣花酸(Δλ=15 nm); f-BSA+鞣花酸(Δλ=60 nm)圖7 三種多酚BSA相互作用的同步熒光光譜Fig.7 Synchronous fluorescence spectra of three polyphenols interacting with BSA注:多酚濃度從0到10依次為0、2、3、4、5、6、7、8、9、10 μmol/L,BSA濃度為1 μmol/L
3 結論
(1)異葒草素、安石榴苷、鞣花酸均可與BSA結合導致熒光猝滅,猝滅過程以靜態猝滅為主;3種多酚與BSA相互作用后,蛋白質的二級結構發生改變。
(2)異葒草素與BSA的結合比例約為 2∶1;安石榴苷、鞣花酸與BSA的結合比例約為 1∶1。
(3)異葒草素、安石榴苷、鞣花酸與BSA之間的相互作用均是自發進行的,3種多酚與BSA之間的結合主要是吸熱和熵驅動的反應,并且主要作用力可初步確定為疏水作用力。
(4)異葒草素使BSA的酪氨酸殘基周圍極性稍有增加,使得疏水性有降低的趨勢;而安石榴苷、鞣花酸使BSA的色氨酸殘基周圍極性稍有增加,且疏水性有降低的趨勢。

