miR-143-3p靶向TREM1基因對狼瘡性腎炎小鼠腎小球系膜細胞炎性因子分泌及凋亡的調控機制
羅慧臣 胡丹慧 張 濟
(南華大學附屬第一醫院風濕免疫科,衡陽 421001)
系統性紅斑狼瘡是臨床上常見的一種由遺傳、免疫反應、激素、感染等因素共同作用的自身免疫性疾病[1]。狼瘡腎炎(lupus nephritis,LN)是系統性紅斑狼瘡患者常見的并發癥之一,也是引起患者殘疾和死亡的重要因素[2]。LN常見的病理特征包括腎小球系膜細胞炎性因子的過度分泌、細胞增殖不斷增加等[3]。因此探究LN中炎性因子的變化以及可能對其進行調控的途徑對于明確LN的發病以及LN的治療均具有重要意義。
髓細胞觸發受體1基因(triggering receptor expressed by myeloid cells-1,TREM1)是多核細胞中的炎性受體,其能夠向細胞內激活接頭發出信號進而作用于下游通路[4]。TREM1也被稱為炎性因子的放大器,在慢性炎癥性腸炎等炎癥疾病患者血清中表達顯著提高[5]。也有研究證實TREM1在類風濕性關節炎的發病中發揮重要作用[6]。此外,中科院北京基因組研究所發現,TREM1的同源基因,TREML2可能對自身免疫性疾病的發病具有遺傳影響[7]。個體免疫系統失調往往導致炎性反應,而炎癥體在自身免疫性疾病中也發揮重要作用。miR-143經以往研究證實能夠對多種炎癥反應進行調節,如Pekow等[8]發現,miR-143在潰瘍性結腸炎中表達被顯著下調,miR-143的缺失能夠促進慢性炎癥的進展。也有研究證實,miR-143能夠靶向ATG2B進而抑制克羅恩病中自噬和炎癥反應[9]。本研究旨在探討miR-143-3p靶向TREM1基因在狼瘡性腎炎小鼠腎系膜細胞炎性因子分泌以及細胞凋亡中的作用并探討其調節機制。
1 材料與方法
1.1材料 雄性MRL/faslpr小鼠及MRL/MPJ小鼠購自南京大學模式動物研究所;pcDNA3.1(+)質粒購自Addgene;高糖DMEM培養基購自北京索萊寶;所有抗體均購自ABCAM;熒光素酶試劑盒購自美國BioVision;Lipofectamin 3000試劑盒、CCK-8試劑盒、Annexin-V-FITC/PI細胞凋亡檢測試劑盒購自美國賽默飛世爾;細胞裂解液、BCA試劑盒購自北京奧維亞生物技術有限公司;CytomicsTMFC 500流式細胞儀購自德國貝克曼;HBS-1096A酶標儀購自南京德鐵實驗設備有限公司;KH-FL20E液相色譜熒光檢測器購自上海科哲生化科技有限公司;FRD-4C倒置顯微鏡購自北京世紀科信科學儀器有限公司。
1.2方法
1.2.1TREM1沉默載體構建 在NCBI的Nucleotide上獲取小鼠TREM1的1號轉錄本全長序列(NM_021406.5),隨后在BLOCK-iTTMRNAi Designer(http://rnaidesigner.thermofisher.com/rna-iexpress/)設計1對shRNA序列(5′-CACCGCCA-GACTTTGACAGTGAAGTCGAAACTTCACTGTCAAAG-TCTGGC-3′)及1對陰性對照序列(5′-CCGGCCTAA-GGTTAAGTCGCCCTCCTCGAGGAGGGCGACTTAAC-CTTAGGTTTTTG-3′),隨后交由華大基因合成并在兩端分別添加EcoRⅠ和BamHⅠ酶切位點。質粒pcDNA3.1(+)用EcoRⅠ和BamHⅠ酶切并回收大片段。取適量合成序列與大片段用T4 DNA連接酶連接過夜,溫度4℃。隨后轉化至DH5α大腸桿菌中進行克隆,使用氨芐青霉素進行抗性菌落的篩選。經瓊脂糖凝膠電泳鑒定后,采用DNA大量抽提試劑盒提取大腸桿菌中重組載體,凍存備用。
1.2.2腎小球系膜細胞分離純化 雄性MRL/faslpr小鼠15只(狼瘡性腎炎模型組)及健康雄性MRL/MPJ小鼠5只(正常對照組)購自南京大學模式動物研究所,周齡11~12周,體重18~22 g,于SPF級動物房適應性喂養1周,小鼠自由進食、飲水,飼養條件:相對溫度(20±2)℃,相對濕度(50±2)%,陰暗和光照各12 h。每周收集24 h尿量,以尿八聯試紙測定尿蛋白,濃度大于0.1~1 mg/L提示狼瘡性腎炎發病[10]。發病小鼠和正常小鼠均腹腔注射1%戊巴比妥鈉(60 mg/kg)溶液進行麻醉后處死。無菌收集小鼠兩側腎臟及外周血,隨后將發病小鼠剝離腎皮質剪成1 mm × 1 mm的碎末并使用1 mg/ml膠原酶37℃水浴消化30 min。之后培養基終止消化;研磨消化產物后收集過篩液體并在4℃下1 000 r/min離心5 min。棄上清,加入含FBS的高糖DMEM培養基重懸腎小球細胞液。37℃,5%CO2條件下用Ⅰ型膠原蛋白包被過的培養皿孵育2 d。待培養皿中細胞匯合度為70%時,2.5 g/L胰酶消化2 min,隨后迅速加入適量完全培養基終止消化,重復多次輕輕吹打細胞使其懸浮,之后置于37℃,5%CO2條件下繼續培養。每隔36 h換液傳代,傳至4~6次即可得純化的腎小球系膜細胞。本研究所有動物實驗均經我院動物倫理委員會審批同意。
1.2.3免疫組化染色 制備發病及正常小鼠腎臟組織的石蠟切片,隨后在60℃烘烤2 h,常規二甲苯脫蠟,梯度酒精脫水,PBS洗滌4次,每次2 min;高壓抗原修復2 min,在pH6.0的0.01 mol/L檸檬酸緩沖液中浸泡3 h,水浴30 min;將切片浸泡于3%的雙氧水溶液中15 min從而阻斷外源過氧化物酶活性;室溫下山羊血清封閉15 min,再與一抗TREM1在4℃條件下孵育過夜;PBS洗滌3次,每次2 min,室溫下加入二抗IgG孵育30 min;反應產物用DAB顯色3 min,再用流水沖洗3次,蘇木素復染20 s,流水沖洗多余染液;梯度酒精脫水,二甲苯透明,中性樹脂封片,顯微鏡下觀察。對組織染色強度(SI)及陽性細胞率(PP)進行評分。SI分為4級:0分為無色,1分為淡黃色,2分為棕黃色,3分為棕褐色。PP分為5級:0分為無陽性細胞<5%,1分為陽性細胞5%~25%,2級為25%~50%,3級為51%~75%,4級為>75%。綜合評分為SI與PP乘積,0為陰性,1分為弱陽性(+),2分為中陽性(++),大于3分為強陽性(+++)[11]。
1.2.4雙熒光素酶驗證miR-143-3p與TREM1靶向關系 借助Targetscan靶向關系預測網站(http://www.targetscan.org/mamm_31/)預測miR-143-3p與TREM1的結合位點,雙酶切將TREM1的3′UTR 片段克隆到熒光素酶報告基因pmirGLO上游,命名為TREM1-3′UTR-WT。挑菌、測序后提純質粒備用。對miR-143-3p與TREM1的結合位點進行定點突變,構建TREM1-3′UTR-MUT突變載體。依據LipofectamineTM3000說明書,將miR-143-3p mimic和mimic NC分別與TREM1-3′UTR-WT及TREM1-3′UTR-MUT兩兩共轉染至293T細胞。轉染后4 h換液,在37℃、5%CO2的培養箱中培養48 h 后,收獲細胞。按照Promega公司雙熒光素酶報告基因試劑盒說明書中的要求,借助化學發光檢測儀對熒光素酶活性進行檢測。熒光素酶活性=螢火蟲熒光素酶活性/海腎熒光素酶活性。
1.2.5系膜細胞轉染及分組 將狼瘡性腎炎小鼠腎小球系膜細胞分為如下幾組:mimic NC組(細胞轉染含mimic NC的脂質體)、miR-143-3p mimic組(細胞轉染含miR-143-3p mimic的脂質體)、sh-TREM1組(細胞轉染含TREM1 shRNA質粒的脂質體)、sh-NC組(細胞轉染含shRNA NC質粒的脂質體)、miR-143-3p mimic+sh-TREM1組(細胞共轉染含TREM1 shRNA和miR-143-3p mimic的脂質體)
轉染方式:將處于對數生長期的腎小球系膜細胞接種至6孔板,待細胞密度50%左右時依據Lipofectamin 3000說明書對細胞進行轉染。首先使用250 μl不含血清培養基Opti-MEM分別稀釋100 pmol miR-143-3p mimic(終濃度50 nmol/L)以及5 μl Lipofectamin 3000,混勻后室溫孵育5 min,之后將以上混合物再次混合在一起,孵育20 min后加入細胞培養孔,5%CO2培養6~8 h,更換完全培養基培養24~48 h,進行后續實驗。
1.2.6Western blot檢測系膜細胞釋放的炎性因子 于各組系膜細胞中加入1 ml細胞裂解液(裂解液組成:50 mmol/L Tris、150 mmol/L NaCl、5 mmol/L EDTA、0.1%SDS、1%NP-40、5 μg/ml Aprotinin、2 mmol/L PMSF),之后將其置冰浴上研成勻漿,加入蛋白裂解液,于4℃條件下裂解30 min,每隔10 min 振搖一次。4℃,12 000 r/min離心20 min,棄除脂層,取上清液采用BCA試劑盒測定每個樣品的蛋白濃度,去離子水調整上樣量為30 μg蛋白/泳道。配制10%SDS分離膠與濃縮膠。樣品與上樣緩沖液混合,100℃煮沸5 min,冰浴、離心后用微量加樣器等量加入各泳道進行電泳分離,再將凝膠上的蛋白轉移至硝酸纖維素膜上。5%脫脂奶粉4℃封閉硝酸纖維素膜過夜。加入稀釋的一抗核因子κB p65(nuclear factor kappa-B p65,NF-κB p65)、腫瘤壞死因子α(tumor necrosis factorα,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)、單核細胞趨化蛋白1(monocyte chemoattractant protein 1,MCP-1)或TREM1孵育過夜,室溫下PBS 洗滌3次,每次5 min。滴加HRP標記的IgG二抗37℃振蕩孵育1 h。室溫下PBS緩沖液洗滌3次,每次5 min。膜與ECL液在室溫下反應1 min。吸去液體,覆蓋保鮮膜,拍攝X光片,觀察結果。以GAPDH為內參,以目標條帶與內參條帶的灰度值之比作為蛋白質的相對表達量。
1.2.7CCK8測定系膜細胞活力 轉染后細胞生長密度達到80%左右,PBS沖洗2遍,使用濃度為0.25%的胰酶消化細胞,之后將細胞懸液以4×103個/孔的密度接種至96孔板,各孔體積0.2 ml,每組設置6個復孔,分別在培養至24 h、48 h、72 h時取出培養板并加入含10%CCK8溶液(5 g/L)的培養基,繼續培養4 h。吸取上清后每孔加入100 μl二甲基亞砜,振蕩混勻使其充分溶解活細胞產生的甲瓚晶體。之后使用酶標儀對各孔490 nm處吸光度值進行檢測并繪制細胞活力曲線,橫坐標為時間點,縱坐標為OD值。
1.2.8PI單染法檢測系膜細胞周期 各組細胞轉染48 h后,0.25%胰酶消化細胞,1 000 r/min離心 5 min棄上清,冷PBS洗滌細胞3次,離心棄上清,PBS重懸細胞,調整其濃度在1×104ml-1左右。將2 ml 濃度為75%的乙醇置于-20℃預冷,之后用于固定細胞,4℃條件下固定30 min,離心后棄乙醇,PBS沖洗,之后加入100 μl RNase A,在37℃、避光條件下水浴30 min,加入400 μl PI染液,混勻后置于4℃避光條件下30 min,流式細胞儀記錄激發波長在488 nm處紅色熒光以檢測細胞周期。
1.2.9Annexin-V FITC/PI雙染檢測系膜細胞凋亡 細胞轉染48 h后,使用0.25%不含EDTA的胰酶消化細胞,1 000 r/min離心5 min,調整細胞濃度在1×104ml-1,取1 ml細胞懸液,離心后棄上清。冷PBS沖洗,再次離心棄上清。依據Annexin-V-FITC/PI試劑盒說明書,將Annexin-V-FITC、PI、HEPES緩沖液按照1∶2∶50的比例混勻配制Annexin-V-FITC/PI染液。100 μl染液重懸1×106個細胞,振蕩混勻后室溫孵育15 min。以488 nm波長激發515 nm、620 nm濾光片分別檢測FITC、PI熒光從而檢測細胞凋亡情況。左上象限代表細胞收集過程中的損傷細胞,左下象限代表正常細胞,右上象限為晚期凋亡細胞和壞死細胞,右下象限為早期凋亡細胞。
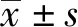
2 結果
2.1光鏡下觀察腎系膜細胞 倒置顯微鏡下觀察分離純化后傳至5代的腎系膜細胞,可見細胞體積較大,多為多角形或梭形,胞質多突起,細胞核位于中央,多呈圓形或橢圓形。見圖1。
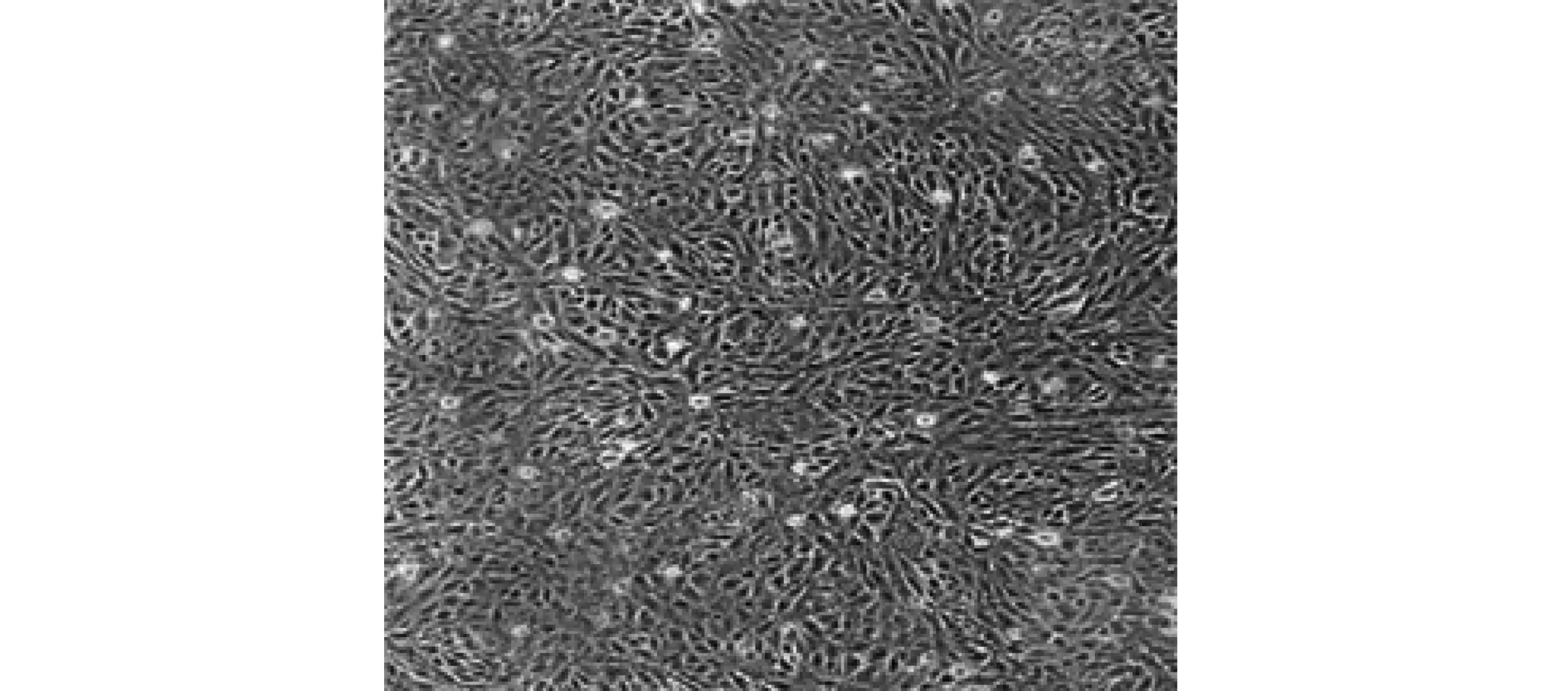
圖1 光鏡下觀察腎系膜細胞(×100)Fig.1 Mesangial cells were detected under optical microscope(×100)
2.2免疫組化染色結果 免疫組化染色檢測狼瘡性腎炎小鼠及正常對照腎組織中TREM1的表達。結果顯示:TREM1主要表達于細胞核中。與正常小鼠相比(+),狼瘡性腎炎小鼠腎組織中TREM1蛋白表達呈強陽性(+++)。見圖2。
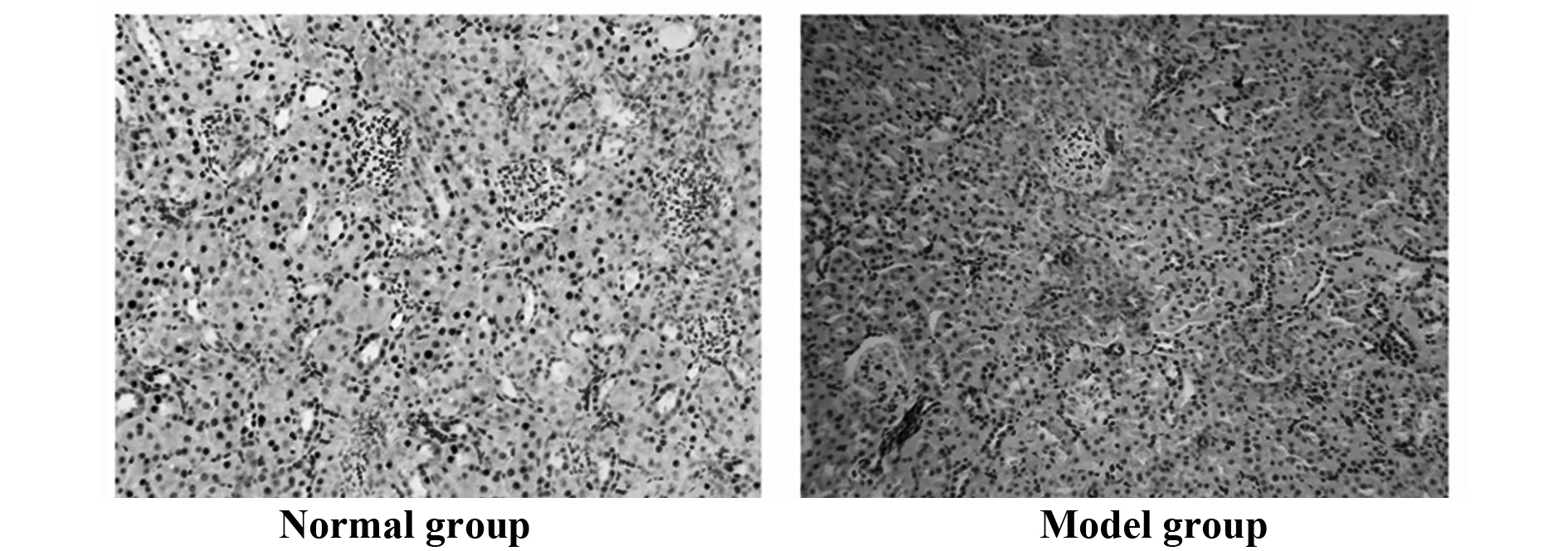
圖2 TREM1蛋白在狼瘡性腎炎小鼠腎組織中的表達(×100)Fig.2 Protein expression of TREM1 in kidney tissue of mice with LN(×100)
2.3miR-143-3p靶向下調TREM1表達 Targets-can預測發現miR-143-3p與TREM1存在結合位點。采用雙熒光素酶報告系統驗證兩者靶向關系。結果顯示:與共轉染mimic NC與TREM1-3′UTR-WT相比,共轉染miR-143-3p mimic與TREM1-3′UTR-WT的293T細胞中的熒光素酶活性顯著下降(P<0.05),其余組則無顯著變化(P>0.05)。同時,與mimic NC組相比,miR-143-3p能顯著下調TREM1的蛋白表達(P<0.05)。見圖3。
圖3 miR-143-3p與TREM1的靶向關系驗證Fig.3 Targeting relationship validation between miR-143-3p and TREM1Note:A.Prediction results through Targetscan;B.Verification results of dual fluorescein reporting system;C.Protein bands of TREM1;D.Quantification of TREM1 protein.Compared with group co-transfected with mimic NC and TREM1-3′UTR-WT,&.P<0.05;compared with mimic NC group,#.P<0.05.
2.4miR-143-3p靶向TREM1抑制系膜細胞炎性因子生成 系膜細胞的促炎因子的分泌是狼瘡性腎炎最主要的病理改變。Western blot對各組系膜細胞NF-κB p65、TNF-α、IL-1β和MCP-1蛋白進行定量。結果顯示:與mimic NC相比,miR-143-3p過表達后NF-κB p65、TNF-α、IL-1β和MCP-1因子的生成被顯著抑制(P<0.05)。sh-TREM1組細胞較sh-NC組而言,其NF-κB p65、TNF-α、IL-1β和MCP-1表達顯著下調(P<0.05)。TREM1沉默聯合miR-143-3p模擬物能更加顯著地抑制上述因子的表達(P<0.05)。見圖4。
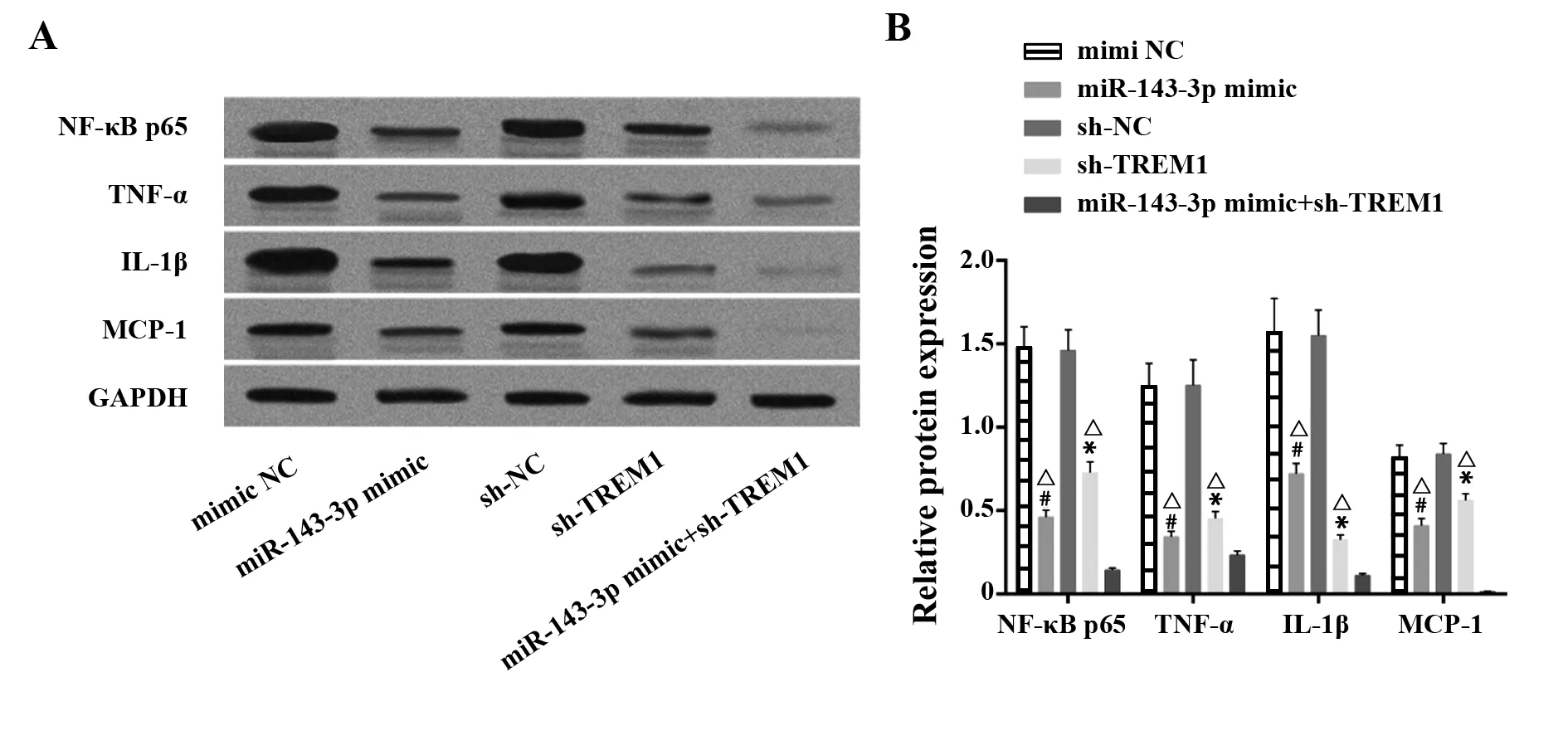
圖4 NF-κB p65、TNF-α、IL-1β和MCP-1蛋白在系膜細胞中的表達Fig.4 Protein expression of NF-κB p65,TNF-α,IL-1β,MCP-1 in each group of mesangial cellsNote:A.Immunoblotting bands of NF-κB p65,TNF-α,IL-1β,MCP-1 in each group;B.Quantification of NF-κB p65,TNF-α,IL-1β,MCP-1.Compared with mimic NC group,#.P<0.05;compared with sh-NC group,*.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group,△.P<0.05.
2.5miR-143-3p靶向TREM1抑制系膜細胞增殖活力 過度的系膜細胞增生同時也是狼瘡性腎炎的誘因之一。CCK8法測定各組系膜細胞活力,結果如下:與各自的陰性對照相比,sh-TREM1組和miR-143-3p mimic組在各個時間點細胞活力被顯著抑制(P<0.05),miR-143-3p mimic+sh-TREM1組抑制效果更加顯著(P<0.05)。見圖5。

圖5 各組系膜細胞活力Fig.5 Viability of mesangial cells in each groupNote:Compared with mimic NC group at the corresponding time point,#.P<0.05;compared with sh-NC group at the corresponding time point,*.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group at the corresponding time point,△.P<0.05.
2.6miR-143-3p靶向TREM1使系膜細胞停滯在G0/G1期 通過PI單染了解各組系膜細胞的細胞周期分布。結果發現:與各自的陰性對照相比,sh-TREM1組和miR-143-3p mimic組G1/G0期細胞比例顯著升高(P<0.05),但S期和G2期細胞比例明顯減少(P<0.05)。說明miR-143-3p能下調TREM1進而阻滯系膜細胞周期。miR-143-3p mimic+sh-TREM1組阻滯效果更加明顯。見圖6。
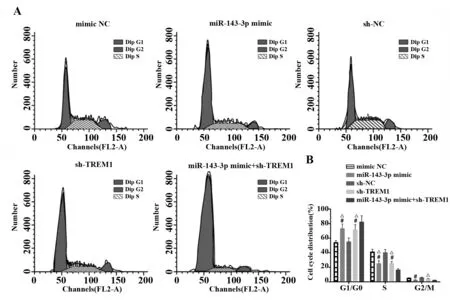
圖6 各組系膜細胞周期分布Fig.6 Cell cycle distribution in each group of mesang-ial cellsNote:A.Cell cycle chart in each group;B.Cell cycle distribution in each group.Compared with mimic NC group at the corresponding time point,#.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group at the corresponding time point,△.P<0.05.
2.7miR-143-3p對系膜細胞凋亡無顯著影響 為檢測miR-143-3p對系膜細胞的影響,本研究使用Annexin V/PI雙標染色檢測各組系膜細胞早期與晚期凋亡細胞的情況。結果顯示:與mimic NC組相比,miR-143-3p組和miR-143-3p mimic+sh-TREM1組系膜細胞凋亡率有所上升,但不具有統計學意義(P>0.05)。sh-NC組與sh-TREM1組細胞凋亡情況無顯著差異(P>0.05)。見圖7。

圖7 各組系膜細胞凋亡情況Fig.7 Apoptosis of mesangial cells in each groupNote:A.Mesangial cells apoptosis was detected by flow cytometry;B.Quantification of apoptosis rate in each group.
3 討論
腎小球系膜細胞的過度增殖被認定為LN的首要病理學指標,也是造成腎損傷的重要原因[12]。miRNA經研究證實在生物體基因的表達以及多種細胞活動的調控中發揮重要作用,另外也有越來越多的研究證實miRNA能夠對免疫功能進行調節[13,14]。以往研究證實誘發miR-143的表達能夠抑制丙酸桿菌介導的皮膚炎性反應[15]。此外,miR-143在炎癥性腸病中的保護作用也被越來越多的證實[8,16]。本研究進一步證實了miR-143-3p能夠靶向調控TREM1基因進而對LN小鼠腎小球系膜細胞炎性因子以及細胞凋亡進行調控。
免疫組化染色對LN小鼠腎組織中TREM1表達進行觀察,發現LN小鼠腎組織中TREM1呈強陽性表達。TREM1經以往研究證實在炎癥反應的調節中以及自身免疫性疾病的發病中發揮重要作用,相對于健康人群,類風濕性關節炎標本中TREM1表達顯著增高[6]。本研究進一步證實了TREM1在LN小鼠腎組織中表達升高,并且通過雙熒光素報告以及Western blot實驗證實TREM1受miR-143-3p調控,miR-143-3p能夠抑制TREM1的表達。炎癥因子的過度分泌是LN的重要病理表現。本研究通過Western blot對各組細胞中炎性相關因子的蛋白進行定量,觀察miR-143-3p靶向TREM1對系膜細胞炎癥因子的影響。LN發病時往往伴隨NF-κB p65、TNF-α、IL-1β和MCP-1等炎癥因子表達水平的提高,而炎癥因子的增強又會進一步加重腎臟固有細胞損傷以及免疫反應,加重病情進展[17]。我們的研究結果發現,過表達miR-143-3p或抑制TREM1表達能夠顯著抑制系膜細胞中炎癥因子的生成。
LN腎小球系膜細胞是增殖性腎損傷發揮作用的重要靶細胞[18]。正常健康狀態下,腎小球系膜細胞的形態和數量均維持在相對穩定的狀態,但特定損傷類因素則容易引起腎小球系膜細胞凋亡減少、過度增殖,使得細胞外基質的過度生成,最終引起腎小球硬化[19,20]。因此,誘導腎小球系膜細胞的凋亡、減少其增殖對于LN的治療以及防止腎小球硬化具有重要意義。本研究通過CCK8以及流式細胞術對各組LN小鼠腎小球系膜細胞的增殖活性、細胞周期以及細胞凋亡情況進行觀察,發現過表達miR-143-3p以及沉默TREM1基因能夠抑制LN小鼠腎系膜細胞增殖活性且聯合處理效果更顯著。此外,過表達miR-143-3p以及沉默TREM1后促進了LN小鼠腎系膜細胞的G0/G1期阻滯且聯合處理效果更明顯,但是各組之間凋亡率差異不顯著。表明LN小鼠腎系膜細胞增殖活性的改變主要是由細胞周期的變化引起的,而miR-143-3p能夠靶向下調TREM1進而促進G0/G1期細胞阻滯進而抑制細胞的增殖活性。
綜上所述,LN小鼠腎系膜細胞中miR-143-3p表達相對于正常小鼠顯著降低,miR-143-3p能夠靶向抑制TREM1進而抑制腎小球系膜細胞炎性因子的分泌以及細胞增殖活性,miR-143-3p有望成為LN治療中的重要靶點。但是對于其具體作用機制以及是否通過下游通路發揮作用仍然需要通過更多的實驗進行證實。
4 結論
miR-143-3p在LN小鼠腎小球系膜細胞中表達顯著降低,TREM1表達則顯著增強,miR-143-3p能夠靶向抑制TREM1的表達進而抑制腎小球系膜細胞炎性因子的分泌以及細胞增殖活性,在LN中發揮保護作用,因此miR-143-3p有望成為LN治療的重要靶點。

