KLF4在彌漫性大B細胞淋巴瘤組織中的表達及其作用機制研究①
林志美 李 建 饒 進 鄒忠晴 余曉玲
(成都大學附屬醫院血液科,成都 610081)
非霍奇金淋巴瘤是發病率增長比較快的惡性腫瘤之一,其最常見的病理類型為彌漫性大B細胞淋巴瘤,彌漫性大B細胞淋巴瘤是一種侵襲性腫瘤,具有明顯異質性,通過聯合化療可使一半以上的患者生存期延長,但部分患者仍因腫瘤進展而死亡,因此探討彌漫性大B細胞淋巴瘤發病的分子機制對治療具有重要的指導意義[1,2]。人鋅指轉錄因子Krüppel 樣因子4(Krüppel-like factor 4,KLF4)是人鋅指轉錄因子KLF家族成員,在多種細胞的生理功能中發揮重要作用,研究表明KLF4在多種惡性腫瘤的發生發展中具有重要作用,與惡性腫瘤細胞的增殖、侵襲和遷移等關系密切[3],過表達KLF4可抑制白血病細胞的增殖和遷移[4,5]。淋巴瘤患者磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信號通路被異常激活,抑制該信號通路對淋巴瘤具有抑制作用[6]。但KLF4在彌漫性大B細胞淋巴瘤組織中的表達及其對彌漫性大B細胞淋巴瘤增殖和侵襲遷移的影響及機制尚不清楚,本文對KLF4在彌漫性大B細胞淋巴瘤中的表達及其對細胞增殖和侵襲遷移能力以及PI3K/Akt信號通路的影響進行研究,為臨床提供依據。
1 材料與方法
1.1材料
1.1.1研究對象 選擇我院2017年6月~2018年6月初診彌漫性大B細胞淋巴瘤患者的彌漫性大B細胞淋巴瘤石蠟組織標本60例和同期淋巴結反應增生患者的淋巴結石蠟組織標本60例為對照。彌漫性大B細胞淋巴瘤患者年齡(48.31±5.36)歲,男性37例,女性23例;淋巴結反應增生患者年齡(47.84±4.97)歲,男性35例,女性25例。彌漫性大B細胞淋巴瘤患者均為初治患者,均經病理證實為彌漫性大B細胞淋巴瘤,兩組患者均簽署知情同意書。
1.1.2細胞株 彌漫性大B細胞淋巴瘤細胞系ly1細胞和人B淋巴母細胞系HMy2.CIR細胞購自中國科學院細胞庫。
1.1.3主要試劑 蘇木素、二甲苯、中性樹膠、DAB試劑盒、3%過氧化氫、抗原修復液(北京中杉金橋生物技術有限公司),兔抗人KLF4單克隆抗體、兔抗人Akt多克隆抗體、兔抗人磷酸化-Akt(phospho-rylation-Akt,p-Akt)多克隆抗體、兔抗人PI3K多克隆抗體、兔抗人磷酸化-PI3K多克隆抗體(phospho-rylation-PI3K,p-PI3K)(美國Abcam公司),BCA蛋白濃度測定試劑盒、CCK-8試劑、Transwell小室、Matrigel、逆轉錄-聚合酶鏈反應(reverse transcri-ption-polymerase chain reaction,RT-PCR)試劑盒(美國Hyclone公司),胎牛血清、RPMI1640培養基(美國Gibco公司)等。
1.2方法
1.2.1免疫熒光雙標雙染色測定彌漫性大B細胞淋巴瘤組織和對照組織中KLF4表達情況 將彌漫性大B細胞淋巴瘤石蠟組織和對照石蠟組織進行切片,烤片30 min,梯度酒精水化,蒸餾水洗滌,PBS浸泡,加入抗原修復液修復30 min,PBS沖洗,加入過氧化氫孵育30 min,PBS洗滌,加入山羊血清封閉30 min,加入兩種一抗:KLF4抗體和CD20抗體(1∶50),過夜孵育,對照組加入PBS代替一抗,PBS洗滌,加入熒光二抗(紅色熒光和綠色熒光)1∶500過夜孵育,PBS洗滌,取出玻片,加入緩沖甘油,覆蓋玻片,熒光顯微鏡400倍視野下觀察。KLF4陽性細胞細胞核顯紅色熒光,CD20陽性細胞細胞膜顯綠色熒光,計算400倍視野下5個視野KLF4和CD20雙陽性細胞數量,在每個400倍視野中KLF4陽性細胞大于15個為高表達,低于15個位低表達。
1.2.2Western blot測定彌漫性大B細胞淋巴瘤細胞系ly1細胞和人B淋巴母細胞系HMy2.CIR細胞中KLF4蛋白水平 取生長良好的ly1細胞和HMy2.CIR細胞,加入蛋白裂解液提取ly1細胞和HMy2.CIR細胞總蛋白,將ly1細胞和HMy2.CIR細胞蛋白加入到SDS-PAGE膠不同泳道中電泳,轉膜,加入脫脂奶粉封閉2 h,加入鼠抗人KLF4抗體(1∶100)過夜孵育,以β-actin(1∶1 500)為內參照,加入羊抗鼠IgG(1∶1 500)孵育1 h,加入發光顯色液顯色,Bio-Rad凝膠成像系統成像,KLF4蛋白相對表達量以KLF4吸光度值/β-actin吸光度值。
1.2.3RT-PCR測定彌漫性大B細胞淋巴瘤細胞系ly1細胞和人B淋巴母細胞系HMy2.CIR細胞中KLF4 mRNA水平 取生長良好的ly1細胞和HMy2.CIR細胞,加入Trizol提取細胞總RNA,將ly1細胞和HMy2.CIR細胞總RNA反轉錄為cDNA,以cDNA為模板,采用PCR法測定ly1細胞和HMy2.CIR細胞中KLF4 mRNA(KLF4上游引物:5′-GGCTGATGGGCAAGTTTGTG-3′,下游引物:5′-CAAGTGTGGGTGGCTGTTCT-3′),以β-actin為內參照,反應條件為:94℃ 5 min,94℃ 15 s、55℃ 30 s,72℃ 30 s,共40個循環。以2-ΔΔCt作為KLF4 mRNA的相對表達量。
1.2.4ly1細胞分組及轉染 將生長良好的ly1細胞分為空白對照組、陰性對照組和過表達KLF4組,每組設7個復孔。將三組生長良好的ly1細胞接種到96孔板中(每孔103個細胞)培養24 h,空白對照組不轉染病毒,陰性對照組轉染陰性對照病毒,過表達KLF4組轉染過表達KLF4病毒,根據感染復數=150稀釋病毒液,取10 μl病毒液加入相應培養孔中,再加入促轉染劑Polybrene,混勻后培養48 h。
1.2.5Western blot法測定轉染后三組ly1細胞中KLF4蛋白水平,RT-PCR測定轉染后三組ly1細胞中KLF4 mRNA水平,具體方法同1.2.2和1.2.3。
1.2.6CCK-8測定轉染后ly1細胞增殖情況 將三組轉染后ly1細胞制成細胞懸液,接種到96孔板中(每孔5×106個細胞),每孔加入含胎牛血清的培養液,分別在接種后1 d、3 d和5 d于每孔中加入CCK-8液10 μl繼續培養4 h(每組每個時間點設7個復孔),酶聯免疫檢測儀上測定波長490 nm處吸光度(A)值。
1.2.7Transwell小室法測定轉染后ly1細胞侵襲和遷移能力 在Transwell小室底部膜下表面均勻涂抹10 μl纖連蛋白(1 g/L),將小室置入培養箱中孵育4 h,將三組轉染后ly1細胞100 μl加入到小室上室(5×105個細胞/ml),下室加入含FBS培養液,每組設7個復孔,培養24 h,取出小室用棉簽擦去上室細胞,多聚甲醛固定遷移到下室的細胞,用0.1%結晶紫染色下室細胞30 min,用PBS洗滌3遍,100倍顯微鏡下觀察遷移細胞數。ly1細胞侵襲能力測定:將Transwell上室用Matrigel膠包被,培養箱中孵育2 h至基質膠凝固,其余實驗步驟與遷移實驗相同。
1.2.8Western blot法測定轉染后三組ly1細胞Akt、p-Akt、PI3K、p-PI3K蛋白水平,具體方法同1.2.2。
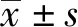
2 結果
2.1彌漫性大B細胞淋巴瘤組織和淋巴結反應增生組織中KLF4表達情況 CD20表達在除漿細胞(分泌免疫球蛋白的B細胞)外的發育分化各階段的B細胞的表面,是最常用的B細胞標記。KLF4和CD20同時陽性細胞代表B細胞中KLF4陽性表達細胞。彌漫性大B細胞淋巴瘤組織B細胞中KLF4陽性表達率(38.33%)低于對照組織B細胞中(56.67%)(P<0.05)。見表1和圖1。

表1 彌漫性大B細胞淋巴瘤組織和對照組織B細胞中KLF4表達情況比較[n=60,n(%)]Tab.1 Comparison of KLF4 expression in diffuse large B-cell lymphoma tissue and control tissues[n=60,n(%)]

圖1 免疫組化染色檢查彌漫性大B細胞淋巴瘤組織和對照組織中KLF4表達(×100)Fig.1 Immunohistochemical staining for KLF4 expression in diffuse large B-cell lymphoma tissue and control tissues(×100)Note:A.Diffuse large B-cell lymphoma tissue;B.Control tissue.
2.2彌漫性大B細胞淋巴瘤細胞系ly1細胞和人B淋巴母細胞系HMy2.CIR細胞中KLF4蛋白和mRNA水平 彌漫性大B細胞淋巴瘤細胞系ly1細胞中KLF4蛋白和mRNA水平低于人B淋巴母細胞系HMy2.CIR細胞(P<0.01)。見表2和圖2。

表2 ly1細胞和HMy2.CIR細胞中KLF4蛋白和mRNA水平比較Tab.2 Comparison of KLF4 protein and mRNA levels in ly1 cells and HMy2.CIR
Note:Compared with HMy2.CIR cell group,1)P<0.01.

圖2 ly1細胞和HMy2.CIR細胞中KLF4蛋白Western blot電泳圖Fig.2 Western blot analysis of KLF4 protein in ly1 cells and HMy2.CIR cellsNote:1.ly1;2.HMy2.CIR.
2.3過表達KLF4對ly1細胞中KLF4蛋白和mRNA水平的影響 與空白對照組和陰性對照組比較, 過表達KLF4組ly1細胞中KLF4蛋白和mRNA水平升高(P<0.01);空白對照組和陰性對照組ly1細胞中KLF4蛋白和mRNA水平比較差異無統計學意義(P>0.05)。見表3和圖3。

表3 三組ly1細胞中KLF4蛋白和mRNA水平比較Tab.3 Comparison of KLF4 protein and mRNA levels in three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.

圖3 三組ly1細胞中KLF4蛋白Western blot電泳圖Fig.3 Western blot analysis of KLF4 protein in three groups of ly1 cellsNote:1.Blank control group;2.Negative control group;3.Overexpressing KLF4 group.
2.4過表達KLF4對ly1細胞增殖的影響 第1天,三組ly1細胞A值比較差異無統計學意義(P>0.05);第3天和第5天,與空白對照組和陰性對照組比較,過表達KLF4組ly1細胞A值降低(P<0.01);空白對照組和陰性對照組ly1細胞A值比較差異無統計學意義(P>0.05)。見表4。

表4 三組ly1細胞A值比較Tab.4 Comparison of A values of three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.
2.5過表達KLF4對ly1細胞侵襲遷移能力的影響 與空白對照組和陰性對照組比較,過表達KLF4組ly1細胞侵襲和遷移細胞數降低(P<0.01);空白對照組和陰性對照組ly1細胞侵襲和遷移細胞數比較差異無統計學意義(P>0.05)。見表5和圖4、5。

表5 三組ly1細胞侵襲遷移細胞數比較Tab.5 Comparison of number of invading and migrating cells of three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.

圖4 測定三組ly1細胞侵襲能力(×100)Fig.4 Migration ability of three groups of ly1 cells(×100)Note:A.Blank control group;B.Negative control group;C.Overex-pressing KLF4 group.

圖5 測定三組ly1細胞遷移能力(×100)Fig.5 Determination of invasive ability of three groups of ly1 cells(×100)Note:A.Blank control group;B.Negative control group;C.Overex-pressing KLF4 group.
2.6過表達KLF4對ly1細胞PI3K/Akt信號通路的影響 三組ly1細胞Akt、PI3K蛋白水平比較差異無統計學意義(P>0.05);與空白對照組和陰性對照組比較,過表達KLF4組ly1細胞p-Akt、p-PI3K蛋白降低(P<0.01);空白對照組和陰性對照組ly1細胞p-Akt、p-PI3K蛋白比較差異無統計學意義(P>0.05)。見表6和圖6。

表6 三組ly1細胞Akt、p-Akt、PI3K、p-PI3K蛋白水平比較Tab.6 Comparison of Akt,p-Akt,PI3K,p-PI3K protein levels in three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.

圖6 三組ly1細胞Akt、p-Akt、PI3K、p-PI3K蛋白Western blot電泳圖Fig.6 Western blot analysis of Akt,p-Akt,PI3K,p-PI3K proteins in three groups of ly1 cellsNote:1.Blank control group;2.Negative control group;3.Overexp-ressing KLF4 group.
3 討論
KLF4在人類組織中廣泛表達,目前發現的KLF家族成員有17名,在細胞增殖、分化、生長以及維持正常組織穩態中發揮重要作用,KLF4為KLF家族成員中最受關注的分子之一,KLF4位于9q31染色體上,包括DNA結合結構域、轉錄調節結構域、核定位序列3個結構域[7,8]。其中DNA結合結構域位于羧基端,高度保守,在調節和DNA結合的特異性中發揮重要作用;轉錄調節結構域在轉錄抑制或轉錄活性中發揮重要作用,位于氨基端;核定位序列在KLF4在細胞核內的定位中發揮重要作用[9,10]。KLF4和不同的靶基因結合在不同的腫瘤(mantle cell lymphoma)組織中發揮促癌或者抑癌作用,研究發現KLF4在口腔鱗癌、乳腺導管癌中表達水平升高,發揮癌基因的作用,而在胃癌、食管鱗癌、肺癌等惡性腫瘤中表達降低,發揮抑癌作用[11]。在血液系統疾病中,Filarsky等[12]發現KLF4在慢性淋巴細胞白血病中失活;李波等[13]發現過表達KLF4可促進白血病K562細胞凋亡,抑制K562細胞增殖;Jiang等[14]發現上調KLF4可誘導霍奇金淋巴瘤細胞凋亡;Li等[15]研究發現套細胞淋巴瘤組織中KLF4水平下降。本文研究發現彌漫性大B細胞淋巴瘤組織中KLF4表達水平下降,過表達KLF4可抑制彌漫性大B細胞淋巴瘤細胞增殖和侵襲遷移。本研究結果表明KLF4在彌漫性大B細胞淋巴瘤的發生發展中也發揮重要作用,KLF4有望成為彌漫性大B細胞淋巴瘤治療的潛在靶點。
PI3K/Akt信號通路在人體各組織中普遍存在,在細胞生長、代謝、分化、增殖、存活中發揮重要作用,在惡性腫瘤的發生發展中,PI3K/Akt參與腫瘤細胞的增殖、凋亡等過程,和腫瘤的耐藥關系也比較密切[16,17]。Akt為PI3K下游效應分子,Akt可通過磷酸化腫瘤抑制因子、激酶等多種細胞蛋白,促進腫瘤細胞增殖、抑制腫瘤細胞凋亡,從而促進腫瘤細胞生長。Akt活化可促進G1期細胞進展,從而加速細胞周期;Akt與腫瘤細胞的侵襲和遷移關系也比較密切,Akt的激活可促進腫瘤細胞的侵襲和遷移[18,19]。淋巴瘤中PI3K/Akt信號通路異常激活,馬濤等[20]研究發現結外NK/T細胞淋巴瘤中PI3K/Akt信號通路異常激活。本研究觀察過表達KLF4對彌漫性大B細胞淋巴瘤細胞中PI3K/Akt信號通路的影響,結果發現過表達KLF4可降低彌漫性大B細胞淋巴瘤細胞中p-Akt、p-PI3K蛋白水平,表明過表達KLF4可抑制彌漫性大B細胞淋巴瘤細胞中PI3K/Akt信號通路,KLF4對彌漫性大B細胞淋巴瘤細胞增殖和侵襲遷移的抑制作用可能與其抑制PI3K/Akt信號通路有關。
綜上所述,彌漫性大B細胞淋巴瘤組織中KLF4表達降低,上調KLF4水平可能通過PI3K/Akt信號通路抑制彌漫性大B細胞淋巴瘤的增殖和侵襲遷移,KLF4有望成為彌漫性大B細胞淋巴瘤潛在的治療靶點。

