ER stress活化促進星形膠質細胞NLRP3表達和IL-1β合成分泌
洪 洋 劉 彬 夏龍飛 賈 佳 劉運江
(河北醫科大學第四醫院,石家莊 050000)
阿爾茲海默病(Alzheimer′s disease,AD)又稱老年癡呆,是以記憶和認知功能障礙為主要特征的中樞神經系統退行性病變[1]。越來越多的證據表明Aβ誘導的神經炎癥反應能夠導致認知能力下降和神經功能退化[2],Aβ腦內的沉積可能是誘發包括星形膠質細胞在內多種神經細胞功能失調的主要原因,明顯影響到星形膠質細胞間的信息加工和傳導能力,并導致大范圍的腦內神經炎癥反應[3]。這就提示我們,調節星形膠質細胞功能可能成為治療大腦神經炎癥反應的重要靶點。
多種證據表明,內質網應激(endoplasmic reticulum stress,ER stress)的產生與AD之間的聯系是多樣的也是復雜的。ER作為一種重要的細胞器調節著細胞內蛋白質的合成代謝功能。多種病理學改變都會誘導ER stress的形成,主要表現為ER分子伴侶蛋白的形成和未折疊蛋白反應(unfolded protein response,UPR)的激活。當UPR過度或持久激活時,最終則會誘導細胞功能性紊亂甚至細胞死亡[4]。越來越多的證據顯示,AD患者腦內和動物模型中,在ER部位附近聚集大量Aβ蛋白,從而誘導ER stress的持久性激活,導致GRP78、ATF4的大量表達,進而影響蛋白質的合成[4,5]。目前Aβ蛋白誘導神經毒性的具體機制尚不完全清楚,但是ER功能障礙有可能在Aβ蛋白引起星形膠質細胞異常活化以及炎癥反應的發生中發揮重要調節作用。
1 材料與方法
1.1材料 Aβ1-42片段,ER stress抑制劑Salubrinal(Sal),ER stress促進劑Tunicamycin(TM)均購置美國Sigma公司(St.Louis,MO,USA),DMEM培養液和胎牛血清FBS購置Gibco(Carlsbad,CA,USA),GRP78、NLRP3、pro-IL-1β、β-actin抗體購置Cell Signaling公司(Beverly,MA,USA)。羊抗兔/FITC多克隆抗體購置 Bioss公司(Beijing,China)。
1.2方法
1.2.1原代星形膠質細胞培養 星形膠質細胞來源于新生SD大鼠大腦皮層,無菌條件下破碎組織,制備單細胞懸液,37℃,5%CO2條件下孵育培養,每2 d更換培養液,待細胞充分覆蓋后,37℃震蕩去除多余小膠質細胞,應用免疫熒光染色法鑒定星形膠質細胞純度(純度>95%),純化后的細胞分別接種于細胞培養板(用于ELISA、免疫熒光、Western blot試驗)。
1.2.2ELISA檢測 取正常培養星形膠質細胞,經過干預處理后,應用ELISA試劑盒檢測細胞上清IL-1β的分泌水平改變。首先,建立1 000、500、250、125、62.5、31.25、15.625和0 pg/ml標準曲線。然后取上清100 μl加入到預先孵育抗IL-1β培養板內。根據試劑盒說明書要求,分別要求依次加入檢測試劑。最后應用酶標儀在450 nm處檢測細胞上清IL-1β濃度。
1.2.3Western blot檢測 取星形膠質細胞裂解后提取總蛋白,BCA蛋白試劑盒計算蛋白含量。取提取蛋白分別制備10%或15%SDS分離膠分離蛋白,并通過半干轉法轉移至PVDF膜。PVDF膜應用5%脫脂奶粉封閉,4℃分別孵育GRP78、pro-IL-1β和NLRP3抗體過夜,室溫孵育二抗2 h,ECL光化學顯色。最后應用Image J分析軟件對掃描條帶進行定量分析。
1.2.4免疫熒光檢測 取4%甲醛固定星形膠質細胞,0.05% Triton X-100和3%BSA封閉打孔,4℃分別孵育GRP78、NLRP3抗體過夜,室溫孵育二抗2 h,DAPI進行核染色,應用熒光顯微鏡檢測細胞。
1.2.5藥物干預與分組 取正常培養星形膠質細胞,隨機分為對照組、Aβ組(5 μmol/L)、TM組(5 μmol/L)、Sal處理組(10 μmol/L)。Aβ組給予多聚化Aβ1-42干預6 h;TM處理組應用TM干預處理2 h;Sal處理組應用Sal預處理1 h,然后與Aβ共處理6 h。對照組給予DMEM培養基對照處理。
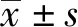
2 結果
2.1Aβ促進星形膠質細胞GRP78表達 前期預實驗研究發現,Aβ處理6 h,星形膠質細胞開始出現早期的神經炎癥反應。為了研究Aβ干預早期星形膠質細胞內病理學改變。我們應用Aβ處理星形膠質細胞6 h。免疫熒光結果顯示(圖1A),相比CTL組,Aβ組星形膠質細胞體積出現明顯膨脹,在胞內ER stress相關蛋白GRP78出現了大量表達,在胞漿和胞核附近均出現明顯大量聚集。Western blot結果顯示(圖1B),相比對照組,Aβ顯著促進了星形膠質細胞GRP78表達(P<0.05)。


圖1 Aβ促進星形膠質細胞GRP78表達
Fig.1 Aβ induced GRP78 expression in astrocytes
Note: A.Immunostained against antibodies GRP78 (green),DAIP was used to stain nuclei (blue);B.Compared with control group,*.P<0.05,the difference was statistically significant.
2.2ER stress活化促進星形膠質細胞IL-1β合成分泌 ELISA結果顯示(圖2),相比對照組,Aβ組和TM組IL-1β分泌水平均出現明顯增加(P<0.01);相比Aβ組,TM組IL-1β分泌水平未出現明顯差異(P>0.05)。研究結果說明,ER stress誘導劑TM促進了星形膠質細胞分泌IL-1β。

圖2 ER stress活化促進星形膠質細胞IL-1β分泌Fig.2 ER stress activation induced IL-1β secretion in astrocytesNote:**.P<0.01,compared with control group,the difference was statistically significant.
2.3ER stress活化促進星形膠質細胞pro-IL-1β表達 Western blot結果顯示(圖3),相比對照組,Aβ和TM均促進了星形膠質細胞pro-IL-1β表達(P<0.05)。研究結果說明,ER stress活化促進星形膠質細胞成熟型pro-IL-1β片段的表達。

圖3 ER stress活化促進星形膠質細胞pro-IL-1β表達Fig.3 ER stress activation induced pro-IL-1β expression in astrocytesNote:*.P<0.05,compared with control group,the difference was statistically significant.
2.4ER stress抑制劑Sal抑制星形膠質細胞NLRP3表達活化 Western blot結果顯示(圖4A),相比對照組,Aβ組明顯促進星形膠質細胞NLRP3表達活化(P<0.05)。ER stress抑制劑Sal顯著抑制了Aβ所誘導NLRP3表達(P<0.05)。另外,免疫熒光結果顯示(圖4B),Aβ組星形膠質胞漿和胞核附近均表達大量NLRP3。相比Aβ組,Sal組星形膠質細胞NLRP3表達出現明顯減少。研究結果說明,Aβ通過調節ER stress活化促進星形膠質細胞NLRP3表達。
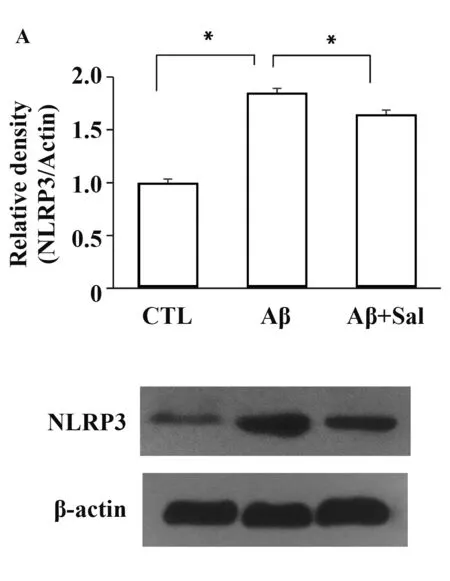

圖4 Sal抑制星形膠質細胞NLRP3表達活化Fig.4 Sal inhibited NLRP3 expression in Aβ-induced astrocytesNote: A.*.P<0.05,compared with Aβ group,the difference was statistically significant;B.Immunostained against antibodies NLRP3 (green),DAIP was used to stain nuclei (blue).
3 討論
神經炎癥反應作為AD重要的病理學特征之一,非常易于在AD患者腦內易感區域發生,表現為大量促炎癥調節因子的合成分泌[6]。這種炎癥調節因子的大量分泌嚴重影響到AD的神經病理學特征,特別是引起記憶和認知功能的下降[7]。IL-1β是一個能誘發或加重多種細胞反應的主要促炎癥細胞因子。IL-1β水平的提升被諸多研究者認為是與疾病發展密切相關,比如Ⅱ型糖尿病,癌癥或是神經退行性疾病等[8,9]。研究證實,阻斷或消除IL-1β信號通路,則明顯改善AD認知功能異常狀態并能有效調節AD病理學癥狀[10,11]。
星形膠質細胞在中樞神經系統內是數量最龐大的一類細胞。然而,當星形膠質細胞異常活化后會產生大量炎癥調節因子,包括IL-1β、TNF-α以及COX-2等。事實上,當星形膠質細胞處于應激狀態會導致其異常活化。我們前期預實驗研究發現,Aβ處理6 h,星形膠質細胞開始出現異常活化狀態,表現為早期的神經炎癥反應。為了研究Aβ干預早期星形膠質細胞內病理學改變,我們應用多聚化Aβ1-42處理6 h。研究結果顯示,星形膠質細胞體積出現明顯膨脹,在胞漿中表達了大量ER stress相關蛋白GRP78并在胞漿和胞核附近出現大量聚集。多種證據表明,當ER stress過度或持久激活時,最終則會誘導細胞功能性紊亂甚至細胞死亡。ER stress發生時,與蛋白激酶(PKR-like ER kinase,PERK)結合的免疫蛋白結合蛋白GRP78會解離,并游離與胞漿中,使PERK蛋白磷酸化,進一步促使elF2α發生磷酸化修飾,從而引起蛋白質合成障礙,影響細胞正常功能[12]。因此我們推斷,Aβ誘導星形膠質細胞ER stress活化與星形膠質細胞開始出現的異常活化狀態存在潛在聯系。
在NLRs家族中,NLRP3是最受專家學者關注的炎癥小體之一。NLRP3炎癥小體是由多種蛋白構成的復合物,包括核心蛋白NLRP3、調節分子ASC以及pro-Caspase-1組成。它常被看作是活化促炎癥細胞因子IL-1β和IL-18的上游蛋白[13]。盡管NLRP3炎癥小體在細胞分子內的調控機制尚未完全闡明,但是可以肯定的是,在溶酶體損傷[14],線粒體鈣離子通量改變[15]以及氧化應激片段ROS形成[16]等應激條件下常常激活細胞內NLRP3大量合成。本研究發現,Aβ能夠誘導ER stress在星形膠質細胞內激活,主要表現為GRP78的表達。為了證實本研究假設,我們應用ER stress誘導劑TM干預星形膠質細胞,結果顯示TM能顯著促進pro-IL-1β、IL-1β和NLRP3的表達合成。然而,ER stress抑制劑Sal顯著抑制了Aβ誘導NLRP3表達。研究結果說明,Aβ通過調節ER stress活化促進星形膠質細胞NLRP3表達以及pro-IL-1β、IL-1β合成分泌。
綜上所述,我們可以推斷 Aβ在星形膠質細胞內的大量聚集能夠誘導ER stress的激活并表現出來的早期神經炎癥細胞毒性反應。因此,異常折疊蛋白所誘導ER stress的激活表現出NLRP3炎癥小體所介導炎癥信號的啟動,并進一步誘發神經炎癥因子的合成和分泌。

