果蔬酵素中純菌種篩選及其在復合發酵中的應用
肖夢月,曹新志*,張楷正,趙迎慶,胡琴,楊建剛
(1.四川輕化工大學 生物工程學院,四川 宜賓 644005;2.四川保寧壓酒有限公司, 四川 閬中 637400;3.山東鳳凰生物有限公司,山東 泰安 271000)
拐棗,學名枳椇,因其形似“萬”字又得名萬壽果。很多研究表明,拐棗中不僅含有蛋白質、多糖、果糖、維生素等營養成分,還含有黃酮和多酚等生物活性物質[1,2]。目前關于拐棗的研究不多,現有產品有限,主要有拐棗酒、拐棗飲料和拐棗醋,還有很多研究是關于其相關成分的提取和檢測[3-5]。酵素本意指酶,現在多指各種原料經過微生物發酵后所得的產品,酵素產品在保留自身有益成分的同時能夠經微生物發酵產生更多的有益成分,所以經很多研究發現酵素具有改善人體內微生態環境,提高免疫力,抗氧化,延緩衰老,預防與心血管和肥胖等相關的疾病的功效[6-8]。日本在20世紀80年代就已經將酵素產品的生產作為技術來研究并進入應用階段,在日本,每天有超過2000萬人在服用酵素產品,食用酵素在日本一年的消費額可達1000億日元[9]。雖然拐棗營養價值極高,但因其形態特殊,并略帶澀味,所以直接食用拐棗的人群較少。目前將拐棗應用于酵素產品的研究還比較少見,本研究將拐棗與果蔬混合制作酵素,有望提高拐棗的加工利用率,使拐棗中的有益成分更好地得以利用。
酵素的發酵工藝可分為3種:不外加菌自然發酵、滅菌后加菌發酵和在自然發酵的基礎上外加菌復合發酵[10]。在自然發酵的基礎上外加菌復合發酵可以有效綜合前兩種方式的優缺點,解決自然發酵過程中的很多問題,并且外加菌發酵還可以增加有益物質的含量[11-14]。本文從自然發酵拐棗果蔬酵素中篩選出純菌種,將篩選出的純菌種應用于外加菌復合發酵酵素工藝,以期達到縮短發酵周期、降低發酵成本的目的。
1 試驗材料與方法
1.1 試驗材料
紅糖、白砂糖及各種果蔬原料:均購于宜賓某市場;沒食子酸、無水碳酸鈉、三羥甲基氨基甲烷、鐵氰化鉀、三氯乙酸、三氯化鐵、磷酸氫二鈉(十二水)、鹽酸、磷酸二氫鈉(二水):均為分析純,購于成都市科隆化工試劑廠;牛肉膏、蛋白胨、酵母浸粉、麥芽浸粉、酵母膏等:生物試劑,北京奧博星生物技術有限責任公司。
1.2 培養基
乳酸菌通用(MRS)培養基[15]:牛肉膏6.0 g,蛋白胨6.0 g,酵母浸粉3.0 g,乙酸鈉3.0 g,磷酸氫二鉀1.2 g,吐溫-80(聚山梨酯-80)0.6 mL,葡萄糖12.0 g,MnSO4·4H2O 0.15 g,MgSO4·7H2O 0.35 g,檸檬酸銨1.2 g,蒸餾水600 mL,pH 6.2±0.2,固體培養基加瓊脂15.0 g,(無菌)碳酸鈣9.0 g,121 ℃、0.1 MPa高壓滅菌20 min。
酵母膏胨葡萄糖瓊脂(YPD)培養基:蛋白胨12.0 g,酵母浸膏6.0 g,葡萄糖12.0 g,固體培養基加瓊脂15.0 g,蒸餾水600 mL,121 ℃、0.1 MPa高壓滅菌15 min。
1.3 主要儀器與設備
GZ-250-S生化培養箱 韶關市廣智科技設備有限公司;HWS-12電熱恒溫水浴鍋 上海齊欣科學儀器有限公司;DHG-9140A電熱恒溫鼓風干燥箱 上海一恒科技有限公司;LS-75HD立式壓力蒸汽滅菌鍋 江陰濱江區醫療設備有限公司;SW-CJ-1FD超凈工作臺 蘇州尚田潔凈技術有限公司;ISO 9001恒溫培養振蕩器 上海智城分析儀器制造有限公司;TG-16臺式高速離心機 四川蜀科儀器有限公司;TGL-16B離心機 上海安亭科學儀器廠;UV-1000紫外可見分光光度計 上海翱藝儀器有限公司;Thermo 868 pH計 熱電(上海)科技儀器有限公司。
1.4 試驗方法
1.4.1 拐棗果蔬酵素工藝流程及操作要點
1.4.1.1 工藝流程
果蔬清洗 風干→去皮、去核→切丁→調配→裝罐密封→一次發酵→過濾→熟成。
1.4.1.2 操作要點
預處理:將拐棗(半干)、橘子、蘋果、梨、蘿卜、卷心菜、菠菜、檸檬、土豆、藕、西紅柿清洗干凈,于通風處自然晾干水分后去皮、去核并切丁,將切好的果蔬按1∶1的比例混合得到混合果蔬。
調配:按比例加入菌種及糖,菌種在加入前進行活化處理,酵母菌接種于YPD培養基中,于28 ℃搖床上,以轉速150 r/min振蕩培養24 h;乳酸菌于MRS培養基中于37 ℃培養48 h。
裝罐密封:裝罐量為容積的80%,不可裝太滿。
一次發酵:前7 d每天攪拌1次。
過濾:一次發酵完成后用雙層紗布過濾。
熟成:將過濾后的一次發酵液密封后于常溫避光處二次發酵熟成,30 d左右完成。
1.4.2 檢測方法
1.4.2.1 還原力
參考毛酸漿酵素的還原力測定方法[16],取經離心處理的上清發酵液0.2 mL,加入2.5 mL濃度為0.2 mol/L的磷酸鹽緩沖溶液(pH 6.6),然后加入質量分數為10%的鐵氰化鉀溶液,于50 ℃水浴20 min后快速冷卻,然后加入2.5 mL 20%的三氯乙酸溶液,于3600 r/min離心15 min后立即取上清液2.5 mL,加入去離子水2.5 mL和0.1%的三氯化鐵0.5 mL。以去離子水作參比在波長700 nm處測定吸光值。吸光值越大,說明還原能力越強,抗氧化效果越好。
1.4.2.2 SOD酶活力測定方法
參考國標GB/T 5009.171-2003[17],于25 ℃左右,取經預處理并適當稀釋的樣液0.2 mL于試管中,然后依次將2.35 mL濃度為0.1 mol/L的三羥甲基氨基甲烷鹽酸緩沖溶液(pH為8.2,內含1 mmol/L EDTA-2Na)、1.8 mL蒸餾水、0.15 mL 4.5 mmol/L鄰苯三酚溶液,混勻后立即倒入石英比色皿中在波長325 nm條件下分別測定初始時和1 min后的吸光值,二者之差為A1,空白比色皿用10 mmol/L鹽酸調零,同樣用蒸餾水代替樣液測定鄰苯三酚的自氧化速率A0,SOD酶活性計算方式如下:
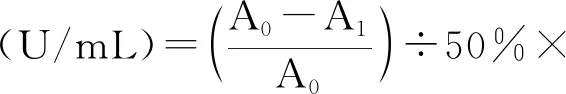
1.4.3 菌種的分離純化[18]
按酵素工藝制備自然發酵拐棗果蔬酵素,調配時加入50%的紅糖和50%的白砂糖,置于陰涼干燥處自然發酵3個月,取1 mL發酵中的自然發酵拐棗果蔬酵素原液,用無菌水逐級稀釋,得到101~107共7個梯度稀釋液。吸取100 μL各梯度的菌懸液分別涂布于MRS培養基和YPD培養基上,其中,MRS培養基于37 ℃恒溫培養約48 h,YPD培養基于28 ℃恒溫培養24~48 h,倒置培養并隔一段時間進行觀察。挑取具有明顯溶鈣圈和酵母菌特征的菌落,再在MRS培養基和YPD培養基上劃線培養。
1.4.4 菌種的篩選[19,20]
對疑似酵母菌的菌落直接水浸片鏡檢,對疑似乳酸菌菌落進行革蘭氏染色和顯微鏡下菌株形態觀察,并選擇具有典型酵母菌、乳酸菌和醋酸菌特征的菌株進行斜面保藏和甘油管冷藏,甘油管冷藏按菌液和60%甘油1∶1的體積比接入甘油管內并冷藏于低溫冰箱內。對鏡檢未完全純化的菌株進行二次劃線純化,并重復以上步驟。
1.4.5 分子生物學鑒定
1.4.5.1 菌株的活化
選擇典型的菌株,接種一環純化后的酵母菌單菌落于YPD液體培養基中,28 ℃、180 r/min培養24~48 h;乳酸菌單菌落接種于100 mL MRS液體培養基中,37 ℃培養24 h;乳酸菌取2 mL菌液于2 mL離心管(EP管)中,酵母菌需按不同提取方法取不同的量,離心后棄上清液,取沉淀。
1.4.5.2 酵母菌18S rDNA分子生物學鑒定
酵母菌通用引物:(1.1 kb)18S rDNA正向引物NS1:5′-GTAGTCATATGCTTGTCTC-3′,反向引物NS4:5′-CTTCCGTCAATTCCTTTAAG-3′;(1.8 kb)18S rDNA正向引物NS1:5′-GTAGTCATATGCTTGTCTC-3′,18S rDNA反向引物NS8:5′-TCCGCAGGTTCACCTACGGA-3′。
PCR反應體系(25 μL):2×Taq MasterMix 12.5 μL;DNA模板2 μL;Primer F,10 μmol/L,0.5 μL;Primer R,10 μmol/L,0.5 μL;無菌超純水9.5~25 μL。
PCR擴增程序:94 ℃變性1 min,52 ℃退火1 min,72 ℃延伸90 s,30個循環;72 ℃ 10 min,于4 ℃保存。
1.4.5.3 乳酸菌16S rDNA分子生物學鑒定
細菌通用引物:(1.6 kb)16S rDNA正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R:5′-AGAGTTTGATCCTGGCTCAG-3′。
PCR反應體系(25 μL):2×Taq MasterMix 12.5 μL;DNA模板2 μL;Primer F,10 μmol/L,0.5 μL;Primer R,10 μmol/L,0.5 μL;無菌超純水9.5~25 μL。
PCR擴增程序:95 ℃預變性5 min,95 ℃變性60 s,55 ℃退火60 s,72 ℃延伸90 s,30個循環,72 ℃ 8 min,于4 ℃保存。
送樣測序:PCR產物通過1%瓊脂糖凝膠電泳,檢測PCR是否成功及片段大小。使用EditSeq結合Chromas軟件對所測序列進行裁剪后,將所得序列在NCBI數據庫中進行Blast比對,分析序列同源性,并選擇相似度較高的序列,采用MEGA 6.0軟件構建菌株的系統發育樹。
1.4.6 復合拐棗果蔬酵素工藝優化
1.4.6.1 單因素試驗
a.發酵菌種的選擇
經預處理后將拐棗與混合果蔬按照1∶4的比例混合,調配時加入30%的混合糖,將樣品進行編號1~4,分別加入酵母菌2%、乳酸菌2%、混合菌2%、混合菌4%。在溫度為30 ℃條件下進行發酵,每天取發酵液測定pH,直至pH穩定后結束發酵進行還原力和SOD酶活力的測定。
b.加糖量的選擇
前處理方式不變,將樣品進行編號1~4,分別在調配時加入20%混合糖(紅糖與白砂糖的比例為1∶1)、30%的混合糖、40%的混合糖、50%的混合糖,每個樣品均添加2%的混合菌種,然后在30 ℃條件下進行發酵,每天取發酵液測定pH,直至pH穩定不再下降后取發酵液經預處理后進行還原力和SOD酶活力的測定。
c.發酵溫度的選擇
前處理方式不變,調配時加入30%的混合糖與2%的混合菌,將樣品進行編號1~4,分別在25,30,35,40 ℃條件下進行發酵,每天取發酵液測定pH,直至pH穩定不再下降后取發酵液經預處理后進行還原力和SOD酶活力的測定。
1.4.6.2 正交試驗
在單因素的基礎上設計正交試驗(見表1),考察加糖量、發酵溫度和接種量3個因素共同作用對拐棗果蔬酵素的影響,發酵結束后對發酵液的還原力和SOD酶活性進行測定,每個樣品重復測定3次,最后結果取平均值,根據測定結果最終選擇出最優工藝條件。

表1 發酵工藝優化正交試驗因素與水平Table 1 The factors and levels of orthogonal experiment for optimization of fermentation process
1.4.7 驗證試驗及發酵過程中pH值、還原力和SOD酶活性的變化規律
按照正交試驗所得到的最優工藝,重新制作一批樣品,并每天取發酵液測定其pH值、還原力和SOD酶活力。
2 結果與分析
2.1 純菌種的篩選結果

表2 酵母菌和乳酸菌菌落及菌株形態特征Table 2 The colonies and morphological characteristics of yeast and lactic acid bacteria
將分離出來的疑似酵母菌和疑似乳酸菌的菌種分別進行純化,挑取單菌落鏡檢,根據表2的酵母菌和乳酸菌菌落及菌株形態特征選取形態不同的菌株進行保藏,分別挑選出2株酵母菌和1株乳酸菌進行生物學鑒定。
2.2 生物學鑒定結果
2.2.1 酵母菌測序結果
將所得序列剪切后在NCBI數據庫中進行Blast比對,J-1-1及J-1-2與釀酒酵母菌(Saccharomycescerevisiae)的同源性為100%,故鑒定為釀酒酵母菌(Saccharomycescerevisiae),其中酵母菌J-2-1和J-1-1的系統發育樹見圖1。

圖1 酵母菌J-1-1和J-2-1基于18S rRNA序列 進行構建系統發育樹Fig.1 Phylogenetic tree of Saccharomyces J-1-1 and J-2-1 based on 18S rRNA sequence
2.2.2 乳酸菌鑒定結果
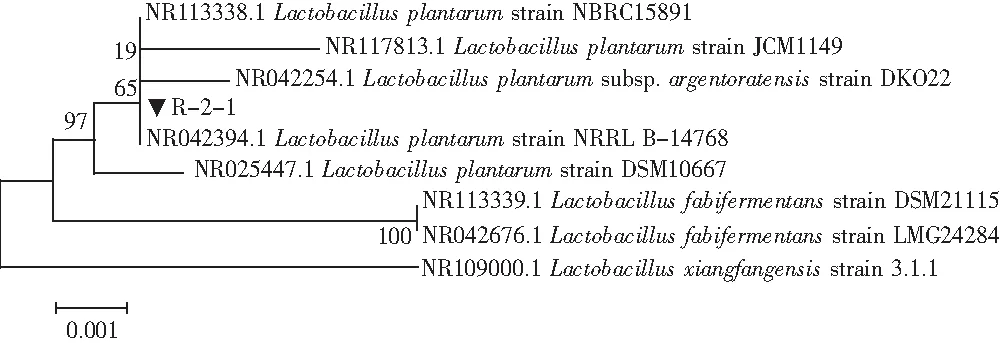
圖2 乳酸菌R-2-1基于16S rRNA序列進行構建系統發育樹Fig.2 Phylogenetic tree of Lactobacillus R-2-1 based on 16S rRNA sequence
檢測發現R-2-1與植物乳桿菌(Lactobacillusplantarum)的同源性為100%,故鑒定為植物乳桿菌(Lactobacillusplantarum),菌株R-2-1的系統發育樹見圖2。
2.3 發酵菌種的選擇結果
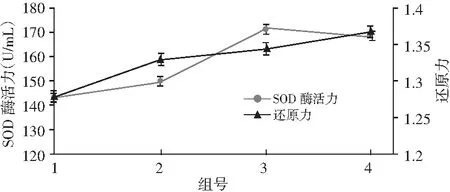
圖3 不同菌種添加量對SOD酶活力和還原力的影響Fig.3 The effects of different strains' additive amount on SOD enzyme activity and reduction ability
由圖3可知,混合菌種添加的發酵效果均優于單菌種添加,且只添加乳酸菌(第2組)的發酵效果要明顯優于只添加酵母菌的(第1組)。其中第3組添加混合菌種量2%和第4組添加混合菌種量4%的發酵效果有差異,說明適宜的菌種種類與菌種添加量對酵素的品質有很大影響。
2.4 加糖量的選擇結果
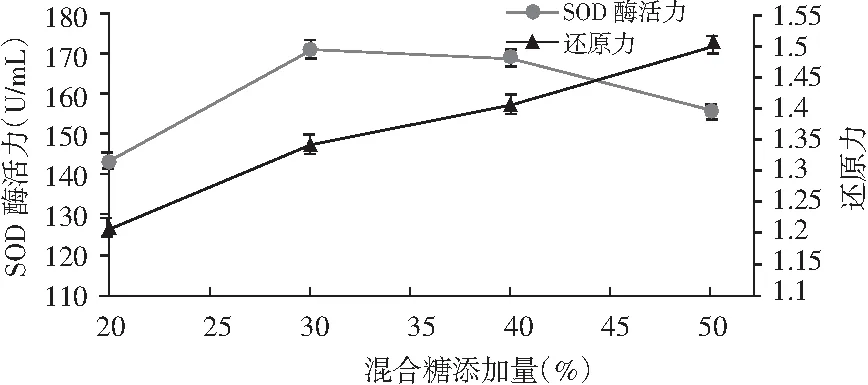
圖4 不同糖添加量對SOD酶活力和還原力的影響Fig.4 The effects of different sugar additive amount on SOD enzyme activity and reduction ability
由圖4可知,糖的添加量對酵素的SOD酶活力和還原力均會產生很大影響,隨著糖添加量的增大,SOD酶活力出現先增大后降低的現象,這可能是過高的糖添加量反而會抑制微生物的生長繁殖,最終導致所產酶活力下降。還原力隨著糖添加量的增大一直增大,這可能是由于糖添加量增多,被微生物分解成還原糖的量也越大,所以最終導致發酵結束時還原力很大。
2.5 溫度的選擇結果
由圖5可知,過高的溫度和過低的溫度均不利于酵素的發酵,隨著溫度的升高,拐棗果蔬酵素的SOD酶活力和還原力出現先上升后下降的趨勢,在35 ℃時SOD酶活力和還原力均達到最大值,這可能與所添加的酵母菌和植物乳桿菌的最適溫度有關系。
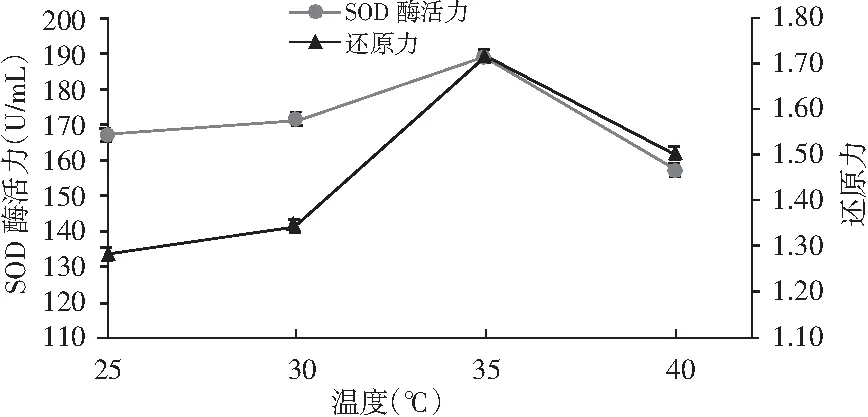
圖5 溫度對SOD酶和還原力的影響Fig.5 The effect of temperature on SOD enzyme and reduction ability
2.6 正交試驗結果
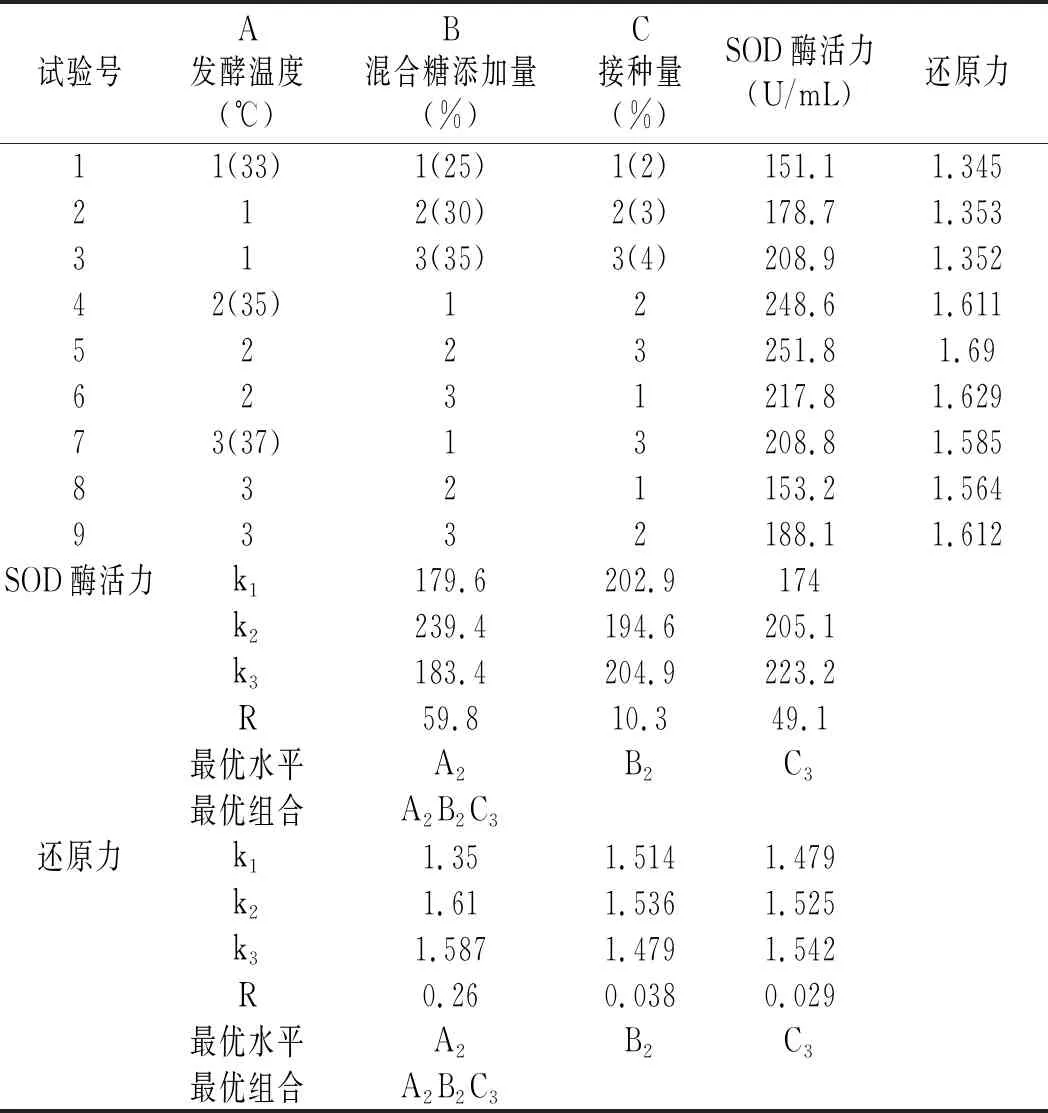
表3 發酵工藝正交試驗結果與分析Table 3 The results and analysis of orthogonal experiment for fermentation process
由表3極差值分析可知,影響酵素樣品SOD酶活力的因素主次順序為A>C>B,發酵溫度是影響酵素樣品SOD酶活力的最主要因素,這可能是由于溫度極大地影響了微生物的生長繁殖,因而影響了酵素的產物組成。影響酵素樣品還原力的主次順序為A>B>C,溫度對還原力的影響最大。對于SOD酶活力和還原力而言,兩種指標均越大越好,所以從兩種指標都可得出最優組合是A2B2C3。
2.7 驗證試驗結果與發酵過程中各指標變化規律
由圖6可知,在正交試驗所得最佳工藝條件下發酵,即發酵溫度35 ℃,混合糖添加量30%,接種酵母菌和植物乳桿菌按1∶1比例混合的混合菌4%,所得的拐棗果蔬酵素pH為3.64,SOD酶活力為252 U/mL,還原力為1.690,發酵時間為5 d。在發酵過程中前3 d pH值變化最明顯,然后趨于平穩,在第6天有少許上升。還原力和SOD酶活力均呈現先上升后下降的趨勢,其中還原力在第3天達到最大值,然后逐漸下降至比較平穩。
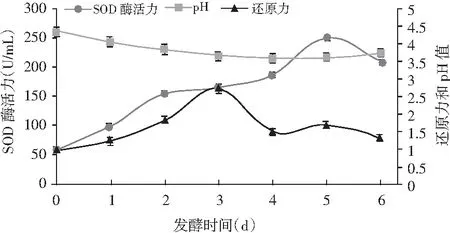
圖6 發酵過程中各指標的變化Fig.6 The changes of indexes during fermentation
3 結論
拐棗的營養豐富,目前應用拐棗制作酵素的報道比較少見,自然發酵的拐棗果蔬酵素發酵周期長,加糖量多。本試驗從自然發酵的拐棗果蔬酵素中分離篩選出3株純菌種,經分子生物學鑒定,2株酵母菌皆為釀酒酵母,1株乳酸菌為植物乳桿菌。將篩選出來的酵母菌和乳酸菌應用于拐棗果蔬酵素的復合發酵工藝,通過單因素試驗和正交試驗最終得到最優工藝為發酵溫度35 ℃,混合糖添加量30%,兩菌種各添加2%。在此工藝條件下發酵5 d所得的拐棗果蔬酵素SOD酶活力為252 U/mL,還原力為1.690,色澤呈淺紅棕色,口味酸甜,有拐棗固有風味且無澀味。比較未添加拐棗的酵素,其含有更多的黃酮類和多酚類物質,且更不易被雜菌污染。

