過客淋巴細胞相關的ABO非同型肝移植后引發重度貧血1例
肖艷麗, 李代紅, 劉 偉
(天津市第一中心醫院輸血科,天津 300192)
肝臟器官移植作為治療慢性肝功能衰竭最有效的治療方法之一,其需求越來越大,而為了彌補其供體來源的局限性,ABO非同型的肝移植例數也在不斷增長。當供體肝移植物中殘存的淋巴細胞被轉移至受體中時,會產生抗受體紅細胞的同種抗體并繼發黃疸和溶血性貧血等一系列的臨床癥狀,發生過客淋巴細胞綜合征(passenger lymphocyte syndrome,PLS)。PLS一般表現為IgG介導的血管外溶血和網織紅細胞增多癥。在天津市第一中心醫院進行的1例肝移植發生移植術后過客淋巴細胞引起的嚴重溶血性貧血(供體B型RhD陽性,受體AB型RhD陽性),經皮質激素和輻照洗滌紅細胞輸注治療后,效果良好。
1 病例資料
患者,女,53歲,AB型及RhD陽性,主因“發現乙型肝炎病毒感染20余年,乏力1個月”入院,臨床診斷:乙型肝炎肝硬化,門靜脈高壓癥,脾切除,經頸靜脈肝內門體分流術(transjugular intrahepatic portosystemic shunt,TIPS)術后及膽囊切除術后,于2018年5月靜脈復合全麻下行原位肝臟移植術,供肝B型RhD陽性,質量完好。術前檢查總膽紅素32 μmol/L,直接膽紅素16 μmol/L。手術過程順利,共輸注交叉配血相合的去白懸浮紅細胞AB型8 U,新鮮冰凍血漿1 980 mL,冷沉淀10 U。術后血紅蛋白97 g/L,靜脈補液,維持內環境穩定。肝臟移植術后早期給予厄他培南抗感染治療,給予FK506和甲潑尼龍琥珀酸鈉抗排斥,同時給予保肝、抑酸、護肝、抗凝等治療,密切觀察患者病情變化。之后患者血紅蛋白穩定在100 g/L左右。術后第8天,血常規檢查:血紅蛋白下降至72 g/L,總膽紅素上升至34 μmol/L,患者無明顯的貧血癥狀,腹部超聲示移植肝及血流未見明顯異常,肝內外膽管無擴張,排除其他出血情況,給予一般治療。直至術后第14天,患者自覺呼吸困難憋氣,皮膚黃染加重,血紅蛋白下降至46 g/L,總膽紅素上升至59 μmol/L(表1),網織紅細胞絕對值209×109/L,申請AB型RhD陽性懸浮紅細胞輸注。血型復檢時發現正反定型不一致并且配血時主次側均凝集。重新抽取血樣進行進一步鑒定。
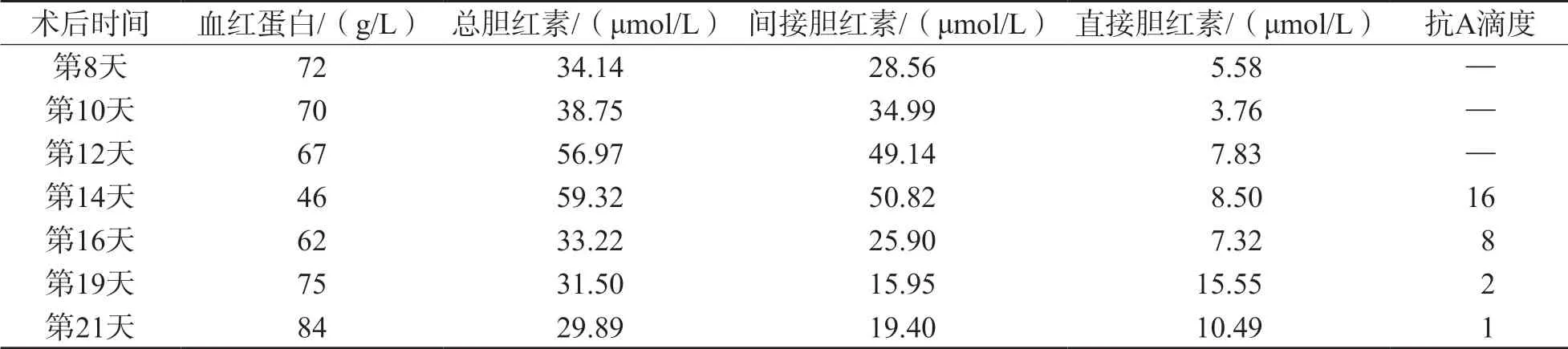
表1 肝臟移植后實驗室指標變化
2 血型血清學試驗
2.1 試劑與儀器
抗A抗B血型定型試劑(單克隆抗體)、Rh D(IgM)血型定型試劑(單克隆抗體)、人ABO反定型用紅細胞試劑盒(上海血液生物醫藥有限公司);紅細胞血型抗體篩選細胞(微柱凝膠法)、人ABO反定型紅細胞測定試劑盒(微柱凝膠法)、ABO-Rh血型檢測卡(微柱凝膠法)、抗人球蛋白檢測卡(微柱凝膠法)均購自西班牙Diagnostic Grifols. S.A.公司;ERYTRA全自動血型分析儀(西班牙Diagnostic Grifols.S.A.公司)。
2.2 血型鑒定
患者術前的血型鑒定為AB型RhD陽性,圖1。術后第14天的血型復檢結果見圖2和表2。

圖1 患者術前血型鑒定結果

圖2 患者術后第14天血型復檢結果
2.3 抗體篩選試驗
使用2種方法檢測意外抗體情況:鹽水介質試管法檢測IgM類抗體,抗人球蛋白卡檢測IgG類抗體,均顯示為陰性,排除抗A抗B以外同種抗體存在的可能性,術后14 d與自身細胞有凝集,提示含有IgG類抗體。見表3。
2.4 直接抗人球蛋白試驗
將患者標本離心后,取壓積紅細胞配成2%~3%的紅細胞懸液,取50 μL加入到微柱凝膠抗人球蛋白檢測卡中,配套離心機離心5 min(90×g 2 min,250×g 3 min),結果陽性(4+),證明患者的紅細胞被致敏,存在IgG類抗體。
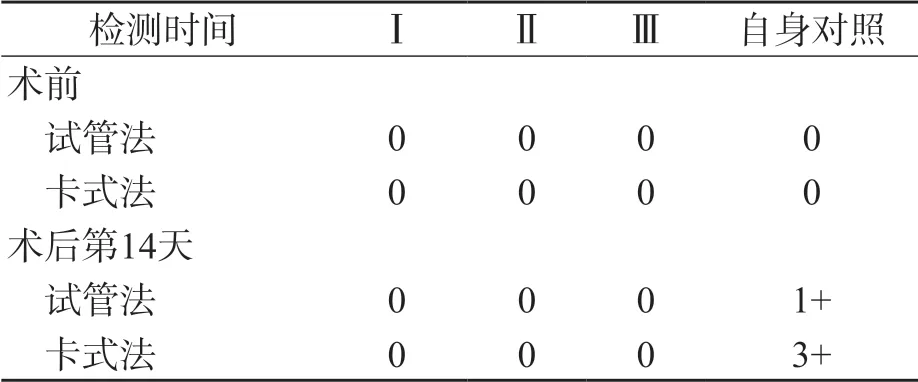
表3 患者抗體篩查結果
2.5 放散試驗
患者紅細胞在56 ℃進行熱放散,放散液分別于A1c、Bc、Oc和抗篩細胞進行反應,反應結果為:與A1c反應凝集強度為2+,與Bc、Oc、Ⅰ、Ⅱ、Ⅲ號抗篩細胞反應為陰性。
2.6 抗體滴度檢測
將患者標本離心后對血漿進行倍比稀釋,用抗人球蛋白法檢測抗體效價。結果顯示抗A抗體效價為16,此后在術后第16天、第19天、第21天進行檢測,抗體滴度明顯下降。見表1。
2.7 輸血治療
受者血清中檢出抗A抗體,經放散試驗證實患者紅細胞被IgG抗A抗體致敏,抗體滴度為16,直接抗人球蛋白試驗4+,抗體篩選為陰性,判斷為PLS。臨床作出診斷后鑒于患者含抗A抗體,為安全起見,改為輸注O型輻照洗滌紅細胞4 U,同時靜脈輸注甲潑尼龍,輸血后血紅蛋白由46 g/L上升至62 g/L,總膽紅素由59 μmol/L下降至33 μmol/L,抗A抗體滴度由16下降到8。術后第21天,抗體效價明顯下降為1,膽紅素水平也逐漸下降,患者貧血癥狀明顯緩解。
3 討論
PLS一般發生在實體器官移植后,骨髓造血干細胞移植[1]或輸注富含B淋巴細胞的細胞治療后[2-3]。 供體過客B淋巴細胞在移植肝臟、腎臟、心臟/肺或其他實體器官后,對受者的紅細胞產生了抗A或抗B免疫抗體[4],常常引起溶血性貧血。PLS主要發生在ABO非同型的器官移植和骨髓移植中,尤以O型供者、A型受者的病例常見,主要是由于O型血的個體更易產生IgG的抗A或抗B抗體[5-6]。另外,ABO血型系統以外的血型抗體,如MNS系統、Kidd系統、Kell系統和Lewis系統的抗體也較易引發PLS[7]。PLS產生的抗體一般有7~14 d的潛伏期,一般在術后3個月抗體水平減弱至消失[8]。有學者提出,在ABO非同型的肝臟移植中抗體的來源途徑為供肝的過客淋巴細胞,供者肝臟中的淋巴細胞不會因為灌洗而減少,其原因可能是肝臟中的淋巴細胞相關抗原1(lymphocyte function-associated antigen-1,LFA-1)的功能很強,該分子又與細胞間黏附因子-1(intercellular adhesion molecule-1,ICAM-1)發生聯系而使其表達增強,最終處理后的供肝淋巴細胞總數為(5.3±2.9)×109個,幾乎達到整個外周血中的淋巴細胞總數的1/2[9]。肝移植再灌注后,最初的免疫反應是供體淋巴細胞釋放入外周血,而受體淋巴細胞則向移植物聚集。肝移植術后供體的大量淋巴細胞會從血液循環進入組織成為衍生淋巴細胞,可在血液、淋巴結和皮膚中存在[9]。這類PLS引起的貧血比較嚴重,需要及時采取針對性的輸血支持治療。
本例患者發生嚴重貧血的時間是在術后第14天,血紅蛋白下降,總膽紅素升高,血清學鑒定檢出IgG抗A抗體,直接抗人球蛋白試驗陽性,血紅蛋白由100 g/L下降至46 g/L,肝移植后患者由于使用免疫抑制劑,免疫力降低,因此引起的貧血較為嚴重。臨床決定給予輸血治療,立即改輸O型輻照洗滌紅細胞,同時給予抗排斥藥物治療,患者的貧血癥狀改善。
目前,國內外對于PLS的預測和治療還未形成統一的標準,臨床治療策略也都是個案報道。但大家普遍認為治療的基本原則是糾正貧血,去除抗體,減少B細胞的增殖[10]。中度到重度PLS的主要治療方法是輸注不與供體來源的抗體發生反應的紅細胞。在大多數情況下,PLS可自行緩解。對于較為嚴重的溶血,可以進行洗滌紅細胞和冰凍血漿輸注,并對洗滌紅細胞進行輻照處理,可以預防輸血相關的移植物抗宿主病(graft-versus-host disease,GVHD)發生,并且新鮮冰凍血漿也應該進行病毒滅活,盡可能為患者提供輸血保護,降低輸血不良反應,減少新的抗體輸入[10]。王文婷等[11]的報道同樣提出對PLS的患者所輸注的血液制品均應進行輻照和病毒滅活。此外,利用抗CD20單克隆抗體治療可以減輕溶血程度[12],大劑量的腎上腺皮質激素治療聯合洗滌紅細胞,外加維持足夠的腎血流量,血漿置換,必要時行脾切除術,也是臨床推薦的治療策略[13]。
綜上所述,對于臨床進行的ABO非同型的肝移植,當發生黃疸及溶血癥狀加重時,應高度懷疑PLS的發生,并作出及時、正確的診斷。因為在肝移植的并發癥中,PLS的發生率高達30%,如果沒有正確而適合的輸血支持,PLS相關貧血的嚴重程度可能會危及患者生命。結合本例報道,此類患者的輸血原則是輸注Rh同型O型去白輻照洗滌的紅細胞。

