修復植物化學鏈氣化中重金屬遷移熱力學平衡分析
諶 通, 金保昇, 王曉佳
(東南大學 能源與環境學院 能源熱轉化及其過程監控教育部重點實驗室,江蘇 南京 210096)
隨著工業化進展的日益加快,不科學的生產方式致使土壤中的重金屬明顯高于原生含量,土壤重金屬污染正成為日益嚴重的環境問題,特別是在工業地區污染問題尤為嚴重。根據中國環境保護部和國土資源部2014年的《全國土壤污染調查公報》,中國大約有5.48×106hm2的土壤處于嚴重污染的狀況,農業部環保監測數據顯示有超過10%的耕地受到重金屬污染,土壤污染問題亟待解決[1-3]。植物修復技術是一項修復土壤重金屬污染的綠色環保技術,其原理是利用超富集植物吸收土壤重金屬,并通過收獲植物帶走重金屬污染物,清除環境中污染物。該技術具備投資少、成本低、經濟盈利、對土壤環境擾動小、不破壞場地結構、美化景觀、應用面積大等優點[4]。自從20世紀80年代問世以來,已經開始進入產業化初期階段,且因其技術獨特及經濟優勢,逐漸發展成為污染治理的重要途徑之一。
然而植物修復過程中會產生大量的收獲物,這些收獲物中往往含有極高濃度的重金屬,屬于危廢,如果處置不當極有可能成為新的污染源。因此,收獲物的安全處置是植物修復領域所面臨的重要問題,如何科學處置修復過程產生的含重金屬植物收獲物已經成為限制該技術發展的關鍵問題之一[5-6]。傳統的處置技術包括焚燒法[7-8]、堆肥法[9-10]、壓縮填埋法[11-12]、液相萃取法[13-14]、熱解法[15-16]等,這些技術經過多年發展,技術路線較為成熟,但都存在一些不容忽視的問題[7-16]。相對于傳統熱處置,化學鏈燃燒(Chemical-looping combustion, CLC)是近年來新興的且被認為是具有前景的燃燒技術[17-20],而化學鏈氣化技術(Chemical looping gasification, CLG)是基于化學鏈燃燒理論基礎發展而來的一種新型氣化技術[21-22]。與CLC工藝相比,CLG的目的不是充分燃燒燃料產生熱量,而是將其部分氧化以獲得高熱值氣體[23]。該技術分為2個過程:還原過程中,利用載氧體(OC)向燃料提供氣化所需的O元素;氧化過程中,失去晶格氧的載氧體在空氣中氧化,重新參與新一輪反應。用于化學鏈氣化的載氧體有金屬載氧體和非金屬載氧體2類。金屬載氧體中的天然鐵礦石由于具有廉價和良好的環境友好特點成為研究焦點[24]。以非金屬氧化物為活性組分的代表是CaSO4載氧體,其具有對環境無污染、廉價等特點[25]。通常把活性組分負載到相應的惰性載體上,使得活性組分比表面積大大增加、孔結構也變得更加發達,可獲得良好的反應特性。目前,使用較多的惰性載體主要有膨潤土、Al2O3、SiO2、TiO2、高嶺土、凹凸棒土等[26]。
國內外學者已經開展了很多生物質化學鏈氣化的研究。Wei等[27]在10 kW連續進料的雙流化床上進行生物質化學鏈氣化的研究,得到了鐵基載氧體在CLG中具有良好的反應性與抗腐蝕性的結論。Xiao等[28]研究了化學鏈制氫的過程,并以生物質快速熱解所產生的生物油重質組分作為原料,以4種鐵礦石為載氧體,證明了該技術的可行性與優越性。鄭瑛等[29]通過熱力學分析,證實了硫酸鹽CaSO4作為潛在載氧體的可行性。沈來宏等[30]對煤的CaSO4串行流化床實驗進行了熱力學模擬,分析了燃料反應器內水煤氣反應中CaSO4以及金屬氧化物載氧體還原反應熱力學特性參數,結果表明CaSO4是煤化學鏈燃燒反應理想的載氧體。Song等[31]用循環流化床反應器進行了長時間的循環實驗,驗證了CaSO4作為載氧體用于循環流化床反應的可行性。
鑒于目前對生物質化學鏈氣化已進行了大量的研究,并得出了生物質化學鏈氣化具有優越性的結論,而修復植物屬于生物質的一種,對其采用化學鏈氣化的方式處置具有技術可行性。修復植物體內富集了大量重金屬,而針對化學鏈氣化過程中重金屬遷移、排放、控制的研究卻鮮有報道。與傳統熱化學工藝產物直接釋放不同,在化學鏈工藝中有產物接觸載氧體這一特別環節,因此重金屬與載氧體的接觸不可避免。另外重金屬和載氧體可能會發生物理或化學吸附,提供了重金屬脫除的途徑。因此化學鏈工藝中重金屬的遷移規律與其他工藝相比可能存在很大區別,具有研究的價值。高溫熱化學過程中,微量的重金屬物理化學形態無法檢測,Abanades等[32]特別指出,熱力學平衡計算是復雜多組分、多相系統中預測重金屬物相唯一有效的方法。研究表明該方法足以定性解釋大多數重金屬的行為特性。鑒于此,筆者基于Gibbs自由能最小化原理,開展修復植物化學鏈氣化過程中重金屬遷移的熱力學模擬,重點研究反應器溫度、氣氛和載氧體種類對重金屬形態分布和遷移特性的影響規律。
1 實驗部分
1.1 原料
所研究的修復植物為湖南某工廠修復基地的東南景天收獲物;鐵礦石來自河北省壽寧縣的貧鐵礦廢渣;無水硫酸鈣,分析純,上海展云化工有限公司產品;SiO2、Al2O3粉末,分析純,國藥集團化學試劑有限公司產品;黏結劑為羧甲基纖維素,河南元春化工有限公司產品。
1.2 物料特性
修復植物東南景天露天曬干后置于溫度為 105 ℃ 的烘箱烘干8 h,其元素分析與工業分析見表1。植物樣品中的重金屬含量采用石墨爐消解-原子吸收分光光度計測量的方法獲得,消解體系為HNO3-HCl-HClO3-HCl,消解方法參照US EPA Method 305B。由于重金屬在樣品中屬于微量元素,為了提高重金屬測量精度,將同一樣品進行3組平行測量,取平均值作為測量結果,如表2所示。

表1 修復植物的元素和工業分析Table 1 Ultimate analysis and proximate analysis of the phytoremediating plant

表2 修復植物中重金屬和堿金屬質量分數Table 2 Heavy metal and alkali metal mass fractions in phytoremediating plant w/(mg·kg-1)
1.3 載氧體的制備
鐵基載氧體的制備:將天然貧鐵礦石破碎,篩選粒徑0.18~0.28 mm的顆粒,送入950 ℃的馬弗爐中煅燒8 h,達到去除硫分等雜質和增強機械強度的目的。鐵基載氧體的XRD表征結果顯示鐵基載氧體的主要物相為Fe2O3、Al2O3、SiO2。XRF測量結果顯示Fe2O3、SiO2和Al2O3的質量分數分別為51%、23.1%、12.6%。
為便于對比,用機械法制備的鈣基載氧體活性成分CaSO4的質量分數與鐵礦石中的Fe2O3相等,并且分別比較了Al2O3與SiO2惰性載體性能。其制備流程為:將CaSO4粉末與Al2O3或SiO2粉末混合均勻后(CaSO4的質量分數為51%),放入黏結劑(羧甲基纖維素CMC),每100 g混合粉末加入約 8 g 黏結劑,并加適量去離子水充分揉和,直至所有粉末黏結成團。將黏團放入擠條機擠成條狀,自然晾干后在105 ℃的烘箱中烘干3 h,然后放入950 ℃的馬弗爐中煅燒3 h,冷卻后破碎。
1.4 熱力學計算
采用HSC chemistry熱力學軟件中平衡組成模塊(Equilibrium composition),基于吉布斯自由能最小化法,即在等溫等壓條件下以體系的Gibbs自由能最小作為平衡判據,求解此時各個產物的組成和濃度。計算模型如圖1所示,系統的輸入初始值根據上述各種樣品的元素分析、XRD、XRF和ICP測量值折算成物質的量確定。其中由于重金屬具體化學形態測量困難極大,為了便于說明形態遷移變化的一般性問題,以元素態的重金屬輸入系統。溫度區間考慮為400~1200 ℃,反應壓力為常壓0.1 MPa,計算點設為32個。由于重金屬是痕量元素,在自然界中不斷富集,計算中考慮了大于重金屬輸入量億萬分之一的生成形態。氣氛考慮N2和水蒸氣,水蒸氣的輸入量按n(Steam)/n(C)=1.2輸入(水蒸氣與原料中C元素摩爾比)。為了方便計算,設定輸入修復植物量為1 kg,載氧體與原料的質量比為3∶1,其中2種載氧體中的活性成分Fe2O3與CaSO4的質量分數相等,鈣基載氧體的惰性載體分別以Al2O3與SiO2單獨進行研究。熱力學模擬物相的選擇調用HSC chemistry中的Gases、Condensed、Liquids數據庫,并用“Select class 1”功能去除一些難以形成的物質。
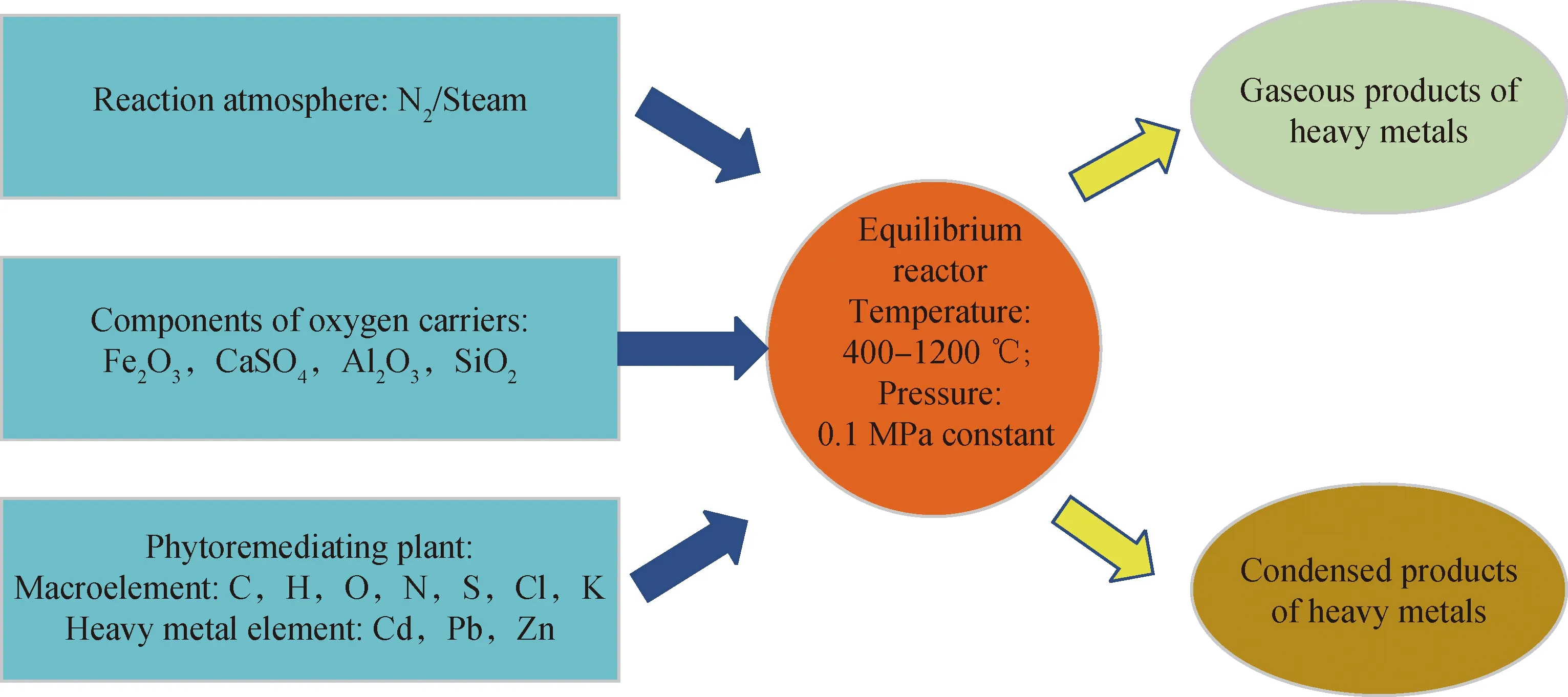
圖1 熱力學平衡計算示意圖Fig.1 Schematic diagram of thermodynamic equilibrium calculation
2 結果與討論
2.1 無載氧體加入時修復植物熱解/氣化的重金屬遷移轉化熱力學模擬
2.1.1 Cd的形態分布
由于計算考慮了生成量大于重金屬輸入量的10-12的生成物,為了便于計算結果的呈現與分析,以下的數據圖中將大于各重金屬輸入物質的量1%的生成物在線性坐標中顯示,小于輸入物質的量1%的生成物在對數坐標顯示。特別說明,跨越線性坐標區和對數坐標區的線對接會存在一些偏差,以數據點表示的值為準。圖2為不同氣氛下修復植物熱解/氣化過程Cd的熱力學平衡分布。由圖2(a)看到,在N2氣氛下的熱解過程中,生物質中的Cd主要生成形態有氣態Cd(g)和熔融態Cd,少量及微量的生成形態有CdS、CdO、CdCO3、Cd(OH)2、Cd(OH)(g)、Cd(OH)2(g)、CdH(g)、CdCl(g)、CdCl2、CdO(g)。在系統溫度較低時,Cd主要以熔融態存在;隨著溫度升高,熔融態的Cd含量逐漸下降并向氣態的Cd(g)轉化;750 ℃以后Cd(g)成為系統中含量最多的Cd生成物;當溫度升到1200 ℃,系統中的Cd元素近乎100%以氣態 Cd(g) 的形式揮發。CdCO3、CdO、Cd(OH)2、CdS、CdCl2含量隨著溫度的升高急劇下降。系統中的Cd氣態揮發物還有少量的氫化物、氫氧化物和氯化物,其中CdCl(g)、CdOH(g)、CdH(g)的含量隨溫度升高而上升,在高溫時成為除Cd(g)外的主要揮發態。
由圖2(b)可知,水蒸氣作為氣化介質時,與熱解相比,熔融態Cd的生成受到了抑制、Cd(g)的生成得到了促進。系統溫度在650 ℃時Cd(g)就達到近乎100%的摩爾分數。與熱解時相比,水蒸氣的加入明顯促進了Cd(OH)(g)、Cd(OH)2(g)的揮發,但對氯化物的揮發物影響不大。且由于水蒸氣提供了氧元素,使得CdO與CdCO3的含量與熱解時相比也有一定的增加。
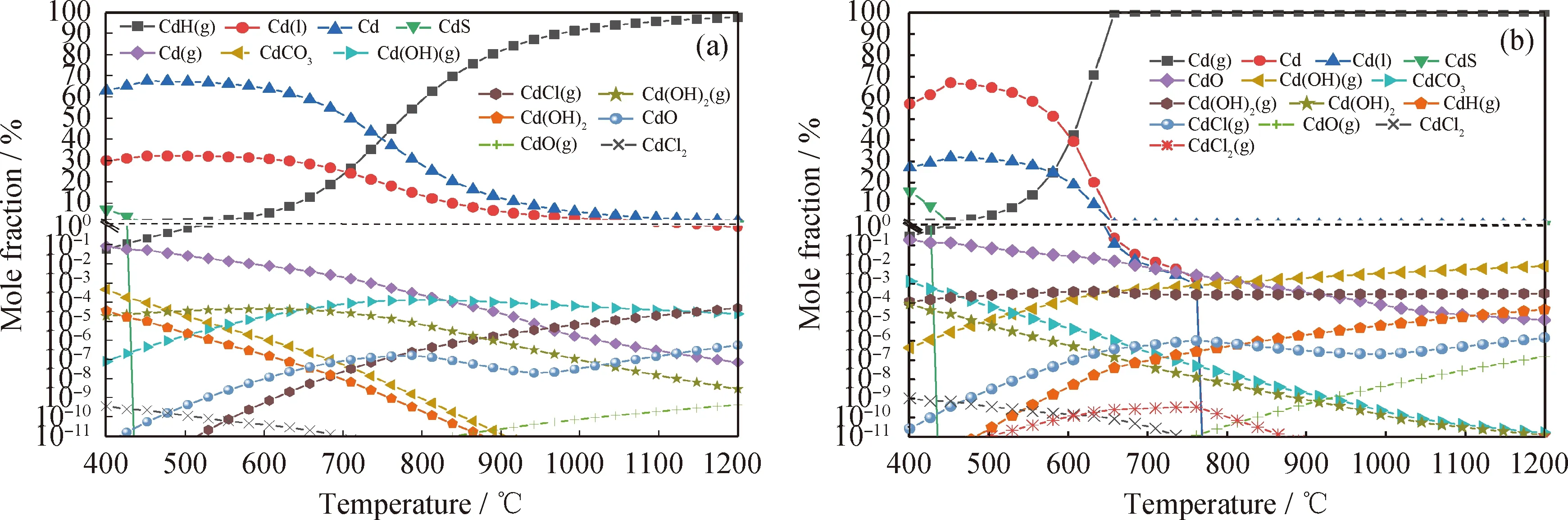
圖2 不同氣氛下修復植物熱解/氣化過程Cd的熱力學平衡分布Fig.2 Thermodynamic equilibrium distribution of Cd in the process of pyrolysis/gasification of the phytoremediating plant under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)=1 kg
2.1.2 Pb的形態分布
圖3為不同氣氛下修復植物熱解/氣化過程中Pb的熱力學平衡分布。由圖3(a)看到,在惰性氣氛N2下修復植物熱解時Pb元素的主要生成形態有熔融態Pb和氣態Pb(g),少量及微量的生成形態有PbS、PbH(g)、PbCO3、PbO、PbO(l)、PbO(g)、PbCl(g)、PbS(g)、Pb2(g)、PbCl2(g)。在所研究的溫度范圍內,修復植物熱解過程中的重金屬Pb幾乎都以熔融態Pb形式生成。氣態揮發物生成量較少,即使在最高溫度1200 ℃時Pb(g)的摩爾分數也只在5%左右,這主要是由于Pb具有較高的沸點。系統中也產生了較多Pb的氧化物和碳酸鹽,PbO主要以熔融態的形態生成,其含量隨溫度升高緩慢下降,而Pb的碳酸鹽較不穩定,隨溫度升高含量下降較快。除了Pb(g)的揮發,系統中也存在較多Pb氫化物PbH(g)和氯化物PbCl(g)的揮發。
由圖3(b)可知:水蒸氣明顯促進了系統中氣態Pb(g)的產生,在750 ℃左右熔融態Pb的摩爾分數急劇下降到0,Pb(g)含量迅速上升,800 ℃以后系統中的重金屬Pb幾乎100%以氣態Pb(g)揮發;Pb的氧化物和碳酸鹽含量顯著升高;水蒸氣的加入也大大促進了氣態揮發物PbCl(g)、PbCl2(g)和 PbH(g) 的生成。由此可見,水蒸氣對Pb的熱力學穩定性影響較大,能夠顯著促進Pb的氣態揮發。
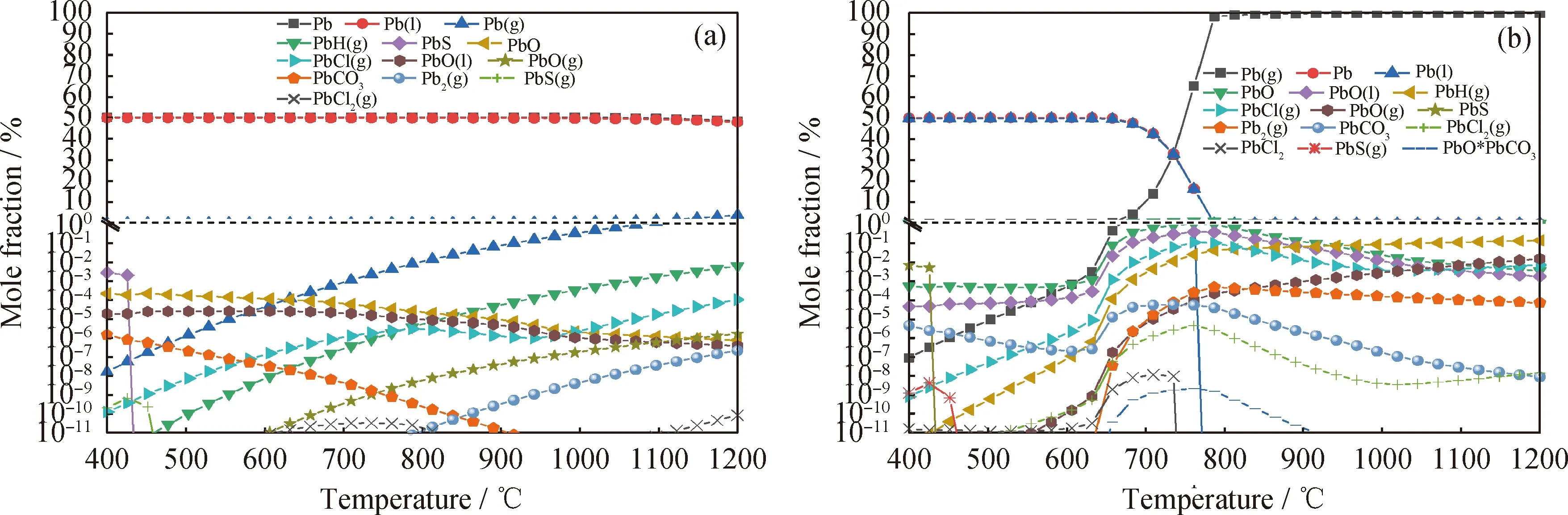
圖3 不同氣氛下修復植物熱解/氣化過程中Pb的熱力學平衡分布Fig.3 Thermodynamic equilibrium distribution of Pb in the process of pyrolysis/gasification of the phytoremediating plant under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)=1 kg
2.1.3 Zn的形態分布
圖4為不同氣氛下修復植物熱解/氣化過程Zn的熱力學平衡分布。由圖4(a)看到,在N2氣氛下修復植物熱解時Zn的主要生成形態有ZnO、Zn(g)、熔融態Zn以及ZnS。少量及微量的生成形態有ZnCO3、ZnH(g)、ZnOH(g)、ZnCl(g)、Zn(OH)2(g)、ZnCl2(g)、ZnO(g)、ZnCl2。在溫度低于700 ℃時,系統中生成了大量ZnO,成為重金屬Zn的主要生成形態,說明Zn很容易與燃料中的O結合形成氧化物。ZnO摩爾分數上升至最大值約99%后,隨溫度升高而逐漸下降。熔融態Zn的含量在600~800 ℃生成較多,800 ℃以后逐漸下降,并向氣態轉換,導致Zn(g)的含量劇增,在1200 ℃時約95%摩爾分數的Zn元素以氣態Zn(g)揮發。系統中氣態揮發物還有少量Zn的氫化物ZnH(g)、氫氧化物ZnOH(g)、Zn(OH)2(g)和氯化物ZnCl(g)、ZnCl2(g),氣態揮發物的含量總體上隨溫度的上升而增加。
由圖4(b)可知,水蒸氣作為氣化介質時,對熔融態的Zn以及氣態Zn(g)生成影響較大,熔融態Zn在水蒸氣氛圍下大幅度減少,導致氣態Zn(g)生成速率更快,900 ℃后達到近乎100%的生成量。水蒸氣主要作用是抑制了熔融態Zn的生成,導致 Zn(g) 的生成無過渡期,從而大量地生成,但對其他生成形態無明顯影響。
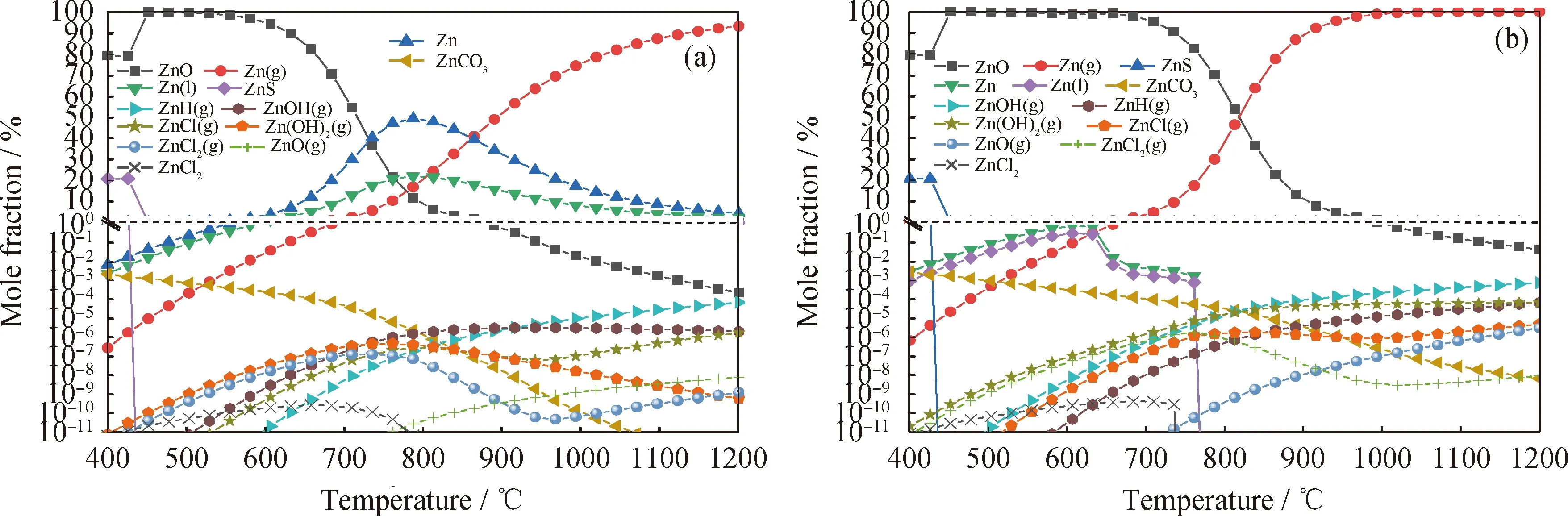
圖4 不同氣氛下修復植物熱解/氣化過程Zn的熱力學平衡分布Fig.4 Thermodynamic equilibrium distribution of Zn in the process of pyrolysis/gasification of the phytoremediating plant under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)=1 kg
2.2 鐵礦石作為載氧體時化學鏈氣化過程重金屬遷移轉化熱力學平衡分析
2.2.1 Cd的形態分布
圖5為不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程中Cd的熱力學平衡分布。由圖5(a)看到,在N2氛圍下的化學鏈氣化與熱解(圖2(a))相比,低溫下生成了更多的CdS,熔融態Cd的含量在425 ℃以后逐漸下降并向氣態Cd(g)轉化,熔融態Cd含量下降速率以及氣態Cd(g)生成速率與熱解時基本相當。鐵礦石的加入導致CdO的含量較熱解相比大量增加,此外,Cd與載氧體中的惰性成分SiO2、Al2O3反應生成化學性質更加穩定的CdSiO3和CdO·Al2O3。CdSiO3的生成量隨溫度升高迅速下降,而CdO·Al2O3的生成量相對穩定;但在所研究溫度范圍內,CdSiO3的生成量均大于 CdO·Al2O3的生成量。Cd的氣態氫氧化物和氯化物的生成量均大于熱解時的生成量,說明鐵礦石的化學鏈氣化促進了Cd的氫氧化物和氯化物的對外揮發。
由圖5(b)看到,在水蒸氣加入后,水蒸氣明顯抑制了熔融態Cd的形成,其生成量在550 ℃后開始急劇下降,750 ℃后幾乎不再出現。熔融態Cd的生成受抑制,從而導致氣態Cd(g)含量在450 ℃左右急劇上升,650 ℃后Cd元素幾乎100%以Cd(g)的形式生成,說明水蒸氣氣氛能明顯促進氣態Cd(g)的揮發。總體而言,水蒸氣的加入只改變了Cd的物理狀態的變化,導致氣態Cd(g)更容易揮發,對于化學結合沒有太大的影響。
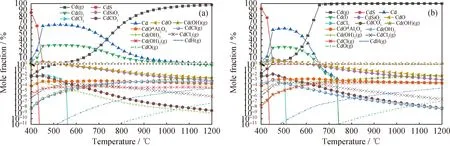
圖5 不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程中Cd的熱力學平衡分布Fig.5 Thermodynamic equilibrium distribution of Cd in the process of the phytoremediating plant CLG with iron ore as oxygen carrier under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)/m(OC)=1∶3
2.2.2 Pb的形態分布
圖6為不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程Pb的熱力學平衡分布。由圖6(a)看到:N2氣氛下以鐵礦石為載氧體的化學鏈氣化過程中,熔融態的Pb是研究溫度范圍內主要的生成形態;PbO的含量明顯高于熱解過程的;Pb與鐵礦石中的SiO2形成了更加穩定的PbSiO3和少量Pb2SiO4,具有一定的化學吸附效果,但與Al2O3不能發生反應;PbO和PbSiO3對溫度變化具有較好的適應性,熱力學穩定性較高,在400~1200 ℃范圍內能夠維持穩定的生成量;Pb的氣態氯化物在化學鏈氣化中更容易生成,其中PbCl(g)、PbCl2(g)的含量遠大于熱解時,并隨著溫度的升高而增加;超過700 ℃時,Pb(g)、PbCl(g)成為氣態揮發的主要形態。
由圖6(b)看到,水蒸氣氛圍對熔融態的Pb以及氣態Pb(g)的生成影響較大。熔融態Pb在600 ℃以上,生成量急劇下降,與此同時氣態Pb(g)生成量隨溫度升高迅速增加;PbO及PbSiO3的含量顯著增加,說明水蒸氣對生成固態物PbO與PbSiO3具有促進作用,有利于Pb的固化;620 ℃以后PbCl(g)的生成顯著增加,PbCl2(g)、PbCl4(g) 以及PbH(g)的揮發不受影響。
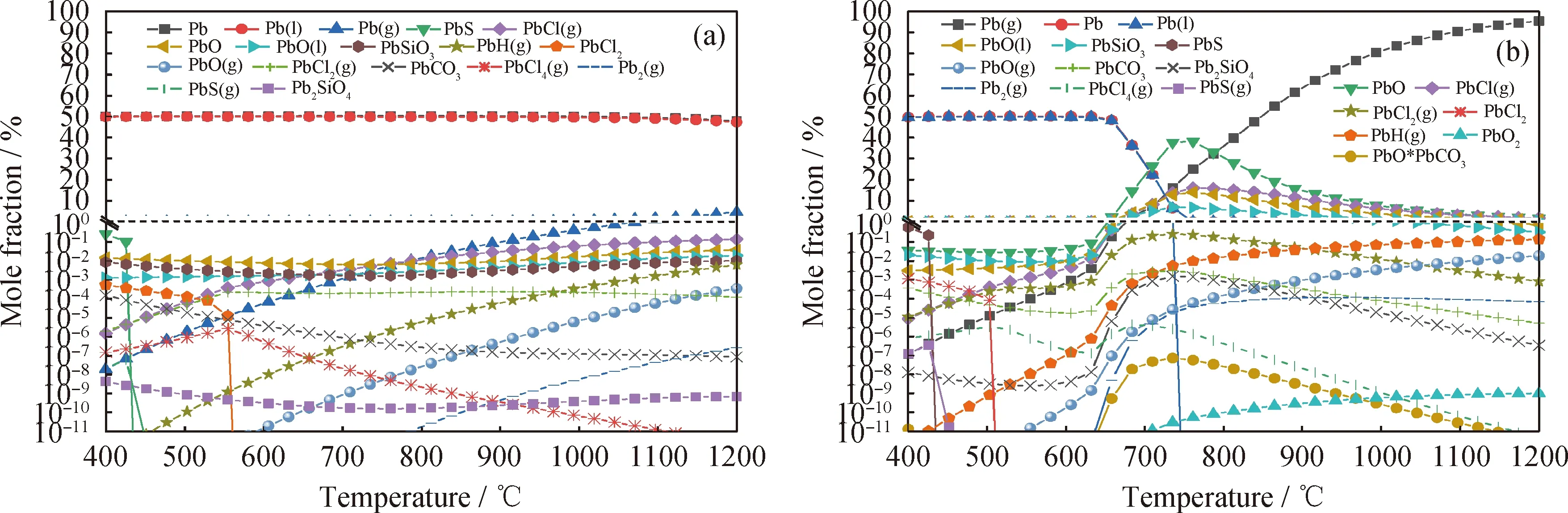
圖6 不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程中Pb的熱力學平衡分布Fig.6 Thermodynamic equilibrium distribution of Pb in the process of the phytoremediating plant CLG with iron ore as oxygen carrier under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)/m(OC)=1∶3
2.2.3 Zn的形態分布
圖7為不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程中Zn的熱力學平衡分布。由圖7(a)看到,N2氣氛下以鐵礦石作為載氧體的化學鏈氣化過程中,ZnO的生成量700 ℃以前明顯低于熱解(圖4(a))時的,但在700 ℃后遠遠大于熱解時的。熱解時ZnO的摩爾分數在800 ℃后迅速下降到1%以下,但是在鐵礦石的化學鏈氣化中能維持較為穩定的ZnO生成量,一直到900 ℃才開始下降,即使在1200 ℃的高溫下ZnO摩爾分數也能達到10%以上,說明鐵礦石下化學鏈氣化有利于高溫下Zn的氧化態形成,能促進Zn的固化;熱解時Zn(g)在700 ℃后隨溫度上升大量生成,但在鐵礦石的化學鏈氣化中延遲到900 ℃后才開始大量生成,說明鐵礦石的加入有利于抑制氣態 Zn(g) 的揮發;從熱力學計算結果來看,鐵礦石載氧體的活性成分和惰性成分均能與系統中的Zn發生反應,生成固態的ZnO·Al2O3、ZnFe2O4、Zn2SiO4、ZnSiO3和Fe2ZnO4,一定程度上抑制了Zn向氣態揮發物轉化。其中生成量最大的是 ZnO·Al2O3,在所研究的溫度范圍都能維持較高的生成量,在1000 ℃前其摩爾分數約占20%以上。ZnFe2O4的生成量主要集中在600 ℃之前,并隨溫度的升高而下降。Zn的硅酸鹽Zn2SiO4、ZnSiO3的生成量隨溫度的變化較為平緩,在中、低溫時生成量較大;Zn的氯化物和氫氧化物揮發分比同等情況下熱解時產生的更多,說明鐵礦石的化學鏈氣化對這一部分的揮發物生成具有一定的促進作用。
由圖7(b)看到,與N2氣氛相比,水蒸氣氣氛下ZnO的生成量得到進一步提升,Zn的熔融態的生成被抑制,對其他生成物影響不大。
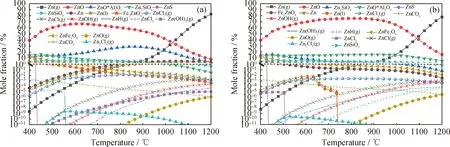
圖7 不同氣氛下鐵礦石作為載氧體時修復植物化學鏈氣化過程中Zn的熱力學平衡分布Fig.7 Thermodynamic equilibrium distribution of Zn in the process of the phytoremediating plant CLG with iron ore as oxygen carrier under different atmosphere(a) N2 atmosphere; (b) Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)/m(OC)=1∶3
2.3 2種載體的鈣基載氧體下化學鏈氣化過程重金屬遷移轉化熱力學平衡分析
2.3.1 Cd的形態分布
圖8為不同氣氛下修復植物在2種載體的鈣基載氧體化學鏈氣化過程中Cd的熱力學平衡分布。由圖8(a)、(c)所示:N2氣氛下,無論是以Al2O3還是SiO2作為載體,固態CdS的摩爾分數在 800 ℃ 以前都能達到90%以上。而在熱解和鐵礦石載氧體時,CdS在400 ℃左右就幾乎消失,可能因為CaSO4為系統引入了額外的S元素,導致系統中的S濃度提高,Cd更傾向與S結合,從而使熔融態Cd幾乎不生成,氣態Cd(g)的揮發也受到抑制,系統中只生成了少量CdS(g)揮發物。由圖8(a)可知:在以Al2O3為載體的過程中,CdS的生成量在 850 ℃ 左右出現了明顯的波動,可能是由于Al2O3導致了CdS的熱力學計算不穩定性;N2氣氛下2種載體的鈣基載氧體氣化過程中Cd的氯化物、氫化物和氫氧化物揮發物的含量也明顯低于熱解和鐵礦石載氧體,主要體現在CdCl(g)、CdCl2(g)生成溫度后移至約600 ℃左右,而且生成量也小于熱解和鐵礦石載氧體的化學鏈氣化,且沒有CdH(g)生成, Cd(OH)2(g)也幾乎不生成。
由圖8(b)、(d)看到:水蒸氣氣氛中,Al2O3為載體時CdS的熱力學不穩定性加劇,在900 ℃處有一較大的波動,并且其含量要小于在惰性氣氛中的,而SiO2為載體時CdS含量與在惰性氣氛中相比無明顯變化;熔融態Cd的生成量都顯著提高,甚至在高溫下都占據一定的份額,尤其以Al2O3為載體時較為明顯,與熱解和鐵礦石載氧體時明顯不同;由于高溫下出現了更多熔融態Cd,使得氣態揮發Cd(g)含量更少,有利于減少Cd的氣態揮發; Cd的氯化物、氫化物和氫氧化物揮發物的變化不大。
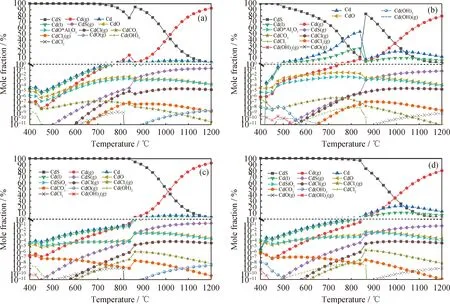
圖8 不同氣氛下修復植物在2種載體的鈣基載氧體化學鏈氣化過程中Cd的熱力學平衡分布Fig.8 Thermodynamic equilibrium distribution of Cd in the process of CLG of the phytoremediating plant with calcium-based oxygen carrier under different atmosphere and two carriers(a) OC: CaSO4&Al2O3, N2 atmosphere; (b) OC: CaSO4&Al2O3, Steam atmosphere;(c) OC: CaSO4&SiO2, N2 atmosphere; (d) OC: CaSO4&SiO2, Steam atmospherep=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1; m(Biomass)/m(OC)=1∶3; w(CaSO4)=51%
2種惰性載體的鈣基載氧體化學鏈氣化中,Al2O3與SiO2都能與Cd發生反應,生成穩定且熔點高的CdO·Al2O3及CaSiO3,達到化學固化的作用,從熱力學計算結果來看,2種氣氛下相同質量的Al2O3和SiO2載體下的CdO·Al2O3和CaSiO3生成量區別不大。總地來說,2種惰性載體對Cd的形態轉化影響不大。
2.3.2 Pb的形態分布
圖9為不同氣氛下修復植物在2種載體的鈣基載氧體化學鏈氣化過程中Pb的熱力學平衡分布。由圖9(a)、(c)看到:N2氣氛下生成了大量的PbS,其中以Al2O3為載體時,在溫度小于600 ℃時Pb元素近乎100%以PbS的形態生成;600 ℃后PbS含量開始下降,并在900 ℃附近出現波動,可能是由于Al2O3引起的熱力學不穩定性。而以SiO2為載體時,PbS的摩爾分數在溫度小于800 ℃時都能達到90%以上,900 ℃后開始下降。900 ℃后2種載體下的PbS生成量差別不大;熔融態Pb的生成量都明顯比同氣氛下熱解和以鐵礦石為載氧體時更少,Pb的氫化物揮發物不再生成。但由于鈣基載氧體引入S元素,導致高溫下氣態PbS(g)的大量生成,2種載體的鈣基載氧體化學鏈氣化中PbS(g)都從850 ℃開始大量生成,并隨溫度升高而增加,1200 ℃ 時有約50%的Pb以PbS(g)揮發;而在同氣氛下熱解和鐵礦石化學鏈氣化中氣態揮發物極少,1200 ℃時只有不到5%的Pb(g)揮發,因此CaSO4載氧體的加入明顯促進了氣態Pb的揮發。
由圖9(b)、(d)看到:水蒸氣氣氛下,2種載體下的PbS含量開始下降的起始溫度與N2氣氛時相比前移,熔融態Pb明顯增多,氣態PbS(g)含量大量降低。Al2O3作為載體時,PbS的生成量在 450 ℃ 時開始急劇下降到1%左右,熔融態的Pb也在450 ℃附近急劇增多并穩定在近100%的產量,后在850 ℃處略微下降并穩定在80%左右;而SiO2為載體時,PbS含量在500 ℃附近開始緩慢下降,熔融態Pb含量也在500 ℃附近緩慢上升,到 850 ℃ 后幾乎全部的Pb元素以熔融態生成,使得高溫下PbS(g)的生成量與N2氣氛相比急劇減少。總地來說,水蒸氣氣氛下的鈣基載氧體抑制了Pb的氣態揮發物的生成。
在2種氣氛下,惰性載體中只有SiO2能與Pb發生化學吸附生成了更加穩定的PbSiO3,而Al2O3不能與Pb發生反應;氣氛對PbSiO3無明顯影響。
2.3.3 Zn的形態分布
圖10為不同氣氛下修復植物在2種載體的鈣基載氧體化學鏈氣化過程中Zn的熱力學平衡分布。由圖10(a)、(c)看到:N2氣氛下的化學鏈氣化過程中,與Cd、Pb的情況相似,由于載氧體引入了更多的S元素,導致系統中ZnS生成量急劇上升,而且在所研究的溫度范圍內均占絕對優勢。在2種載體的鈣基載氧體化學鏈氣化中,ZnS生成摩爾分數在1100 ℃之前都能達到99%左右,即使在1200 ℃的高溫也能達到約90%。由于ZnS的主導作用,導致系統中幾乎沒有氣態Zn(g)揮發,只在1100 ℃后有少量的揮發,說明CaSO4載氧體的加入從熱力學上能以ZnS的形式顯著固化Zn。與同氣氛下鐵礦石載氧體時相比,系統中的ZnO和熔融態Zn的摩爾分數明顯減少,且都低于1%;Zn的氫化物以及氫氧化物不再生成,Zn的氯化物揮發物在鈣基載氧體中更不容易生成,生成溫度在700 ℃以后。此外在鐵礦石作為載氧體時,Zn易與Fe2O3發生反應消耗載氧體的活性成分,而鈣基載氧體更加穩定,其活性成分不易與Zn發生反應。
由圖10(b)、(d)看到,在水蒸氣氛圍下,與N2氣氛相比,以Al2O3為載體時在850 ℃之前生成了較多的ZnO·Al2O3,導致ZnS含量下降。水蒸氣對ZnO·Al2O3和ZnSiO3、Zn2SiO4的生成具有一定的促進作用,對ZnO·Al2O3的促進作用尤為明顯;對Zn(g)和Zn的氯化物的揮發無明顯影響。
在2種同質量分數惰性載體的鈣基載氧體中,Zn更傾向與Al2O3固化,且水蒸氣可以促進 ZnO·Al2O3的形成。
2.4 重金屬固化率分析
定義重金屬固化率為在熱力學計算結果中的非揮發性重金屬生成物的物質的量占輸入的各重金屬物質的量的百分比。圖11為2種氣氛下熱解/氣化、鐵礦石和不同載體的鈣基載氧體的修復植物化學鏈氣化中3種重金屬固化率隨溫度的變化曲線。由圖11 看到,總體上重金屬的固化率隨溫度的升高而下降。2種氣氛下的鐵礦石載氧體對Cd的固化與熱解/氣化相比略低,主要是因為更多Cd的氣態氫氧化物和氯化物生成,但在鈣基載氧體中的固化率優勢明顯。而Pb由于自身熔、沸點較高,與熱解相比,在N2氣氛下化學鏈氣化中的固化率無明顯優勢,其在鈣基載氧體下固化率最低,主要因為生成了更多PbS(g);但在水蒸氣氣氛下,化學鏈氣化對Pb的固化優勢明顯,其中鈣基載氧體的固化率遠大于鐵礦石。2種載氧體在2種氣氛下對Zn的固化優勢均明顯,其中鈣基載氧體更高。無載氧體加入熱解/氣化中,水蒸氣氛圍下3種重金屬的固化率遠低于N2氣氛;水蒸氣氛圍下鐵礦石載氧體的化學鏈氣化中,Cd、Pb的固化率也遠低于N2氣氛下的,但對Zn的固化有一定的促進,主要是因為有更多ZnO生成;在鈣基載氧體的化學鏈氣化中,水蒸氣可以促進高溫下Cd、Pb的固化,對Zn的固化無明顯影響;惰性載體的種類對鈣基載氧體化學鏈氣化中重金屬的固化率無明顯影響。
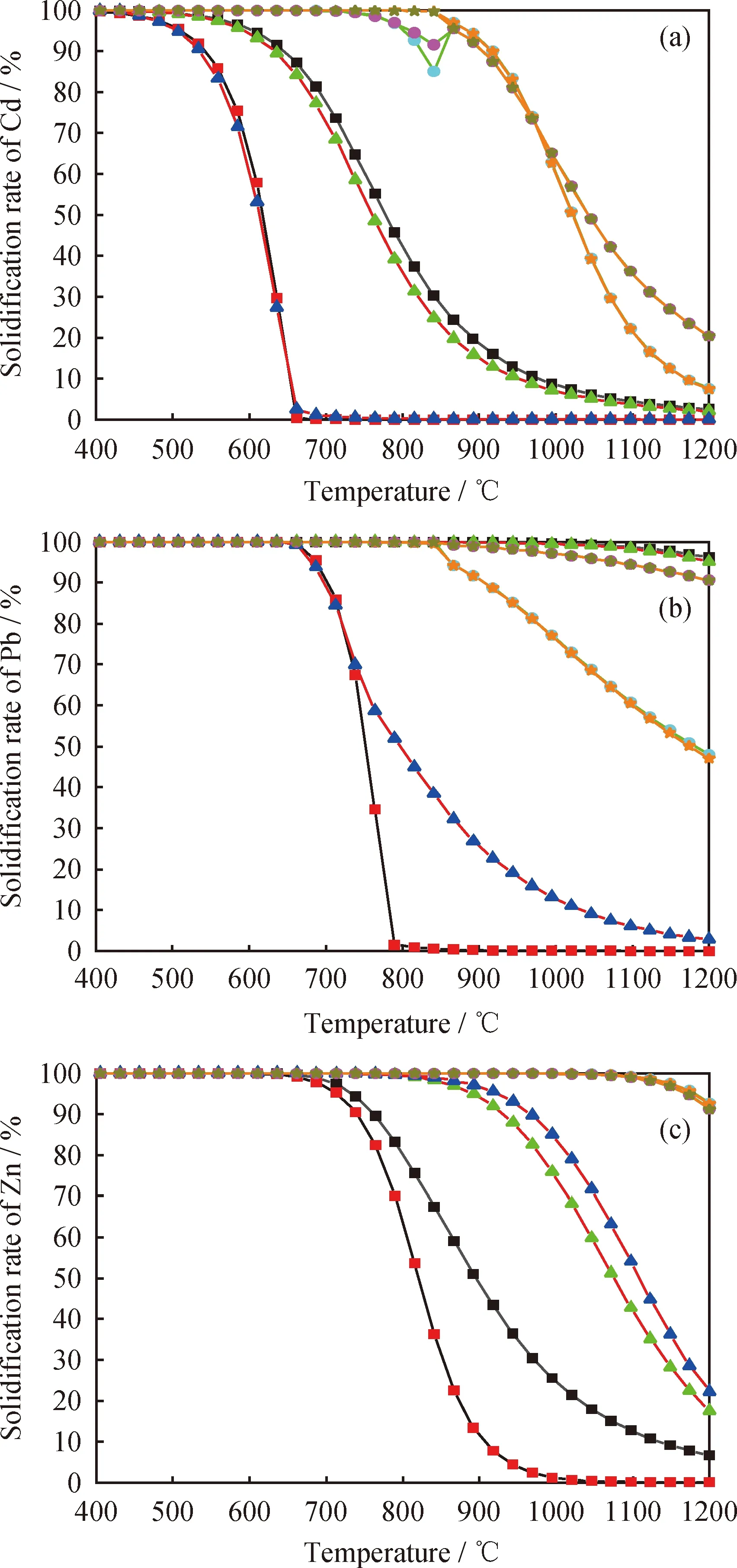
圖11 不同氣氛下熱解/氣化中、鐵礦石和鈣基作載氧體時修復植物化學鏈氣化中重金屬固定率隨溫度的變化曲線Fig.11 Curves of solidification rate of heavy metals with temperature in the process of pyrolysis/gasification,iron ore oxygen carrier and calcium-based oxygen carrier under different atmosphere(a) Solidification rate of Cd; (b) Solidification rate of Pb;(c) Solidification rate of Znp=0.1 MPa; n(N2)=0.1 mol; n(Steam)/n(C)=1.2∶1;m(Biomass)/m(OC)=1∶3; w(CaSO4)=51% Pyrolysis under N2 atmosphere; Gasification under steam atmosphere; CLG with iron ore under N2 atmosphere; CLG with iron ore under steam atmosphere; CLG with CaSO4&Al2O3 under N2 atmosphere; CLG with CaSO4&Al2O3 under steam atmosphere; CLG with CaSO4&SiO2 under N2 atmosphere; CLG with CaSO4&SiO2 under steam atmosphere
3 結 論
(1)富集重金屬Cd、Pb、Zn的修復植物在熱解過程中S和O能促進重金屬形成硫化物和氧化物固化,而Cl則會促進重金屬以氯化物的形態揮發,H與OH也會與重金屬結合形成氣態揮發物;水蒸氣氣氛下的氣化抑制了熔融態金屬的形成,導致氣態重金屬比例上升,但水蒸氣提供了O元素,使重金屬氧化態有所提升。
(2)以鐵礦石作為載氧體的化學鏈氣化過程中,2種氣氛下,3種重金屬的氧化態均比熱解/氣化時顯著增多;重金屬的氯化物、氫化物和氫氧化物的氣態揮發量明顯升高;鐵礦石中的SiO2、Al2O3能不同程度地與重金屬反應,生成更加穩定且不易揮發的重金屬硅酸鹽和鋁酸鹽,達到固化的效果;Zn可以與載氧體的活性成分反應生成鐵酸鹽;與N2氣氛相比,水蒸氣氣氛同樣抑制了重金屬熔融態的形成,金屬單質氣態更容易揮發。
(3)在以2種不同載體的鈣基載氧體化學鏈氣化中,2種氣氛下,重金屬的硫化物成為重金屬最主要的生成形態,氣態揮發量也極大減少,但卻促進重金屬Pb生成較多的PbS(g)揮發;系統中重金屬的氣態氫化物和氫氧化物幾乎消失,重金屬氯化物的生成得到抑制;2種載體SiO2、Al2O3可以起到一定的化學固化重金屬的作用,SiO2對Cd、Pb的固化效果較好,Al2O3對Zn的固化效果更好,SiO2可以促進PbS的形成;與N2氣氛相比,水蒸氣氣氛明顯促進了3種重金屬高溫下熔融態的形成,抑制了高溫下重金屬的氣態揮發,其中對Zn的鋁酸鹽和硅酸鹽的促進作用明顯。
(4)與熱解/氣化相比,化學鏈氣化對重金屬固化具有一定的優勢,特別是鈣基載氧體的化學鏈氣化。水蒸氣不利于鐵礦石載氧體化學鏈氣化中對Cd、Pb的固化,但有利于Zn的固化。在鈣基載氧體化學鏈氣化中水蒸氣促進了重金屬的固化。惰性載體的種類對鈣基載氧體化學鏈氣化中重金屬的固化率無明顯影響。

