高同型半胱氨酸血癥對老年高血壓患者RAAS 系統影響
王鋒 陳繼群 楊志勇 巫大偉
(合肥第三人民醫院老年病科 安徽 合肥 230022)
近年來,隨著我國逐漸人口老齡化進程不斷加劇,老年人高血壓患病率日益增高,最新研究結果表明相當部分臨床明確診斷高血壓人群往往合并血清同型半胱氨酸(HCY)水平增高,并且進一步發現老年臨床高血壓患者血清HCY 水平顯著升高。大量臨床研究顯示血清HCY 水平增高與動脈粥樣硬化程度相關,可能與其促動脈血管中層平滑肌細胞過度增殖、減低血管內皮細胞功能、導致其功能不全有關,目前被公認為動脈粥樣硬化性疾病如冠心病、腦血管疾病等為心-腦血管疾病獨立危險因素。臨床高HCY 血癥引起心腦血管病的具體發病機制尚不十分明確,研究結果也未達成共識。本文進一步了解高同型半胱氨酸的心腦血管疾病具體致病機制,對伴高同型半胱氨酸血癥老年高血壓患者臨床干預及治療提供一定的理論依據。
1.資料與方法
1.1 一般資料
選取2014 年6 月—2017 年9 月本院老年病科住院老年高血壓患者112 例,年齡60~82 歲,平均(75.45±8,18)歲;其中,女49 例(43.7%),男63 例(56.2%)。排除標準:既往無腦血管性疾病、冠狀動脈硬化性心臟病、惡性腫瘤等慢性疾病病史,肝-腎功能檢測及胸片檢查均無異常,近3 個月內有服用影響半胱氨酸代謝藥物如葉酸、維生素B6及維生素B12類等藥物,同時排除存在各部位感染、激素使用等影響測量結果患者。
1.2 方法
對所有患者均進行常規檢查,包括一般情況檢測、血液常規、肝功能、B 超、胸片等常規檢測項目。通常清晨空腹采血了解影響心血管系統的各類危險因素情況,其項目包括TG、HDL-C、TC、LDL-C 等血脂項目、空腹血糖(FPG)、血漿HCY、血清尿酸血癥及血漿腎素活性(PRA)、血清血管緊張素Ⅱ(Ang Ⅱ)水平、醛固酮(ALD)活性等高血壓相關指標檢測。112 例老年高血壓患者根據是否合并血漿HCY 增高分為實驗組(高HCY 血癥組51 例)和對照組(HCY 正常組61 例)。血漿HCY 參考值:HCY ≥15.0umol/L。
兩組實驗對象之間比較:一般情況比較包括性別比、年齡、體重、收縮壓(SBP)、舒張壓(DBP)及心-腦血管危險因素暴露情況等。分析實驗組患者高HCY 血癥與老年高血壓患者RAAS系統、血脂異常、高尿酸血癥等之間的關系。
1.3 臨床診斷標準
(1)老年高血壓臨床診斷標準:依據《老年高血壓的診斷與治療中國專家共識(2011 版)》,診斷標準定為:年齡≥60 歲,在未服用降壓藥物的情況下,非同日3次測量血壓,SBP ≥140mmHg 和(或)DBP ≥90mmHg。若SBP ≥140mmHg,SBP ≤90mmHg,則定義為老年單純收縮期高血壓(ISH)。(2)血脂代謝異常為滿足以下診斷依據4 項中任何1 項者,TC ≥5.18mmol/L,或TG ≥1.7mmol/L,或HDLC ≤1.04mmol/L,LDL-C ≥3.37mmol/L。[1](3)高尿酸血癥是指血清尿酸水平為男性≥416umol/L,女性≥357umol/L 者;尿酸參考水平上限設定為450umol/L。
1.4 統計學方法
應用SPSS21.0 統計軟件分析,計數資料以(%)表示,采用χ2檢驗;計量資料以()表示,采用t檢驗,P<0.05為差異具有統計學意義。
2.結果
2.1 兩組生化指標測定結果
在112 例患者中,HCY 升高者51 例(45.5%),HCY 正常者61 例(54.4%)。血脂異常52 例(46.4%),高TG40 例(35.7%),高尿酸血癥58 例(51.7%)。
2.2 兩組心腦血管危險因素比較
根據是否合并高HCY 血癥將患者分為高HCY 血癥組與血漿HCY 正常組。兩組在年齡、性別構成方面均無顯著差異(P>0.05)。但高HCY 組患者尿酸、甘油三酯水平顯著高于HCY 正常組(P<0.01,P<0.001),而其血HDL-C 水平則顯著低于HCY 正常組(P<0.05)。RAAS 系統相關因素結果檢測表明:高HCY 組患者血清Ang Ⅱ、PRA、ALD 濃度較HCY 正常組呈現下降趨勢,但只有Ang Ⅱ水平在兩組之間比較差異具有統計學意義(P<0.01),見表1。
表1 兩組心腦-血管病危險因素指標比較()
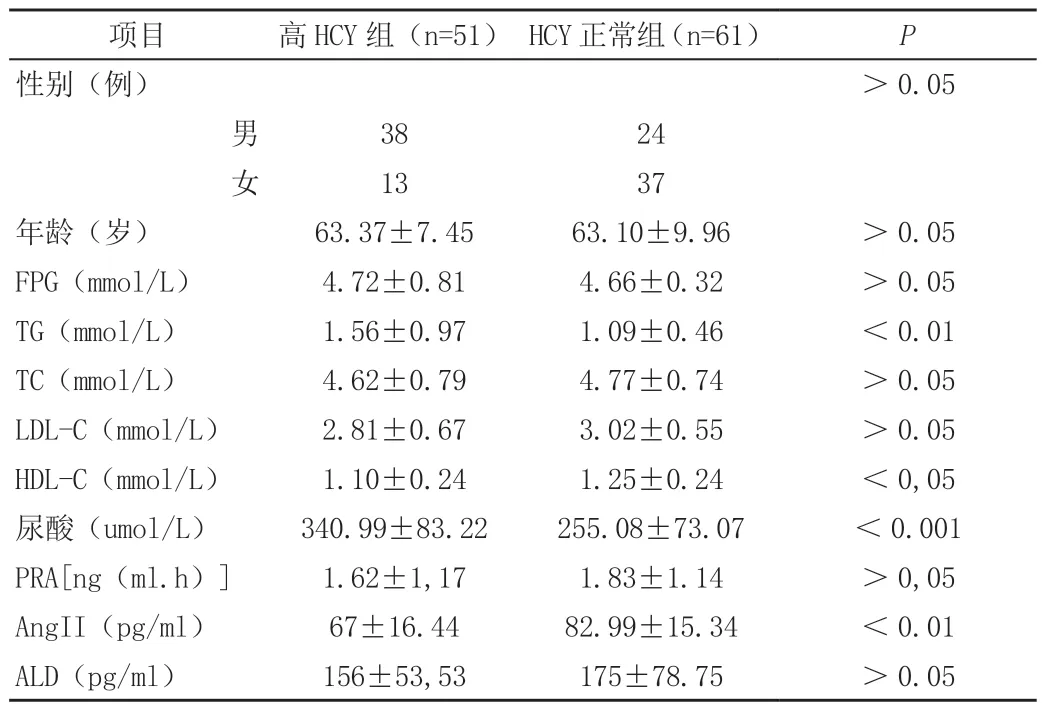
表1 兩組心腦-血管病危險因素指標比較()
2.3 兩組患者一般臨床情況比較
結果提示高尿酸血癥、血脂代謝異常更常見于高HCY 血癥組患者,差異顯著(均P<0.01),見表2。
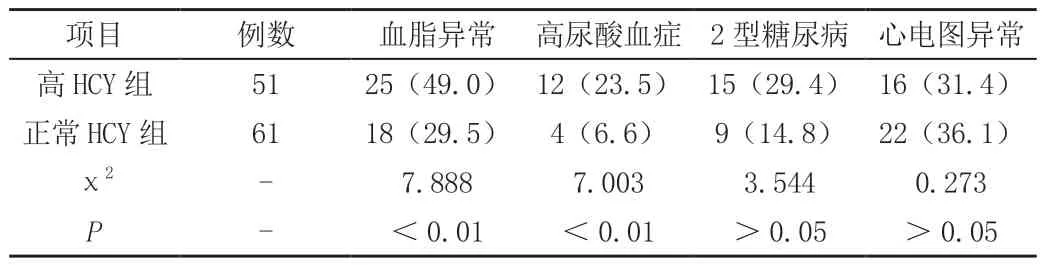
表2 兩組患者臨床情況的比較[n(%)]
3.討論
臨床大量實驗研究發現血漿HCY 水平中度增高在一般人群中十分常見,且與非致命或致命心血管疾病發生風險增加有一定的相關,研究發現其作用獨立于其他傳統心腦血管危險因素之外[2,3]。多種研究實驗提示HCY 損傷效應主要靶器官或靶目標包括血管內皮細胞、血管平滑肌細胞、血管結締組織、血小板、凝血因子、血漿脂質甚至是細胞信號分子如NO 信號轉導分子等。高HCY 血癥可在體內促進血管內皮細胞產生活性氧、活性氮和其他活性物質如活性硫醇物質等,這些物質可減少血管內皮細胞NO 生成及減低NO 的生物活性,導致血管調節異常,誘發高血壓發生。同時上述異常反應可刺激血管-心肌內潛在的基質金屬蛋白酶激活,同時誘導金屬蛋白酶組織抑制劑失活,造成兩者之間水平失衡進而導致心臟或動脈血管重構發生[4]。在過去近半世紀、近百例臨床實驗項目明確證實HCY 與心臟冠狀動脈、大腦動脈、外周動脈以及臨床靜脈系統疾病之間的相互關系[5]。
本結果顯示:高HCY 血癥在老年高血壓患者有較高的發病率,同時高HCY 者往往同時合并血脂異常、高尿酸血癥。高HCY血癥和心血管疾病高風險之間的關系目前已經基本明確,但同時研究發現血漿HCY 水平仍明顯受到包括吸煙、飲食、久坐等日常生活方式影響。同時研究證實血漿HCY 水平同樣與遺傳因素相關[6]。高HCY 發病率與高TG 發病率相當,均為36%左右。由于本樣本含量限制,無法代表一般人群,但據此結果仍可部分預示特定人群中高HCY 血癥具有一定普遍性,其臨床發病率與高TG 血癥發病率相當,提示對于高HCY 血癥采取一定的干預措施十分必要。
臨床研究發現,雖然HCY 患者的脂蛋白和血脂水平有中度升高,但并不能充分解釋其心血管疾病發病風險增加。研究已證實高HCY 血癥是患者體內甲硫氨酸代謝紊亂導致,目前證實其成為動脈粥樣硬化性疾病一個獨立的的危險因素。一項研究用于揭示血漿HCY 水平與FCH 之間的關系,結果顯示FCH 組的患者血漿平均HCY 水平與對照組無顯著性差異(P>0.05)。部分研究提示與無FCH 患者相比,在FCH 組患者中高HCY 血癥引起的心血管發病未見明顯增高。進一步研究發現血漿HCY 水平與血漿脂蛋白和脂質水平之間無明顯相關性,同時研究未發現血漿HCY 水平與胰島素抵抗有類似的相關性[7]。目前諸多實驗研究關于血漿HCY 與血脂兩者之間的關系結論無明顯一致性。最近國內有關研究發現高TC 血癥患者體內基因C677T 突變率增高,而此類基因編碼蛋白調節亞甲基四氫葉酸還原酶活性,進一步研究證實該酶是HCY 代謝關鍵酶之一,此基因突變能夠引起血漿HCY 代謝障礙,從而導致患者高HCY 血癥發生[8]。其他實驗表明,患者血漿HCY水平與其血清肌酐、尿酸水平呈正比,而與其血葉酸濃度成負相關[9]。我們依據患者血漿HCY 水平進行分組,結果顯示高HCY組患者血漿TG 水平、尿酸水平明顯高于血漿HCY 正常組,而該組患者血漿HDL-C 水平明顯低于正常HCY 組。其可能原因考慮為與HCY 正常組患者相比,高HCY 組患者體重明顯偏高有關。
RAAS 為機體對心血管功能和腎臟功能進行精細調控的主要系統,其在維持機體水-電解質平衡和動脈血壓穩定等方面具有重要作用。其參與調節因子眾多,其中Ang Ⅱ是該調控系統中發揮關鍵調節作用的效應分子。
國內外部分研究學者對于臨床代謝綜合征和庫欣綜合征(Cushing syndrome,CS)病人嘗試使用ARB 類藥物纈沙坦治療30 天后觀察其臨床療效及測定相關指標,以探討RAAS 系統或HCY 之間可能存在的相關性,研究結果顯示,使用纈沙坦治療后代謝綜合征或CS 患者中,其體內活性腎素水平明顯增高,而治療后患者血漿HCY 水平未見顯著改變,提示兩者之間無明顯相關性。該研究表明對于臨床代謝綜合征和CS 患者,其血漿HCY 水平可能不作為其相關心血管疾病風險的一種可靠指標[10]。但是部分研究提示Ang Ⅱ所引起心肌肥厚效應,其可能機制是通過高HCY 血癥途徑介導[11]產生的。因此,本文也初步探討了RAAS 系統與高HCY 血癥之間的關系,通過對RAAS 相關成分結果分析提示:在高HCY 組中血漿PRA、Ang Ⅱ、ALD 水平呈共同下降趨勢,但其中Ang Ⅱ下降程度兩組之間有顯著差異(P<0.05)。而兩者之間顯著性差異產生可能機制目前尚未完全明確,有待于以后更多臨床研究進一步探討。

