過表達(dá)鉀轉(zhuǎn)運(yùn)蛋白基因trkH提高玉米的鉀營養(yǎng)
丁寶娟 安利佳 蘇 喬
(大連理工大學(xué)生物工程學(xué)院,大連 116023)
鉀是植物生長發(fā)育所必須的營養(yǎng)元素之一,占植物干重的2%~10%,參與多種生理生化過程,包括蛋白質(zhì)合成、光合作用和滲透調(diào)節(jié)等[1~2]。地殼中鉀含量豐富,但能被植物吸收利用的速效鉀不足[3]。玉米(ZeamaysL.)作為世界三大糧食作物之一,在我國農(nóng)業(yè)生產(chǎn)中占有重要的地位。土壤缺鉀嚴(yán)重影響了玉米的產(chǎn)量和品質(zhì)。通過遺傳改良的方式提高玉米的鉀營養(yǎng)是解決這個(gè)問題的有效途徑之一。
植物對鉀的吸收主要依靠鉀離子通道和鉀離子轉(zhuǎn)運(yùn)體兩大鉀轉(zhuǎn)運(yùn)系統(tǒng),前者主要包括Shaker通道、TPK通道和Kir-like通道[4],后者主要包括KUP/HAK/KT轉(zhuǎn)運(yùn)體,Trk/Ktr/HKT轉(zhuǎn)運(yùn)體、KEA轉(zhuǎn)運(yùn)體和CHX轉(zhuǎn)運(yùn)體[5~7]。其中,Shaker通道和KUP/HAK/KT轉(zhuǎn)運(yùn)體是目前研究最為廣泛的兩大家族。目前已從棉花(Gossypiumhirsutum)[8]、小花堿茅(Puccinelliatenuiflora)[9]、鹽地堿蓬(Suaedasalsa)[10]、霸王(Zygophyllumxanthoxylum)[11]和水稻(Oryzasativa)[12]等植物中分離得到AKT1基因。Ahmad等[12]研究發(fā)現(xiàn)過表達(dá)OsAKT1基因可以提高水稻的鉀營養(yǎng)吸收。Duan等[10]研究發(fā)現(xiàn),過表達(dá)SsAKT1基因在低鉀條件下能夠提高鹽地堿蓬的鉀吸收能力。KUP/HAK/KT鉀轉(zhuǎn)運(yùn)體家族存在于植物、真菌和細(xì)菌中,參與植物體內(nèi)K+的吸收和轉(zhuǎn)運(yùn),提高植物的耐鹽性以及對干旱脅迫的反應(yīng)[13]。KUP/HAK/KT鉀轉(zhuǎn)運(yùn)體在植物的發(fā)育過程也起到重要的作用,例如根毛的生長和生長素的分布等[14]。目前,研究人員已從碧桃(Prunuspersica)[15]、木薯(Manihotesculenta)[16]、棉花(Gossypiumhirsutum)[17]和柳杉(Cryptomeriajaponica)[18]等植物中克隆得到鉀轉(zhuǎn)運(yùn)蛋白基因。譚穎等[19]在煙草中過表達(dá)NtHAK1基因顯著提高了轉(zhuǎn)基因煙草的鉀吸收能力。Han等[20]的研究表明,過表達(dá)KUP7基因能夠提高轉(zhuǎn)基因擬南芥的K+吸收。Song等[21]在水稻中過表達(dá)空心蓮子草的ApKUP3基因,提高了轉(zhuǎn)基因水稻的K+吸收。Wang等[17]在擬南芥中過表達(dá)GhKT2基因,低鉀條件下轉(zhuǎn)GhKT2基因擬南芥的干重和K+含量顯著高于野生型。
TrkH是一種細(xì)菌鉀轉(zhuǎn)運(yùn)蛋白,其在細(xì)菌中的結(jié)構(gòu)和功能已進(jìn)行了詳盡的研究[22],但在植物中的功能未知。本實(shí)驗(yàn)室前期從海洋微生物宏基因組DNA中克隆得到細(xì)菌鉀轉(zhuǎn)運(yùn)蛋白基因trkH(Accession Number:MK863632),在酵母和煙草中驗(yàn)證了功能。本研究采用農(nóng)桿菌介導(dǎo)的幼胚侵染法,以Hi-Ⅱ基因型的玉米為受體品種,將trkH基因?qū)胗衩字校ㄟ^鉀耗竭實(shí)驗(yàn)分析了轉(zhuǎn)trkH基因玉米的K+吸收功能,為獲得鉀營養(yǎng)高效的玉米新品種奠定基礎(chǔ)。
1 實(shí)驗(yàn)材料與方法
1.1 植物材料和表達(dá)載體
植物材料為Hi-Ⅱ基因型玉米。植物表達(dá)載體為pTF101:trkH,含有目的基因trkH和篩選標(biāo)記基因Bar,為本實(shí)驗(yàn)室構(gòu)建和保存(圖1)。
1.2 培養(yǎng)基
玉米轉(zhuǎn)化培養(yǎng)基及其組成見表1。
1.3 農(nóng)桿菌介導(dǎo)的玉米遺傳轉(zhuǎn)化
參照Frame等[23]的方法進(jìn)行玉米轉(zhuǎn)化,方法略有修改,農(nóng)桿菌菌液濃度為OD550=0.35~0.45,抗生素為200 mg·L-1的頭孢噻肟。
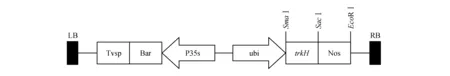
圖1 pTF101:trkH載體結(jié)構(gòu)簡圖Fig.1 Schematic representation of pTF101:trkH vector
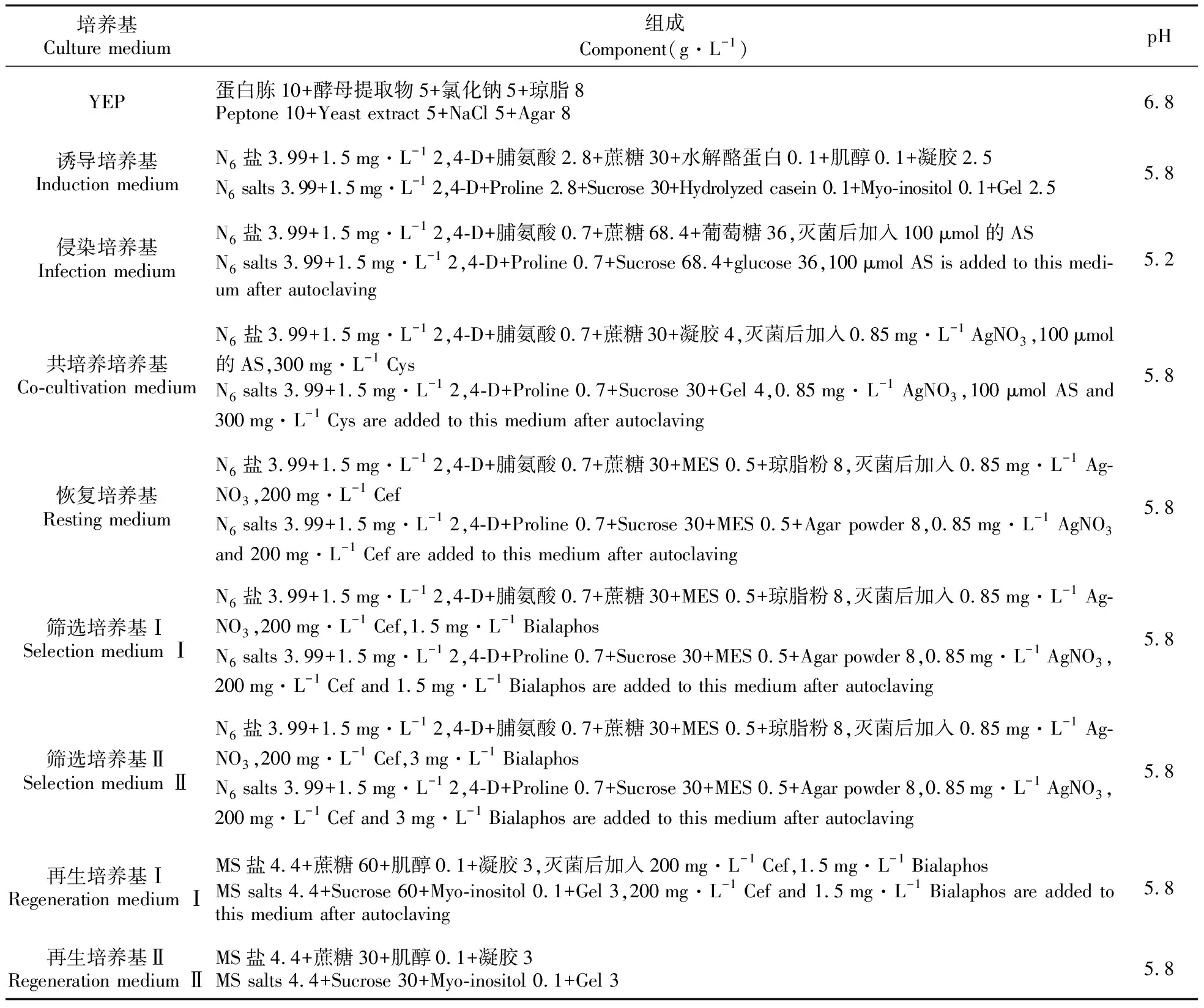
表1 培養(yǎng)基組成
1.4 T0代轉(zhuǎn)化植株的PCR檢測
采用快捷型植物基因組DNA提取試劑盒進(jìn)行玉米基因組DNA的提取,利用表2中trkH和Bar基因的引物分別進(jìn)行PCR擴(kuò)增。PCR反應(yīng)條件:94℃預(yù)變性5 min;94℃變性30 s,58℃退火30 s,72℃延伸90 s,35個(gè)循環(huán);72℃延伸10 min;4℃保存。1%瓊脂糖凝膠電泳檢測PCR擴(kuò)增產(chǎn)物。
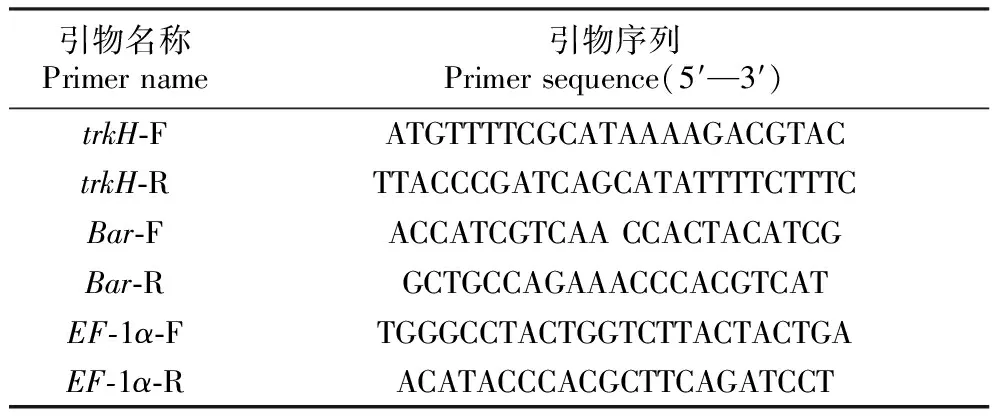
表2 PCR檢測的引物序列
1.5 T1代轉(zhuǎn)基因植株Bar試紙條檢測
根據(jù)QuickStixTMKit for LibertyLink?(bar) Cotton Leaf & Seed說明書進(jìn)行Bar基因的蛋白水平檢測。
1.6 T1代轉(zhuǎn)基因植株的半定量RT-PCR檢測
將部分T0代轉(zhuǎn)基因植株與玉米骨干自交系PH6WC雜交,獲得8個(gè)T1代株系。采用TRIZol試劑提取玉米葉片總RNA,根據(jù)大連寶生物公司PrimerScriptTMRT reagent Kit with g DNA Eraser(Perfect Real Time)說明書進(jìn)行反轉(zhuǎn)錄反應(yīng)。以反轉(zhuǎn)錄得到的cDNA為模板進(jìn)行半定量RT-PCR檢測,以EF-1α為內(nèi)參基因,trkH和EF-1α引物序列見表2。PCR反應(yīng)條件:94℃預(yù)變性5 min;94℃變性30 s,58℃退火30 s,72℃延伸90 s,27個(gè)循環(huán);72℃延伸10 min;4℃保存。1%瓊脂糖凝膠電泳檢測PCR擴(kuò)增產(chǎn)物。
1.7 T1代轉(zhuǎn)基因植株的遺傳分析
選取籽粒飽滿的8個(gè)T1代轉(zhuǎn)基因株系玉米種子各30粒,播種到含有營養(yǎng)土的花盆中,待玉米幼苗長至三葉一心期時(shí),噴灑除草劑,統(tǒng)計(jì)T1代轉(zhuǎn)基因株系的分離比。選取分離比接近1∶1的轉(zhuǎn)基因株系進(jìn)行PCR檢測,trkH引物序列見表2,PCR反應(yīng)條件同1.4。統(tǒng)計(jì)PCR檢測結(jié)果并進(jìn)行χ2測驗(yàn)。
1.8 T1代轉(zhuǎn)基因植株的鉀離子耗竭分析
切取少量玉米胚乳組織,采用堿煮法[24]提取L3、L5和L7轉(zhuǎn)基因株系T1代種子的基因組DNA。為保證遺傳背景盡量一致,經(jīng)PCR檢測后,以PCR檢測陽性材料為轉(zhuǎn)基因玉米,以PCR檢測陰性材料為野生型進(jìn)行鉀離子耗竭實(shí)驗(yàn)。將玉米種子進(jìn)行簡單的表面消毒后于托盤中萌發(fā)3~5 d。萌發(fā)的玉米幼苗定植到1/2 Hoagland[25]營養(yǎng)液中進(jìn)行通氣培養(yǎng),pH6.0,每3天更換一次營養(yǎng)液。待幼苗長至四葉一心期時(shí),分別將轉(zhuǎn)基因植株和野生型植株轉(zhuǎn)移至缺鉀的1/2 Hoagland營養(yǎng)液中,其中,KH2PO4用NaH2PO4替代,KNO3用Ca(NO3)2替代,其余成分相同,饑餓處理48 h。饑餓處理后,將玉米幼苗轉(zhuǎn)移至耗竭液(0.2 mmol CaSO4,1 mmol KCl)中,每隔12 h取樣一次,每次吸取1 mL溶液,并用雙蒸水補(bǔ)足體積,耗竭處理72 h,玉米幼苗在處理期間保持通氣狀態(tài)。采用原子吸收光譜儀測定樣品中的鉀離子含量。
2 結(jié)果與分析
2.1 轉(zhuǎn)基因玉米植株的獲得
采用農(nóng)桿菌介導(dǎo)的幼胚侵染法對玉米Hi-Ⅱ品種進(jìn)行遺傳轉(zhuǎn)化。在共培養(yǎng)培養(yǎng)基中培養(yǎng)3 d后,生長良好的幼胚會變大且質(zhì)地堅(jiān)硬(圖2:a);經(jīng)過7 d的恢復(fù)培養(yǎng),會誘導(dǎo)出Ⅱ型愈傷組織,此時(shí)可通過愈傷組織的生長狀態(tài)來判斷幼胚是否可以轉(zhuǎn)移至篩選培養(yǎng)基中(圖2:b);經(jīng)過4~6周的篩選培養(yǎng)后,獲得蓬松狀態(tài)的抗性愈傷(圖2:c~d);將抗性愈傷分成小塊,在再生Ⅰ培養(yǎng)基中培養(yǎng)2周,長出呈乳白色的胚狀體(圖2:e);挑選生長健壯的胚狀體轉(zhuǎn)移至再生Ⅱ培養(yǎng)基中,2周后生長出再生苗(圖2:f)。最終獲得T0代Baster抗性苗21株。
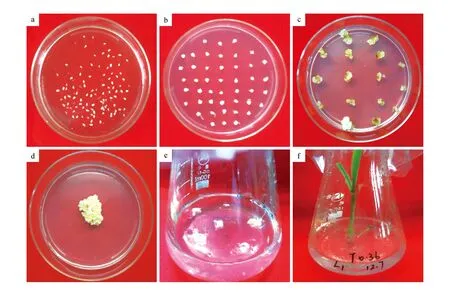
圖2 農(nóng)桿菌介導(dǎo)玉米的遺傳轉(zhuǎn)化 a.共培養(yǎng);b.恢復(fù);c~d.篩選;e.胚狀體;f.再生植株Fig.2 Agrobacterium-mediated genetic transformation of maize a.Co-cultivation; b.Resting; c-d.Selection; e.Embryoid; f.Regeneration plant
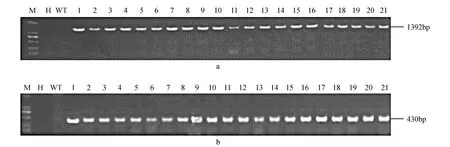
圖3 轉(zhuǎn)trkH基因植株的PCR檢測 a.trkH基因;b.Bar基因 M.DL2000 Marker;H.ddH2O;WT.野生型植株;1~21.轉(zhuǎn)基因植株Fig.3 PCR detection of the trkH transgenic plants a. trkH gene; b. Bar gene; M. DL2000 Marker; H. ddH2O; WT. Wild type; 1-21. Transgenic plants

圖4 轉(zhuǎn)trkH基因植株的Bar試紙條檢測 WT.野生型植株;1~21.轉(zhuǎn)基因植株Fig.4 Bar strip detection of trkH transgenic plants WT. Wild type; 1-21. Transgenic plants
2.2 T0代Baster抗性植株的鑒定
以提取的玉米基因組DNA為模板,對目的基因trkH和篩選標(biāo)記基因Bar進(jìn)行PCR檢測,擴(kuò)增出符合預(yù)期大小的片段,表明目的基因和篩選標(biāo)記基因成功轉(zhuǎn)入到玉米基因組中(圖3)。Bar試紙條檢測結(jié)果表明,21株抗性苗出現(xiàn)了檢測線,而野生型植株沒有出現(xiàn)檢測線,說明Bar基因在蛋白水平上成功表達(dá)(圖4)。
2.3 T1轉(zhuǎn)基因植株的半定量RT-PCR分析
將部分T0代轉(zhuǎn)基因植株與玉米骨干自交系PH6WC進(jìn)行雜交,收獲8個(gè)T1代株系。半定量RT-PCR檢測結(jié)果表明,T1代株系在轉(zhuǎn)錄水平上均能表達(dá),且表達(dá)量差異不大(圖5)。

圖5 T1代轉(zhuǎn)trkH基因植株的半定量RT-PCR WT.野生型植株;L1~L8.轉(zhuǎn)基因植株Fig.5 Semi-quantitative RT-PCR detection of T1trkH transgenic plants WT. Wild type; L1-L8. Transgenic plants
2.4 T1代轉(zhuǎn)基因植株的遺傳分析
選取籽粒飽滿的T1代轉(zhuǎn)基因株系玉米種子各30粒,三葉一心期時(shí)噴灑除草劑,非抗性植株葉片逐漸萎黃,直至死亡。然后統(tǒng)計(jì)分離比,選擇其中比例接近1∶1的L3、L5和L7轉(zhuǎn)基因株系進(jìn)行PCR檢測。切取少量玉米胚乳組織,采用堿煮法提取玉米基因組DNA,將其作為模板,利用trkH基因的引物進(jìn)行PCR擴(kuò)增,統(tǒng)計(jì)PCR檢測結(jié)果并進(jìn)行χ2測驗(yàn),結(jié)果表明L3、L5和L7轉(zhuǎn)化株系的后代均符合孟德爾分離定律(表3)。

表3 轉(zhuǎn)trkH基因玉米T1代遺傳分析
注:PCR+.陽性植株;PCR-.陰性植株χ2=3.841,P<0.05
Note:PCR+.Positive plants; PCR-.Negative plantsχ2=3.841,P<0.05
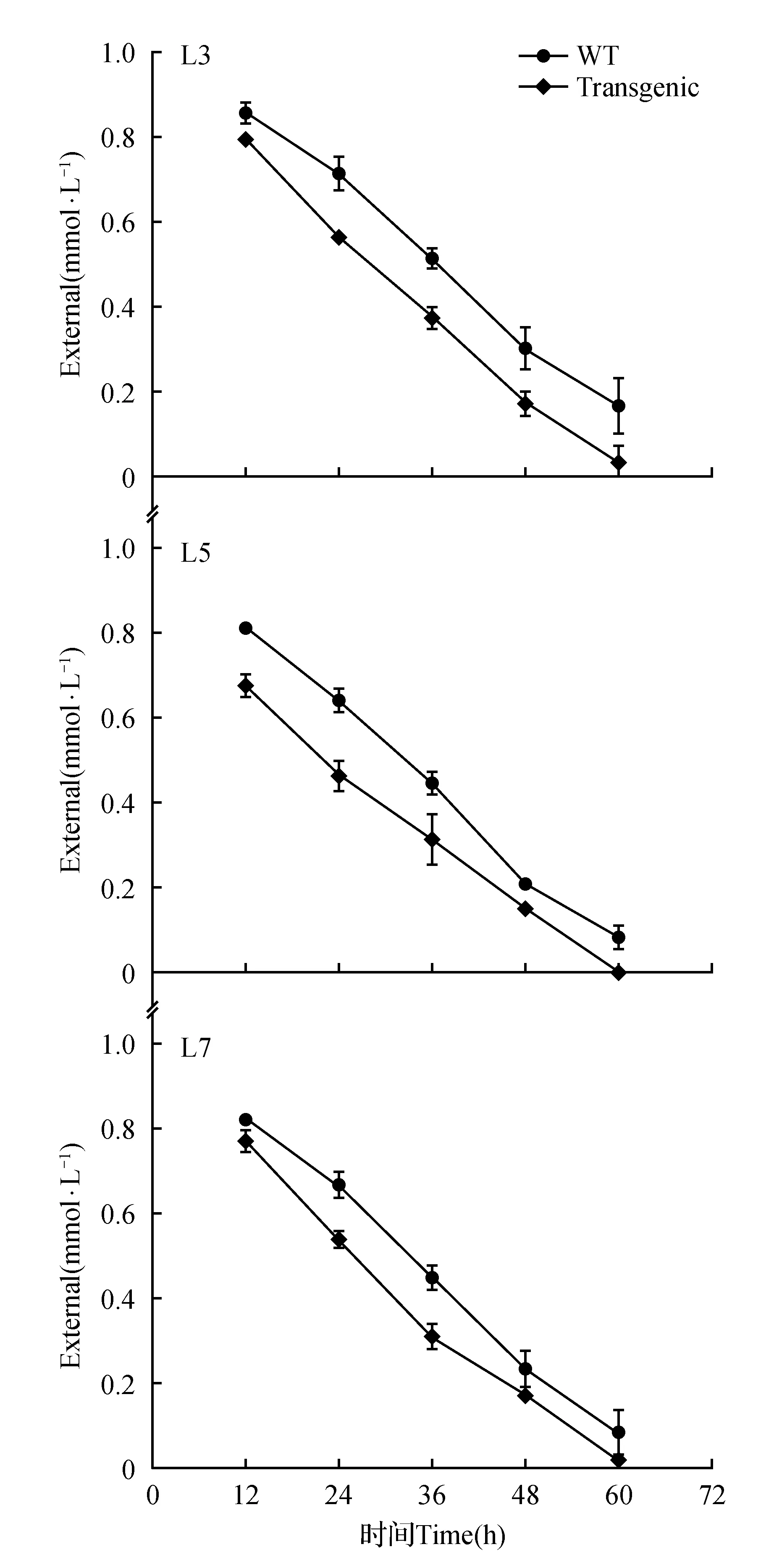
圖6 T1代轉(zhuǎn)trkH基因植株在1 mmol K+濃度下的耗竭實(shí)驗(yàn)Fig.6 Depletion experiment of T1trkH transgenic plants at 1 mmol K+ concentration
2.5 T1代轉(zhuǎn)基因植株的K+耗竭實(shí)驗(yàn)
為評估低K+脅迫下過表達(dá)trkH基因能否提高轉(zhuǎn)基因玉米的K+吸收能力,挑選四葉一心期的轉(zhuǎn)基因和野生型玉米進(jìn)行K+耗竭實(shí)驗(yàn)。結(jié)果表明,在1 mmol K+濃度條件下耗竭處理72 h,L3、L5和L7轉(zhuǎn)基因玉米的K+吸收能力高于野生型(圖6)。
3 討論
土壤缺鉀影響玉米的產(chǎn)量和品質(zhì),培育鉀營養(yǎng)高效的玉米品種是解決這個(gè)問題的途徑之一。本研究通過農(nóng)桿菌介導(dǎo)的幼胚侵染法將細(xì)菌鉀轉(zhuǎn)運(yùn)蛋白基因trkH轉(zhuǎn)入玉米Hi-Ⅱ幼胚中。PCR檢測結(jié)果初步表明外源基因trkH成功轉(zhuǎn)入玉米基因組中。半定量RT-PCR檢測結(jié)果表明trkH基因在轉(zhuǎn)錄水平上表達(dá)。Bar試紙條檢測結(jié)果表明Bar基因在蛋白水平上表達(dá)。將T0代轉(zhuǎn)基因株系與PH6WC雜交,對其后代進(jìn)行PCR檢測,結(jié)果符合1∶1的孟德爾分離比,推測L3、L5和L7轉(zhuǎn)基因株系為單拷貝且可以穩(wěn)定遺傳。玉米苗期鉀耗竭實(shí)驗(yàn)結(jié)果表明轉(zhuǎn)基因玉米的鉀吸收能力高于野生型,與Ahmad等[12]在水稻中過表達(dá)OsAKT1基因、Han等[20]在擬南芥中過表達(dá)KUP7基因和Song等[21]在水稻中過表達(dá)ApKUP3基因的研究結(jié)果一致。
細(xì)菌Trk系統(tǒng)主要包括介導(dǎo)K+轉(zhuǎn)運(yùn)的跨膜亞基TrkH或TrkG以及外圍調(diào)節(jié)亞基TrkA,多數(shù)情況下細(xì)菌中TrkH實(shí)現(xiàn)K+跨膜轉(zhuǎn)運(yùn)需要TrkA的輔助調(diào)節(jié);真菌中的Trk系統(tǒng)表現(xiàn)為單一亞基結(jié)構(gòu),只有介導(dǎo)離子轉(zhuǎn)運(yùn)的跨膜亞基,并沒有輔助的調(diào)節(jié)亞基。推測可能是由于真核系統(tǒng)較為復(fù)雜,有其他提供能量或者調(diào)節(jié)激活的機(jī)制[5,22,26~27]。本實(shí)驗(yàn)室前期從海洋微生物宏基因組DNA中克隆得到細(xì)菌鉀轉(zhuǎn)運(yùn)蛋白基因trkH,在酵母和煙草中驗(yàn)證了其功能,結(jié)果表明TrkH在高等生物中可以不依賴于TrkA發(fā)揮鉀吸收的功能。本研究表明單獨(dú)過表達(dá)trkH基因能夠提高轉(zhuǎn)基因玉米的鉀吸收能力,為培育鉀營養(yǎng)高效玉米新品種奠定基礎(chǔ)。

