大花鐵線蓮單重被花的轉錄組差異分析
熊陽陽 羅琳莉 趙士豪 周安龍 王 錦
(西南林業大學園林學院,昆明 650224)
被譽為“攀援植物皇后”的鐵線蓮隸屬毛茛科(Ranunculaceae)鐵線蓮屬(Clematis),因鐵線蓮無花瓣,其顯示出的花瓣實際是由萼片發育出來,故形態學中將其不同形態的花瓣稱之為花被。大花鐵線蓮花型由于萼瓣數的不同及雌雄蕊不同程度的瓣化顯現出單瓣、半重瓣及重瓣3種不同的形態。觀賞植物的花朵重瓣程度高低對其觀賞效果有極大的影響,而重瓣花也隨其應用價值提升近年來成為觀賞植物育種的重點對象。近年來研究成果中發現,與植物花發育相關的基因并且參與花發育調控網絡的轉錄因子大部分都屬于MADS-box基因家族[1],在ABCDE模型相關的基因中現已被報道出對植物重瓣花性狀起到調控作用的基因亞家族主要有AP1、AP3[2~3]、PI[3~4]、AGAMOUS[5~6]、FRUITFULL[7]、TM6-like[8]、SEP[9]等。影響花器官形成的條件有光照、溫度、水分、肥料及生長調節物質[10]。開花誘導是開花發育的關鍵,也是植物生殖生長的啟動階段,受光周期促進、自發促進、春化作用、開花抑制、赤霉素誘導以及年齡途徑等多條途徑控制[11]。重瓣花性狀的形成是外界條件及內在多類基因表達共同作用的結果。之前通過石蠟切片的試驗了解到大花鐵線蓮重被花的形態起源方式為雌雄蕊不同程度的瓣化,但鐵線蓮重瓣化形成的分子調控機理仍然未知。典型的鐵線蓮重被品種“薇安”(C.patens‘Vyvyan Pennell’)在不同季節表現為重被與單被的特性是探究重被花形成機制較好的研究素材。本次研究采用高通量測序技術對鐵線蓮“薇安”同一株上出現的3種不同花型(單被、半重被、重被)進行測序并分析相關生物學信息。應用轉錄組測序技術能在減少成本的同時獲取大量 EST,發掘功能基因成為一種非常高效可靠且高輸出的重要手段,適合缺乏基因組信息的非模式物種開展生物信息學相關研究[12]。通過轉錄本的豐富情況反映出3個樣本中各差異基因的表達水平,并采用RT-qPCR技術進一步驗證,初步篩選出可能參與鐵線蓮單重被花性狀調控的關鍵基因,為后續在分子水平上繼續發掘鐵線蓮重瓣化的調控基因及具體的克隆、分離與表達等研究提供基礎的理論依據。
1 材料與方法
1.1 試驗材料
該試驗材料選取引進的早花大花型線蓮中典型的重被品種“薇安”(C.patens‘Vyvyan Pennell’)同一株上同一時期3種不同花型的完整花瓣(圖1)進行轉錄組測序。該品種由于雄蕊瓣化程度不同進而外觀上產生即可開單瓣又可開半重瓣及重瓣的性狀。材料取下后放入液氮中速凍,之后保存在超低溫冰箱中備用。

圖1 供試材料“薇安”Fig.1 Test materials C.patens‘Vyvyan Pennell’
1.2 樣品檢測及cDNA文庫的構建
將鐵線蓮“薇安”的3個樣品(A:單被花;B:半重被;C:重被)送往北京諾禾致源科技生物公司。先使用Qubit2.0和Agilent 2100檢測RNA的濃度和完整度,再使用Q-PCR方法對文庫的有效濃度進行準確定量。RNA濃度檢驗合格后通過PCR富集得到cDNA文庫,Clean reads采用Trinity v2.4.0軟件拼接成為transcripts[13]。
1.3 序列拼接、功能注釋及生物學通路分析
使用blast軟件將unigene序列分別與KOG、NR、NT、Swiss-Prot、KEGG、GO和Pfam數據庫進行比對統計功能注釋信息[14]。利用diamond軟件獲得NR、KOG及Swiss-Prot庫的基因功能注釋信息后,采用blast2go軟件獲取unigenes的GO注釋信息,再用KAAS軟件將unigenes與KEGG數據庫進行比對[15]。利用GOseq R和KOBAS軟件包進行差異表達基因GO和KEGG富集分析[16]。
1.4 差異基因篩選及熒光定量PCR驗證
先采用TMM對read count數據進行標準化處理,再用DEGseq進行差異分析,篩選閾值為Q-value<0.05且|log2FoldChange|>1,且Q-value越小基因表達量差異越顯著[17]。在3個樣品中共存的差異表達基因中篩選出與鐵線蓮花芽分化的相關關鍵基因進行熒光定量PCR驗證。用肌動蛋白(actin>Cluster-24019.26582[Sedum alfredii])作為內參基因,用primer5.0設計PCR引物序列,各基因設3次PCR重復檢測,利用2^-△△Ct分析基因的相對表達量[18],用超微量核酸蛋白測定儀(scandrop100)檢測RNA OD值,A260/A280比值計算RNA純度。樣品RNA檢測結果見表1,設定引物序列(5′—3′)見表2。
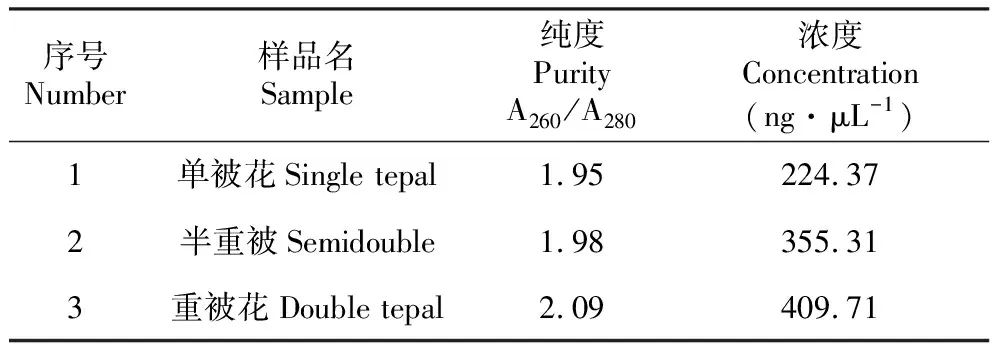
表1 樣品RNA檢測結果

表2 熒光定量PCR引物設定
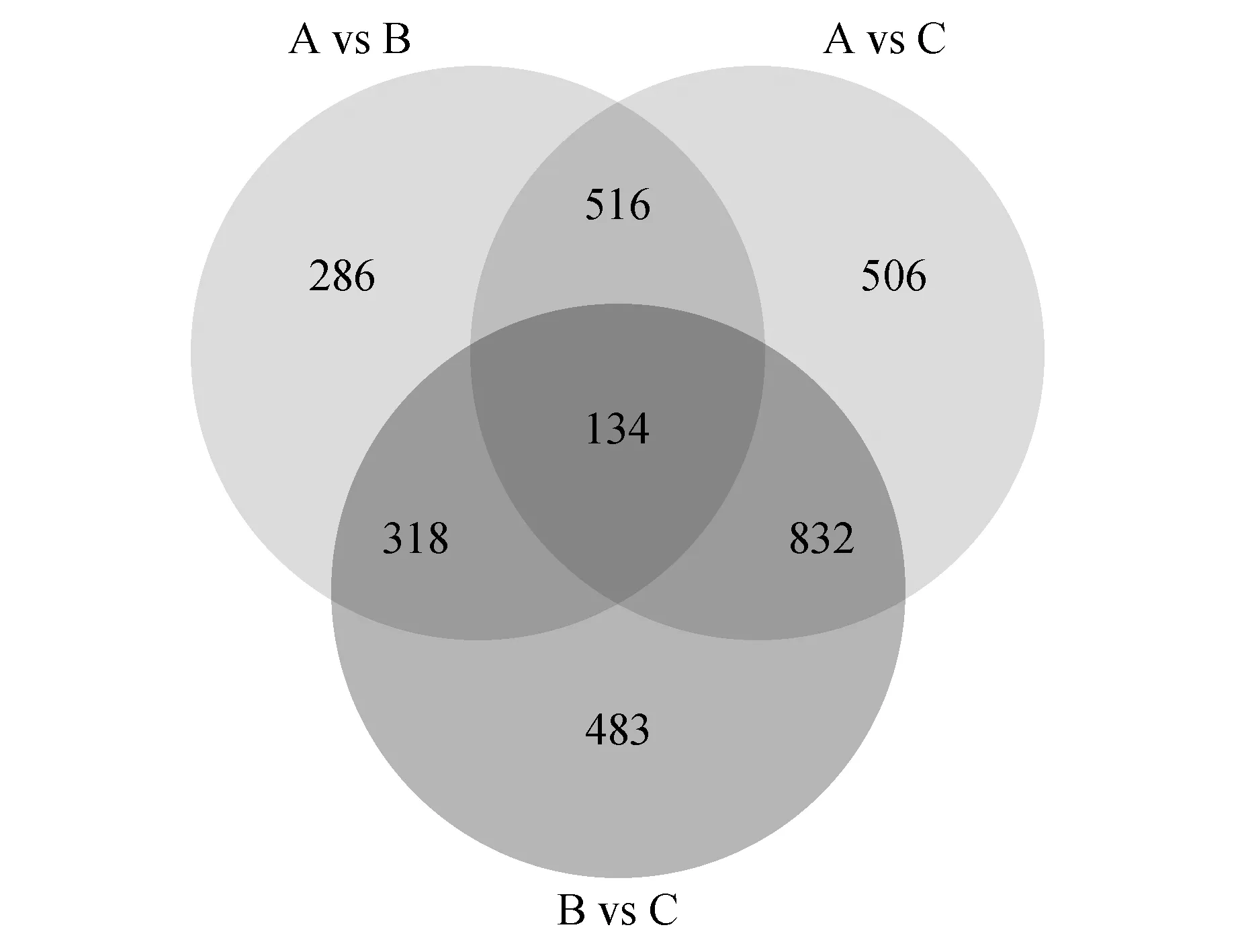
圖2 差異基因維恩圖Fig.2 Differential gene venn diagram
2 結果與分析2.1 數據組裝拼接
通過轉錄組測序,共獲取3個樣品(A:單被花;B:半重被;C:重被)的轉錄組文庫,產生13.8GB原始數據。3個樣本Phred數值大于30比例(%)均超過87.44%。對組裝結果進行統計,共產生轉錄組序列146 036個,基因99 652個。序列長度分布在201~14 638 bp,平均長度977 bp。N50分別為1 679及1 825 bp,拼接效果較好。
2.2 基因功能分類
將組裝得到的99 652條All-unigenes分別與7個公共數據庫NR、NT、Swiss-Prot、KEGG、GO、Pfam和KOG比對,結果有9 133條(9.16%)unigenes在以上7個數據庫中均注釋成功。在轉錄本中,能夠被注釋到GO分類的Unigene有47 346條(47.51%),有16 484條Unigene注釋到KOG數據庫,占總基因數的16.54%。KEGG通路分析共有23 555個基因參與了19個代謝通路,占總unigene的23.64%。通過與Nr庫進行比對注釋獲取到與鐵線蓮基因序列最近緣的物種是蓮(Nelumbonucifera)[19]。
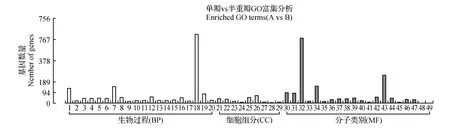
圖3 單被薇安與半重被薇安差異基因GO富集柱狀圖 橫坐標為GO三個大類的下一層級的GO term,縱坐標為注釋到該term下(包括該term的子term)的差異基因個數 1.碳水化合物代謝過程;2.對生長素的反應;3.細胞葡聚糖代謝過程;4.葡聚糖代謝過程;5.多糖代謝過程;6.細胞多糖代謝過程;7.氧化還原過程;8.細胞碳水化合物代謝過程;9.細胞壁修飾;10.激素反應;11.對內生刺激的反應;12.脂類生物合成的過程;13.脂肪酸生物合成過程;14.對有機物的反應;15.脂肪酸代謝過程;16.化學反應;17. 細胞壁組織;18.代謝過程;19.脂質代謝過程;20.細胞壁組織或生物發生;21.外部封裝結構;22.細胞壁;23.質外體;24.脂肪酸合成酶復合物;25.細胞外圍;26.胞外區;27.胞質部分;28.BB若干;29.細胞胞質;30.水解酶活性,作用于糖基鍵;31.水解酶活性,水解鄰糖基化合物;32.催化活性;33.木葡聚糖:木葡糖苷轉移酶活性;34.氧化還原酶活性;35.果膠酯酶活性;36.酶抑制劑的活性;37.血紅素結合;38.四吡咯粘合物;39.轉移酶活性,轉移己糖基;40.羧酸酯水解酶活性;41. 3-氧基酰基載體蛋白質合成酶活性;42.轉移酶活性,轉移糖基;43.水解酶活性;44.轉移酶活性,轉移酰基;45.脂肪酸合酶活性;46.轉移酶活性,轉移氨基酰基以外的酰基;47.鐵離子結合;48.腺苷同型半膀氨酸酶活動;49.水解酶活性,作用于醚鍵Fig.3 Single and semidouble flower C.patens‘Vyvyan Pennell’ GO enriched terms 1.Carbohydrate metabolic process; 2.Response to auxin; 3.Cellular glucan metabolic process; 4.Glucan metabolic process; 5.Polysaccharide metabolic process; 6.Cellular polysaccharide metabolic process; 7.Oxidation-reduction process; 8.Cellular carbohydrate metabolic process; 9.Cell wall modification; 10.Response to hormone; 11.Response to endogenous stimulus; 12.Lipid biosynthetic process; 13.Fatty acid biosynthetic process; 14.Response to organic substance; 15.Fatty acid metabolic process; 16.Response to chemical; 17.Cell wall organization; 18.Metabolic process; 19.Lipid metabolic process; 20.Cell wall organization or biogenesis; 21.External encapsulating structure organization; 22.Cell wall; 23.Apoplast; 24.Fatty acid synthase complex; 25.Cell periphery; 26.Extracellular region; 27.Cytosolic part; 28.BBSome; 29.Cytosol; 30.Hydrolase activity,acting on glycosyl bonds; 31.Hydrolase activity,hydrolyzing O-glycosyl compounds; 32.Catalytic activity; 33.Xyloglucan:xyloglucosyl transferase activity; 34.Oxidoreductase activity; 35.Pectinesterase activity; 36.Enzyme inhibitor activity; 37.Heme binding; 38.Tetrapyrrole binding; 39.Transferase activity, transferring hexosyl groups; 40.Carboxylic ester hydrolase activity; 41. 3-oxoacyl-[acyl-carrier-protein] synthase activity; 42.Transferase activity,transferring glycosyl groups; 43.Transferase activity,transfer sugar-based; 44.Hydroase activity; 45.Fatty acid synthase activity transferase activityl; 46.Transferase activity,transferring acyl groups other than amino-acyl groups; 47.Adenosylhomocysteinase activity; 48.Iron ion binding; 49.Hydrolase activity,acting on ether bonds
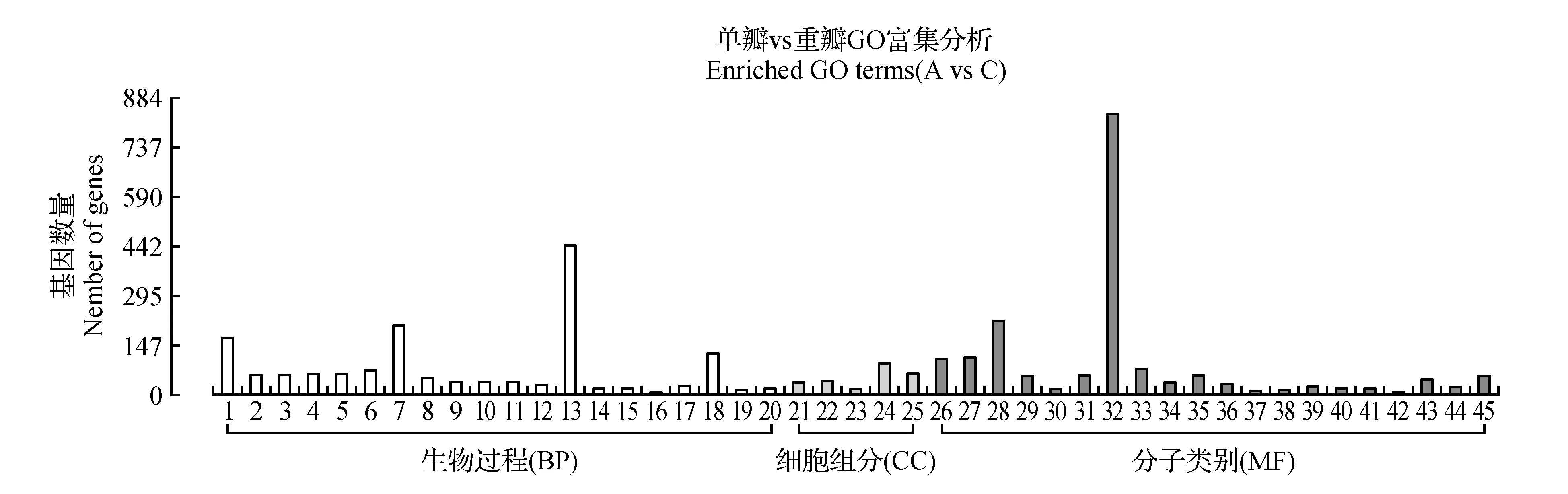
圖4 單被薇安與重被薇安差異基因GO富集柱狀圖 1.碳水化合物代謝過程;2.細胞葡聚糖代謝過程;3.葡聚糖代謝過程;4.細胞多糖代謝過程;5.多糖代謝過程;6.細胞碳水化合物代謝過程;7.氧化還原過程;8.防御反應;9.蔗糖代謝過程;10.淀粉代謝過程;11.二糖代謝過程;12.細胞壁組織或生物發生;13.單個有機體代謝過程;14.胺生物合成的過程;15.細胞生物胺生物合成工藝;16.Wnt信號通路負調控;17.酪氨酸代謝過程;18.逆境反應;19.細胞壁修飾;20.細胞壁組織;21.細胞壁;22.外部封裝結構;23.質外體;24.胞外區;25.細胞外圍;26.水解酶活性,水解鄰糖基化合物;27.水解酶活性,作用于糖基鍵;28.氧化還原酶活性;29.血紅素結合;30.木葡聚糖:木葡糖苷轉移酶活性;31.四吡咯粘合物;32.催化活性;33.轉移酶活性,轉移糖基;34.酶抑制劑的活性;35.轉移酶活性,轉移己糖基;36.碳氧裂解酶的活動;37.聚半乳糖醛酶活性;38.果膠酯酶活性;39.抗氧化活性;40.過氧化物酶活性;41.氧化還原酶活性,作用于過氧化氫作為受體;42.色氨酸合成酶活性;43.鐵離子結合;44.羧酸酯水解酶活性;45.裂合酶活性Fig.4 Single and double flower C.patens‘Vyvyan Pennell’ GO enriched term 1.Carbohydrate metabolic process; 2.Cellular glucan metabolic process; 3.Glucan metabolic process; 4.Cellular polysaccharide metabolic process; 5.Polysaccharide metabolic process; 6.Cellular carbohydrate metabolic process; 7.Oxidation-reduction process; 8.Defense response; 9.Sucrose metabolic process; 10.Starch metabolic process; 11.Disaccharide metabolic process; 12.Cell wall organization or biogenesis; 13.Single-organism metabolic process; 14.Amine biosynthetic process; 15.Cellular biogenic amine biosynthetic process; 16.Negative regulation of Wnt signaling pathway; 17.Tyrosine metabolic process; 18.Response to stress; 19.Cell wall modification; 20.Cell wall organization; 21.Cell wall; 22.External encapsulating structure; 23.Apoplast; 24.Extracellular region part; 25.Cell periphery; 26.Hydrolase activity,hydrolyzing O-glycosyl compounds; 27.Hydrolase activity,acting on glycosyl bonds; 28.Oxidoreductase activity; 29.Heme binding; 30.Xyloglucan:xyloglucosyl transferase activity; 31.Tetrapyrrole binding; 32.Catalytic activity; 33.Transferase activity,transferring glycosyl groups; 34.Enzyme inhibitor activity; 35.Transferase activity,transferring hexosyl groups; 36.Carbon-oxygen lyase activity; 37.Polygalacturonase activity; 38.Pectinesterase activity; 39.Antioxidant activity; 40.Peroxidase activity; 41.Oxidoreductase activity,acting on peroxide as acceptor; 42.Tryptophan synthase activity; 43.Iron ion binding; 44.Carboxylic ester hydrolase activity; 45.Lyase activity
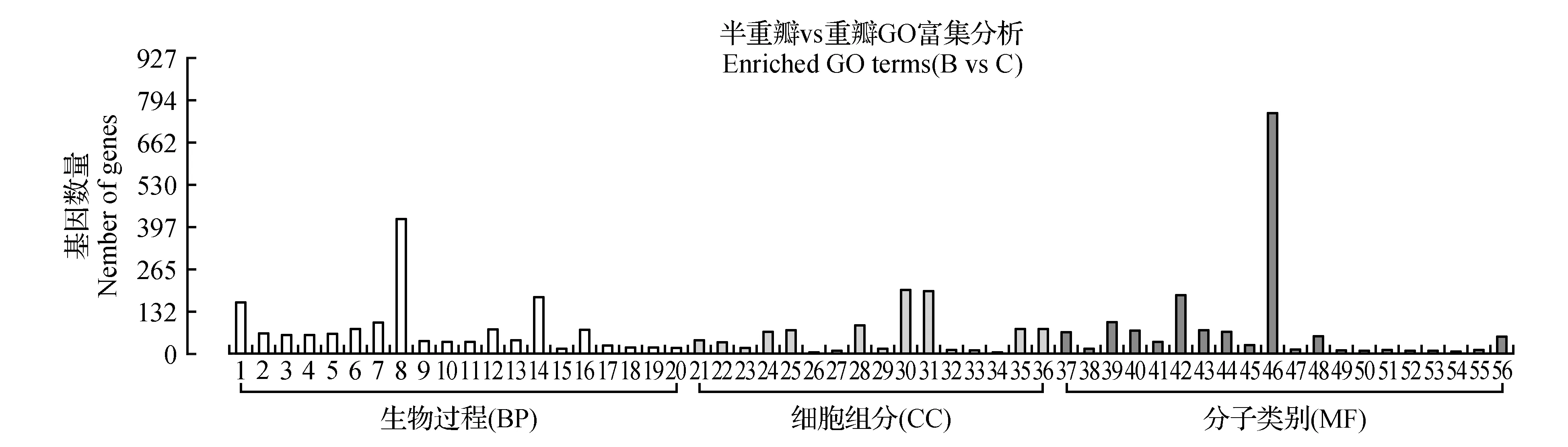
圖5 半重被薇安與重被薇安差異基因GO富集柱狀圖 1.碳水化合物代謝過程;2.多糖代謝過程;3.細胞葡聚糖代謝過程;4.葡聚糖代謝過程;5.細胞多糖代謝過程;6.細胞碳水化合物代謝過程;7.單細胞碳水化合物代謝過程;8.單個有機體代謝過程;9.二糖代謝過程;10.蔗糖代謝過程;11.淀粉代謝過程;12.核糖體生物合成;13.寡糖代謝過程;14.氧化還原過程;15.細胞壁修飾;16.核糖核蛋白復雜生物起源;17.細胞壁組織或生物起源;18.含吲哚的復合生物合成過程;19.外部封裝結構組織;20.細胞壁組織;21.外部封裝結構;22.細胞壁;23.質外體;24.細胞外圍;25.核糖體;26.病毒基因組;27.β-半乳糖苷酶復合體;28.胞外區;29.細胞外基質;30.膜的固有成分;31.膜的積分分量;32.蛋白質的細胞外基質;33.光系統Ⅰ;34.精母細胞5-精母細胞6復合體;35.細胞內核糖核蛋白復合體;36.核糖核蛋白復合體;37.核糖體的結構成分;38.木葡聚糖:木葡糖苷轉移酶的活性;39.結構分子活性;40.水解酶活性,水解鄰糖基化合物;41.酶抑制劑的活性;42.氧化還原酶活性;43.水解酶活性,作用于糖基鍵;44.轉移酶活性,轉移糖基;45.羧酸酯水解酶活性;46.催化活性;47.果膠酯酶活性;48.轉移酶活性,轉移己糖基;49.聚半乳糖醛酶活性;50.色氨酸合成酶活性;51.β-半乳糖苷酶活性;52.DNA-3甲基腺嘌呤糖基化酶的活性;53.DNA-3甲基堿糖基化酶的活性;54.碳氧裂解酶活性,作用于多糖;55.半乳糖苷酶活性;56.裂合酶活性Fig.5 Simidouble and double flower C.patens‘Vyvyan Pennell’GO enriched term 1.Carbohydrate metabolic process; 2.Polysaccharide metabolic process; 3.Cellular glucan metabolic process; 4.Glucan metabolic process; 5.Cellular polysaccharide metabolic process; 6.Cellular carbohydrate metabolic process; 7.Single-organism carbohydrate metabolic process; 8.Single-organism metabolic process; 9.Disaccharide metabolic process; 10.Sucrose metabolic process; 11.Starch metabolic process; 12.Ribosome biogenesis; 13.Oligosaccharide metabolic process; 14.Oxidation-reduction process; 15.Cell wall modification; 16.Ribonucleoprotein complex biogenesis; 17.Cell wall organization or biogenesis; 18.Indole-containing compound biosynthetic process; 19.External encapsulating structure organization; 20.Cell wall organization; 21.External encapsulating structure; 22.Cell wall; 23.Apoplast; 24.Cell periphery; 25.Ribosome; 26.Viral genome; 27.Beta-galactosidase complex; 28.Extracellular region; 29.Extracellular matrix; 30.Intrinsic component of thylakoid membrane; 31.Integral component of membrane; 32.Proteinaceous extracellular matrix; 33.Photosystem Ⅰ; 34.Smc5-Smc6 complex; 35.Intracellular ribonucleoprotein complex; 36.Ribonucleoprotein complex; 37.Structural constituent of ribosome; 38.Xyloglucan:xyloglucosyl transferase activity; 39.Structural molecule activity; 40.Hydrolase activity,hydrolyzing O-glycosyl compounds; 41.Enzyme inhibitor activity; 42.Oxidoreductase activity; 43.Hydrolase activity,acting on glycosyl bonds; 44.Transferase activity,transferring glycosyl groups; 45.Carboxylic ester hydrolase activity; 46.Catalytic activity; 47.Pectinesterase activity; 48.Transferase activity,transferring hexosyl groups; 49.Polygalacturonase activity; 50.Tryptophan synthase activity; 51.Beta-galactosidase activity; 52.DNA-3-methyladenine glycosylase activity; 53.DNA-3-methylbase glycosylase activity; 54.Carbon-oxygen lyase activity,acting on polysaccharides; 55.Galactosidase activity; 56.Lyase activity
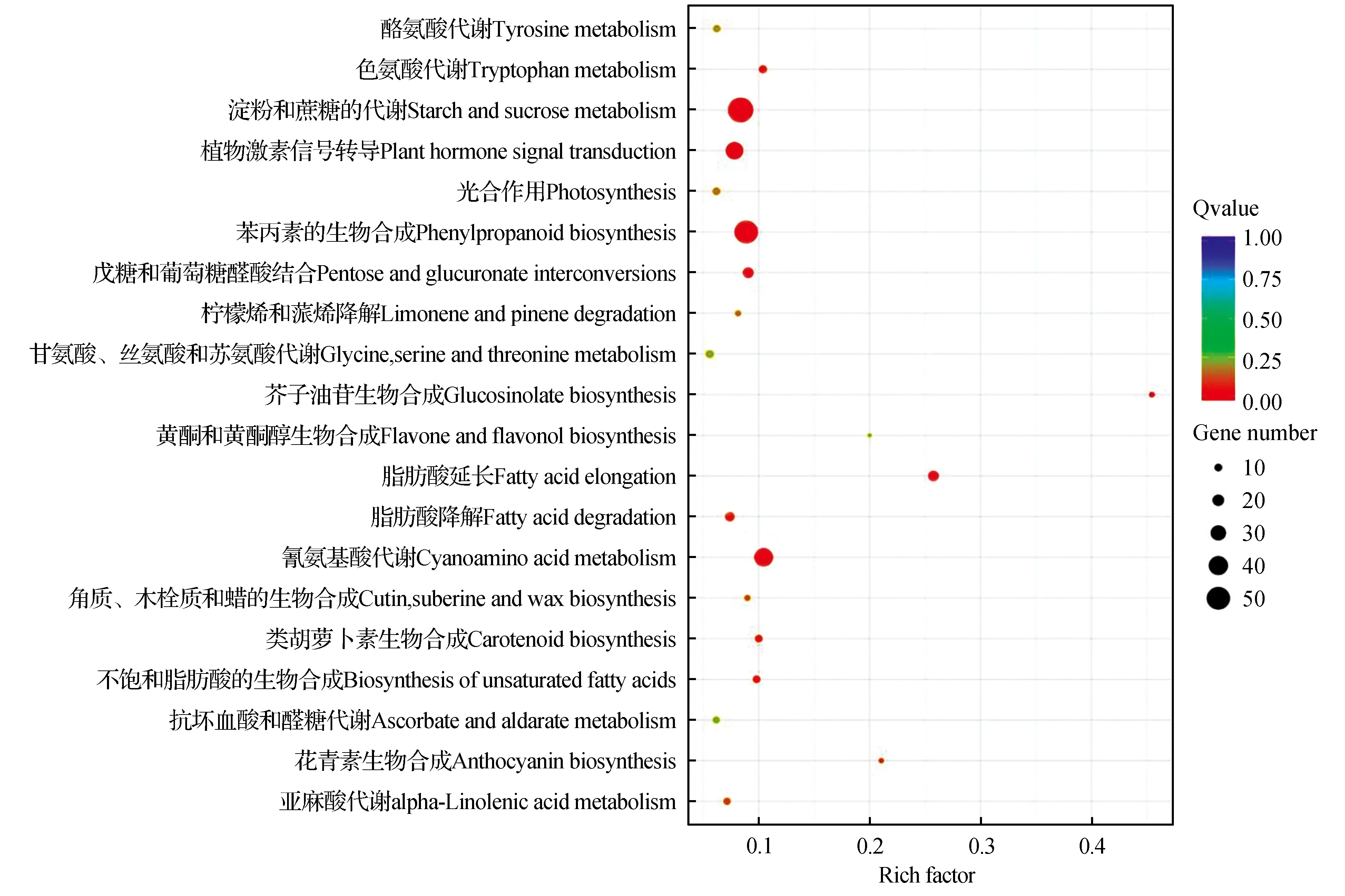
圖6 單被vs半重被差異基因KEGG富集散點圖Fig.6 A vs B DEG enriched KEGG pathway
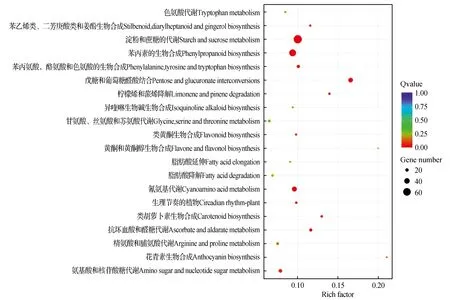
圖7 單被vs重被差異基因KEGG富集散點圖Fig.7 A vs C DEG enriched KEGG pathway
2.3 “薇安”不同花被中的差異基因分析
通過對試驗材料“薇安”同一時期同一植株上的3個不同花型的轉錄本兩兩對比進行差異基因表達分析,共獲得3 075條差異表達基因(DEG),其中單被花與半重被樣本對比(A vs B)包括649條上調DEG,605條下調DEG;半重被花與重被花對比(B vs C)包括上調DEG 1 046條和下調DEG 721條;單被花與重被花對比(A vs C)有上調DEG 1 129條和下調DEG 859條。將各組合比較得到的差異基因個數進行統計畫成維恩圖可直觀展現出各差異比較組合之間共有與特有的差異基因數目,對3個兩兩比較的組合篩選的差異基因數目繪制維恩圖結果見圖2。
2.3.1 差異表達基因的GO富集分析
對“薇安”3種花型兩兩比較組合的差異基因根據上調或下調分開分別進行富集分析,差異表達基因分屬于生物過程(BP)、細胞組分(CC)及分子類別(MF)三大類。如圖3,單被“薇安”與半重被“薇安”(A vs B)對比注釋到2 220條Unigene,在49個二級節點中,差異基因數目分布最多的是代謝生物過程(614個,64.97%)、細胞外區域細胞成分(68個,7.2%)、催化活性分子功能(580個,61.38%);如圖4,單被“薇安”與重被“薇安”(A vs C)對比注釋到2 592條Unigene,在45個二級節點中,差異基因數目分布最多的是碳水化合物代謝過程(172個,11.67%)、胞外區(94個,6.38%)、催化活性(839個,56.92%);如圖5,半重被“薇安”與重被“薇安”(B vs C)對比注釋到2 507條Unigene,在56個二級節點中,差異基因數目分布最多的是單個有機體代謝過程(422個,31.87%)、膜的固有成分(200個,15.11%)、催化活性(753個,56.87 %)。
2.3.2 差異表達基因的KEGG富集分析
差異基因KEGG富集散點圖是KEGG富集分析結果的圖形化展示方式,KEGG富集程度通過Rich factor、qvalue和富集到此通路上的基因個數來衡量[20]。在3個樣本兩兩對比中挑選出富集最顯著的20條pathway條目展示在圖中。如圖6,單被與半重被“薇安”差異表達基因對比共參與93條代謝通路,其中富集程度較多的是3(淀粉和蔗糖的代謝,55個)、6(苯丙素的生物合成,50個)以及14(氰氨基酸代謝,38個)。單被與重被“薇安”差異對比共參與96條代謝通路,富集程度較多的是3(淀粉和蔗糖的代謝,66個)、4(苯丙素的生物合成,53個)、14(氰氨基酸代謝,35個)(圖7)。半重被與重被“薇安”差異對比共參與98條代謝通路,其中富集程度較多的是3(核糖體,54個)、2(淀粉和蔗糖的代謝,36個)、9(戊糖和葡萄糖醛酸結合,28個)(圖8)。
2.3.3 鐵線蓮單重被花性狀相關基因的篩選
根據差異篩選的閾值及基因功能注釋,在所有的DEG中共挑選出25條可能與鐵線蓮重瓣化性狀相關的基因(表3)。25條差異基因的FPKM值進行表達水平聚類分析用于計算3個樣本中相對表達量的高低情況[21](圖9)。Log2FC為表達量差異倍數的對數值,值為正數代表該基因上調,值為負數代表基因下調。綜合圖表可知在單瓣花中表達量較高的基因有MADS域蛋白中的PMADS1、AP3、FRUITFULL基因,促進頂端分生組織蛋白及主要在雌蕊柱中表達的1-氨基環丙烷1-羧酸合成酶;生長素類有吲哚乙酸和脫落酸;在半重瓣中表達量較高的有MADS轉錄調節蛋白FLC下游蛋白,以及激活甲基化反應的S-腺苷-L-高半胱氨酸水解酶、參與細胞壁構建的果膠甲酯酶及木葡聚糖內轉糖苷酶等,生長素類有吲哚乙酸和脫落酸;在重瓣花中表達量較高的基因是參與冷脅迫的幾丁質酶、CHY鋅指結構及生長素輸入載體蛋白。
2.4 10條候選基因的熒光定量PCR驗證
在3個樣本中共存的134條差異表達基因中根據各基因代謝通路及功能選出10個readcount值較大、序列較長且可能與花發育有關的基因進行熒光定量PCR驗證(圖10~19)。綜合轉錄組數據及熒光定量PCR驗證結果對比可知:10個基因中轉錄組結果與PCR結果對比在三類花型中差異情況完全一致的有4個,部分差異一致的基因有5個,僅1個ATP酶亞基類基因結果存在差異。其中在單瓣中表達量數值最高的基因類型有cluster-24019.21952硝酸還原酶,最低的有cluster-24019.21011生長素反應蛋白IAA9、cluster-24019.24487ATP酶亞基、 cluster-24019.26193ABC轉運體、cluster-24019.26426柚苷配基,2氧化戊二酸3加雙氧酶。在重瓣花中差異表達量最高的基因有cluster-24019.29079、cluster-24019.21011生長素反應蛋白IAA9;表達量最低的有cluster-24019.25875木葡聚糖內轉糖苷酶、cluster-24019.48125脫落酸 8′羥化酶、cluster-24019.23933MADS轉錄調節FLC下游蛋白。
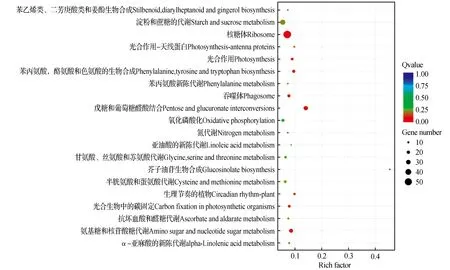
圖8 半重被vs重被差異基因KEGG富集散點圖Fig.8 B vs C DEG enriched KEGG pathway
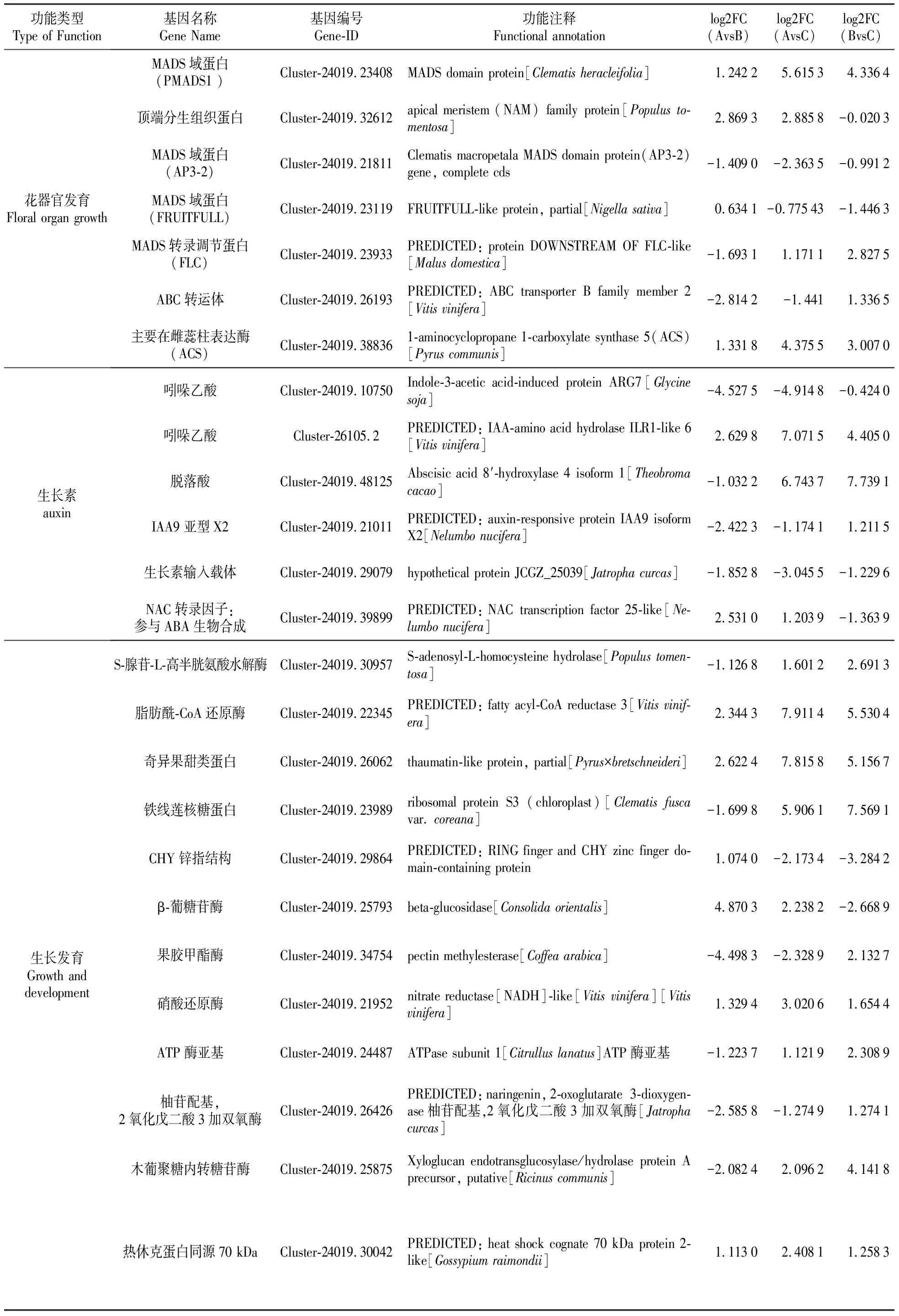
表3 25個關鍵基因的名稱、功能及表達模式
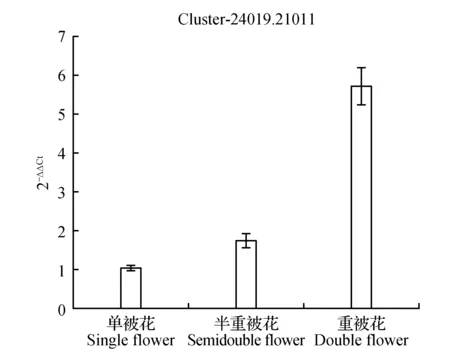
圖10 生長素反應蛋白IAA9表達量差異Fig.10 Expression difference of auxin-responsive protein IAA9
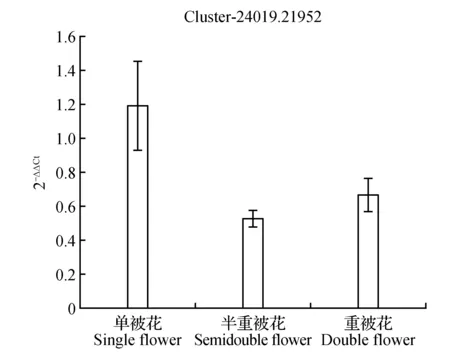
圖11 硝酸還原酶表達量差異Fig.11 Expression difference of nitrate reductase[NADH]
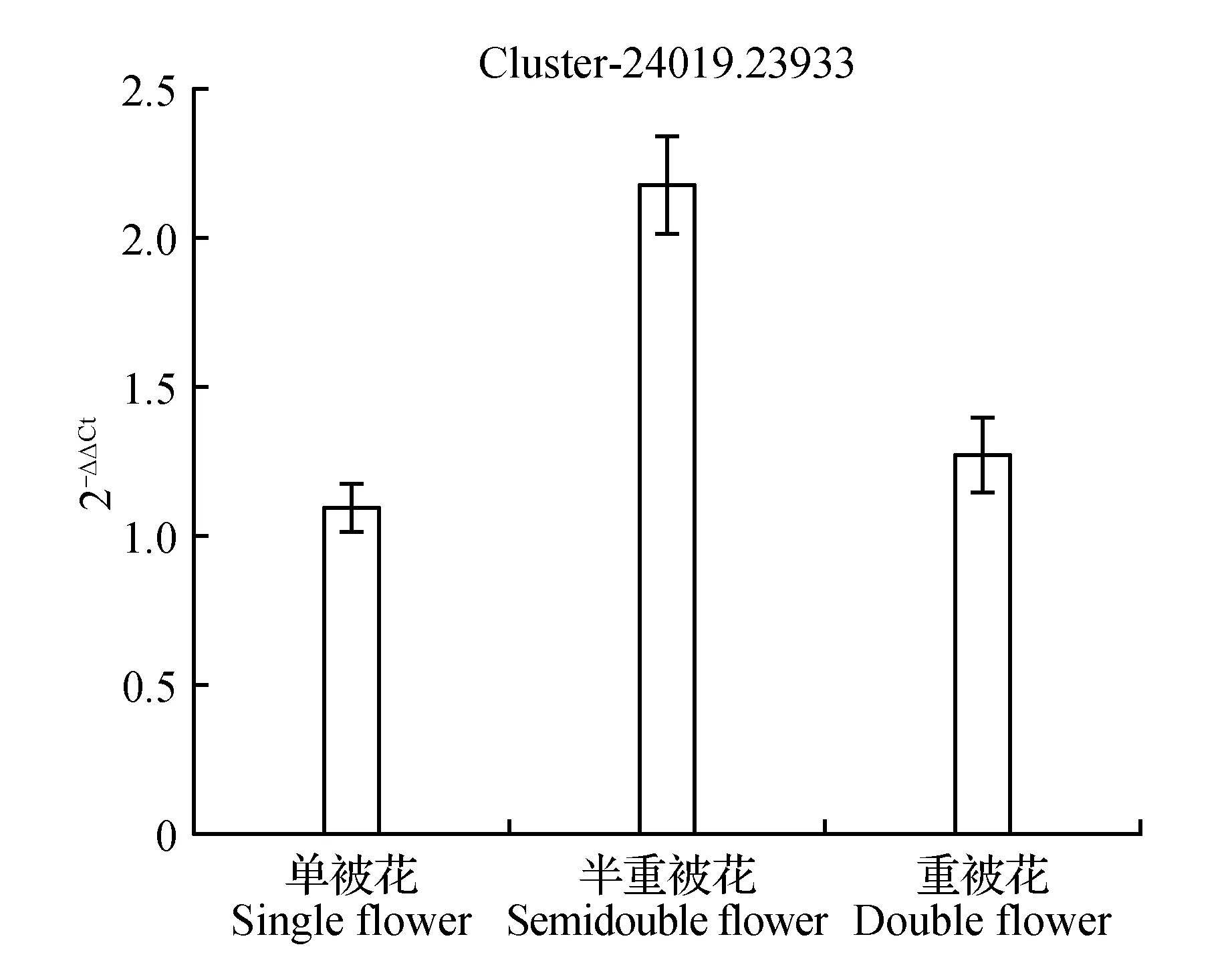
圖12 MADS轉錄調節FLC下游蛋白表達量差異Fig.12 Expression difference of protein downstream of FLC
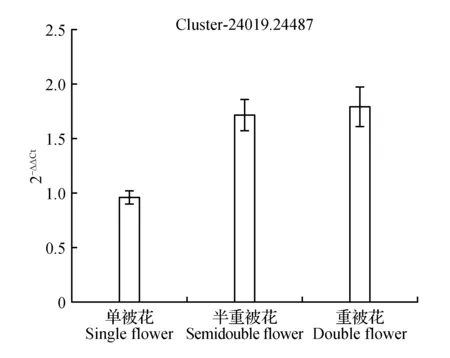
圖13 ATP酶亞基表達量差異Fig.13 Expression difference of ATPase subunit
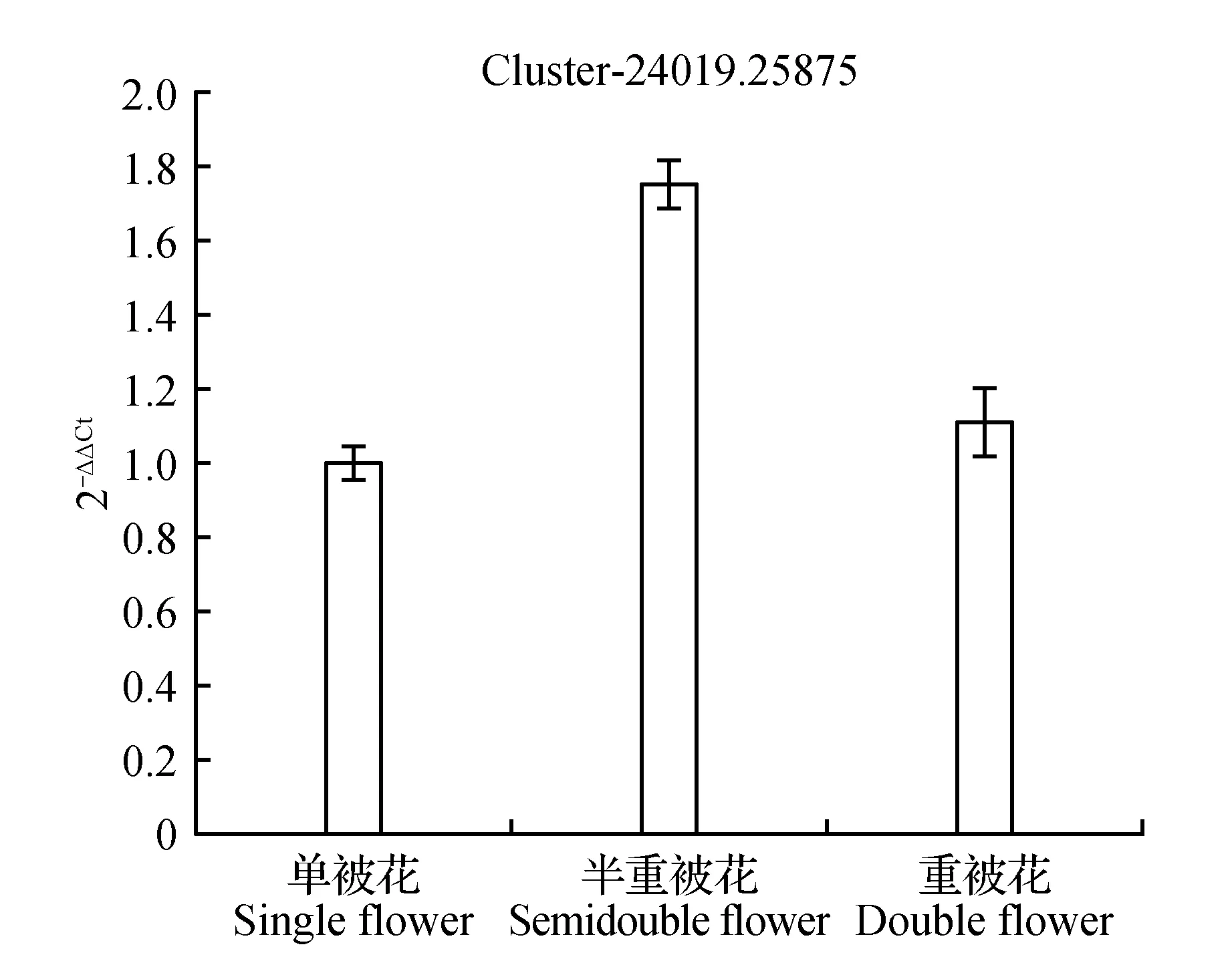
圖14 木葡聚糖內轉糖苷酶表達量差異Fig.14 Expression difference of xyloglucan endotransglucosylase
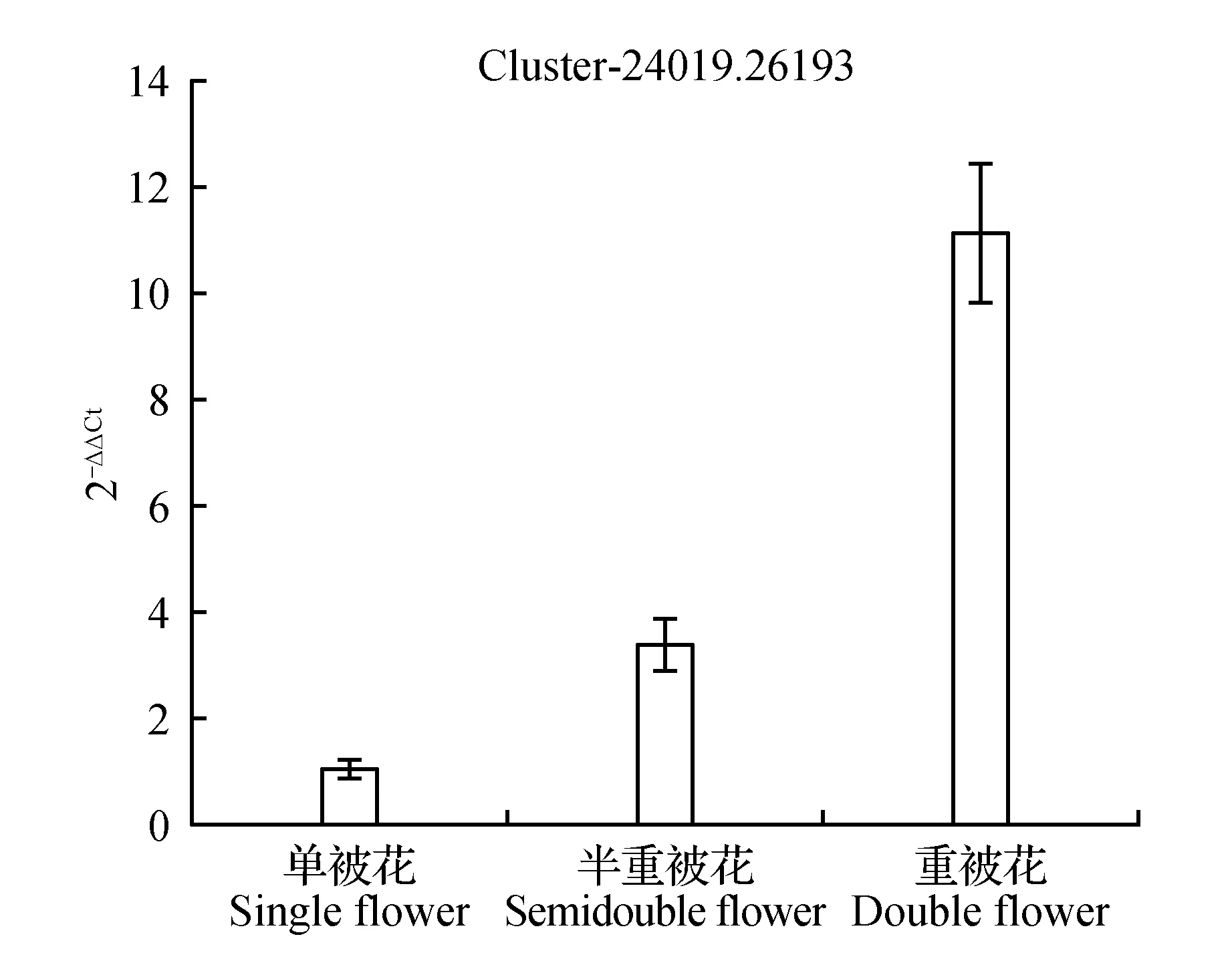
圖15 ABC轉運體表達量差異Fig.15 Expression difference of ABC transporter B family
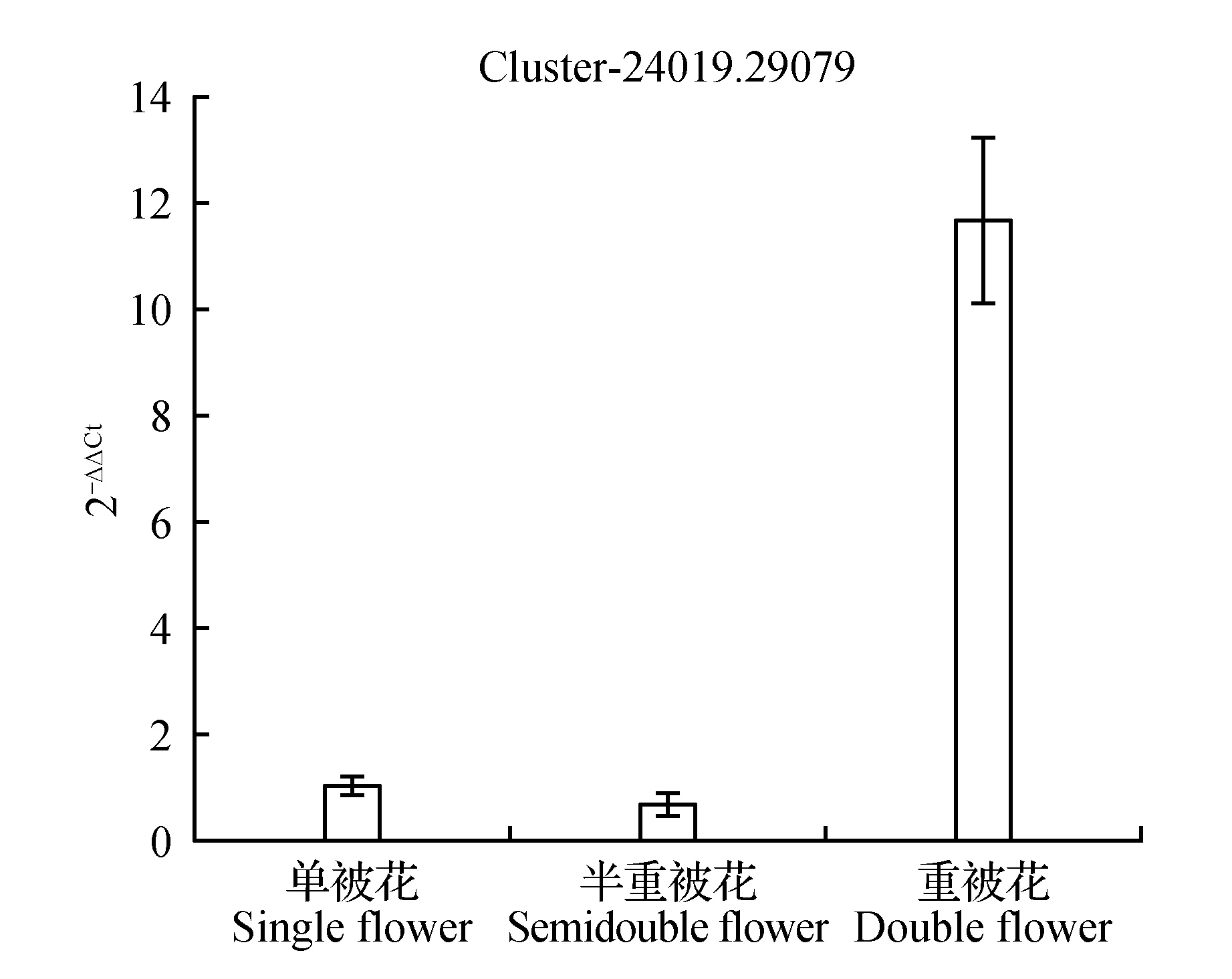
圖16 生長素載體蛋白表達量差異Fig.16 Expression difference of auxin carrier protein

圖17 柚苷配基,2氧化戊二酸3加雙氧酶表達量差異Fig.17 Expression difference of naringenin,2-oxoglutarate 3-dioxygenase
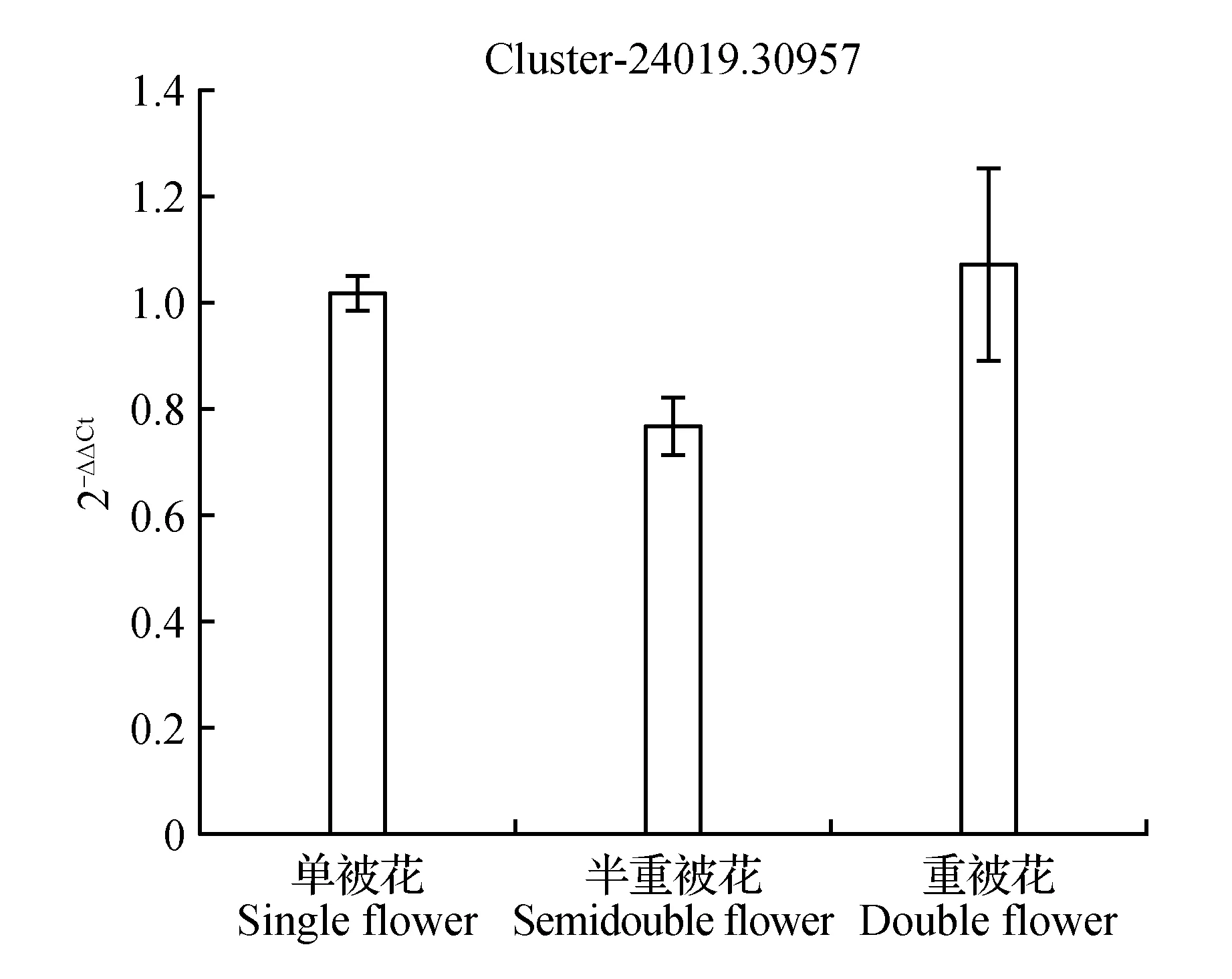
圖18 S-腺苷-L-高半胱氨酸水解酶表達量差異Fig.18 Expression difference of S-adenosyl-L-homocysteine hydrolase
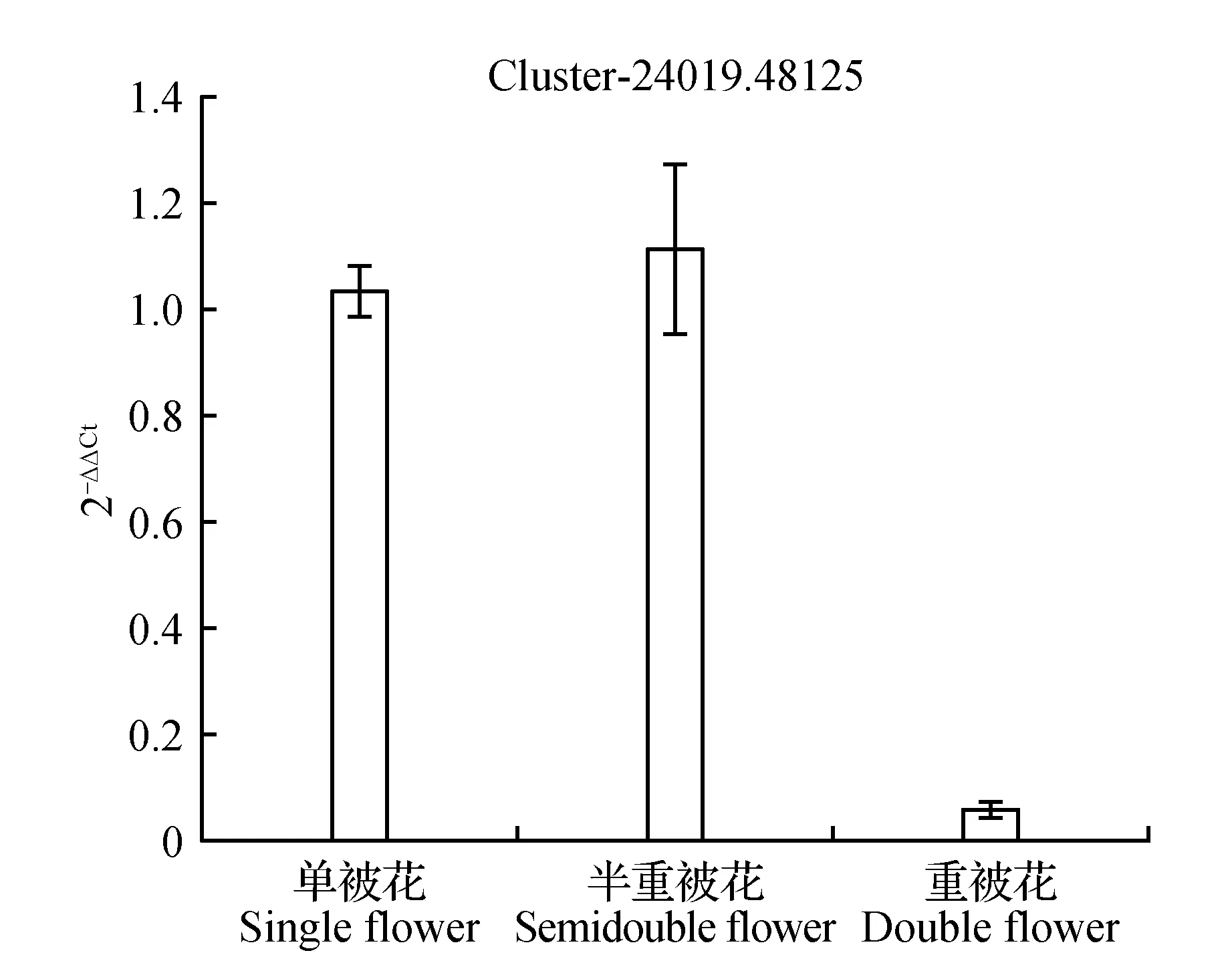
圖19 脫落酸8′羥化酶表達量差異Fig.19 Expression difference of Abscisic acid 8′-hydroxylase
圖10顯示生長素反應蛋白IAA9在重被花中表達量最高且差異顯著,在單被中表達量最低,PCR結果與轉錄組數據結果基本一致;圖11中硝酸還原酶在單被花中表達量最高,在半重被及重被中表達量差別不大,與轉錄組數據基本一致;圖12中MADS轉錄調節FLC下游蛋白在半重被中表達量較高,單重被的表達量差別不大,這與轉錄組結果完全一致;圖13中ATP酶亞基PCR顯示在單被中表達量最低,但轉錄組數據中重被的表達量最低,三者間表達量值差別不大;圖14中木葡聚糖內轉糖苷酶在半重被中表達量最高,單重被花中的表達量差別不大,這與轉錄組結果完全吻合;圖15中ABC轉運體基因在單被中表達量最低,PCR顯示在重被中表達量顯著較高,結果與轉錄組數據部分一致;圖16中生長素載體蛋白在轉錄組與PCR結果中均顯示表達量在重被中顯著較高;圖17中柚苷配基,2氧化戊二酸3加雙氧酶在轉錄組與PCR數據中均顯示表達量在單被中表達量顯著較低,PCR顯示在重被中表達量顯著較高;圖18中S-腺苷-L-高半胱氨酸水解酶在三類花瓣中的表達量數值相近,PCR顯示在重被中的差異表達量較高;圖19中脫落酸8′羥化酶在轉錄組與PCR驗證中均顯示差異表達量在重被中顯著下調,二者結果對比差異情況完全一致。
3 討論
根據植物對環境條件的反應及自身的生物學特性,可以將植物成花類型分成光周期成花、春化作用成花和基因控制的植物成花3個類型[22]。重瓣花形成的分子機理可能是與 MADS-box功能基因突變或互作有關,這其中很可能是C-function基因突變及對下游調控因子的影響造成重瓣花形成,近年來調控重瓣花發育的許多同源異形基因被分離鑒定[23]。在篩取差異基因的過程中發現與MADS-box相關的基因約60個,但在單被和重被樣本對比中存在樣本對比差異的基因只有5個,說明在鐵線蓮重瓣化的過程中的行使調控功能作用的不僅僅由開花相關類基因調控。在鐵線蓮單被向重被轉化過程中表達量存在顯著差異的基因類型主要與生長素類、ABCDE模型基因、低溫、生長發育中與細胞結構及DNA甲基化反應相關。在單被與重被樣本對比中篩到的MADS-BOX類基因有PMADS1、AP3、FRUITFULL及參與MADS調控的FLC下游蛋白,且都在單被中表達量較高,重被中表達量較低。由此可推測這幾類開花基因在花瓣中的低表達影響了鐵線蓮由單被向重被的轉化。半重被是鐵線蓮萼片由單被逐漸瓣化為重被的過程形態,它們行使的功能與生長發育、內源物質及與生長素類有關的基因IAA9、生長素載體蛋白在重被中表達量顯著最高,而脫落酸 8′羥化酶在單被中表達量較高。綜合轉錄組數據及熒光定量PCR驗證結果對比:在三類花型中共存的10個差異基因中轉錄組結果與PCR結果對比差異情況完全或基本一致的有9個,說明本次試驗數據可靠且具有一定的說服性。
4 結論
將鐵線蓮“薇安”同一時期同一株上的3種花型的轉錄本兩兩比較,在GO富集分析中,3個對比數據中差異基因數目分布最多的共同二級類別是催化活性,KEGG富集分析中差異基因數目分布較多的共同通路是淀粉和蔗糖的代謝。在幾類內源激素中主要參與了重瓣化的調控激素是吲哚乙酸和脫落酸,且相同條件下IAA在重被中表達量較高,ABA在單被中表達量較高。在鐵線蓮單被向重被轉化的過程中,特定開花基因的調控、低溫、內源激素含量變化均起到了不可忽略的主導作用。綜合數據結果初步篩選出可能調控鐵線蓮重被化的部基因主要有MADS-BOX類基因PMADS1、AP3、FRUITFULL、FLC;生長素反應蛋白IAA9、生長素輸入載體、吲哚乙酸誘導蛋白、ARG7脫落酸 8′羥化酶。這些基因表達量顯著上調或下調都有可能使鐵線蓮重瓣性狀產生。本次試驗步篩選出部分可能參與鐵線蓮重瓣性狀調控的關鍵基因,為探究鐵線蓮重瓣化形成分子機制提供了基礎數據和理論依據,后續可對這些候選基因進一步功能驗證及深入研究。

