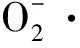鳙魚和三文魚頭湯中不同粒徑膠粒的抗氧化活性
樂彩虹,蘇紅,陶寧萍, 2*
1(上海海洋大學 食品學院,上海,201306)2(上海水產品加工及貯藏工程技術研究中心,上海,201306)
鳙魚(Aristichthysnobilis)又名胖頭魚、花鰱、黑鰱,與鰱魚、草魚、青魚并稱我國四大家魚[1],是中國特有的淡水經濟魚類,有“水中清道夫”的雅稱[2]。鳙魚頭富含膠質所以味道特別鮮美[3],且其頭部腦髓和磷脂含量豐富,素有“鳙魚頭,肉饅頭”的說法[1]。三文魚(SalmonSalar),又名大馬哈魚、鮭魚、撒蒙魚,被國際美食界譽為“水中珍品”“冰海之皇”[4],它的肉質鮮美,營養豐富,含有大量DHA和EPA等[5]。三文魚在加工過程中會產生大量的副產物,如魚頭、魚皮和魚骨等,都有很高的利用價值,對三文魚副產物的再利用也越來越受到人們的重視[6],但對魚頭的研究較少。
湯種類眾多、味道鮮美、制作便捷[7]。在熬煮過程中經過一系列化學物理反應,湯中的化學成分既有從食品中遷移的原始成分,也有原始成分通過相互作用形成的新成分,這些成分還可以通過分子間次級鍵相互作用形成新的超分子結構[8]。湯中含有大量水溶性營養成分,可以很容易被吸收,同時也具有各種生物活性。王莉嫦[9]以鯪魚下腳料為原料,熬煮得到的鯪魚湯營養成分含量高,味道鮮美。徐紅梅[10]研究發現熬煮鳙魚湯2 h后組織中各營養物質的遷移總量達到最大值。蔣靜[11]研究發現在熬煮鯽魚湯過程中,粗蛋白、水溶性蛋白和氨基酸含量不斷增加。田沁等[12]利用電燉鍋熬制鰱魚頭湯,在一定條件下,熬制魚頭湯的營養成分和風味成分含量高。HONDA等[13]研究發現受試者攝取干鰹魚高湯4周后,視覺疲勞主觀癥狀能得到良好的改善。ISHIZAKI等[14]研究發現適量的干鰹魚高湯能有效改善受試者的不良情緒。黃國榕[15]和張勇[16]研究發現鯽魚湯具有治療肝硬化腹水作用和腎臟保護作用。ZHANG等[17]研究了鯽魚湯和黑魚湯的營養成分和抗氧化能力,發現黑魚湯礦物質含量高于鯽魚湯,但氨基酸總量和抗氧化能力低于鯽魚湯。
魚頭湯在熬煮的過程中會自組裝形成不同粒徑大小的微納膠粒,本文在前期優化熬煮魚頭湯方式[18]的基礎上選取熬煮時間為150 min的鳙魚和三文魚頭湯,通過粗濾、離心、微濾和超濾不同方式處理得到不同粒徑大小膠粒的魚頭湯,采用馬爾文激光粒度分析儀測定其膠粒的粒徑分布,利用6種化學法研究魚頭湯中不同粒徑膠粒的體外抗氧化活性,以期為魚頭湯的精深加工提供理論依據,從而創造更大的經濟效益。
1 材料與方法
1.1 材料與試劑
本實驗所用原料鳙魚頭、三文魚頭均購自大連翔祥食品有限公司,捕撈于丹麥法羅群島。大豆油,市售。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),無水乙醇,FeCl2,菲啰嗪(Ferrozine),過硫酸鉀,磷酸鹽(PBS)緩沖液(pH=7.4,pH=6.6),2,2′-二氮-雙(3-乙基苯并噻唑-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS),三羥甲基氨基甲烷(Tris),HCl,鄰苯三酚,H2O2,水楊酸(CH3CH2OH-C7H6O3),FeSO4,K4Fe(CN)6,FeCl3,三氯乙酸(TCA),均購自上海麥克林生物科技有限公司。
1.2 儀器與設備
C21-WT2112T 美的電磁爐,廣東美的網絡科技有限公司;UV-2200 紫外分光光度計,美國Unico公司;SLFPTAD Synergy 多功能酶標儀,美國伯騰儀器有限公司;MS2000 激光粒度分析儀,英國馬爾文儀器有限公司;TG16-WS 臺式高速離心機,湖南湘儀實驗室儀器開發有限公司;HWS-24 電熱恒溫水浴鍋,上海恒科學儀器有限公司。
1.3 實驗方法
1.3.1 樣品生物學測量
抽取相近規格大小鳙魚、三文魚頭各25只,平均頭長、頭寬、頭重見表1。置于-80 ℃冰箱中貯藏待用。

表1 鳙魚、三文魚頭的生物學測量(濕重, mean±SD,n=25)Table 1 The biochemical indicator of A.nobilis, SalmonSalar head
1.3.2 魚頭湯熬煮
參照QIAN等[19]的方法并稍作修改。鳙魚和三文魚頭流水解凍后去鰓,分別切成3 cm×3 cm×2 cm的小塊,洗凈備用。取(20±1)g市售大豆油倒入鍋中于電磁爐(120 ℃)上預熱30 s,加入魚頭塊(400±2)g,煎炸40 s。然后將煎炸魚頭塊與3.2 kg飲用水(魚水質量比為1∶8)倒入不銹鋼鍋中大火熬煮((97±2)℃)至煮沸后,轉小火熬煮((90±2)℃)150 min后棄去魚頭塊即得鳙魚和三文魚頭湯。
1.3.3 魚頭湯膠粒粒徑分布
鳙魚和三文魚頭湯經過濾紙粗濾除去不溶物即為原湯,原湯經10 000 r/min離心15 min取上清液為離心樣品,離心樣品過0.45 μm水相濾膜為微濾樣品,微濾樣品經100 kDa超濾膜得到超濾樣品,由此共制得4種不同粒徑大小的魚頭湯膠粒樣品。用MS2000激光粒度分析儀測定經不同方式處理后的鳙魚和三文魚頭湯膠粒的平均粒徑。平均粒徑的分布主要通過表面積平均粒徑D(3,2)=(Σdi3/Σdi2)、體積平均粒徑D(4,3)=(Σdi4/Σdi3)、d(0.1)、d(0.5)和d(0.9)進行評價(d(0.1)、d(0.5)和d(0.9)分別表示粒度范圍內體積占顆粒總體積的10%,50%和90%時的粒徑大小)。
1.3.4 魚頭湯膠粒DPPH·清除率測定
參照ABU BAKAR等[20]的方法并稍作修改。取不同粒徑的鳙魚和三文魚頭湯各1 mL,分別加入DPPH溶液(0.4 mg/mL)1 mL,混合均勻,室溫反應30 min后,取200 μL于96孔板中,在酶標儀517 nm處測其吸光值A1(此操作過程應全程嚴密避光)。以等量的蒸餾水代替樣品溶液為空白組,測得吸光度A0,等量的蒸餾水代替DPPH溶液作為對照組,測得吸光度A2。DPPH·清除率計算如公式(1):
(1)
1.3.5 魚頭湯膠粒Fe2+螯合能力測定
參照韓娜等[21]的方法并稍作修改。取不同粒徑的鳙魚和三文魚頭湯各1 mL,依次加入50 μL FeCl2(2 mmol/L)、200 μL Ferrozine(5 mmol/L)與2.75 mL蒸餾水混合搖勻,室溫下反應10 min,562 nm處測得吸光值A1,以等量的蒸餾水代替樣品為空白組,測得吸光度A0,以等量的蒸餾水代替FeCl2為對照組,測得吸光度A2。Fe2+螯合能力的計算如公式(2):

(2)
1.3.6 魚頭湯膠粒ABTS+·清除率測定
參照白海娜等[22]的方法并稍作修改。取5 mL ABTS溶液(7 mm)和88 μL過硫酸鉀溶液(140 mm)混合,并在室溫條件下避光放置12~16 h,作為ABTS+·儲備液,用蒸餾水稀釋ABTS+·儲備液至其在734 nm波長的吸光度為0.700±0.005(大約稀釋50倍),作為ABTS+·工作液。取ABTS自由基工作液4 mL,加入不同粒徑的鳙魚和三文魚頭湯各40 μL,室溫避光反應10 min后在734 nm處測得吸光值A1,以等量的蒸餾水代替樣品為空白組,測得吸光度A0,以等量的蒸餾水代替ABTS工作液為對照組,測得吸光度A2。ABTS+·清除率的計算如公式(3):
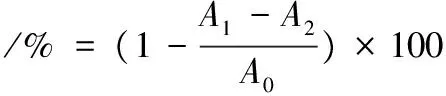
(3)
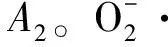
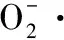
(4)
1.3.8 魚頭湯膠粒·OH清除率測定
參照LAI等[24]的方法并稍作修改。取不同粒徑的鳙魚和三文魚頭湯各1 mL,依次加入FeSO4、CH3CH2OH—C7H6O3、H2O2、H2O各1 mL,混勻啟動反應,在37 ℃培養箱中反應30 min后取上清液在510 nm處測得吸光值A1,以等量的蒸餾水代替樣品為空白組,測得吸光度A0,以等量的蒸餾水代替H2O2溶液為對照組,測得吸光度A2,·OH清除率的計算如公式(5):
(5)
1.3.9 魚頭湯膠粒總還原能力測定
參照陳靜等[25]的方法并稍作修改。取不同粒徑的鳙魚和三文魚頭湯各0.5 mL,加入2.5 mL PBS緩沖液(0.2 mol/L,pH=6.6)和2.5 mL K4Fe(CN)6(1%)混勻,在50 ℃的水浴中反應20 min,迅速冷卻后加入2.5 mL TCA(10%),混勻后在3 000 r/min下離心10 min,取上清液2 mL,加入2 mL H2O和1 mL FeCl3(0.1%)混勻,室溫放置10 min后于700 nm處測其吸光值。
1.4 數據分析
所有實驗均重復3次,結果以平均值±標準偏差(mean±SD)的形式表示。采用SPSS 16.0軟件,根據單因素方差(One-Way ANOVA)方法對數據進行差異顯著性比較分析,P<0.05為數據之間存在顯著性差異。Origin 8.0(Origin Lab,USA)軟件用于處理和生成圖像。
2 結果與分析
2.1 不同方式處理的魚頭湯膠粒粒徑分布
如果D(3,2)和D(4,3)的值接近,則顆粒的形狀將更加規則并且分布更加集中;如果值之間的差異很大,則分布將更寬。由表2可知,隨著處理方法的不同,鳙魚頭湯和三文魚頭湯形成膠粒的平均粒徑顯著變小,并且三文魚頭湯膠粒的平均粒徑大于鳙魚頭湯,可能與三文魚是海水魚,含有更高濃度的油脂有關。鳙魚和三文魚頭原湯膠粒的粒徑分布范圍比較大,10 000 r/min離心15 min后,鳙魚頭湯和三文魚頭湯膠粒的各粒徑參數都有顯著性變化(P<0.05),說明湯經過離心之后平均粒徑顯著變小,在通過0.45 μm的濾膜微濾和100 kDa的超濾離心管超濾之后,較大的顆粒在膜過濾過程中被濾膜截留,而較小的顆粒則通過膜,平均粒徑變得非常小。所以,經過不同方式處理后魚頭湯膠粒分布粒徑大小不同,這為之后研究魚頭湯中不同粒徑膠粒與其抗氧化活性之間的關系提供參考。

表2 不同方式處理的鳙魚和三文魚頭湯膠粒粒徑分布Table 2 Colloidal particle size distribution of A. nobilis and Salmon Salar head soup with different treatment methods
注:上標小寫字母表示不同處理方式之間具有顯著性差異,上標大寫字母表示不同魚湯之間具有顯著性差異,P<0.05
2.2 不同方式處理魚頭湯膠粒的抗氧化活性
DPPH·是一種穩定的以氮原子為中心的自由基,它的穩定性來源于空間障礙和3個苯環的共振穩定作用,使夾在中間的氮原子上不成對的電子不能發揮電子成對作用[26]。DPPH的醇溶液為深紫色,在517 nm處有最大吸收峰,當體系中存在自由基清除劑時,氮原子上的孤電子被配對,DPPH·便會被還原成黃色的DPPH-H非自由基的形式[27]。
圖1為不同處理方式的鳙魚和三文魚頭湯膠粒的DPPH·清除率。由圖1可知,處理方式不同,樣品的DPPH·清除率之間存在明顯差別。具體表現為鳙魚頭和三文魚頭原湯膠粒DPPH·清除率顯著高于離心、微濾和超濾魚頭湯(P<0.05),并且經過離心和微濾的魚頭湯膠粒DPPH·清除率顯著高于超濾后的魚頭湯(P<0.05),這與分布的結果一致,表明在一系列處理過程中,大部分大顆粒物質被截留,有效活性物質也被截留,導致其DPPH·清除率減小。鳙魚頭和三文魚頭的原湯和微濾樣品膠粒DPPH·清除率不存在顯著性差別(P>0.05),但離心和超濾樣品膠粒DPPH·清除率存在顯著性差別(P<0.05),且2種魚頭湯膠粒DPPH·清除率均表現為原湯>離心>微濾>超濾。
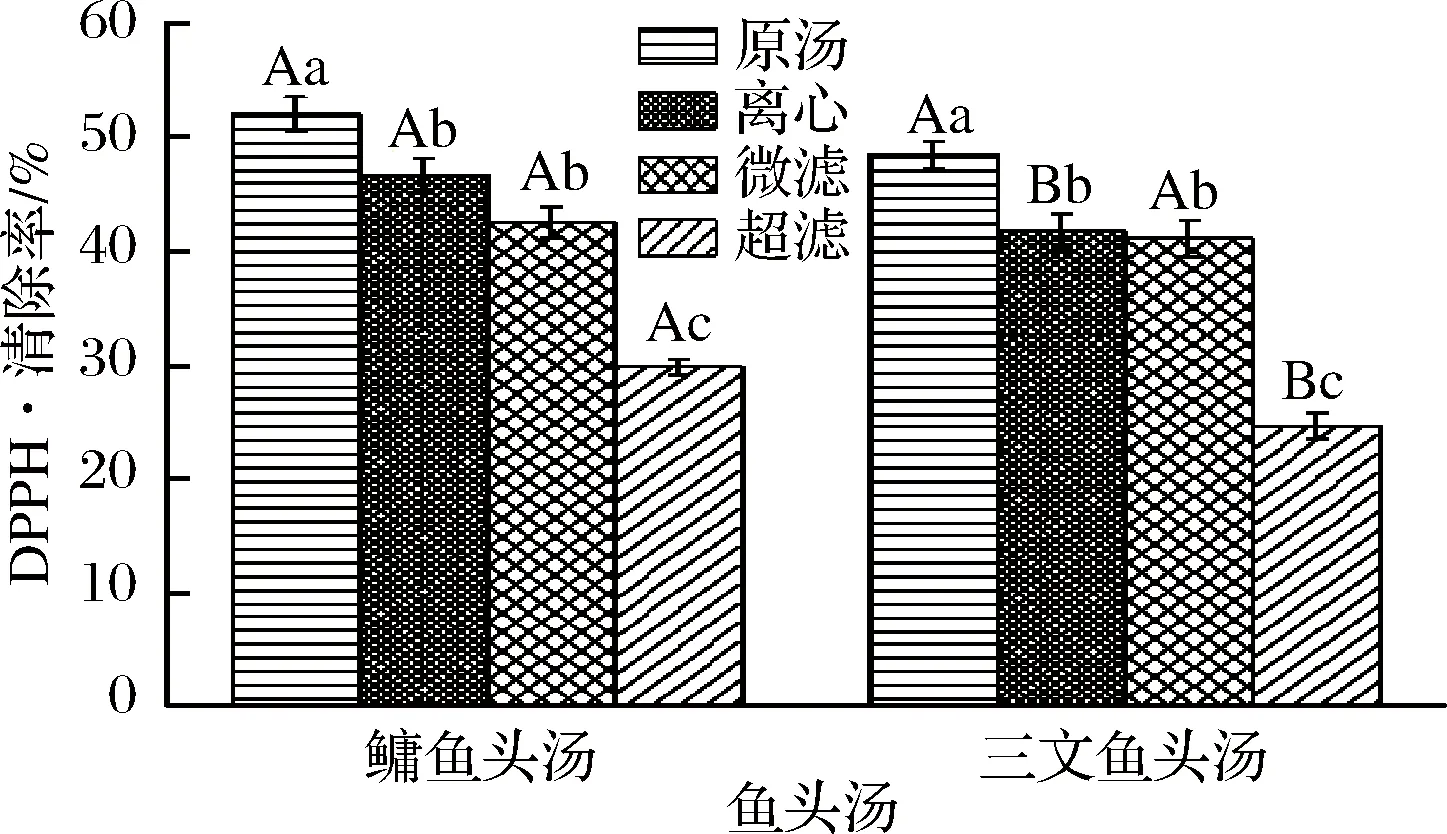
圖1 不同處理方式的鳙魚和三文魚頭湯膠粒的DPPH·清除率Fig.1 DPPH free radical scavenging rate of A. nobilisand Salmon Salar head soup colloidal with differenttreatment methods注:上標小寫字母表示不同處理方式之間具有顯著性差異,上標大寫字母表示不同魚湯之間具有顯著性差異,P<0.05(下同)
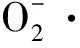
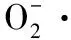
圖2 不同處理方式的鳙魚和三文魚頭湯膠粒的清除率 scavenging rate of A. nobilis and Salmon Salarhead soup colloidal with different treatment methods
Fe2+能夠與抗氧化劑發生鰲合反應[29],避免了Fe2+與H2O2發生Fenton反應而產生自由基,在反應結束時,在反應體系中加入Ferrozine試劑,沒有被螯合的Fe2+會與Ferrozine試劑反應生成有色基團,該有色基團在563 nm處有強的吸收峰,從而能夠間接反映魚頭湯的抗氧化能力。
圖3為不同處理方式的鳙魚和三文魚頭湯膠粒的Fe2+螯合能力。由圖3可知,鳙魚頭原湯與離心魚頭湯膠粒Fe2+螯合能力不存在顯著性差異(P>0.05),但都顯著性高于微濾與超濾魚頭湯(P<0.05),微濾魚頭湯膠粒Fe2+螯合能力顯著性高于超濾魚頭湯(P<0.05);不同粒徑的三文魚頭湯膠粒Fe2+螯合能力之間存在顯著性差異(P<0.05)。兩種魚頭湯膠粒Fe2+螯合能力均表現為原湯>離心>微濾>超濾。而且不同粒徑鳙魚頭湯膠粒Fe2+螯合能力均大于三文魚頭湯。ZHANG等[17]用同種方法測定了鯽魚湯和黑魚湯原湯經過模擬體外消化后的抗氧化活性,經對比可知,鳙魚頭湯Fe2+螯合率高于鯽魚湯(60.05%)和黑魚湯(43.48%),但鯽魚湯和黑魚湯Fe2+螯合率高于三文魚頭湯。
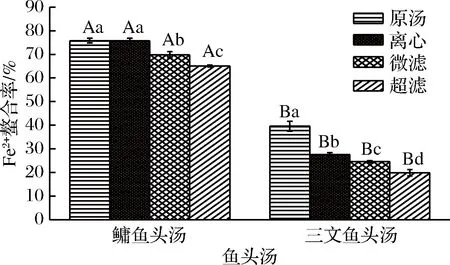
圖3 不同處理方式的鳙魚和三文魚頭湯膠粒的Fe2+螯合率Fig.3 The Fe2+ chelation rate of A. nobilis and Salmon Salarhead soup colloidal with different treatment methods
ABTS+·是一種人工合成的自由基,其在氧化劑的作用下會生成綠色的陽離子ABTS+·,該自由基在734 nm處有吸收峰[30]。若反應體系中含有抗氧化劑,則會抑制ABTS+·的產生,從而間接反映樣品抗氧化能力的大小。
圖4為不同處理方式的鳙魚和三文魚頭湯膠粒的ABTS+·清除率。由圖4可知,鳙魚頭原湯膠粒ABTS+·清除率顯著性高于離心、微濾和超濾魚頭湯(P<0.05),離心與微濾魚頭湯膠粒ABTS+·清除率無顯著性差異(P>0.05),但都顯著高于超濾魚頭湯(P<0.05);三文魚頭原湯、離心與微濾魚頭湯膠粒ABTS+·清除率不存在顯著差異(P>0.05),但都顯著性高于超濾魚頭湯(P<0.05)。2種魚頭湯膠粒ABTS+·清除率均表現為原湯>離心>微濾>超濾,且不同粒徑鳙魚頭湯膠粒ABTS+·清除率均大于三文魚頭湯,這與鳙魚和三文魚頭湯膠粒的Fe2+螯合能力的結果一致。

圖4 不同處理方式的鳙魚和三文魚頭湯膠粒的ABTS+·清除率Fig.4 ABTS+· scavenging rate of A. nobilis and Salmon Salar head soup colloidal with different treatment methods
·OH能殺死紅細胞,降解DNA、細胞膜和多糖化合物[16],它是迄今發現最活躍的自由基之一,可以快速有效的氧化幾乎所有化合物[32]。利用Fe2+與H2O2發生Fenton反應而產生·OH[33],它能夠與水楊酸反應產生2,3-二羥基苯甲酸,其在510 nm處有最大吸收峰。
圖5為不同處理方式的鳙魚和三文魚頭湯膠粒的·OH清除率。由圖5可知,鳙魚頭原湯與離心魚頭湯膠粒·OH清除率不存在顯著性差異(P>0.05),但都顯著高于微濾與超濾魚頭湯(P<0.05),且微濾與超濾魚頭湯膠粒·OH清除率不存在顯著性差異(P>0.05);三文魚頭原湯、離心與微濾魚頭湯膠粒·OH清除率不存在顯著性差異(P>0.05),但都顯著性高于超濾魚頭湯(P<0.05),且不同粒徑三文魚頭湯膠粒·OH清除率高于鳙魚頭湯。
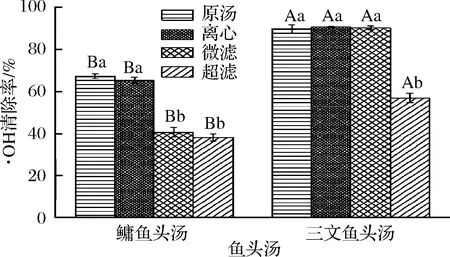
圖5 不同處理方式的鳙魚和三文魚頭湯膠粒的·OH清除率Fig.5 The hydroxyl free radical scavenging rate of A. nobilis and Salmon Salar head soup colloidal with different treatment methods
樣品的抗氧化劑能使K4Fe(CN)6的Fe3+還原成Fe2+[KFe(CN)3],Fe2+進一步和FeCl3反應生成在700 nm處有最大吸光度的普魯士藍Fe4[Fe(CN)6]3,因此測定700 nm處的高低可以間接反映抗氧化劑的還原能力大小,吸光度越大,還原能力越強[34]。反應式如下:
3K4Fe(CN)6+4FeCl3→Fe4[Fe(CN)6]3+12KCl
圖6為不同處理方式的鳙魚和三文魚頭湯膠粒的總還原能力。由圖6可知,鳙魚頭原湯與離心魚頭湯膠粒總還原能力不存在顯著性差異(P>0.05),但都顯著高于微濾與超濾魚頭湯(P<0.05),且超濾魚頭湯膠粒顯著高于微濾魚頭湯(P<0.05);三文魚頭原湯膠粒總還原能力顯著性高于離心、微濾與超濾魚頭湯(P<0.05),離心與微濾魚頭湯膠粒總還原能力不存在顯著性差異(P>0.05),但都顯著高于超濾魚頭湯(P<0.05)。而且不同粒徑三文魚頭湯膠粒的總還原能力均大于鳙魚頭湯,這與鳙魚和三文魚頭湯膠粒·OH清除率的結果一致。
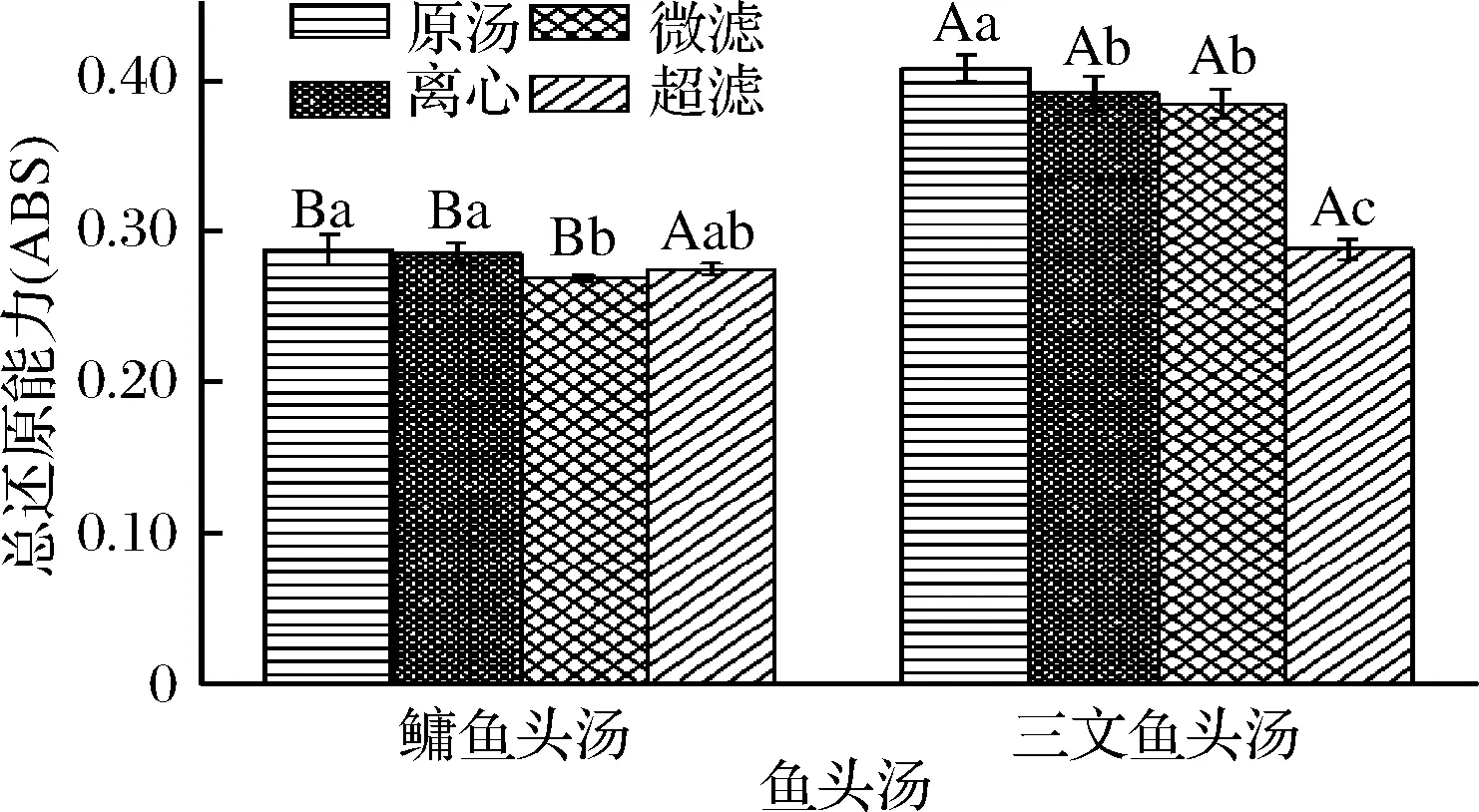
圖6 不同處理方式的鳙魚和三文魚頭湯膠粒的總還原能力Fig.6 The total reducing power of A. nobilis and Salmon Salar head soup colloidal with different treatment methods
3 結論