染料木素對LPS誘導BV2小膠質細胞炎癥反應的作用
苗悅 都中蕊 楊葉 陳文芳

[摘要]目的探討染料木素(GEN)對脂多糖(LPS)誘導的BV2小膠質細胞炎癥反應的抑制作用及雌激素核受體(ER)阻斷劑ICI182,780的阻斷效應。
方法常規培養BV2小膠質細胞,分為對照組、LPS組、GEN+LPS組、ICI182,780+GEN+LPS組。對照組和LPS組細胞分別給予0.1g/L二甲基亞砜(DMSO)和1mg/L的LPS作用6h;GEN+LPS組細胞在加入LPS前先用GEN(10μmol/L)預保護1h;ICI182,780+GEN+LPS組先加入ICI182,780(1μmol/L)作用細胞1h,然后加入GEN預保護1h,再加入LPS共同作用6h。應用實時熒光定量PCR技術檢測各組腫瘤壞死因子α(TNF-α)和白細胞介素1β(IL-[STBX]1β)基因的表達。
結果與對照組比較,LPS組炎性因子TNF-α和IL-[STBX]1β基因的表達明顯上調(F=131.00、43.13,q=26.04、14.95,P<0.01);GEN預保護能明顯降低LPS誘導的TNF-α和IL-[STBX]1β基因表達上調(q=17.08、9.70,P<0.01),此作用可以被ER特異性阻斷劑ICI182,780所阻斷(q=10.27、5.85,P<0.01)。
結論GEN能夠抑制LPS誘導的BV2小膠質細胞TNF-α和IL-[STBX]1β的基因表達,其抗炎機制與ER途徑的激活有關。
[關鍵詞]染料木黃酮;脂多糖類;小神經膠質細胞;炎癥;腫瘤壞死因子α;白細胞介素1β
[中圖分類號]R338.2;R916.4
[文獻標志碼]A
[文章編號]2096-5532(2020)01-0001-04
近年來,越來越多的研究結果表明,小膠質細胞參與了帕金森病(PD)的發病和進展[1]。雖然小膠質細胞數量較少,僅占成年大腦神經膠質細胞群的10%~15%[2],但它在中樞神經系統的宿主防御和組織修復中起重要作用[3]。因此,如何有效地預防或抑制小膠質細胞的活化并保護神經元免受損傷是研究人員目前關注的問題。研究表明,雌激素可以抑制小膠質細胞的活化,其抑制作用與小膠質細胞上的雌激素受體有關[4]。然而,長期使用雌激素可導致激素依賴性疾病[5],如乳癌和子宮內膜癌等,從而限制了雌激素的臨床應用。植物雌激素因其具有副作用小、使用安全等特點越來越受到人們的關注。染料木素(GEN)是從豆科植物如大豆中提取的,該物質化學結構與類固醇雌激素相似,可以激活經典的雌激素核受體(ER)和G蛋白偶聯雌激素受體(GPER)。GEN的生物學作用包括抗炎[6]、抗氧化[7]、抗癌[8]、保護骨骼[9]以及保護心血管系統[10]。有研究發現,GEN可以抑制炎性因子的生成,在體內發揮抗炎保護作用。有臨床研究表明,PD病人腦內小膠質細胞被激活,釋放的炎癥因子導致神經元損害,而神經元的損傷會進一步激活小膠質細胞,從而在小膠質細胞激活和神經元損傷之間形成惡性循環,進而導致神經元的死亡[11]。GEN可對抗上述過程[12-13]。本課題組前期實驗已經證明GEN可以通過雌激素膜受體(GPER)發揮抗炎作用[14],因GEN還能與ER結合,為探討ER是否參與了GEN對小膠質細胞炎癥反應的抑制作用,本研究觀察了ER特異性阻斷劑ICI182,780對GEN抗炎作用的影響。現將結果報告如下。
1材料與方法
1.1實驗材料
GEN購自上海同田生物技術有限公司;脂多糖(LPS)和ICI182,780購自美國Sigma公司;BV2小膠質細胞屬于小鼠小膠質瘤細胞系,購自北京市協和醫學院細胞資源中心;TRIzol試劑購自美國LifeTechnologies公司;聚合酶鏈式反應(PCR)逆轉錄試劑盒購自Roche公司;SYBRGreen購自美國Takara公司。
1.2細胞培養及分組
將BV2小膠質細胞接種于培養瓶或6孔板中,應用高糖DMEM培養液(含100kU/L青霉素、100mg/L鏈霉素和體積分數0.10FBS),置于含體積分數0.05CO2的37℃無菌培養箱中常規培養。顯微鏡下觀察細胞融合度達到80%~90%時進行分組和加藥處理。將細胞分為對照組(A組)、LPS組(B組)、GEN+LPS組(C組)和ICI182,780+GEN+LPS組(D組)。對照組細胞給予0.1g/L二甲基亞砜(DMSO)處理;LPS組細胞則加入LPS(1mg/L)作用6h;GEN+LPS組細胞加LPS前先用GEN(10μmol/L)預保護1h;ICI182,780+GEN+LPS組細胞先加入ICI182,780(1μmol/L)作用1h,然后加入GEN(10μmol/L)預保護1h,再加入LPS(1mg/L)共同作用6h。
1.3實時熒光定量PCR(RT-PCR)檢測腫瘤壞死因子α(TNF-α)和白細胞介素1β(IL-[STBX]1β)mRNA的表達
應用TRIzol裂解細胞,提取總RNA。加入總RNA1μg、5×gDNAEraserBuffer2μL、gDNA1μL,補充DEPC水使總體積達10μL,輕輕混勻、離心。在42℃下變性2min,立即置于冰上冷卻。然后將RTPrimerMix1μL、5×PrimeScriptBuf-
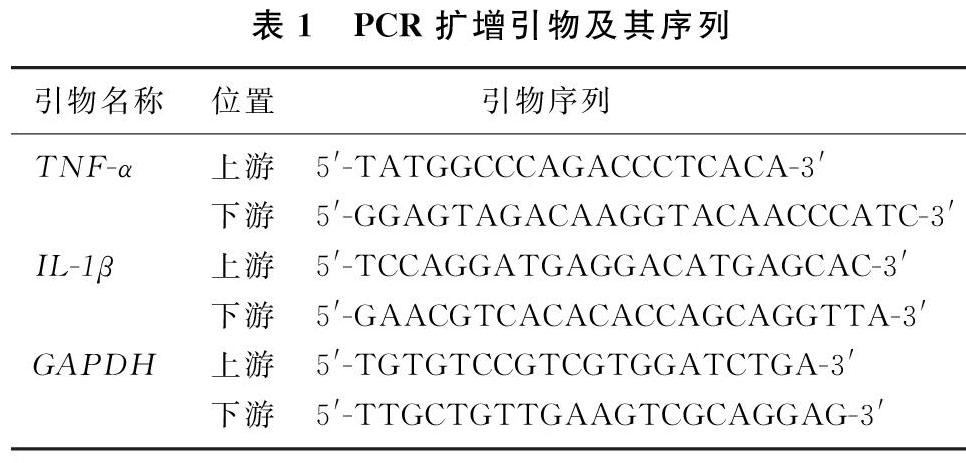
fer2(forRealTime)4μL、PrimeScriptRTEnzymeMixⅠ1μL、RNaseFreeddH2O4μL加入第一步反應體系中至總體積20μL,混勻、離心。在37℃下反應15min,然后升溫至85℃,作用5s使逆轉錄酶失活,4℃冷卻。采用SYBRGreen染料法定量檢測TNF-α和IL-[STBX]1β與GAPDH的基因表達。PCR擴增引物及其序列見表1。采用2-△△CT法計算目的基因相對表達量。
1.4統計學處理
實驗結果以[AKx-D]±s形式表示,應用GraphPadPrism5.0統計軟件進行單因素方差分析(One-WayANOVA)并繼以Tukey法進行兩兩比較。P<0.05則表明差異有統計學意義。
2結果
與對照組相比,LPS組炎性因子TNF-α和IL-[STBX]1β的基因表達均明顯上調(F=131.00、43.13,q=26.04、14.95,P<0.01);GEN+LPS組TNF-α和IL-[STBX]1β的基因表達較LPS組均明顯降低,差異有統計學意義(q=17.08、9.70,P<0.01);GEN的抗炎作用可以被ER特異性拮抗劑ICI182,780所阻斷,ICI182,780+GEN+LPS組與GEN+LPS組細胞TNF-α和IL-[STBX]1β基因表達比較,差異有統計學意義(q=10.27、5.85,P<0.01)。見表2。
3討論
PD是發病率僅次于阿爾茨海默病(AD)的一種神經退行性疾病[15],其病理學特征是黑質中多巴胺能神經元的進行性退化和缺失[16]。PD的確切病因目前尚不明確,但已知與環境、遺傳和免疫因素等有關。1988年,有研究者認為炎癥可能是PD的第一致病機制[17]。MCGEER等[18]研究結果顯示,促炎細胞因子合成增加可以激活PD病人紋狀體的小膠質細胞。近年來,越來越多的研究表明,神經炎癥在PD的發病機制中起著重要作用[19-22]。神經炎癥的特征包括小膠質細胞的活化,反應性星形膠質細胞增多以及許多炎癥遞質如細胞因子、趨化因子、前列腺素、補體級聯蛋白、活性氧和活性氮等物質的釋放[23-25]。這些因素可以破壞血-腦脊液屏障并使免疫細胞進入中樞神經系統。因此,越來越多的研究者開始關注如何有效降低神經炎癥,為神經退行性疾病的治療提供作用靶點。
GEN是一種從豆科植物中提取的脂溶性黃酮類化合物,作為一種能有效滲透血-腦脊液屏障的植物雌激素受到了廣泛關注[26-28]。以往的研究結果表明,GEN能與ER結合誘導雌激素調控的靶基因表達[29]。近年來,人們認為GEN在體內和體外都具有神經營養和神經保護作用[30-33]。本課題組前期研究結果表明,GEN對1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)誘導的小鼠黑質神經元凋亡具有保護作用[34]。GEN能對抗6-羥基多巴胺(6-OHDA)對SK-N-SH細胞的神經毒性[35]。近年來的研究顯示,GEN可通過Toll樣受體4(TLR4)和核因子κB(NF-κB)信號通路拮抗β-淀粉樣肽或LPS誘導的小膠質細胞炎癥損傷[12-13]。本課題組前期研究表明,GEN對LPS誘導的小膠質細胞一氧化氮合酶(iNOS)、環氧化酶-2(COX-2)、TNF-α、IL-1β和IL-6的表達有劑量依賴性的抑制作用,10μmol/L的GEN抗炎作用顯著,且其抗炎作用可以被GPER特異性阻斷劑G15所阻斷[14]。為進一步探討經典核受體ER是否參與了GEN的抗炎抑制作用,本實驗觀察了ER的特異性阻斷劑ICI182,780對GEN抗炎作用的影響,結果顯示,應用阻斷劑后,GEN對炎癥因子TNF-α和IL-[STBX]1β基因表達的抑制作用明顯降低,表明ER也參與了GEN的抗炎作用。
綜上所述,GEN能夠抑制LPS誘導的BV2小膠質細胞TNF-α和IL-[STBX]1β的基因表達,其抗炎機制與ER信號途徑的激活有關。
[參考文獻]
[1][ZK(#]KETTENMANNH,KIRCHHOFFF,VERKHRATSKYA.Microglia:newrolesforthesynapticstripper[J].Neuron,2013,77(1):10-18.
[2]NAYAKD,ROTHTL,MCGAVERNDB.Microgliadeve-lopmentandfunction[J].AnnuRevImmunol,2014,32:367-402.
[3]KETTENMANNH,HANISCHUK,NODAM,etal.Physiologyofmicroglia[J].PhysiolRev,2011,91(2):461-553.
[4]VILLAA,VEGETOE,POLETTIA,etal.Estrogens,neuroinflammation,andneurodegeneration[J].EndocrineReviews,2016,37(4):372-402.
[5]HANRui,GUShanzhi,ZHANGYujiao,etal.Estrogenpromotesprogressionofhormone-dependentbreastcancerthroughCCL2-CCR2axisbyupregulationofTwistviaPI3K/AKT/NF-κBsignaling[J].ScientificReports,2018,8(1):9575.
[6]LIJinchao,LIJun,YUEYe,etal.Genisteinsuppressestumornecrosisfactorα-inducedinflammationviamodulatingreactiveoxygenspecies/Akt/nuclearfactorκBandadenosinemonophosphate-activatedproteinkinasesignalpathwaysinhumansynoviocyteMH7Acells[J].DrugDesignDevelopmentandTherapy,2014,8:315-323.
[7]JAVANBAKHTMH,SADRIAR,DJALALIM,etal.Soyproteinandgenisteinimprovesrenalantioxidantstatusinexperimentalnephroticsyndrome[J].Nefrologia,2014,34(4):483-490.
[8]CHENWF,HUANGMH,TZANGCH,etal.Inhibitoryactionsofgenisteininhumanbreastcancer(MCF7)cells[J].BiochimicaetBiophysicaActa,2003,1638(2):187-196.
[9]CHENWF,WONGMS.GenisteinmodulatestheeffectsofparathyroidhormoneinhumanosteoblasticSaOS2cells[J].TheBritishJournalofNutrition,2006,95(6):1039-1047.
[10]LEESH,LEEJJ,ASAHARAT,etal.Genisteinpromotesendothelialcolony-formingcell(ECFC)bioactivitiesandcardiacregenerationinmyocardialinfarction[J].PLoSOne,2014,9(5):e96155.
[11]HAQUEME,AKTHERM,JAKARIAM,etal.TargetingthemicroglialNLRP3inflammasomeanditsroleinParkinsonsdisease[J].MovementDisorders,2019.doi:10.1002/mds.27874.
[12]ZHOUXin,YUANLinhong,ZHAOXia,etal.Genisteinantagonizesinflammatorydamageinducedbyβ-amyloidpeptideinmicrogliathroughTLR4andNF-κB[J].Nutrition(Burbank,LosAngelesCounty,Calif.),2014,30(1):90-95.
[13]JEONGJW,LEEHH,HANMH,etal.Anti-inflammatoryeffectsofgenisteinviasuppressionofthetoll-likereceptor4-mediatedsignalingpathwayinlipopolysaccharide-stimulatedBV2microglia[J].Chemico-BiologicalInteractions,2014,212:30-39.
[14]DUZhongrui,FENGXiaoqing,LINa,etal.Gprotein-coupledestrogenreceptorisinvolvedintheanti-inflammatoryeffectsofgenisteininmicroglia[J].Phytomedicine:InternationalJournalofPhytotherapyandPhytopharmacology,2018,43:11-20.
[15]CACABELOSR.Parkinsonsdisease:frompathogenesistopharmacogenomics[J].IntJMolSci,2017,18(3):551.
[16]DICKSONDW.NeuropathologyofParkinsondisease[J].ParkinsonismRelatDisord,2018,46(Suppl1):S30-S33.
[17]MCGEERPL,ITAGAKIS,BOYESBE,etal.ReactivemicrogliaarepositiveforHLADRinthesubstantianigraofParkinsonsandAlzheimersdiseasebrains[J].Neurology,1988,38(8):1285-1291.
[18]MCGEERPL,MCGEEREG.InflammationandneurodegenerationinParkinsonsdisease[J].ParkinsonismRelatDisord,2004,10Suppl1:S3-S7.
[19]LEEY,LEES,CHANGSC,etal.SignificantrolesofneuroinflammationinParkinsonsdisease:therapeutictargetsforPDprevention[J].ArchivesofPharmacalResearch,2019,42(5,SI):416-425.
[20]VIVEKANANTHAMS,SHAHS,DEWJIR,etal.NeuroinflammationinParkinsonsdisease:roleinneurodegenerationandtissuerepair[J].IntJNeurosci,2015,125(10):717-725
[21]KEMPURAJD,THANGAVELR,NATTERUPA,etal.Neuroinflammationinducesneurodegeneration[J].JNeurolNeurosurgSpine,2016,1(1):PMID28127589.
[22]WANGQ,LIUY,ZHOUJ.NeuroinflammationinParkinsonsdiseaseanditspotentialastherapeutictarget[J].TranslNeurodegener,2015,4:19.
[23]SCHAINM,KREISLWC.Neuroinflammationinneurodegenerativedisorders—areview[J].CurrentNeurologyandNeuroscienceReports,2017,17(3):25.
[24]曹飛.小膠質細胞介導的神經炎癥在帕金森病發生發展中的作用[J].濟寧醫學院學報,2019,42(4):289-293,297.
[25]GONZLEZ-REYESRE,NAVA-MESAMO,VARGAS-SNCHEZK,etal.InvolvementofastrocytesinAlzheimersdiseasefromaneuroinflammatoryandoxidativestressperspective[J].FrontiersinMolecularNeuroscience,2017,10:427.
[26]MOZOLEWSKIP,MOSKOTM,JAKBKIEWICZ-BANECKAJ,etal.Nonsteroidalanti-inflammatorydrugsmodulatecellularglycosaminoglycansynthesisbyaffectingEGFRandPI3Ksignalingpathways[J].ScientificReports,2017,7:43154.
[27]CHENWF,HUANGMH,TZANGCH,etal.Inhibitoryactionsofgenisteininhumanbreastcancer(MCF-7)cells[J].BiochimBiophysActa,2003,1638(2):187-196.
[28]CHENWF,WONGMS.GenisteinmodulatestheeffectsofparathyroidhormoneinhumanosteoblasticSaOS-2cells[J].BrJNutr,2006,95(6):1039-1047.
[29]THOMASP,DONGJ.Bindingandactivationoftheseven-transmembraneestrogenreceptorGPR30byenvironmentalestrogens:apotentialnovelmechanismofendocrinedisruption[J].TheJournalofSteroidBiochemistryandMolecularBiology,2006,102(1/5):175-179.
[30]吳環立,馬現啟,趙海洋.染料木素對實驗性腦出血大鼠PI3K/Akt通路的影響[J].臨床與病理雜志,2018,38(5):917-921.
[31]劉瑞珍,黎曉,朱焱,等.染料木素磺酸鈉對腦缺血再灌注損傷大鼠細胞凋亡相關基因表達的影響[J].贛南醫學院學報,2018,38(2):99-102,107.
[32]WUHuancheng,HUQunliang,ZHANGShijun,etal.NeuroprotectiveeffectsofgenisteinonSH-SY5YcellsoverexpressingA53Tmutantα-synuclein[J].NeuralRegenerationResearch,2018,13(8):1375-1383.
[33]OZBEKZ,AYDINHE,KOCMANAE,etal.Neuroprotectiveeffectofgenisteininperipheralnerveinjury[J].TurkishNeurosurgery,2017,27(5):816-822.
[34]LIULixing,CHENWenfang,XIEJunxia,etal.NeuroprotectiveeffectsofgenisteinondopaminergicneuronsinthemicemodelofParkinsonsdisease[J].NeuroscienceResearch,2008,60(2):156-161.
[35]GAOQG,XIEJX,WONGMS,etal.IGF-ⅠreceptorsignalingpathwayisinvolvedintheneuroprotectiveeffectofgenisteinintheneuroblastomaSK-N-SHcells[J].EuropeanJournalofPharmacology,2012,677(1/3):39-46.
(本文編輯 馬偉平)

