早期婦科腫瘤術后患者IVF治療的臨床觀察分析
李穎,紀亞忠,石禮紅
(同濟大學附屬同濟醫院生殖醫學中心,上海 200065)
隨著細胞學篩查、婦科超聲、磁共振等診斷技術的進步以及人們保健意識的增強,早期婦科腫瘤患者的生存率逐漸提高,預后獲得了明顯改善。經積極治療后的早期宮頸癌(IA~IB1)患者5年無病生存率>85%[1-2],卵巢交界性腫瘤和生殖細胞腫瘤患者的5年無病生存率高達90%以上[3],整體存活率接近100%[4]。另一方面,婦科腫瘤的發病率逐年提高并呈年輕化趨勢,而隨著現代社會發展生育年齡卻不斷被推遲,越來越多的女性在確診腫瘤時尚未完成生育計劃。婦科腫瘤手術和放化療如同“雙刃劍”,在減滅腫瘤的同時,對女性的卵巢功能乃至生育能力產生顯著不良影響,患者接受治療后常合并不孕,因此,婦科惡性、交界性腫瘤年輕患者治療后的生育問題值得我們共同關注和重視。本文收集了2013年8月至2019年8月在本中心接受體外受精-胚胎移植(IVF-ET)助孕的早期婦科腫瘤保留生育功能術后患者5例,包括宮頸癌2例、卵巢交界性腫瘤、未成熟畸胎瘤及無性細胞瘤各1例,并根據年齡、體重指數(BMI)等在同時期個體匹配10例無手術史不孕癥患者作為對照組,比較兩組患者的基本資料、促排卵情況、胚胎培養結果及臨床結局。并將腫瘤術后組中成功分娩的4例患者分為宮頸癌術后和卵巢腫瘤術后兩個亞組,與對照組的母胎預后情況進行比較分析。
資料與方法
一、研究對象及分組
腫瘤術后組納入了2013年8月至2019年8月在本中心接受體外受精-胚胎移植(IVF-ET)助孕的早期婦科腫瘤術后合并不孕癥患者5例,包括宮頸癌3例、卵巢交界性腫瘤、未成熟畸胎瘤及無性細胞瘤各1例。5例患者均進行了保留生育功能的手術治療,其中2例宮頸癌IB1期患者行廣泛宮頸切除+盆腔淋巴結清掃術,病理均為鱗癌;1例交界性腫瘤患者行患側附件切除術,病理為交界性漿液性腫瘤,術后予以紫杉醇/卡鉑(TC)方案腹腔內化療1個療程;2例卵巢生殖細胞腫瘤患者均行雙側卵巢腫瘤切除術,術后病理分別為未成熟畸胎瘤和無性細胞瘤,后者術后予以博來霉素/依托泊苷/順鉑(BEP)方案化療3個療程。5例患者均無復發,其中4例患者成功分娩,按腫瘤類型分為宮頸癌術后和卵巢腫瘤術后兩個亞組,每組各2例患者。
對照組為與腫瘤術后組患者同時期、既往無手術史的IVF患者,按年齡、BMI等與腫瘤術后組中患者進行個體匹配,匹配比例為1∶2。
二、IVF促排卵方案
1.自然周期取卵:在月經周期的第9或第10天,陰道超聲監測卵泡自發生長情況,當卵泡直徑達到14 mm左右時,每日監測血LH、E2、P,卵泡直徑達到18 mm或LH峰出現時予人絨毛膜促性腺激素(HCG,珠海麗珠制藥)4 000~6 000 U扳機,34~36 h后行取卵術。
2.微刺激方案:月經周期第2~5天開始口服枸櫞酸氯米芬(CC,法地蘭,高特制藥,塞浦路斯)100 mg/d,第5天始加用促性腺激素(gonadotropins,Gn),Gn種類包括注射用尿促卵泡素(麗申寶,珠海麗珠制藥)和人絕經期促性腺激素(HMG,樂寶得,珠海麗珠制藥)兩種藥物,啟動劑量為75~150 U/d,CC和Gn均至扳機日停止,根據當日血清E2水平,注射HCG 4 000~8 000 U扳機,34~36 h后行取卵術。
3.拮抗劑方案:于月經周期第2~3天檢測女性基礎激素水平、陰道超聲監測竇卵泡數目,Gn啟動劑量為150~300 U,在Gn使用的第5~6天根據激素水平及卵泡生長情況,當最大卵泡平均直徑達到13~14 mm或者血清E2水平達到1 480 pmol/L添加拮抗劑注射用醋酸西曲瑞克(思則凱,百特,德國)0.25 mg/d,當有2個主導卵泡平均徑線達到18 mm或3個卵泡平均徑線達到17 mm以上時,根據當日血清E2水平,注射HCG 4 000~8 000 U扳機,34~36 h后行取卵術。
4.長方案:于促排前一周期的黃體中期,應用長效促性腺激素釋放激素激動劑(注射用醋酸亮丙瑞林,貝依,珠海麗珠制藥)1.25~3.75 mg,皮下注射。于降調第14天檢測女性激素水平及陰道超聲監測竇卵泡數目、大小和子宮內膜厚度以確定是否達到降調節標準,Gn啟動劑量為150~225 U,用藥的第4~6天及以后每天或隔天通過陰道超聲監測卵泡發育,同時檢測女性激素水平。依照卵泡發育速度和血清E2水平上升的情況來調整藥物劑量。當有2個優勢卵泡平均徑線達到18 mm或3個優勢卵泡平均徑線達到17 mm以上時,根據當天血清E2水平,注射HCG 4 000~8 000 U扳機,34~36 h后行取卵術。
三、FET內膜準備方式和黃體支持
FET的內膜準備方式按照本科室常規進行,主要為自然周期(natural cycle,NC)和激素替代周期(hormone replacement treatment,HRT)兩種方案;當陰道超聲提示子宮內膜厚度≥8 mm時轉化內膜準備移植,3 d后解凍分裂期胚胎,5 d后解凍囊胚。NC方案排卵后予以口服地屈孕酮(達芙通,雅培,美國),10 mg,3次/d;HRT周期為月經第3天起口服雌二醇地屈孕酮片紅片(芬嗎通,雅培,美國)2~3 mg,2次/d×14 d,檢測至內膜達標后進行內膜轉化,改黃片2~3 mg,2次/d,聯合黃體酮陰道緩釋凝膠(雪諾同,默克雪蘭諾,瑞士)90 mg,1次/d,均用至移植后14 d查血HCG,陽性者移植28 d行陰道超聲,見孕囊及原始心管搏動者為臨床妊娠,繼續黃體支持用藥至移植后72 d。
四、觀察及隨訪指標
觀察指標包括:用藥方案、Gn用量、獲卵數、有效胚胎數、臨床妊娠率、活產率。所有患者均電話、微信隨訪至2019年9月1日,并囑患者定期行盆腔B超和婦科檢查,婦科門診就診排除腫瘤復發。隨訪內容:產式、喂養方式、哺乳時間、轉經時間、新生兒體重、有無畸形。
五、統計學方法
結 果
一、基本資料比較
本研究共納入15例研究對象,腫瘤術后組5例,對照組10例。兩組患者間年齡、BMI、不孕年限和基礎性激素水平均無統計學差異(P>0.05),腫瘤術后患者竇卵泡數顯著少于對照組,差異有統計學意義(P<0.01)(表1)。
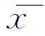
表1 腫瘤術后組與對照組基本資料比較(±s)
注:與對照組相比較,**P<0.01
二、促排情況比較
腫瘤術后組5例患者共行9個助孕周期(即取卵周期),對照組10例患者共行10個取卵周期,腫瘤術后組的促排卵方案主要采用自然周期(44.4%)和微刺激方案(33.3%),對照組主要采用長方案(80%);與對照組相比,腫瘤術后組的Gn天數和Gn總量均顯著減少,差異有統計學意義(P<0.01)(表2)。
三、獲卵及胚胎發育情況比較
與對照組相比,腫瘤術后組的獲卵數、可用胚胎數、優質胚胎數顯著減少,差異具有統計學意義(P<0.01);兩組的受精率、卵裂率、優胚率無統計學差異(P>0.05)(表3)。
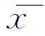
表2 腫瘤術后組與對照組促排情況比較[(±s),%]
注:與對照組相比較,**P<0.01
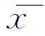
表3 腫瘤術后組與對照組獲卵及胚胎發育情況比較[(±s),%]
注:與對照組相比較,**P<0.01
四、臨床結局及母胎預后比較
腫瘤術后組共進行了6個移植周期,其中鮮胚移植周期占33.3%(2/6),凍胚移植周期占66.7%(4/6),每周期平均移植(1.83±0.41)枚胚胎,4個周期實現臨床妊娠:2例單胎、2例雙胎,均活產,無流產。對照組共進行了15個移植周期,其中鮮胚移植周期占26.7%(4/15),凍胚移植周期占73.3%(11/15),每周期平均移植(1.80±0.41)枚胚胎,11個周期實現臨床妊娠:1個周期流產、10個周期活產(7例單胎、3例雙胎)。兩組的移植方式、平均移植胚胎數、妊娠率、流產率、活產率均無統計學差異(P>0.05)(表4)。
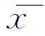
表4 腫瘤術后組與對照組移植及臨床結局比較[(±s),%]
兩組母胎預后分析顯示,與對照組相比較,腫瘤術后組的分娩孕周、單胎出生體重、雙胎出生體重顯著降低,差異有統計學意義(P<0.05);兩組的分娩方式、哺乳時間、產后轉經和隨訪時間的差異均無統計學意義(P>0.05)(表5)。
宮頸癌術后亞組、卵巢腫瘤術后亞組和對照組的母胎預后分析顯示,與對照組和卵巢腫瘤術后亞組相比,宮頸癌術后組的分娩孕周、哺乳時間和轉經時間顯著降低,早產率顯著升高,均有統計學差異(P<0.05)(表6)。
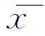
表5 腫瘤術后組與對照組母胎預后比較[(±s),%]
注:與對照組相比較,*P<0.05
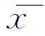
表6 宮頸癌術后與卵巢腫瘤術后亞組母胎預后比較[(±s),%]
注:與對照組相比較,*P<0.05;與卵巢癌術后亞組相比較,#P<0.05;a:其中1例宮頸癌術后患者因產后出血切除子宮,故無轉經
討 論
目前,婦科腫瘤發病率逐年上升并呈年輕化趨勢。在宮頸癌患者中,35歲以下的患者占2%[5],45歲以下的患者占38.5%[3];卵巢腫瘤患者中,35歲以下的患者占1.5%~17%[5],20~40歲的育齡期婦女在卵巢交界性腫瘤中約占50%[6],惡性生殖細胞腫瘤在卵巢惡性腫瘤中占3%~5%,好發于青少年女性(<20歲)[7]。另一方面,晚婚晚育的社會趨勢導致許多年輕女性在腫瘤治愈后仍未完成生育計劃,因此早期婦科惡性、交界性腫瘤年輕患者治療后的生育問題值得我們共同關注和重視。輔助生育技術能幫助接受了婦科腫瘤保留生育功能手術的不孕癥患者實現生育愿望。
婦科惡性、交界性腫瘤對女性生育力的影響包括腫瘤對卵巢功能的破壞以及手術過程、放化療對卵巢儲備功能、生殖器官解剖結構和性功能的影響[8]。惡性腫瘤可通過調節內分泌及代謝影響卵母細胞質量從而損害生育力;同時,腫瘤患者攜帶的特定的突變基因也可能導致卵巢低反應[9]。盆腔手術可直接損傷卵巢組織及其血供從而影響卵巢儲備功能。早期宮頸癌(IA2-IB1期)患者行廣泛宮頸切除術雖保留了生育功能,但仍造成子宮解剖結構異常,導致不孕、流產、胎膜早破和早產等不良結局[10-11]。化療藥物可通過直接作用和下丘腦-垂體軸損傷卵巢功能,例如博來霉素、依托泊苷或4個周期的紫杉醇化療均可造成患者中度風險不孕(永久閉經風險為40%~60%)[12]。本研究中早期婦科腫瘤術后組患者接受助孕治療時平均年齡僅29.6歲,平均竇卵泡數則為4.4個,卵巢儲備功能均較同齡女性明顯減退。2例宮頸癌患者為鱗癌IB1期,均接受開腹廣泛宮頸切除術治療,一位宮頸癌患者術后6年至我科助孕治療,發現宮頸管極短,宮頸口粘連,采取全麻下用Cook移植管金屬內芯擴宮頸口后再行胚胎移植;另一位宮頸癌患者手術時間為2015年,較前位患者晚5年,宮頸管保留有一定長度,移植順利,推測可能與手術技術進步有關;2例患者均提前分娩,可能與術后子宮解剖結構改變密切相關。2例卵巢腫瘤患者術后曾行化療,其中卵巢交界性腫瘤患者行TC方案(紫杉醇+卡鉑)腹腔化療1個療程,無性細胞瘤患者行BEP方案(博來霉素+依托泊苷+順鉑)化療3個療程,2例患者均于2008年接受手術和化療,確診年齡分別為22歲和17歲,開始助孕的年齡分別為27歲和28歲,竇卵泡數分別為5個和2個,與文獻報道的化療藥物損害卵巢儲備功能,且與劑量、類型、年齡相關性的觀點相符[13-14]。
婦科惡性腫瘤保留生育能力的治療方法主要有:保留生育功能的手術治療、術中或術后生育力保存技術、術后的生育指導和輔助妊娠。目前卵巢生育力保存的生殖內分泌技術主要包括促性腺激素類似物(gonadotropin-releasing hormone agonist,GnRH-a)療法抑制卵巢功能、胚胎冷凍、卵子冷凍、卵巢組織冷凍技術等[12,15]。胚胎冷凍技術目前已十分成熟,但因受到法律、宗教、倫理等多方面的限制,該技術目前只能應用于已婚患者,同時患者需在腫瘤治療前接受促排卵治療,因而可能延誤患者治療時機,而促排卵藥物是否會對患者原發病產生影響,目前尚未定論。卵子及卵巢組織凍存技術可用于未婚及無性生活患者,但因其需要行陰道超聲或手術治療,患者接受度較低,目前國內尚未廣泛開展。GnRH-a治療不需促排卵及配偶參與、不影響治療時機及方案、易于被患者接受,多項隨機試驗表明GnRH-a在化療期間應用有保護卵巢功能作用,但具體機制尚不清楚,持續時間和對妊娠結局的影響仍有爭議[16-17]。因此,婦科惡性、交界性腫瘤保留生育功能治療愈后患者,若有生育要求,應及時進行生育指導,若合并不孕應積極助孕治療。
腫瘤術后組共5例患者,其中4例進行了胚胎移植,共進行了6個周期,其中鮮胚移植周期占33.3%(2/6),凍胚移植周期占66.7%(4/6),4個周期實現臨床妊娠并活產,無流產,雙胎率50%,與對照組的活產率無顯著差異,所有新生兒均未發現畸形,所有產婦至最后隨訪時間均無腫瘤復發。本研究的初步結果顯示早期婦科腫瘤保留生育功能愈后患者IVF助孕有效且安全。2016年西班牙一項系統性回顧分析顯示:婦科腫瘤患者經保留生育力治療后,行IVF助孕能實現安全的妊娠[10];有文獻研究表明,不孕癥相關促排卵藥物應用不增加卵巢癌、交界性腫瘤、宮頸癌風險[18]。本研究中兩組患者的促排卵方案比較顯示,對婦科腫瘤愈后患者應采取個體化的促排卵方案,伴卵巢功能減退的患者,自然周期和微刺激方案更為合適,助孕效果好且促排藥物劑量較低,安全性更高。
國內外文獻綜述表明,宮頸根治術雖保留了生育功能,但可導致宮頸機能不全、晚期流產和早產的風險顯著增加,宮頸環扎能起到一定的預防作用[19-20]。本研究結果顯示宮頸癌術后亞組無論是與卵巢腫瘤亞組還是與對照組相比較,早產率高、分娩孕周較小、新生兒出生體重較低、哺乳和產后轉經時間較短,且有統計學差異。本研究中兩例宮頸癌愈后助孕患者均早產,其中單胎妊娠產婦產前多次陰道出血,單絨雙羊分娩產婦因胎盤植入產后大出血行子宮動脈栓塞+子宮切除治療,反思該產婦此次胎盤植入可能與之前9次流產史有關,本次為再婚,初婚時育有一女,現其所在家庭求子心切,本次分娩兩名女嬰,女方子宮切除后喪失生育功能,導致產后抑郁。遵照輔助生育技術中有利于患者、保護后代、倫理監督的原則,對此類情況特殊的高危患者應在充分評估患者的身心、家庭、孕期風險等全面情況的基礎上,對夫婦進行充分的知情同意后,在倫理委員會的監督下開始助孕治療,提倡單胚胎移植,注意與產科、胎兒醫學科的會診溝通,適時行宮頸環扎術,孕期和產后密切監護母胎情況,注重產婦心理疏導。
綜上所述,早期婦科腫瘤保留生育功能術后合并不孕癥患者行IVF助孕治療有效且安全。由于婦科惡性或交界性腫瘤手術和術后放化療可對女性患者的卵巢儲備功能造成嚴重影響,對年輕患者應注重生育力的保護,術后合并不孕癥患者應在充分全面評估和知情同意后采取積極助孕治療。宮頸癌術后患者孕期應警惕產前和產后出血,加強孕期監護,延長孕周,改善母胎預后。

