小鼠精原細胞分化的蛋白質組學研究
李堃 劉悅 黃鵬 楊智昉 胡茜 張穎 李志宏 呂葉輝 梁樂
(1. 上海健康醫學院基礎醫學院,上海 201318;2. 上海健康醫學院臨床醫學院,上海 201318;3. 上海交通大學醫學院,上海 200025)
隨著時代的進步,輔助生殖技術大大發展,而在此過程中精子的選擇尤為重要。精子在雄性動物遺傳信息傳遞過程中發揮著重要作用,其發生過程相對復雜。精子發生過程中,精原細胞作為精子發生的“種子”,起著十分重要的作用。根據分化的不同,精原細胞可以分為兩大類:未分化的精原細胞(Undifferentiated spermatogonia)和分化中的精原細胞(Differentiating spermatogonia)。未分化的精原細胞包括單一型和合胞體型的A型精原細胞(A single、A paired、A aligned)。A single可以通過有絲分裂形成新的A single細胞或者A paired和A aligned細胞,從而維持精原細胞的數量的穩定。在精原細胞自身增殖過程中,有部分細胞發生分化,分化過程中依次形成A1精原細胞、A2精原細胞、A3精原細胞、A4精原細胞、In精原細胞和B型精原細胞。B型精原細胞再次分裂后則形成初級精母細胞進行減數分裂。精原細胞的命運和調控精原細胞的增殖或者分化的機制均尚未明確。未分化精原細胞與分化中精原細胞蛋白質組有所不同。因此有效地將兩類精原細胞蛋白質組的表達差異進行探索,并且鑒定與精原細胞分化相關的蛋白質,對于精原細胞分化的研究具有重要的意義。
未分化的精原細胞和分化中的精原細胞在形態上很難區分,其主要依靠特異性標志物進行區分[1]。因此很難從形態學上對精原細胞的分化調控進行直觀分析。而未分化的精原細胞和分化中的精原細胞來自同一個體,其基因組相同,因此用基因組學的方法對精原細胞分化的調控的研究也受到局限。而因為分化狀態的不同,兩類精原細胞的基因表達調控水平(蛋白組)會發生顯著變化。因此,通過比較蛋白質組學研究能對精原細胞分化過程中蛋白質調控網絡有廣泛而完整的認知,找到精原細胞分化過程中的發生改變的重要蛋白。蛋白質組學方法通過高通量、大規模水平去研究細胞或機體內動態變化蛋白質的組成、翻譯后修飾及表達水平[2],可以反映細胞或者組織整體的蛋白質動態變化[3],因此利用蛋白組學的方法對兩類精原細胞的研究具有整體性。在蛋白質組學研究的諸多方法中,高效液相色譜串聯質譜方法(LC-MS/MS)具有高靈敏度檢測范圍、高通量和高質量的優勢[4],所以我們選擇LC-MS/MS的方法對兩類精原細胞進行研究。
通過蛋白質組學的方法將兩類精原細胞的蛋白質組鑒定出來后,我們將獲取到大量而復雜的蛋白質組數據。因此需通過肽段序列的注釋、數據庫的比對、GO功能分析以及KEGG通路分析等生物信息學[5]的方法將實驗結果中的有效信息篩選出來,進而對下一步實驗提供方向。本研究利用高效液相色譜串聯質譜方法(LC-MS/MS)方法結合生物信息學分析,從未分化和分化中兩類精原細胞的蛋白水平揭示調控精原細胞分化的差異蛋白,旨為兩類精原細胞的特性提供科學依據,為進一步研究精原細胞的分化的相關分子機制奠定了基礎。
1 材料與方法
1.1 材料
選擇生后7 d雄性C57BL/6小鼠,由中國科學院上海實驗動物中心提供。抗Thy1(CD90)磁珠抗體(貨號:130-049-101德國美天旎公司)、抗c-Kit(CD117)磁珠抗體(貨號:130-091-224 德國美天旎公司)、膠原酶I,DNase I,胰蛋白酶(美國羅氏公司)、Laminin包被培養皿(美國BD公司)、精原細胞培養液:α-MEM培養液中添加1%FBS、1×NEAA、1×N2-1、4 ng/mL GDNF、1 000 U/mL LIF( 美 國Gibico公司)。新鮮配制使用。DPBS,乙醚,BSA等一般化學試劑購自上海化學試劑有限公司。
1.2 方法
1.2.1 精原細胞的分離、純化
1.2.1.1 消化分離小鼠睪丸細胞
(1)每批8-10只出生7 d小鼠,取出雙側睪丸。體視鏡下(30×)去除白膜,收集生精小管,加入3-4mL D-PBS。
(2)反復吹打分散生精小管,吸除上層液體,再加入3 mL DPBS,重復洗2遍。
(3)吸除DPBS,加入3 mL膠原酶I 1 mg/mL,于37℃孵育10-15 min。每隔5 min小心吹打,直至無明顯組織團塊,自然沉降5 min。
(4)吸除膠原酶,DPBS洗2遍,去除DPBS。加入2 mL 0.25%和0.2 mL 10 mg/mL DNase I,37℃孵育2-5 min,充分吹打,顯微鏡下觀察,細胞基本分散,呈單細胞狀態。
(5)加入5 mL PBE液終止蛋白酶反應。將細胞懸液經細胞濾器過濾,收集濾過的細胞懸液,200×g離心2 min,收集細胞沉淀。
1.2.1.2 磁珠分選純化精原細胞
(1)200 μL PBE溶液重懸細胞,加入20 μL抗Thy1(CD90)或者抗c-Kit(CD117)磁珠抗體,吹打混勻,4℃孵育20 min。
(2)將磁珠分選柱置于磁力架上,加入4 mL PBE溶液洗滌柱子。然后將抗體標記的細胞懸液小心加在分選柱中心,待液體完全進入柱體后,加入6 mL PBE溶液洗滌細胞。
(3)用6 mL PBE溶液重復洗滌3次。
(4)將分選柱從磁力架上取下,置于15 mL離心管,向分選柱內加入3 mL PBE溶液,將液體快速推出分選柱,收集細胞懸液,即為分離純化的精原細胞。
1.2.2 蛋白質譜分析
1.2.2.1 蛋白質譜分析 以8-10只小鼠取到的細胞為一組。將磁珠分選純化分離的細胞以PBS(含蛋白酶抑制劑)洗滌3次,充分去除BSA。-80℃凍存。共收集到Thy1陽性細胞3組,c-kit陽性細胞4組,進行生物學重復實驗。將細胞沉淀交給中國科學院上海生化所蛋白質組分析中心進行蛋白質譜分析:蛋白酶解,并置于反相高效液相層析柱上洗脫蛋白,然后以LTQ-Orbitrap高效液相色譜組合式高分辨率質譜聯用系統進行蛋白質譜分析。每個樣品重復3次,以排除實驗誤差。
1.2.2.2 蛋白定量比較及生物信息學分析
(1)利用Maxquant軟件將肽段質譜原始數據在小鼠IPI數據庫中進行比對,匹配蛋白質。以非標記定量的方法對質譜結果中的蛋白進行定量,并比較兩組中含量差異的蛋白質(P<0.05且差異>1.5倍)。
(2)以層次聚類分析(Hierachical cluster analysis,HCA)方法進行聚類分析,確認實驗重復性。
(3)以互聯網的生物信息學軟件DAVID和KEGG數據庫對質譜結果進行分析,推測差異蛋白的生物學分類和功能分類。
1.2.3 細胞標志基因及篩選出通路中重要基因的表達分析 以Gfrα1、Plzf作為未分化精原細胞標志,以c-Kit、Sohlh2作為分化精原細胞標志,prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1和ctnna1作為篩選出通路的相關基因,磁珠分選的兩組精原細胞,抽提總RNA后,反轉錄成cDNA。按照Premix exTaq說明書,以表1所示引物在ABI7500熒光定量PCR儀上進行定量擴增。記錄CT值,用2-ΔΔCT法計算mRNA表達變化。
1.2.4 統計學處理 統計學分析應用SAS9.0統計軟件進行統計學分析。流式細胞儀和免疫熒光法檢測細胞純度實驗各組數據,均數±標準差(x-±s)表示,組間樣本數據比較采用t檢驗,Real-time PCR檢測標志基因表達的數據用均數±標準差(x-±s)表示,組間樣本數據比較采用t檢驗。
2 結果
2.1 兩類精原細胞的純度
經流式細胞分選,Thy1+細胞中抗Gfrα1染色陽性率為85.65%±8.35%,而c-Kit+細胞約5.03%±1.98%(P<0.01)。 在 c-Kit+細 胞 中, 未分化精原細胞的表面標志Gfrα1陽性的細胞約2.41%±0.93%,c-Kit+細胞達到約90.02%±2.77%(P<0.01)。以抗 Gfrα1抗體為一抗對 Thy1+細胞進行染色,細胞純度 86.83%±7.35%(P<0.01)。以抗c-Kit為一抗驗證c-Kit+分選細胞,細胞純度90.37%±3.74%(P<0.01)。

表1 Real-time PCR引物
2.2 兩類精原細胞蛋白質鑒定基本結果
檢測的7組樣品,在“1%FDR” 的過濾標準下,共有 112 584條肽段,112 584條特異肽段和3 228個蛋白得到鑒定。兩類精原細胞中含量差異的蛋白質(P<0.05且差異>1.5倍)共256個(表2)。分化中的精原細胞表達上調的蛋白質數量為193個,在分化中的精原細胞表達下調的蛋白質數量為63個。在3 228個蛋白質中,蛋白質長度主要集中在100-750個氨基酸(圖1-A),蛋白質的分子量大小主要集中在100-200 kD和10-60 kD(圖1-B)。

表2 兩類精原細胞蛋白質鑒定結果
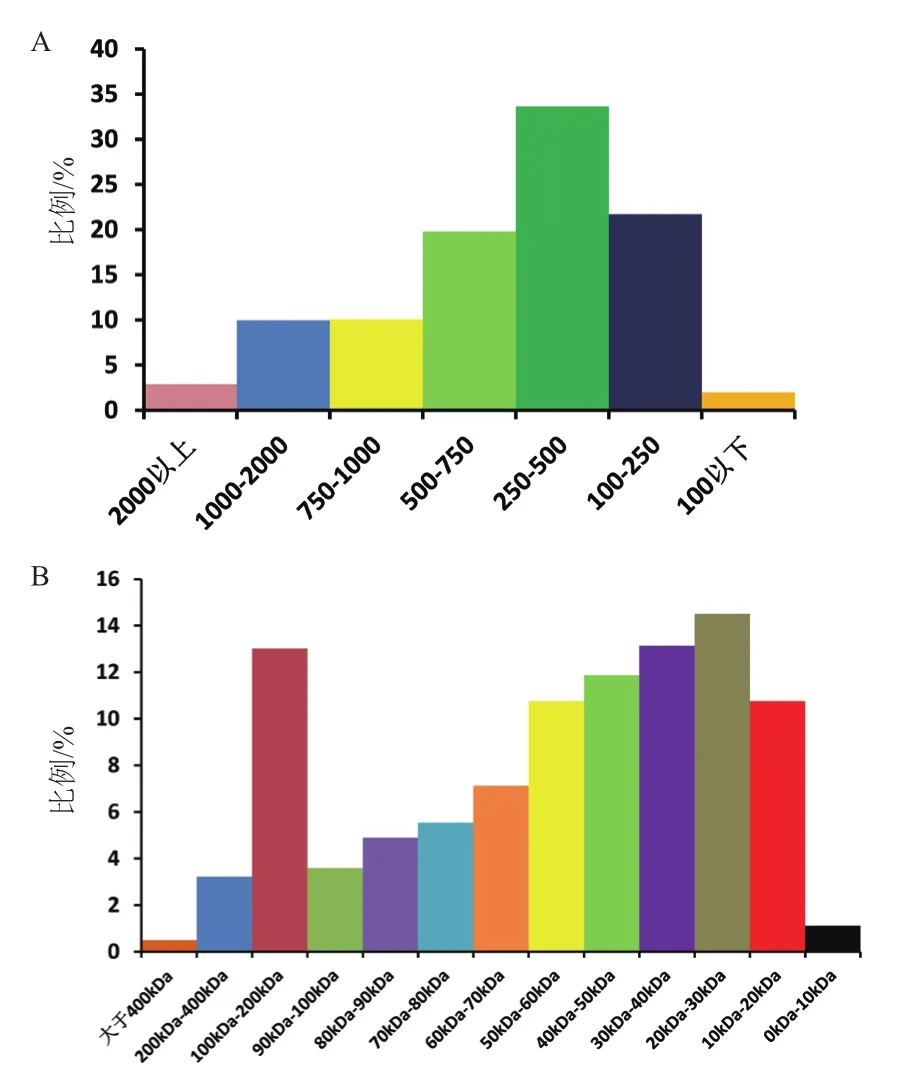
圖1 蛋白質的分子量大小及長度
2.3 兩類精原細胞差異表達蛋白質功能聚類
差異蛋白的富集分析發現,在生物過程方面,注釋結果顯示差異蛋白主要在代謝過程(Primary metabolic process),細胞代謝過程(Cellular metabolic process),分子代謝過程(Macromolecule metabolic process)和氮化合物代謝過程(Nitrogen compound metabolic process)中富集,他們占比分別17.94%,18.19%,15.06%和9.91%;在細胞組分方面,蛋白主要富集在細胞(Cell part)、細胞內組分(Intracellular part)和細胞器(Intracellular organelle)中;在分子功能方面,鑒定到的蛋白主要參與蛋白結合(Protein binding)、核苷結合(Nucleotide binding)、水解酶活性(Hydrolase activity)和核酸結合過程(Nucleic acid binding),它們占比分別達到39.13%、30.83%、21.74%和29.64%(圖2)。
2.4 兩類精原細胞差異表達蛋白質KEGG注釋

圖2 兩類精原細胞差異表達蛋白質GO分析
KEGG注釋結果顯示:c-Kit陽性的精原細胞中上調的蛋白質中有65個蛋白質在KEGG數據庫中有功能注釋,共參與了12條代謝通路。其中,最主要的代謝通路是剪接體(Spliceosome)和泛素介導的蛋白水解(Ubiquitin mediated proteolysis),分別有12(6.25%)和 10(5.21%)個蛋白參與。在Kit陽性的精原細胞中下調的蛋白質中有23個蛋白質在KEGG數據庫中有功能注釋,共參與了6條代謝通路。其中,最主要的代謝通路是緊密連接(Tight junction),有6個(9.83%)蛋白質參與。另外,在c-Kit陽性的精原細胞中下調的蛋白質中有3個蛋白質在黏著連接(Adherens junction)通路有功能注釋(圖 3)。
2.5 差異蛋白質層次聚類分析
將256個差異蛋白進行層次聚類分析。左側3列表示Thy1表達陽性的3組未分化的精原細胞,右側4列表示c-Kit表達陽性的4組分化中的精原細胞。圖中顏色表示表達量值,在分化中的精原細胞表達上調的蛋白質為綠色,表達下調的蛋白質為紅色。3組Thy1+的細胞中蛋白表達的趨勢基本一致,4組c-Kit+的細胞中蛋白的表達的趨勢基本一致。結果如圖(圖4),在c-Kit+的分化中的精原細胞中,約2/3的差異蛋白表達上升。細胞分化前后標志基因及篩選出通路中相關蛋白表達分析的結果以Real-time PCR進一步分析。
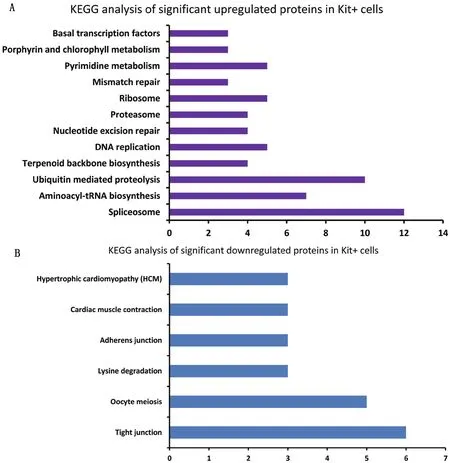
圖3 在分化中精原細胞中上調蛋白質和下調蛋白質的KEGG分析
2.6 細胞標志基因及篩選出通路中相關基因的表達分析
通過熒光定量實時定量PCR(Real-time PCR)方 法 分 別 對 Gfrα1、Plzf、c-Kit、Sohlh2、prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1和ctnna1基因在磁珠分選的兩組細胞的mRNA的表達差異。可見在Thy1+細胞中Gfrα1和Plzf兩個未分化精原細胞的標志基因的相對表達量分別可達到c-Kit+細胞的約9.47±1.29和4.40±0.59倍(P<0.01);緊密連接和黏著連接相關通路的tjp1和ctnna1基因的相對表達量分別可以達到c-Kit+細胞的3.04±0.22和2.33±0.15倍(P<0.01)。而在c-Kit+細胞中kit和sohlh2兩個分化中精原細胞的標志基因的相對表達量分別可達到Thy1+細胞的約7.38±1.07和 3.88±0.28倍(P<0.01);剪接體通路相關的prp4、prp8和p68基因的相對表達量分別可以達到Thy1+ 細胞的 3.15±0.52,2.32±0.44(P<0.05)和2.60±0.14倍(P<0.01);DNA/RNA/蛋白合成相關的ddx1、fkbp5和top2 基因的相對表達量可以達到Thy1+細胞的 2.29±0.19,2.96±0.29和 3.02±0.18倍(P<0.01);泛素介導的蛋白水解通路相關的uba1和ube2o基因的相對表達量可以達到Thy1+細胞的3.27±0.36 和 2.52±0.45 倍(P<0.01)(圖 5)。
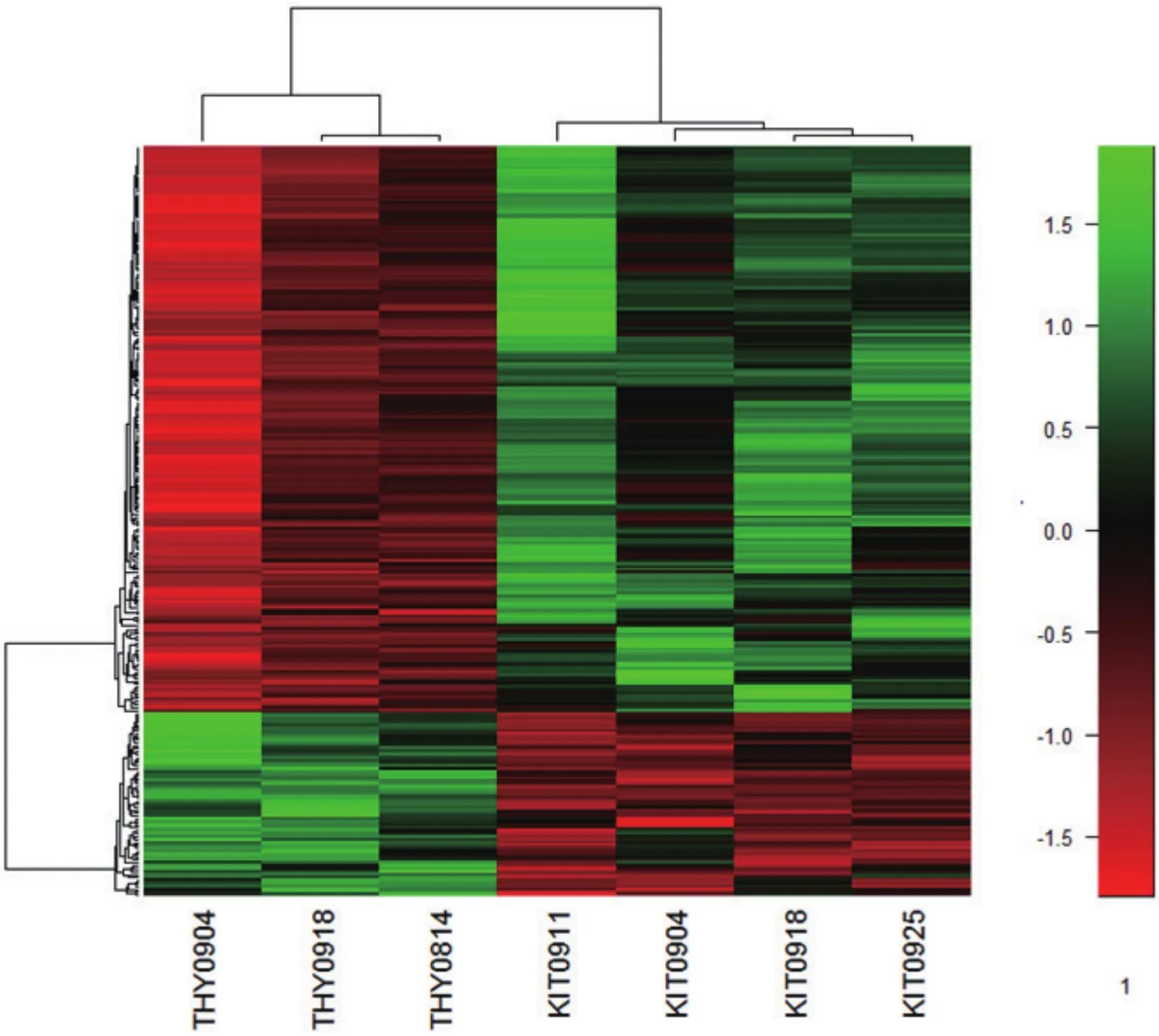
圖4 差異蛋白質層次聚類分析
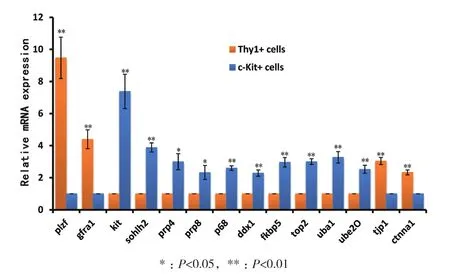
圖5 Real-time PCR檢測Thy1+細胞和c-Kit+細胞中的Gfrα1、Plzf、c-Kit、Sohlh2、prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1 和 ctnna1基因的mRNA表達水平的相對差異
3 討論
精子的產生依賴于一組精原細胞(Spermatogonia)的分化,它們是在嬰兒時期通過其前體細胞生殖母細胞(Gonocytes)分化而形成。在整個成年期,精原細胞將自我更新或分化,以維持干細胞儲備,同時為生精周期提供細胞。精原細胞進一步分化,以形成第一波生精波。精原細胞自我更新以維持干細胞的數量,以維持整個成年期的精子生成。人們較重視青春期后的精子形成,而生殖細胞發育的早期階段直到最近才引起人們的注意。蛋白質是生命的物質基礎,是有機大分子,是構成細胞的基本有機物,是生命活動的主要承擔者。機體所有重要的組成部分都需要有蛋白質的參與。精原細胞的分化有大量蛋白質參與其中,未分化的精原細胞和分化中的精原細胞中的蛋白質存在大量的差異蛋白質。此前的研究都著眼于特定或不同睪丸時期的蛋白組研究[6-10]、睪丸中已經分化的不同時期的生精細胞的蛋白組研究[11]。然而,目前對于未分化的精原細胞和分化中的精原細胞中的差異蛋白質并未有過多討論。本研究通過蛋白質組學結合生物信息學的方法,篩選出了未分化精原細胞和分化中的精原細胞的差異蛋白質并嘗試揭示調控精原細胞的自我更新和分化的基因和途徑。
本研究通過生物信息學數據庫分析,3 228個蛋白得到鑒定。兩類精原細胞中含量差異的蛋白質(P<0.05且差異>1.5倍)共256個。其中在分化中的精原細胞表達上調的蛋白質數量為193個,在分化中的精原細胞表達下調的蛋白質數量為63個。可見在精原細胞分化過程中,相對更多的蛋白質的表達上調。在3 228個蛋白質中,蛋白質長度主要集中在100-750個氨基酸的中等大小的蛋白質,蛋白質的分子量大小主要集中在100-200 kD和10-60 kD兩個區間中。通過差異蛋白的富集分析發現來推測,精原細胞分化過程中,主要是參與細胞分子代謝的蛋白質的表達發生了變化,說明分化中的精原細胞和未分化的精原細胞中的細胞代謝水平有明顯區別。并且通過分析細胞組分,主要是細胞內的細胞器的蛋白質表達水平出現明顯差異,說明精原細胞分化過程中細胞內的成分和細胞器的種類和數量都發生了明顯改變。從分子功能方面分析,鑒定到的差異蛋白主要參與蛋白結合、核苷結合、水解酶活性和核酸結合過程,說明精原細胞分化過程中細胞中的蛋白質相互作用,蛋白質與核酸的相互作用都比較旺盛,預示著分化中的精原細胞即將進入減數分裂,最終分化為成熟的精子。
KEGG注釋結果顯示:分化中的c-Kit陽性的精原細胞中上調的蛋白質中有65個蛋白質在KEGG數據庫中有功能注釋,共參與了12條代謝通路。其中,最主要的代謝通路是剪接體和泛素介導的蛋白水解,剪接體依靠RNA-RNA、RNA-蛋白質、蛋白質-蛋白質等三方面的相互作用。要涉及snRNA的堿基配對,相互識別等。它由多個核蛋白聚集而成,具有識別mRNA前體的5'剪接位點、3'剪接位點和分支點的功能[12]。這也與精原細胞分化過程中,精原細胞分化的眾多基因表達調控相吻合。泛素化在蛋白質的定位、代謝、功能、調節和降解中都起著十分重要的作用。同時,它也參與了細胞周期、增殖、凋亡、分化、轉移、基因表達、轉錄調節、信號傳遞、損傷修復、炎癥免疫等幾乎一切生命活動的調控。說明在精原細胞的分化過程中泛素化起著非常重要的作用[13]。
在分化中的c-Kit陽性的精原細胞中下調的蛋白質中有23個蛋白質在KEGG數據庫中有功能注釋,共參與了6條代謝通路。其中,最主要的代謝通路是緊密連接,并且有3個蛋白質在黏著連接有功能注釋。在精原細胞分化為精子的過程中,精原細胞從睪丸生精上皮中支持細胞(Sertoli cells)形成的基底小室向近腔小室遷移。在此過程中,血睪屏障需要在特定的時間節點開閉。血睪屏障是生精小管與毛細血管血液之間的一層屏障結構。包括間質的毛細血管內皮、基膜、結締組織、生精上皮基膜及支持細胞間的緊密連接[14-17]。血睪屏障的開閉取決于支持細胞間緊密連接的形成與否或緊密程度[18-19]。因此,分化中的精原細胞中表達下調的參與緊密連接的蛋白質可能與血睪屏障的調節有關系。
通過差異蛋白質層次聚類分析我們可以看到,3組Thy 1陽性細胞和4組c-Kit陽性細胞中表達的蛋白質圖譜基本具有一致性,因此可以確認本實驗的重復性。細胞分化前后標志基因及篩選出通路中相關基因的Real-time PCR表達分析的結果顯示,剪接體通路相關的prp4、prp8和p68基因,DNA/RNA/蛋白合成相關的ddx1、fkbp5和top2基因,泛素介導的蛋白水解通路相關的uba1和ube2o基因在c-Kit+細胞中表達升高。而緊密連接和黏著連接相關通路的tjp1和ctnna1基因的c-Kit+細胞中表達降低。這些結果都與KEGG注釋結果相互印證。
4 結論
本實驗基于未分化精原細胞和分化中精原細胞的蛋白質組進行了鑒定及差異分析。研究發現,兩類精原細胞中3 228個蛋白得到鑒定,其中含量明顯差異的蛋白質共256個。差異蛋白在生物過程方面主要在代謝過程,細胞代謝過程,分子代謝過程和氮化合物代謝過程中富集;在細胞組分方面,蛋白主要富集在細胞、細胞內組分和細胞器中;在分子功能方面,鑒定到的蛋白主要參與蛋白結合、核苷結合、水解酶活性和核酸結合過程。兩類精原細胞中差異蛋白質中共有88個蛋白參與了18條代謝通路。這些結果為闡明精原細胞分化的分子機制提供了新的策略與理論依據。

