磁性復(fù)合載體固定生姜蛋白酶的酶學(xué)性質(zhì)研究
羅璇,陳常緣,王秀原,杜婧加,劉婧雨,吳蒙
(武漢設(shè)計(jì)工程學(xué)院 食品與生物科技學(xué)院,武漢 430205)
酶作為一種高效、安全的生物催化劑,已被廣泛地運(yùn)用在食品原料開(kāi)發(fā)、品質(zhì)改良、工藝改造等領(lǐng)域[1]。其中蛋白酶是食品加工生產(chǎn)中應(yīng)用最廣泛的酶種之一,被廣泛用于奶制品、豆制品等食品的精細(xì)加工[2]。生姜蛋白酶作為新型的植物蛋白酶,不僅具有藥用保健價(jià)值,還可用作食品添加劑,其應(yīng)用前景廣泛。然而,在實(shí)際生產(chǎn)應(yīng)用中,游離的生姜蛋白酶穩(wěn)定性較差,易失活,但可通過(guò)對(duì)其進(jìn)行固定化,以顯著提高酶穩(wěn)定性[3]。
目前,國(guó)內(nèi)外對(duì)生姜蛋白酶的提取、純化及固定化已有了較多報(bào)道,但利用新型載體磁性復(fù)合物固定生姜蛋白酶及其酶學(xué)性質(zhì)的研究卻未見(jiàn)報(bào)道。
磁性Fe3O4納米粒子可以和各種天然生物大分子、合成高分子及無(wú)機(jī)物反應(yīng)生成磁性復(fù)合微球,并借助外部磁場(chǎng)將其應(yīng)用在流床式酶反應(yīng)器中,使其表面積增大,提高固定化酶的催化效率[4,5]。但由于載體會(huì)影響酶蛋白的活性,從而會(huì)限制酶的活性中心,因而酶學(xué)性質(zhì)將受到不同程度的影響[6]。
為了解決這一問(wèn)題,本文通過(guò)單因素實(shí)驗(yàn)法來(lái)確定固定化生姜蛋白酶的最佳條件,并對(duì)磁性凝膠微球固定生姜蛋白酶的酶學(xué)性質(zhì)進(jìn)行了研究;探討酶固定化的最適條件,以期在提高酶的催化效果的同時(shí)實(shí)現(xiàn)酶的重復(fù)使用,將酶的利用價(jià)值最大化。
1 材料與方法
1.1 材料與器材
鮮生姜:市售;磷酸氫二鈉、磷酸二氫鈉、檸檬酸鈉、氨水、海藻酸鈉、明膠、三氯化鐵、硫酸亞鐵、三氯乙酸、碳酸鈉、干酪素、50%戊二醛、氯化鈣:均為分析純;福林酚試劑:生物純。
TG16-WS離心機(jī) 長(zhǎng)沙湘智離心機(jī)儀器公司;FA2014B電子天平 上海越平科技儀器有限公司;UV2000紫外可見(jiàn)分光光度計(jì) 尤尼柯(上海)儀器有限公司;HH-S2電熱恒溫水浴鍋、SHZ-88恒溫振蕩器 金壇市醫(yī)療儀器廠。
1.2 方法
1.2.1 生姜蛋白酶液的制備
取外形完好、無(wú)腐爛和機(jī)械損傷的新鮮生姜50 g洗凈, 切成小塊后,加入2倍體積的磷酸氫二鈉-磷酸二氫鈉緩沖液(0.05 mol/L,pH 6)研磨30 min, 過(guò)濾, 將濾液收集至250 mL的三角瓶中,并置于4 ℃冰箱中,2 h后以4000 r/min離心10 min,取上清液,即得生姜蛋白酶液,測(cè)其初始酶活。
1.2.2 Fe3O4磁核的制備
將0.25 mol/L的硫酸亞鐵溶液100 mL、0.5 mol/L氯化鐵溶液200 mL以及0.1 mol/L檸檬酸鈉溶液40 mL混合,于75 ℃恒溫?cái)嚢?0 min,滴加10%氨水調(diào)節(jié)pH至10,并等待其繼續(xù)反應(yīng)40 min后,離心10 min,棄上清液,濾渣用蒸餾水重復(fù)洗滌至中性,放入80 ℃烘箱中干燥,保存?zhèn)溆谩?/p>
1.2.3 磁性微球的制備方法
將一定量的Fe3O4磁核、3.5%海藻酸鈉及3.0%明膠以一定體積比例混合,室溫下恒溫振蕩器混合均勻;用注射器吸取上述混合液,從一定高度滴入濃度為2%的CaCl2溶液中,以形成凝膠微球;更換CaCl2溶液,于4 ℃下靜置硬化2 h后,再濾出凝膠微球,用質(zhì)量分?jǐn)?shù)為0.9%的NaCl溶液洗滌,瀝干,于 50 ℃干燥。
1.2.4 固定化生姜蛋白酶
將磁性凝膠微球與戊二醛交聯(lián)2.5 h后,用蒸餾水洗滌,并于50 ℃干燥,以獲得磁性凝膠微球復(fù)合載體。將其與酶液混合,室溫下恒溫振蕩器混合均勻,用蒸餾水洗滌,獲得磁性復(fù)合載體固定化生姜蛋白酶,并測(cè)其酶活。
1.2.5 酪氨酸標(biāo)準(zhǔn)曲線的制作方法[7,8]
取上述溶液各1.00 mL,各加0.4 mol/L的碳酸鈉溶液5.0 mL, 福林試劑1.00 mL, 在40 ℃左右(±0.2 ℃)水浴中使其顯色20 min, 將分光光度計(jì)波長(zhǎng)設(shè)置為680 nm, 分別測(cè)定其吸光度, 并以O(shè)D值為縱坐標(biāo),酪氨酸標(biāo)準(zhǔn)溶液的濃度為橫坐標(biāo), 繪制標(biāo)準(zhǔn)曲線。
1.2.6 單因素實(shí)驗(yàn)

表2 單因素實(shí)驗(yàn)因素水平Table 2 Factors and levels of single factor experiment
由表2可知單因素實(shí)驗(yàn)條件,測(cè)定其對(duì)應(yīng)的酶活力,并換算成相對(duì)酶活力。
1.2.7 方差分析
基于上述單因素實(shí)驗(yàn)所測(cè)得的數(shù)據(jù),通過(guò)SPSS 18.0處理,確定影響固定化酶活力的各因素的大小關(guān)系并進(jìn)行方差分析。
1.2.8 酶學(xué)性質(zhì)的研究
1.2.8.1 酶的最適溫度及溫度穩(wěn)定性測(cè)定
檢測(cè)固定化生姜蛋白酶和游離生姜蛋白酶在不同溫度(20~80 ℃)下的酶活力,確定酶的最適溫度。然后將兩種酶分別在不同溫度下處理1 h,在最適溫度下檢測(cè)各自酶活力,并計(jì)算熱處理后的剩余酶活力(%),分析兩種酶的溫度穩(wěn)定性。
1.2.8.2 酶的最適pH及酸堿穩(wěn)定性測(cè)定[9]
測(cè)定固定化生姜蛋白酶和游離生姜蛋白酶在不同pH (3.0~8.0)下的酶活力,確定最適pH。再將兩種酶分別置于不同pH的0.1 mol/L 檸檬酸緩沖液中,4 ℃下處理2 h,在最適pH下檢測(cè)各自酶活力,計(jì)算酸堿處理后剩余的酶活力(%),分析兩種酶的酸堿穩(wěn)定性。
1.2.8.3 酶的動(dòng)力學(xué)參數(shù)測(cè)定
測(cè)定酶的米氏常數(shù)(Km):分別測(cè)定底物生姜蛋白濃度范圍在1.0~5.0 mg/mL時(shí),固定化酶和游離酶的酶活力,利用Lineweaver-Burk雙倒數(shù)作圖法作圖可得游離生姜蛋白酶的米氏常數(shù)和固定化生姜蛋白酶的表觀米氏常數(shù)。
1.2.8.4 固定化酶操作穩(wěn)定性的測(cè)定
測(cè)定上述制備的1 g固定化生姜蛋白酶的酶活力,固定化酶每使用一次,用蒸餾水清洗3次,再次進(jìn)行測(cè)定,并計(jì)算出相對(duì)酶活力(%);連續(xù)測(cè)定6次,根據(jù)測(cè)定的酶活力分析固定化酶的操作穩(wěn)定性。
1.2.8.5 固定化酶儲(chǔ)存穩(wěn)定性的測(cè)定
固定化酶在25 ℃下每隔2 d測(cè)其剩余酶活力(%),共測(cè)定5次。
1.2.8.6 酶活力和相對(duì)酶活力的測(cè)定[10]
酶活力測(cè)定方法:分別取酶液和酪蛋白底物1 mL于水浴預(yù)熱 2 min,混合均勻后繼續(xù)恒溫反應(yīng)10 min,加入 0.4 mol/L 三氯乙酸 2 mL,沉淀殘余蛋白。離心,取 1 mL 上清液,加入 0.4 mol/L 碳酸鈉溶液和1 mL稀釋后的福林酚試劑,混合均勻,在 40 ℃水浴顯色 10 min,用紫外可見(jiàn)分光光度計(jì)測(cè)試其在 680 nm 下的吸光度。
生姜蛋白酶活力(U)=A×K×N×4/10。
式中:A為樣品的平均吸光度值;K為100除以酪氨酸標(biāo)準(zhǔn)曲線上100 μg/mL對(duì)應(yīng)680 nm處的吸光度值;N為酶液稀釋倍數(shù);4為反應(yīng)液總體積;10為10 min,酶液分解酪蛋白反應(yīng)時(shí)間。
固定化酶相對(duì)酶活力(%)=每次使用后固定化酶活力/最高固定化酶活力×100。
2 結(jié)果與分析
2.1 酪氨酸標(biāo)準(zhǔn)曲線
由圖1可知,酪氨酸標(biāo)準(zhǔn)曲線的R2=0.9983,說(shuō)明線性關(guān)系良好。

圖1 酪氨酸標(biāo)準(zhǔn)曲線Fig.1 Standard curve of tyrosine
2.2 單因素實(shí)驗(yàn)結(jié)果與方差分析
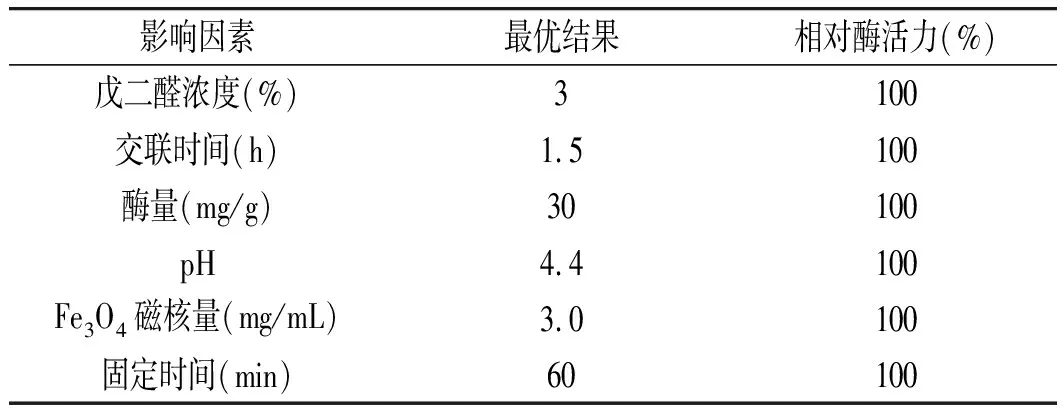
表3 單因素實(shí)驗(yàn)結(jié)果Table 3 Results of single factor experiments
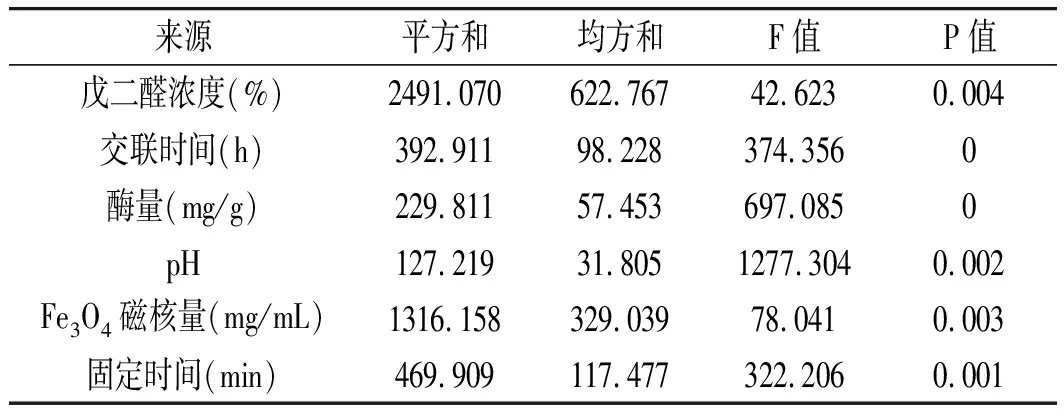
表4 單因素實(shí)驗(yàn)方差分析Table 4 Analysis of variance of single factor experiments
單因素的實(shí)驗(yàn)數(shù)據(jù)借助SPSS 18.0來(lái)處理,通過(guò)F檢驗(yàn),查表可知當(dāng)F≥F表時(shí)表明兩組數(shù)據(jù)存在顯著差異;P值即概率,反映某一事件發(fā)生的可能性大小,P<0.001為有極其顯著的統(tǒng)計(jì)學(xué)差異。所以,確定影響固定化生姜蛋白酶酶活力各因素的大小關(guān)系為:交聯(lián)時(shí)間>酶量>固定時(shí)間>pH>Fe3O4磁核量>戊二醛濃度。其中交聯(lián)時(shí)間、酶量、固定時(shí)間3個(gè)因素的P值分別為0,0,0.001,是影響固定化生姜蛋白酶的主要因素,戊二醛的濃度、Fe3O4磁核量、pH影響的顯著性相對(duì)較弱。
2.3 酶學(xué)性質(zhì)的研究
2.3.1 酶的最適溫度測(cè)定
溫度升高會(huì)使維持酶蛋白空間構(gòu)象的次級(jí)鍵發(fā)生斷裂從而導(dǎo)致酶變性失活,而固定化的酶由于酶分子與載體間多處連接可防止由于溫度過(guò)高引起的酶分子伸展變形作用。由圖2可知,固定化生姜蛋白酶的最適溫度(60 ℃)大于游離酶的最適溫度(50 ℃),說(shuō)明固定化酶的溫度穩(wěn)定性有一定程度的提高。
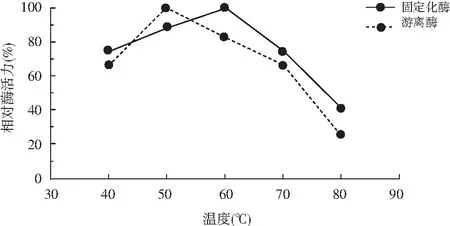
圖2 酶的最適溫度測(cè)定Fig.2 Determination of optimum temperature of enzymes
2.3.2 酶的最適pH測(cè)定

圖3 酶的最適pH測(cè)定Fig.3 Determination of optimum pH value of enzymes
由圖3可知,固定化生姜蛋白酶最適pH均為5.0,固定化生姜蛋白酶在pH 3.0~6.0范圍內(nèi)相對(duì)穩(wěn)定,而游離酶的最適pH為6.0,最適范圍在pH 5.0~7.0;說(shuō)明固定化酶比游離酶更能在酸性條件下保持活性。
2.3.3 酶的動(dòng)力學(xué)參數(shù)測(cè)定
在不同的生姜蛋白底物濃度下分別測(cè)定固定化生姜蛋白酶和游離酶的酶活力,采用Lineweaver-Burk雙倒數(shù)作圖法[11],以滴定度(及消耗的NaOH 體積)對(duì)時(shí)間作圖,得一直線,其斜率即為初速度V1.0(相當(dāng)于1.0 mg/mL的蛋白酶濃度),然后分別取2.0,3.0,4.0,5.0 mg/mL的底物重復(fù)上述操作,分別測(cè)出V2.0、V3.0、V4.0、V5.0,以反應(yīng)速度倒數(shù)為x,底物濃度為y作圖,得固定化生姜蛋白酶的線性方程為:y=0.6897x+0.1004,可得固定化酶表觀米氏常數(shù)Km=6.869 mg/mL;游離酶的線性方程為y=0.3805x+0.2743,求得游離酶的米氏常數(shù)Km=1.387 mg/mL。說(shuō)明經(jīng)磁性復(fù)合載體固定的生姜蛋白酶對(duì)底物的親和力有所下降,但并不顯著。酶與底物的親和力有下降得是正常現(xiàn)象,但下降得太多會(huì)影響到達(dá)最大反應(yīng)速率的時(shí)間。
2.3.4 固定化生姜蛋白酶操作穩(wěn)定性的測(cè)定
對(duì)固定化酶進(jìn)行重復(fù)使用,重復(fù)使用4次,相對(duì)酶活力為56.71%;重復(fù)使用5次,酶活力還剩余44.83%,而且磁性球形載體還保持較好彈性,破碎現(xiàn)象少;游離酶在重復(fù)使用3次后,酶活力只剩下了50.24%;重復(fù)使用5次后只剩下20.18%,相對(duì)酶活力極低。

圖4 酶的動(dòng)力學(xué)參數(shù)的測(cè)定Fig.4 Determination of kinetic parameters of enzymes

圖5 生姜蛋白酶操作穩(wěn)定性的測(cè)定Fig.5 Determination of operational stability of ginger protease
由圖5可知,以海藻酸鈉-明膠協(xié)同的磁性復(fù)合載體固定化的生姜蛋白酶不僅酶活力回收率高,且操作穩(wěn)定性更優(yōu)于游離酶。
2.3.5 固定化生姜蛋白酶儲(chǔ)存穩(wěn)定性的測(cè)定
固定化酶在25 ℃條件下每隔2 d測(cè)其相對(duì)酶活力(%),共測(cè)5次。固定化酶在25 ℃條件下儲(chǔ)存2 d,相對(duì)酶活力可達(dá)88.47%;但25 ℃下儲(chǔ)存10 d后,固定化酶活力只剩50.66%,而游離酶在25 ℃條件下儲(chǔ)存2 d,相對(duì)酶活力可達(dá)86.34%,但25 ℃下儲(chǔ)存10 d后,游離酶活力只剩33.57%。
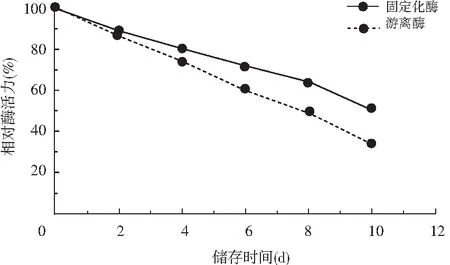
圖6 固定化生姜蛋白酶儲(chǔ)存穩(wěn)定性的測(cè)定Fig.6 Determination of storage stability of immobilized ginger protease
由圖6可知,固定化酶及游離酶的活力隨著儲(chǔ)存時(shí)間的延長(zhǎng)會(huì)逐漸降低,但磁性復(fù)合載體固定化的生姜蛋白酶儲(chǔ)存穩(wěn)定性相比于游離酶的儲(chǔ)存穩(wěn)定性較高。
3 結(jié)論
實(shí)驗(yàn)采用海藻酸鈉與明膠為載體,對(duì)磁性Fe3O4進(jìn)行包埋,形成了磁性復(fù)合載體凝膠微球。當(dāng)濃度為3.0%,戊二醛中交聯(lián)1.5 h,1 g磁球載體中加入30 mg/g酶量時(shí)可制得彈性好且不易碎的磁性微球載體;磁性海藻酸鈉-明膠協(xié)同固定化生姜蛋白酶的最適pH為5.0,最適溫度為60 ℃,在pH 3.0~6.0、40~70 ℃溫度范圍內(nèi)固定化酶相對(duì)穩(wěn)定,表觀米氏常數(shù)Km=6.869 mg/mL,重復(fù)使用4次后,相對(duì)酶活力為56.71%,重復(fù)使用5次后,酶活力還剩余44.83%,此時(shí)磁性球形載體還保持較好彈性;經(jīng)磁性固定化后的酶在25 ℃條件下儲(chǔ)存2 d,相對(duì)酶活力為88.47%;儲(chǔ)存10 d后,酶活力仍達(dá)50.66%。
而游離酶的最適pH為6.0,最適溫度為50 ℃,在pH 5.0~7.0、50~60 ℃溫度范圍內(nèi)酶相對(duì)穩(wěn)定;表觀米氏常數(shù)Km=1.387 mg/mL;游離酶在重復(fù)使用3次后,酶活力只剩下了50.24%,重復(fù)使用5次后只剩下20.18%;在25 ℃條件下儲(chǔ)存2 d,相對(duì)酶活力為86.34%,但在25 ℃下儲(chǔ)存10 d后,游離酶活力只剩33.57%。由此可知,在同等條件下,磁性復(fù)合載體固定生姜蛋白酶所表現(xiàn)出來(lái)的酶學(xué)性質(zhì)要遠(yuǎn)遠(yuǎn)優(yōu)于游離酶。

