紅曲發酵藜麥基質適生性研究
賀圣凌,林雨蝶 ,鄧茹月,熊江 ,周鑼娜 ,羅林麗,周玉鋒*
(1.貴州省農業科學院生物技術研究所,貴陽 550006;2.大連海洋大學 食品科學與工程學院,遼寧 大連 116023;3.貴州省農業科學院水稻研究所,貴陽 550006)
藜谷、南美藜、昆諾阿藜等都是藜麥(ChenopodiumquinoaWilld.)的別稱,作為莧科藜屬的一年生雙子葉植物,在安第斯山地區的種植歷史已有7000多年,為古印加民族的主要糧食作物之一[1]。藜麥是一種具有較高營養價值的雜糧。聯合國糧農組織(FAO)認證藜麥是一種單體植物即可滿足人體基本營養需求的食物,正式推薦藜麥為最適宜人類的全營養食品[2]。而對于藜麥的研究現狀而言,國外研究遠早于國內,李娜娜等[3]對藜麥的研究現狀與發展前景進行了相對仔細的分析,結果表明我國對藜麥的研究開始得較晚,且缺乏自主知識產權的品種,藜麥作為全營養雜糧的價值已被廣泛認可,雖對其進行了初步的研究,卻不夠深入,其藥用保健功能有待進一步研究。紅曲菌能產生洛伐他汀類物質、紅曲色素、γ-氨基丁酸、麥角甾醇、桔霉素以及多種酶類等次級代謝產物,這些代謝產物大多數具有生理活性[4],經眾多研究表明紅曲在其色素和功能性方面都有著很好的應用前景,2018年,張婷婷等[5]探究了紅曲紅作為肉脯中亞硝酸鹽發色作用替代品的可行性。2018年,胡楊等[6]采用全液態發酵生產紅曲米醋,開發了全液態發酵紅曲米醋的生產工藝。2018年,張江寧等[7]研究了不同發酵基質對紅曲產洛伐他汀、桔青霉素含量的影響,進一步說明不同發酵基質對紅曲發酵代謝產物的影響尤為顯著。2019年,張江寧等[8]研究了紅曲菌發酵制備紅曲米過程中的關鍵控制點,為紅曲米制備提供了高效且安全的發酵工藝條件。從近年來國內相關紅曲類食品發明專利申請的情況來看[9],目前紅曲的應用除了發酵大米方面,在著色劑、釀酒、飲料、調味品及保健品方面也得到廣泛應用。為提高藜麥的食用價值,為藜麥微生物固態發酵提供基礎,本研究將紅曲菌與藜麥結合,分析基質適生性尤為重要。
1 材料與方法
1.1 材料
原料:紅藜麥,產自山西忻州,由繁峙縣玥晨貿易有限公司提供。
菌種:紫紅曲霉3.4629(Monascuspurpureus),購自中國普通微生物菌種保藏管理中心。
試劑:蛋白胨、蔗糖、硫酸鎂、馬鈴薯葡糖、PDA培養基、營養瓊脂。
1.2 儀器設備
LDZX-50KBS型立式壓力蒸汽滅菌鍋;PYX-DHS隔水式電熱恒溫培養箱;JM2003型電子天平;LDP-750A型高速多功能搖擺粉碎機;KDN-04CHP6890/5975C型氣相色譜-質譜聯用儀 美國安捷倫公司;手動固相微萃取裝置 美國Supelco公司;CS21FS1型光學顯微鏡 日本Olympus公司。
1.3 試驗方法
1.3.1 紅曲發酵藜麥基質單因素試驗
藜麥添加量對紅曲菌的擴大培養:以藜麥添加量為0的種子培養基為基礎,分別按60,80,100 g/L的添加量添加藜麥,接種量為10%,培養溫度為30 ℃,搖瓶轉速為180 r/min,培養5 d。測定種子液的菌體量,考察藜麥添加量對紅曲菌擴大培養的影響。
不同碳源對紅曲菌的擴大培養:以無碳源的種子液培養基為基礎,按30 g/L的添加量分別添加蔗糖、葡萄糖、麥芽糖為碳源,藜麥添加量為60 g/L,接種量為10%,培養溫度為30 ℃,搖瓶轉速為180 r/min,培養5 d。測定種子液的菌體量,考察不同碳源對紅曲菌擴大培養的影響。
不同氮源對紅曲菌的擴大培養:以無氮源的種子液培養基為基礎,按20 g/L的添加量分別添加蛋白胨、牛肉膏、酵母膏為附加氮源,藜麥添加量為60 g/L,葡萄糖添加量為30 g/L,接種量為10%,培養溫度為30 ℃,搖瓶轉速為180 r/min,培養5 d。測定種子液的菌體量,考察不同氮源對紅曲菌擴大培養的影響。
不同無機鹽對紅曲菌的擴大培養:以無機鹽的種子培養基為基礎,分別添加硫酸鎂、磷酸二氫鉀、硫酸亞鐵為無機鹽,添加量為1 g/L,接種量為10%,培養溫度為30 ℃,搖瓶轉速為180 r/min,培養5 d。測定種子液的菌體量,考察不同無機鹽對紅曲菌擴大培養的影響。
1.3.2 正交試驗設計
設計以藜麥添加量、碳源添加量、氮源添加量及無機鹽添加量為因素的正交試驗,該試驗以菌體干重為評分指標。綜合分析單因素試驗結果,由于不同濃度的硫酸鎂在整個試驗驗中所顯示出來的差異性不明顯,因此,試驗選擇藜麥添加量、碳源(蔗糖)添加量、氮源(蛋白胨)添加量為因素設計三因素三水平正交試驗,見表1。

表1 正交試驗因素水平表Table 1 The table of factors and levels of orthogonal experiment g/L
1.3.3 感官評定
利用種子液進行固態發酵,其發酵工藝為:將紫紅曲霉活化后制成濃度為1×106CFU/mL的孢子懸浮液,備用;將藜麥蒸料滅菌(121 ℃,15 min),待其冷卻后按10%的接種量接入孢子懸浮液進行搖床培養(30 ℃,180 r/min);利用正交試驗所得的最優培養基組合的種子液對藜麥進行固態發酵發酵培養(30 ℃,8 d)。
參考GB/T 15682-2008《糧油檢驗 稻谷、大米蒸煮食用品質感官評價方法》對樣品進行感官評定[10],擬定的紅曲發酵后的藜麥參考評定表見表2。

表2 感官評分參考表Table 2 Reference table of sensory scoring
1.3.4 風味物質的測定
分別取混勻未發酵樣品2 g和發酵樣品2 g,置于10 mL固相微萃取儀采樣瓶中,插入裝有2 cm-50/30 μm DVB/CAR/PDMS Stable Flex纖維頭的手動進樣器,在60 ℃的平板加熱條件下頂空萃取50 min后,移出萃取頭并立即插入氣相色譜儀進樣口(溫度250 ℃)中,熱解吸5 min進樣。
色譜柱為HP-5MS (60 m×0.25 mm×0.25 μm)彈性石英毛細管柱,柱溫40 ℃(保留2 min),以3.5 ℃/min升溫至208 ℃,再以10 ℃/min升溫至228 ℃,運行時間52 min;汽化室溫度250 ℃;載氣為高純He(99.999%);柱前壓6.89 psi,載氣流量1.0 mL/min;不分流進樣;溶劑延遲時間3 min。
離子源為EI源;離子源溫度230 ℃;四極桿溫度150 ℃;電子能量70 eV;發射電流34.6 μA;倍增器電壓1658 V;接口溫度280 ℃;質量范圍29~500 amu。
對總離子流圖中的各峰經質譜計算機數據系統檢索及核對Nist 14和Wiley 275標準質譜圖,確定了X種揮發性化學成分,用峰面積歸一化法測定各化學成分的相對質量分數。
2 結果與分析
2.1 單因素試驗結果分析

圖1 藜麥添加量對紅曲菌培養的影響Fig.1 Effect of quinoa additive amount on Monascus culture

圖2 不同碳源對紅曲菌擴大培養的影響Fig.2 Effect of different carbon sources on expanding culture of Monascus
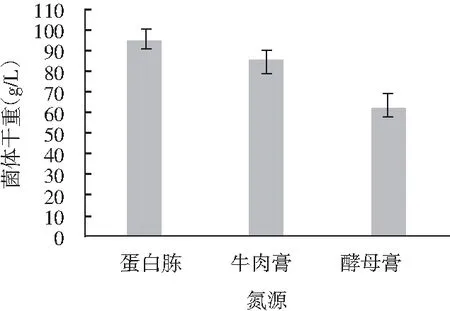
圖3 不同氮源對紅曲菌擴大培養的影響Fig.3 Effect of different nitrogen sources on expanding culture of Monascus

圖4 不同無機鹽對紅曲菌擴大培養的影響Fig.4 Effect of different inorganic salts on expanding culture of Monascus
由圖1可知,菌體干重隨著藜麥添加量的增加而有所增加,當添加量為30 g/L時,菌體干重為59.49 g/L,當藜麥添加量為50 g/L時,菌體干重達78.75 g/L,表明藜麥添加量是影響紅曲發酵藜麥的重要因素。由圖2可知,當碳源添加量都為30 g/L時,添加蔗糖作為附加碳源對紅曲菌擴培的促進作用較其他兩種碳源更大,此時菌體干重達78.68 g/L,因此,選擇蔗糖作為種子培養基的較適合碳源。由圖3可知,當附加氮源添加量都為20 g/L時,添加不同氮源對紅曲擴培影響顯著,其中添加蛋白胨對紅曲菌的擴培效果更好,因此,選擇蛋白胨作為培養基的最適氮源。由圖4可知,同濃度無機鹽作用下,硫酸鎂作用最為顯著,菌體干重高達77 g/L,因此,選擇硫酸鎂作為培養基的最適無機鹽,但因硫酸鎂濃度水平影響極不顯著,故不再分析其濃度水平。
2.2 正交試驗結果分析
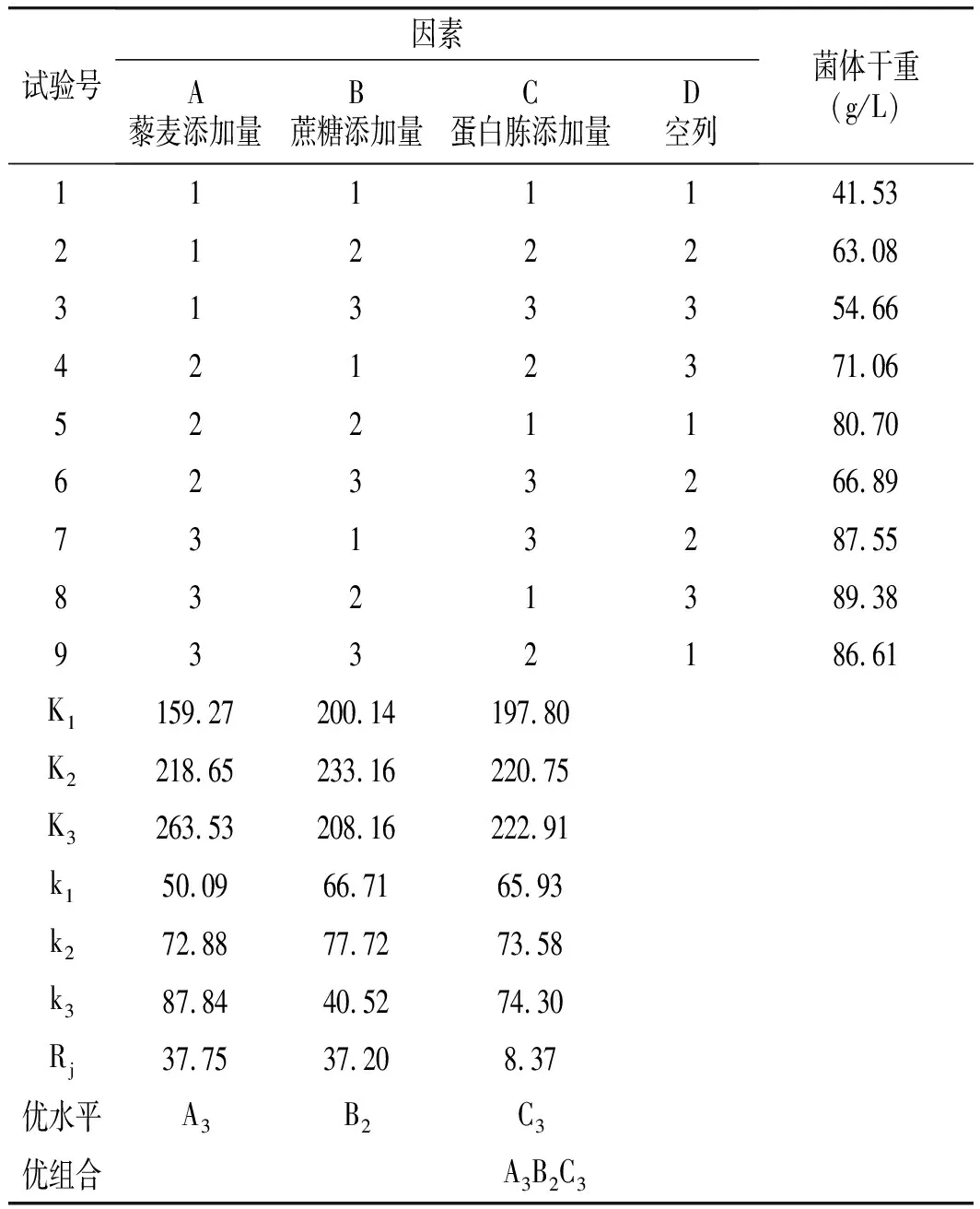
表3 正交試驗結果分析Table 3 Orthogonal test results and analysis
由表3極差分析可知,3個因素對菌體干重的影響大小排序為:A>B>C,即3個因素主次關系為藜麥添加量>蔗糖添加量>蛋白胨添加量,且最終可以得出最佳種子培養基組合為A3B2C3,即最優組合為:藜麥添加量100 g/L,蔗糖添加量30 g/L,蛋白胨添加量30 g/L時,最優組合得到菌體干重為91.24 g/L。
由表4中F檢驗表方差分析可知,藜麥添加量對紅曲培養影響極顯著(P<0.01),而蔗糖添加量和蛋白胨添加量的影響不顯著(P>0.05)。且3個因素影響程度的大小排序為:A>B>C,即3個因素的主次關系為藜麥添加量>蔗糖添加量>蛋白胨添加量,與表3中極差分析得到的結果一致。

表4 培養基正交試驗結果方差分析表Table 4 Anova of orthogonal test results of culture medium
注:R2=0.994(RAdj2=0.975)。
2.3 感官評定結果分析
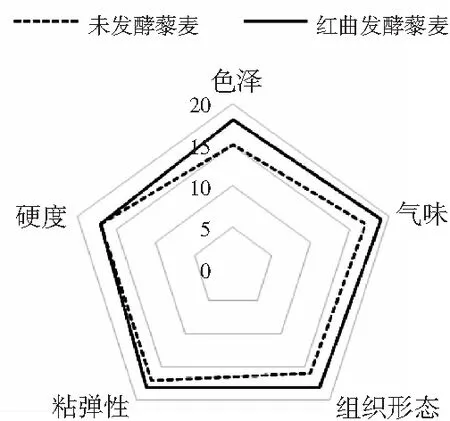
圖5 感官分析雷達圖Fig.5 Sensory analysis radar map
由圖5可知,未發酵藜麥的感官綜合評分為82分,紅曲發酵藜麥的最終感官評分為90分,結果表明僅從感官方面,紅曲發酵藜麥已經比未發酵的藜麥更加良好,尤其在色澤、氣味和組織形態方面差距最為明顯。
2.4 風味物質測定結果分析

圖6 未發酵藜麥風味物質離子流圖Fig.6 Ion flow diagram of flavor substances of unfermented quinoa
圖7 紅曲發酵藜麥風味物質離子流圖Fig.7 Ion flow diagram of flavor substances of quinoa by Monascus fermentation
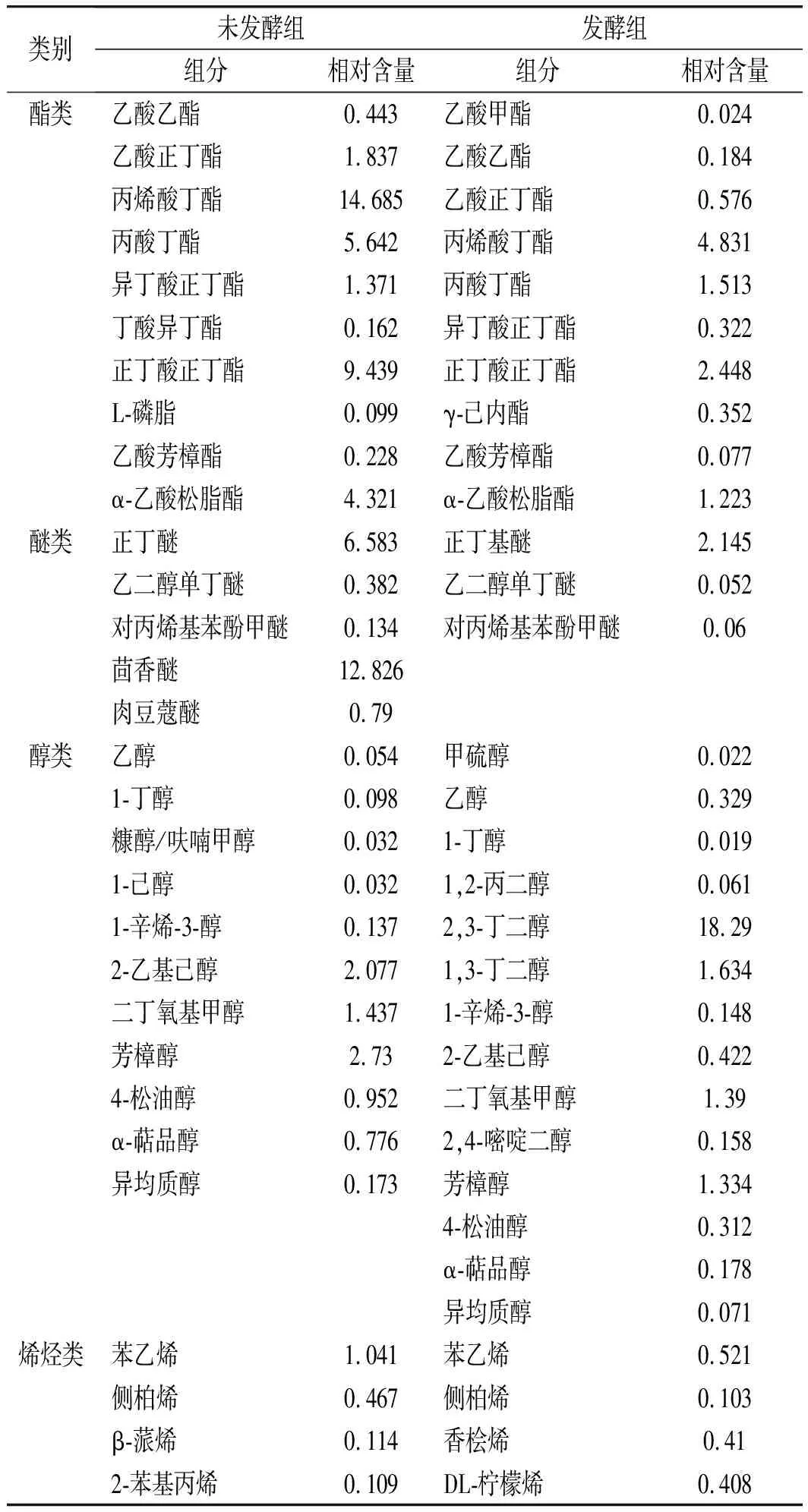
表5 風味物質含量對比表Table 5 Comparison table of flavor substances content

續 表
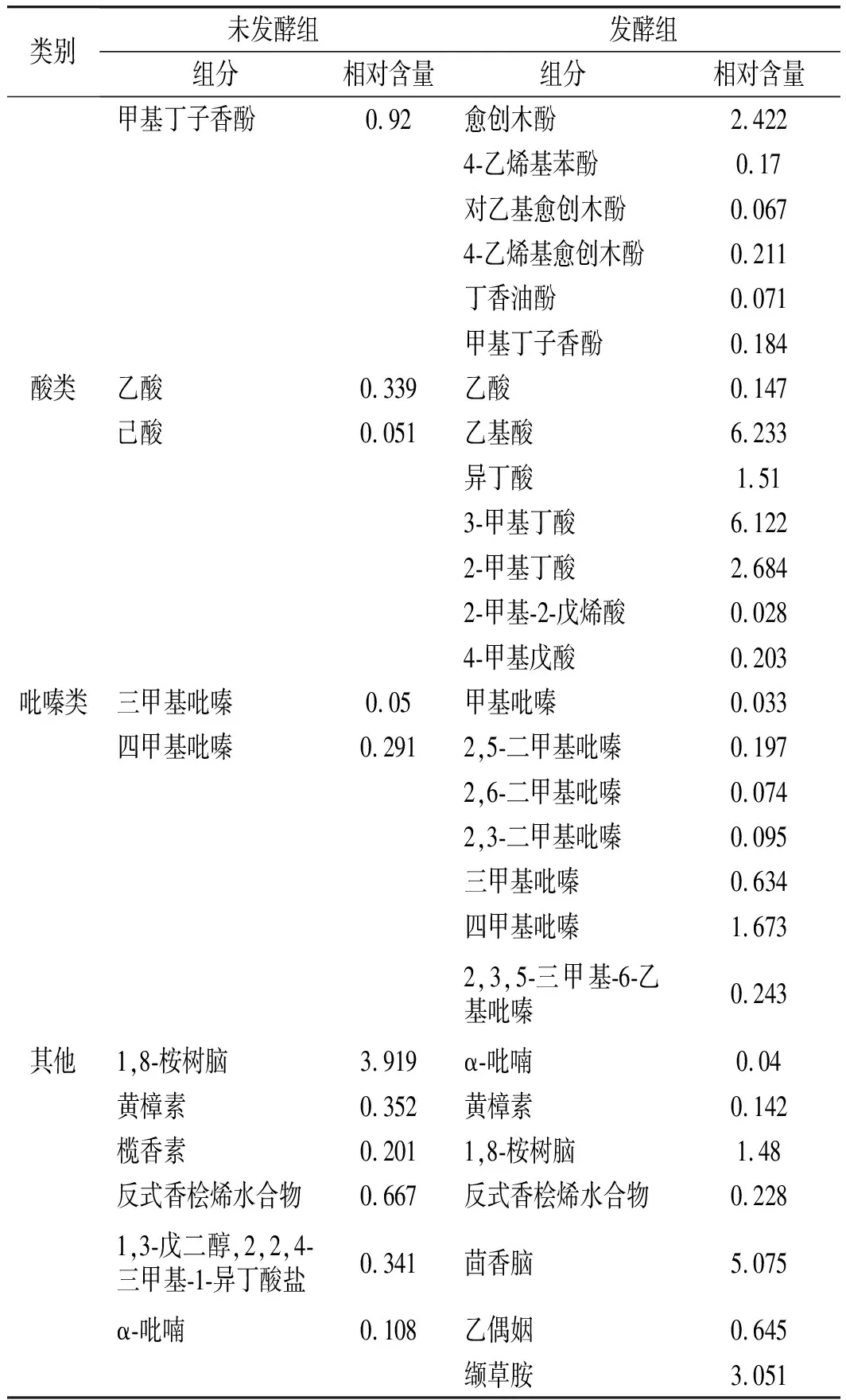
續 表
由圖6、圖7和表5可知,在風味物質總數上,發酵組中共有88種化合物,未發酵組只有85種化合物,紅曲發酵藜麥總數略優。在類別上,未發酵組中只有16種(含其他類中各類),其中酯類化合物百分含量最高,為38.23%;其次為醚類化合物,占20.72%;其他類化合物含量都在10%以內;發酵組風味物質共17類(含其他類中各類),且其醇類化合物(24.27%)、酸類化合物(16.93%)、酯類化合物(11.55%)、烯烴類化合物(11.85%)等多種化合物的百分含量都有極明顯的提升。綜合分析,紅曲發酵后使藜麥風味物質更多樣化,紅曲發酵藜麥組優于未發酵組。
3 結論
通過單因素試驗,確定了種子液培養基的基本成分:藜麥、蔗糖、蛋白胨、硫酸鎂。正交試驗結果顯示,最佳培養基配方為A3B2C3,即藜麥添加量為100 g/L,蔗糖添加量為30 g/L,蛋白胨添加量為30 g/L。由感官試驗可以得出,紅曲發酵后的藜麥整體上比未發酵的藜麥評分高,風味物質檢測結果表明,利用紅曲菌發酵后的藜麥風味物質優于未發酵的藜麥。相對紅曲菌的應用來說,藜麥作為發酵基質的應用目前還較少,2017年,劉曉艷等[11]對藜麥味噌釀造工藝進行了研制;2018年,韓林等[12]利用酵母發酵藜麥,并對其發酵工藝進行了優化;2019年,孫子羽等[13]利用藜麥為原料發酵制造格瓦斯,并對其工藝進行了優化;2019年,張紛等[14]利用藜麥和小麥混合發酵制作饅頭,并對其生產工藝進行了優化。雖然我國對以藜麥為發酵基質的研究較少,但并不是空白,本研究將益生菌——紅曲菌和全營養食品藜麥相結合,證實了紅曲菌可較好利用藜麥基質,具有較好的適生性,對其培養基質條件的優化無論是為將來藜麥飲料的開發還是藜麥調味品的開發都奠定了一定基礎。

