三明野生蕉-1,3-葡聚糖酶Mugsp7基因克隆及其在低溫處理下的表達分析
徐小萍 謝燕萍 陳芳蘭 陳曉慧 陳裕坤 張梓浩 程春振 林玉玲 賴鐘雄

摘? 要:以三明野生蕉組培苗為材料,通過RT-PCR技術克隆獲得-1,3-葡聚糖酶基因Mugsp7(-1,3-glucanase)的?cDNA?和?gDNA?序列,并對該基因進行生物信息學分析和不同低溫下的實時熒光定量PCR表達分析,并進一步測定8?℃處理1、2、3、4和5?d后三明野生蕉葉片-1,3-葡聚糖酶活性。結果表明:Mugsp7的?gDNA?長?1132?bp,開放閱讀框(ORF)長984?bp,具有一個148?bp的內含子,共編碼?327?個氨基酸。cDNA、gDNA?的登錄號分別為?KU363808和KU363809。生物信息學分析表明,Mugsp7?屬于酸性、親水、穩定性蛋白,不具有信號肽,與小果野蕉、大葉藻、玉米、大麥、水稻等位于同一分支,與小果野蕉親緣關系較近分為一類。實時熒光定量PCR表明,不同低溫處理和8?℃低溫不同時間處理下,Mugsp7?呈現不同表達模式,且三明野生蕉葉片-1,3-葡聚糖酶活性的測定分析也進一步表明,Mugsp7?能進一步響應低溫脅迫。因此,推測?Mugsp7?在三明野生蕉抗寒響應中發揮重要作用。
關鍵詞:三明野生蕉;-1,3-葡聚糖酶;Mugsp7;基因克隆;低溫脅迫;qPCR
Abstract: The tissue culture seedlings of a wild banana germplasm from Sanming were used to clone the cDNA and gDNA sequences of β-1,3-glucanase gene Mugsp7 by RT-PCR. Bioinformatics and qRT-PCR analysis of the expression at different low temperature were also carried out, and the enzyme activity of mperatureureent lowthe leaves was further determined by treating at 8?℃ for 1, 2, 3, 4 and 5 days. The gDNA sequence of Mugsp7 was?1132?bp with an open reading frame (ORF) of 984 bp and one intron of 148 bp, which encoding?327?amino acids. Bioinformatics analysis showed that Mugsp7 was an acidic hydrophobic stable protein, and there was no signal peptide. The amino acid sequence of Mugsp7 shared significant similarity with that in Musa acuminata, Zostera marina, Maize, Hordeum vulgare L , Oryza sativa on the same branch, and it was closely related to Musa acuminata. The expression pattern of Mugsp7 under different low temperature treatments was different, suggesting that Mugsp7 was a low temperature stress related gene.
Keywords: wild banana germplasm from Sanming; β-1,3-glucanase; Mugsp7; gene cloning; low temperature stress; qPCR
香蕉屬于芭蕉科(Musaceae)芭蕉屬(Musa)植物,是世界第4大糧食作物,具有重要的經濟價值。隨著全球氣候和壞境的變化,植物生長經常會遭受高溫、低溫、機械傷害、病原菌等不利條件影響。寒害已成為制約我國香蕉產業健康發展的主要災害之一[1],嚴重寒害在一定程度上可能會引起香蕉整個植株死亡,導致香蕉產量降低。福建省作為香蕉的重要產區,因其環境因素孕育豐富的野生蕉優質基因資源。但由于地處亞熱帶,經常遭受寒害侵襲,進而影響到香蕉的產量和品質。目前大量研究表明,野生蕉與栽培香蕉相比具有更強的抗寒性和抗病性,充分開發利用野生蕉的優良特性,對選育抗寒性香蕉品種具有重要意義[2-5]。
β-1,3-葡聚糖酶(β-1, 3-glucanase)基因屬于糖基水解酶第17家族成員[6],廣泛存在于植物中,已在擬南芥、田菁、可可、玉米、大葉藻、葡萄、白菜、水稻等眾多植物中克隆獲得。研究發現,β-1, 3葡聚糖酶除了參與調控植物的生長發育[7]和逆境脅迫外[8],還參與植物抗病[9-10]和抗寒[11]。β-1,3-葡聚糖酶是一類重要的PR蛋白[12],其在抗病性方面的研究取得了重大進步[13],但對其抗寒性的研究相對較少。低溫會誘導一系列生理生化反應和調節基因的表達產生相應逆境蛋白,如抗凍蛋白(AFP)的產生提高了植物抵抗低溫的能力。AFP在魚類中第1次被發現,前人研究表明[14],將抗凍蛋白基因導入植物后提高了植物抗寒性。Griffit等[14]經過氨基酸的分析,證明冬黑麥3種AFP的N端序列與內切β-1,3-葡聚糖酶具有同源性。為了改良香蕉的抗寒性,可進一步探討野生蕉β-1,3-葡聚糖酶基因與抗寒性相關性的研究。
目前,關于香蕉β-1,3-葡聚糖酶基因(Mugsp)的克隆也有報道。張妙霞[4]對三明野生蕉β-1,3-葡聚糖酶基因抗寒機理研究表明,Mugsp基因是抗凍蛋白基因,Mugsp1蛋白是抗凍蛋白的同工酶。陳芳蘭等[3]通過克隆獲得另外5個β-1,3-葡聚糖酶基因(Mugsp1.2、Mugsp2、Mugsp3、Mugsp4和Mugsp5),表明β-1,3-葡聚糖酶基因均在低溫處理下增加表達量,提高了植物抵抗低溫的能力。
因此,為提高香蕉產量和品質,促進香蕉產業發展。本研究在前人研究的基礎上,選用三明野生蕉作為材料,為篩選香蕉抗寒基因資源提供良好的遺傳背景,并采用RT-PCR技術克隆得到三明野生蕉的β-1,3-葡聚糖酶基因Mugsp7。對不同低溫處理下的Mugsp7進行定量表達分析,進一步測定不同時間低溫處理下的三明野生蕉β-1,3-葡聚糖酶活性變化,為進一步研究三明野生蕉β-1,3-葡聚糖酶基因在低溫下的功能奠定理論基礎。
1? 材料與方法
1.1? 材料
本研究克隆所用材料是為福建農林大學園藝植物生物工程研究所繼代保存的三明野生蕉組培苗。測定β-1,3-葡聚糖酶活性所用材料為長勢一致的三明野生蕉第1~2片新葉,采自園藝植物生物工程研究所香蕉種質資源圃。
1.2? 方法
1.2.1? Mugsp7的cDNA及gDNA克隆? 以三明野生蕉組培苗葉片為材料,參照天澤試劑盒提取植物總RNA,根據瓊脂糖凝膠電泳檢測?RNA?質量,采用超微量紫外分光光度計測定?RNA?吸光值,以?A260/A280?在?1.9~2.1?之間為宜,采用Thermo公司的RevertAid First Strand cDNA Synthesis Kit試劑盒逆轉錄成cDNA[16]。采用CTAB改良法提取三明野生蕉葉片的DNA[17]。參照小果野蕉基因組數據庫中已經注釋的β-1,3-葡聚糖酶基因序列,以標注為“GSMUA_Achr5T08100_001”的基因序列作為參考序列進行同源克隆。采用DNAMAN?6.0?軟件,根據引物設計原則設計上、下游引物(Mu?g?sp7-F,Mugsp7-R),用于cDNA及?gDNA的克隆,PCR反應體系延伸時間為70 s。PCR?產物采用?1%瓊脂糖凝膠電泳檢測,采用Biomega ?PCR產物純化試劑盒進行回收、TA克隆,最后進行菌液?PCR?鑒定。菌液?PCR?產物經過電泳后,選取陽性克隆子至鉑尚公司測序。利用DNAM?A?N? 6.0對克隆所得到的基因與基因組序列進行比對分析。
1.2.2? 生物信息學分析? 對克隆得到的基因序列和蛋白質序列采用以下的軟件進行生物信息學分析,相應的分析軟件見表1。
1.2.3? 低溫下Mugsp7實時熒光定量PCR檢測? 根據陳芳蘭等[3]對三明野生蕉低溫響應的研究,分別取生長勢相近的三明野生蕉組培苗葉片進行以下處理:28、20、13、4、0、?2、?4、?6?℃處理36?h,8?℃下處理0~36?h。經過不同溫度處理后提取RNA。實時熒光定量表達分析的cDNA則參照SYBR Ex Script RT-PCR kit進行逆轉錄。
在靠近序列起始密碼區域處設計定量上下游引物,引物序列見表2。將不同處理的三明野生蕉葉片?cDNA?各取1?μL進行混樣,對混合的?c?D?N?A ??進行?5、25、125和?625?倍的梯度稀釋,熒光定量?PCR試驗結果顯示,E值在?1.9~2.1?之間,建立的溶解曲線。以?18?s?為內參基因[4],使用羅氏LightCycler? 480 system熒光定量PCR儀進行擴增。以不同處理后稀釋10倍的cDNA作為模板進行熒光定量?PCR,對得到的平均?Cp?值采用單基因內參法2ΔΔCT計算基因相對表達量,每個處理?3?次重復。
1.2.4? 低溫處理后-1,3-葡聚糖酶活性的測定? 為進一步探討不同溫度處理下三明野生蕉Mug?sp7?轉錄水平表達模式,測定不同溫度處理下的β-1,3-葡聚糖酶活性。精確配制1 mg/mL的葡萄糖標準溶液,按照表3的順序依次在編號1~6的試管中加入相應試劑,充分混勻后沸水浴5 min,定容至25?mL。測定所有試管溶液的吸光度(A),使用的波長為540?nm。制作葡萄糖標準曲線。將生長健壯且長勢相近的三明野生蕉葉片分別經過8?℃處理1、2、3、4、5?d后,參考蔣躍明[18]方法測定β-1,3-葡聚糖酶活性。每個處理?3?個生物學重復。
表3? 測定酶活性其試劑加入順序
Tab. 3? Enzyme activity assay reagent addition
試管編號Test tube number
1???? 2???? 3???? 4???? 5???? 6
含糖量/mg???? 0???? 0.4?? 0.8?? 1.2?? 1.6?? 2.0
葡萄糖/mL???? 0???? 0.4?? 0.8?? 1.2?? 1.6?? 2.0
蒸餾水/mL???? 2???? 1.6?? 1.2?? 0.8?? 0.4?? 0
DNS/mL 2???? 2???? 2???? 2???? 2???? 2
M:DL2000 Marker;泳道1和泳道2分別是
cDNA和gDNA擴增產物。
M: DL2000 marker. Lane 1 and lane 2 are amplified products of cDNA and gDNA, respectively.
圖1? PCR擴增產物電泳結果
Fig. 1? Electrophoresis of PCR amplification
2? 結果與分析
2.1? 三明野生蕉β-1,3-葡聚糖酶基因Mugsp7 cDNA與gDNA序列獲得
以三明野生蕉的cDNA和gDNA為模板,經過PCR擴增產物結果見圖1。預測目的條帶約為1000?bp,第1條帶接近1000?bp,第2條帶接近1100?bp,與預測長度相符且條帶明亮,因此,割下這2條帶放入1.5?mL的離心管進行回收、純化、TA克隆和菌液PCR鑒定。菌液PCR產物,采用1%凝膠電泳檢測,挑選陽性克隆子送測。測序結果顯示,這2條序列均帶有完整的?ORF,最后獲得了984?bp的?ORF cDNA?序列,1132?bp?的gDNA序列。
在?NCBI?上進行?BLAST?發現,目的條帶的序列與其他物種的-1,3-葡聚糖酶基因序列具有較高的相似性,且在NCBI上進行功能結構域分析發現,所得的-1,3-葡聚糖酶基因序列具有糖基水解酶第17家族保守特征結構域[LIVM]. [LIVMFYWA]{3} [STAG]E[STA]GWP[STN]. [SAGQ]。將克隆得到的開放閱讀框序列與模板基因(GSMUA_Ach?r?5?T??0?8??100_001)序列進行比對,相似性達到97.67%,說明克隆獲得的序列為三明野生蕉的β-1,3-葡聚糖酶基因,命名為?Mugsp7,其cDNA、gDNA序列在NCBI上的登錄號分別為?KU?36?3?8?0?8、KU363809。同時將?cDNA、gDNA?序列在?DNA?M?AN6.0?軟件上比對發現,β-1,3-葡聚糖酶基因Mug?sp7具有一個148?bp的內含子。
2.2? 三明野生蕉Mugsp7蛋白的生物信息學分析
2.2.1? 蛋白質的基本理化性質分析? 采用Pro?p?ram對Mugsp7蛋白基本理化性質進行分析,結果表明:Mugsp7基因共編碼327個氨基酸,編碼的蛋白分子量為?35154.8 Da,預測分子式為C1560H2433N443O463S11,理論PI值為6.53。該蛋白屬于酸性、親水、穩定性蛋白。該基因共編碼?20?種氨基酸,其中丙氨酸(Ala)的含量最高,為13.5%,其次是纈氨酸(Val),為9.5%。預計N端氨基酸為蛋氨酸(Met),該蛋白的脂肪族系數為85.08。使用SignalP 4.0 Server 軟件對Mugsp7蛋白信號肽進行預測,結果顯示,Mugsp7蛋白不具有典型的信號肽。使用PSORT對Mugsp7蛋白進行亞細胞定位發現,Mugsp7蛋白位于葉綠體基質、線粒體基質空間、線粒體膜間隙、細胞質的可能性分別為0.520、0518、0.473、0.450,主要定位在葉綠體基質和線粒體基質上。
2.2.2? 蛋白質的跨膜結構及保守結構域分析? 使用TMpred對Mugsp7的蛋白質進行跨膜結構分析發現,Mugsp7屬于跨膜蛋白,跨膜區域共有8
個,即內到外和外到內的跨膜區域各有4個,7~25位氨基酸最有可能形成從內到外的跨膜區域,161~188位氨基酸最有可能形成從外到內的跨膜區域。使用NCBI-Protein Tools對Mugsp7蛋白的保守結構域預測發現,Mugsp7蛋白屬于糖基水解酶第17家族(Glycosyl hydrolases family),該蛋白質在第17~27?個氨基酸之間含有一大段與糖基水解酶第17家族一致的保守結構域即,[LIVM]. [LIVMFYWA]{3}[STAG]E[STA]GWP[STN]. [SA?G?Q]。因此,Mugsp7蛋白屬于糖基水解酶第17家族,很有可能在糖基水解酶調節方面發揮著重要的作用。
2.2.3? Mugsp7蛋白質結構分析? 使用Coils預測Mugsp7蛋白的卷曲螺旋結構發現,Mugsp7蛋白卷曲的幾率小于20%。根據?Coils?判斷方法,即若幾率小于50%螺旋結構就不能形成,幾率大于50%則螺旋結構有可能形成,故Mugsp7蛋白形成卷曲螺旋結構的可能性很小,因此,推測Mugsp7沒有卷曲螺旋的結構。使用NPS預測Mugsp7蛋白的二級結構,結果顯示,Mugsp7蛋白的結構主要由無規則卷曲(41.28%)、α螺旋(30.28%)和延伸鏈(28.44%)組成。由于富含無規則卷曲結構,能形成多種構象,在不同條件下可表達不同的功能。使用Swiss-model預測三明野生蕉Mugsp7?蛋白質的三維結構(圖3),其主要的結構元件是無規則卷曲、α螺旋和延伸鏈,與二級結構預測的結果保持一致。使用NetPhos?2.0?對?Mugsp7?蛋白進行磷酸化位點預測,結果顯示,Mugsp7?蛋白可能在絲氨酸(4個)、蘇氨酸(2個)和酪氨酸(2個)這?3?種氨基酸上發生磷酸化修飾。
2.2.4? Mugsp7氨基酸序列同源性和分子系統進化分析? 使用NCBI對三明野生蕉Mugsp7蛋白和其他物種β-1,3-葡聚糖酶的同源性進行比對,同時對系統進化進行分析。根據對比結果,選取有代表性的和同源性高的幾個物種建立發育樹,主要的分析結果為:三明野生蕉Mugsp7與水稻(Oryza sativa)、玉米(Zea)的相似性均為59%,與大葉藻(Zostera marina)的相似性為58%,與大麥(Hordeum vulgare)的相似性為54%,與葡萄(Vitis vinifera)、橡膠樹(Hevea brasiliensis)的相似性為49%。采用MEGA6.0對具有代表性的單子葉和雙子葉植物的蛋白質序列進行進化樹分析,擬南芥獨立分為一類(圖4)。葡萄、橡膠樹、田菁、油橄欖、玫瑰、百合和可可樹分為一類,三明野生蕉Mugsp7與小果野蕉、大葉藻、玉米、大麥、水稻分為一類,且與小果野蕉位于同一分支,說明三明野生蕉Mugsp7與小果野蕉具有高度的親緣關系。
2.3? 低溫下三明野生蕉Mugsp7的熒光定量表達分析
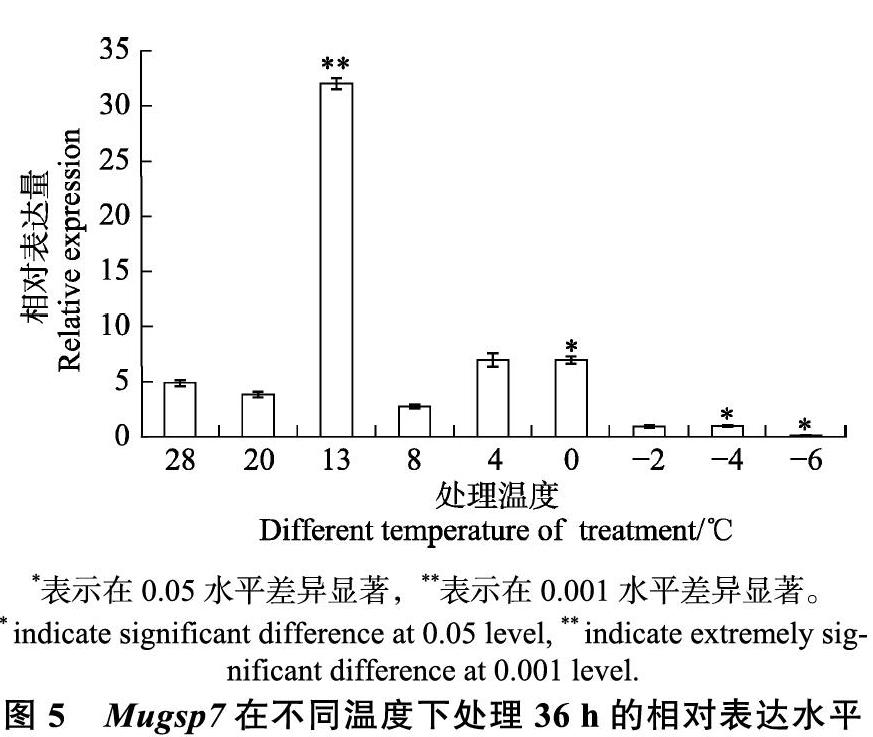
在不同溫度(28、20、13、8、4、0、?2、?4、和?6?℃) 處理36 h,以28 ℃處理為對照,Mugsp7的相對表達量呈現“升-降-升-降”趨勢(圖5)。當溫度為13?℃時,相對表達量達到最大值,約為對照組的6.5倍。當溫度為8?℃時,Mugsp7的相對表達量突然降低,為對照組的0.57倍。在更低溫度下,表達量稍微上升后又下降。結果表明,除13?℃處理外,Mugsp7在其他溫度的表達水平均較低。由于13?℃是生長臨界溫度,以上結果說
為進一步了解三明野生蕉β-1,3-葡聚糖酶基因Mugsp7在8?℃低溫表達量突然下降的原因,對三明野生蕉組培苗在8?℃中進行0~36 h的不同時間處理。以28?℃處理為對照,Mugsp7的相對表達量呈現“升-降-升”趨勢(圖6),表明Mugsp7可以快速響應8?℃。而8?℃下不同持續時間處理會使表達量發生變化,且低溫不同持續時間處理的表達量均高于對照組,介于1.6和7倍之間。在8?℃低溫處理4 h時,Mugsp7的表達量達到最大值約為對照的7倍。處理8 h時,其表達量突然降低,約為對照的1.6倍,而后隨著低溫時間持續增加,Mugsp7的表達量變化不明顯。因此,研究結果表明,Mugsp7在低溫不同持續時間剛開始發生變化時即感受低溫,同時開始啟動抗寒應答。
2.4? 低溫處理后三明野生蕉β-1,3-葡聚糖酶活性變化
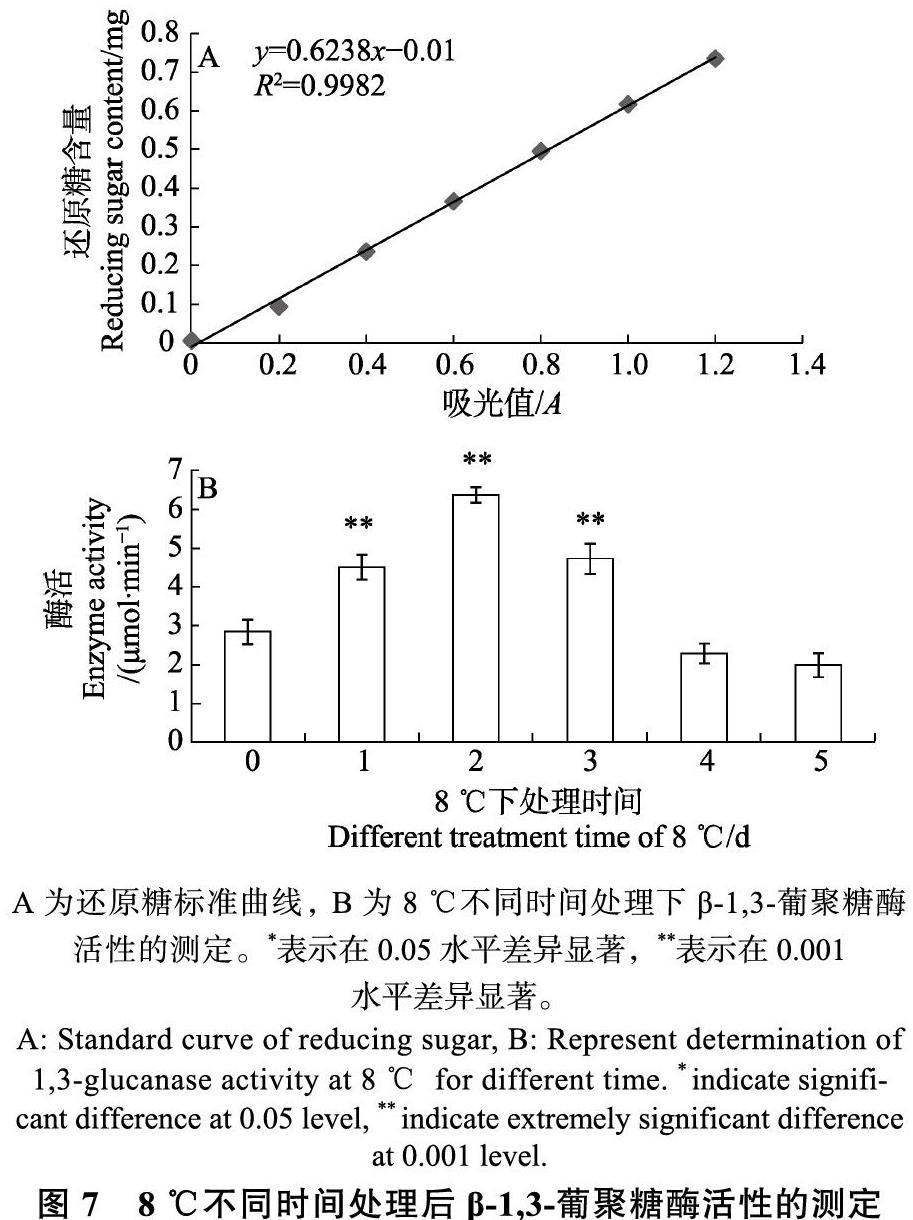
葡萄糖標準曲線如圖7所示,根據標準曲線公式和相應計算得到三明野生蕉β-1,3-葡聚糖酶活性(圖7)。結果顯示,將三明野生蕉葉片置于低溫下處理一定時間(8?℃處理1、2、3、4和5?d),葉片體內的β-1,3-葡聚糖酶活性發生了顯著性變化,總體上呈現“先升后降”的趨勢,在正常植物體葉片中通常是低水平表達的[19]。在低溫處理的短時間內即出現較大波動,活性在第2天達到最高值。當處理時間繼續增加,在第3天時突然下降,之后緩慢降低。因此,三明野生蕉β-1,3-葡聚糖酶在短時間低溫處理下對低溫的響應強烈,隨著處理時間的延長,對低溫的響應減弱。
A為還原糖標準曲線,B為8?℃不同時間處理下β-1,3-葡聚糖酶活性的測定。*表示在0.05水平差異顯著,**表示在0.001
水平差異顯著。
通過?SPSS?軟件分析可知,8?℃下處理1、2、3?d與對照組間的酶活性具有極顯著差異,4、5?d與對照組的差異不明顯。表明低溫在一定時間內會影響β-1,3-葡聚糖酶的活性,并且在處理2?d達到極大值。Mugsp7在8?℃下處理24~36?h期間基因表達顯著上調,與酶活性呈現一致的表達模式,而在處理3?d開始下降。處理1?d與處理3、4與5?d處理的酶活性無明顯差異,甚至低于對照組的活性。進而推測β-1,3-葡聚糖酶可以協助三明野生蕉耐受一定時間的低溫,低溫處理2?d時,通過提高?Mugsp7?的表達量,提高酶活性,達到一定程度后(3?d),體內抵抗低溫能力遭到破壞。
3? 討論
3.1? Mugsp7基因結構可能與三明野生蕉抗寒功能相關
低溫處理下三明野生蕉Mugsp7蛋白的二級結構主要由無規則卷曲(41.28%)、α?螺旋(30.28%)、延伸鏈(28.44%)構成。三明野生蕉β-1,3-葡聚糖酶?Mugsp7基因的表達情況賦予了植物一定的抗寒性,三明野生蕉的抗寒功能可能與這種結構特點有關。正常生長條件下,植物的細胞膜是流動的。當植物遭受低溫脅迫時,為維持正常的生長發育,可通過減少細胞膜的流動性,增加其剛性,從而將減少低溫造成的傷害。
王維香等[20]認為α螺旋可以與細胞膜結合,穩定膜功能,防止膜低溫損傷,同時也可以抑制冰點的生長。一般認為,無規則卷曲區域可決定蛋白質的功能,在不同條件下可表達不同的功能[21]。同時對最早在魚類中發現的抗凍蛋白基因研究發現,該基因在植物中表達可使植物降低胞外溶液冰點,從而使植物在抗寒性方面得到提高,并且該蛋白和其他一些抗凍蛋白的二級結構中也含有該種結構。其他已經克隆獲得的β-1,3-葡聚糖酶成員中也含有這種結構。因此,猜測這種二級結構對于β-1,3-葡聚糖酶具有一定的抗寒性。通過進化樹分析可知,不同物種的β-1,3-葡聚糖酶基因結構的具有較高同源性,說明β-1,3-葡聚糖酶保守區域在遺傳過程中具有一定穩定性。
3.2? Mugsp7抗寒作用機制的探討
β-1,3-葡聚糖酶基因是一類重要的抗逆境相關基因[22-23]。在本研究中,低溫8?℃不同時間處理后β-1,3-葡聚糖酶的活性呈現“先上升后下降”的趨勢,說明β-1,3-葡聚糖酶能夠響應低溫脅迫。普遍認為13?℃是香蕉的低溫臨界溫度[24],在冷害溫度下,溫度越低則越快出現冷害[25]。本研究28~?6?℃的實時熒光定量結果表明,整體呈現出“先升高后降低”的表達趨勢,特別是在13?℃達到了極大值,可能原因是三明野生蕉Mugsp7對溫度敏感,提高表達量的同時累積了一定量的β-1,3-葡聚糖酶,足夠抵抗8?℃一定時間的低溫脅迫,所以8?℃條件下表達量急劇降低。這與張妙霞[4]推測三明野生蕉Mugsp基因的抗寒作用具有累積效應一致,并得出Mugsp1基因是抗凍蛋白基因。本研究?Mugsp7?能強烈響應低溫,特別是臨界生長點13?℃,但在0?℃后,表達量很低甚至接近?0,可能不同物種、不同成員功能上有差異。將Mugsp7?低溫下的定量表達結果同陳芳蘭等[3]的Mugsp1.2-5?基因在低溫下的表達情況比較發現,β-1,3-葡聚糖酶基因不同成員都在8?℃下1~4?h顯著提高表達量,但是不同成員的表達模式不盡相同,不同的是在香蕉生長臨界溫度(13?℃)下,Mugsp7基因達到表達高峰,這與陳芳蘭等[3]的結果有所差異。Mugsp1.2、Mugsp2、Mugsp5在4?℃時達到表達高峰,Mugsp1、Mugsp3、Mugsp4?在0?℃表達量達到最高。推測在低溫下,本研究克隆獲得的三明野生蕉β-1, 3-葡聚糖酶基因Mug?sp7,協同和互補了陳芳蘭等[3]及張妙霞[4]克隆獲得的Mugsp、Mugsp1-5基因等β-1, 3-葡聚糖酶家族基因,幫助植物抵抗低溫脅迫,家族基因間的協同表達作用提高了β-1, 3-葡聚糖酶抗寒效應。然而,β-1, 3-葡聚糖酶基因在感受到低溫信號后具體是如何傳遞的、如何提高植物抗寒等問題可以在今后中進行深入的研究。
參考文獻
王安邦, 金志強, 劉菊華, 等. 香蕉寒害研究現狀及展望[J]. 生物技術通報, 2014(8): 28-33.
Heslop-Harrison J S, Schwarzacher T. Domestication, genomics and the future for banana[J]. Annals of botany, 2007, 100(5): 1073-1084.
陳芳蘭, 林玉玲, 陳裕坤, 等. 三明野生蕉β-1,3葡聚糖酶基因克隆及其低溫下SA處理后的表達分析[J]. 西北植物學報, 2015, 35(9): 1709-1721.
張妙霞. 野生香蕉(Musa spp., AB group)抗寒相關基因的克隆與表達分析[D]. 福州: 福建農林大學, 2010.
賴鐘雄, 陳? 源, 林玉玲, 等. 三明野生蕉基本生物學特性調查[J]. 亞熱帶農業研究, 2006(4): 241-244.
Gaudioso-Pedraza R, Benitez-Alfonso Y. A phylogenetic approach to study the origin and evolution of plasmodesmata-localized glycosyl hydrolases family 17[J]. Frontiers in Plant Science, 2014, 5: 212.
Abeles F B, Bosshart R P, Forrence L E, et al. Preparation and purification of glucanase and chitinase from bean leaves[J]. Plant Physiology, 1971, 47(1): 129-134.
Hon W C, Griffith M, Mlynarz A, et al. Antifreeze proteins in winter rye are similar to pathogenesis-related proteins[J]. Plant Physiology, 1995, 109(3): 879-889.
王廷璞, 馬靜靜, 趙菲佚. -1,3-葡聚糖酶和幾丁質酶在農作物病蟲害防治中的研究進展[J]. 安徽農業科學, 2010, 38(26): 14417-14419.
楊樹奎. -1,3-葡聚糖酶和幾丁質酶在農作物病蟲害防治中的研究進展的幾點思考[J]. 中國農業信息, 2013(15): 98-98.
卞海云, 王友華, 陳兵林, 等. 低溫條件下相關關鍵酶活性對棉纖維比強度形成的影響[J]. 中國農業科學, 2008 (4): 1235-1241.
Van Loon L C, Van Strien E A. The families of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999, 55 (2): 85-97.
Zhu Q, Maher ? E A, Sameer Masoud R A, et al. Enhanced protection against fungal attack by constitutive co–expre?ssion of chitinase and glucanase genes in transgenic tobacco [J]. Bio/Technology, 1994, 12 (8): 807-812.
Hightower R, Baden C, Penzes E, et al. Expression of antifreeze proteins in transgenic plants[J]. Plant Molecular Biology, 1991, 17(5): 1013-1021.
Griffith M, Marentes E, Ala P, et al. The role of ice binding proteins in frost tolerance of winter rye[M]//Paul H L. Advances in plant cold hardiness. University of Michigan: CRC Press, 1993: 177-186.
趙雙宜, 吳耀榮, 夏光敏. 介紹一種簡單高效的植物總RNA提取方法[J]. 遺傳, 2002, 24(3): 337-338.
淦國英, 漆艷香, 蒲金基, 等. 改良CTAB法提取高質量香蕉葉片總RNA[J]. 廣東農業科學, 2009(7): 192-195.
蔣躍明. 香蕉采后炭疽病發生與幾丁酶、β-1,3-葡聚糖酶和多巴胺的關系[J]. 植物生理學報, 1997, 23(2): 158-162.
高曉蓉, 安利佳, 范? 琦, 等. 大豆-1,3-葡聚糖酶基因的研究初報[J]. 農業生物技術學報, 2000, 8 (3): 240-247.
王維香, 魏令波, 張? 虎. 沙冬青熱穩定抗凍蛋白的分離純化及其部分性質研究[J]. 四川大學學報(自然科學版), 2007, 44(4): 912-917.
王轉梅, 陳崇順, 王? 軼, 等. 煙草品種Xanthi NN堿性β-1,3-葡聚糖酶基因的克隆與生物信息學分析[J]. 江蘇農業科學, 2009(1): 28-31.
Bove J, Kim C Y, Gibson C A, et al. Characterization of wound-responsive RNA-binding proteins and their splice variants in Arabidopsis[J]. Plant Molecular Biology, 2008, 67(1-2): 71-88.
Balasubramanian V, Vashisht D, Cletus J, et al. Plant β-1,3-glucanases: their biological functions and transgenic expression against phytopathogenic fungi[J]. Biotechnology Letters, 2012, 34 (11): 1983-1990.
Dixon R A, Achnine L, Kota P, et al. The phenylpropanoid pathway and plant defence—a genomics perspective[J]. Molecular Plant Pathology, 2002, 3(5): 371-390.
牟海飛, 吳代東, 鄒? 瑜, 等. 香蕉寒害及防寒栽培技術研究進展[J]. 南方農業學報, 2012, 43(7): 965-970.

