運輸脅迫對大菱鲆生理免疫影響的初步探究
馬壯 田濤 吳忠鑫

摘 要:大菱鲆(Scophthalmus maximus)是我國北方的重要經濟魚種,為研究運輸脅迫對大菱鲆生理免疫的影響,并確定大菱鲆的優選運輸方案,采用體長為4.65±1cm(幼體組)和14.50±1cm(成體組)2種規格的大菱鲆為研究對象,在實驗室模擬運輸條件,分析其非特異性免疫、呼吸排泄及死亡率變化,并探究活魚苗運輸的優選方案,結果顯示:(1)過氧化氫酶(CAT)、堿性磷酸酶(AKP)、超氧化物歧化酶(SOD)、溶菌酶(LZM)呈現降低趨勢并明顯低于對照組,隨著模擬運輸中溫度的升高、密度的增加和震動強度的增加而降低,谷草轉氨酶(GOT)、谷丙轉氨酶(GPT)、丙二醛(MDA)呈現升高趨勢并明顯高于對照組,隨著模擬運輸中溫度的升高、密度的增加和震動強度的增加而升高;(2)大小2種規格的大菱鲆在運輸脅迫下表現出了不同的免疫能力,幼體組中的GOT、GPT、SOD、MDA的表現優于成體組,成體組中的CAT、AKP、LZM優于幼體組;(3)耗氧率和排氨率隨著模擬運輸中溫度的升高、密度的增加和震動強度的增加而升高,幼體組的耗氧率和排氨率的升高程度要低于成體組;(4)實驗結束后的幼體組與成體組大菱鲆死亡率均隨時間變化先升高后降低,在實驗結束時的死亡率極低,而在0~24h死亡率達總死亡率的50%以上,24~48h內的死亡率又開始下降。隨著模擬運輸中溫度的升高、密度的增加和震動強度的增加,2種規格的大菱鲆的總死亡率呈現上升趨勢,成體組的總死亡率的升高程度要低于幼體組;(5)通過正交實驗極差分析法得出綜合考慮成本及運輸效果前提下,幼體組與成體組大菱鲆的優選運輸方案均為A1B1C2,即溫度為15℃、密度為ind·L-1、震動強度為200RPM。
關鍵詞:大菱鲆;非特異性免疫;運輸脅迫;溫度;密度;震動強度
中圖分類號 S981.14文獻標識碼 A文章編號 1007-7731(2020)04-0074-10
Abstract:Turbot (Scophthalmus maximus) is an important economic fish species in the north of China. In order to study the effect of transportation stress on the physiological immunity of turbot,and to determine the optimal transportation scheme of turbot,the turbot with the body length of 4.65±1 cm (juvenile group) and 14.50±1 cm (adult group) was used as the research object,and the transportation conditions were simulated in the laboratory,and explore the optimal transportation plan,analyze the changes in non-specific immunity,respiratory excretion and mortality,the results show:(1) CAT,AKP,SOD,LZM showed a decreasing trend and were significantly lower than those of the control group. With the increase of temperature,density and vibration intensity during simulated transportation,GOT,GPT,MDA showed an increasing trend It is significantly higher than the control group,and increases with the increase in temperature,density,and vibration intensity during simulated transportation;(2) Two groups of turbot showed different immune abilities under transportation stress. The performance of GOT,GPT,SOD,and MDA in the juvenile group was better than that in the adult group. CAT,AKP,LZM in the adult group Better than juvenile group;(3) The oxygen consumption rate and ammonia excretion rate increase with the increase of temperature,density,and vibration intensity during the simulated transport,and the increase of the oxygen consumption rate and ammonia excretion rate of the juvenile group is lower than Adult group;(4) After the experiment,the mortality of juvenile and adult turbot increased and then decreased with time. The mortality at the end of the experiment was extremely low,and the mortality reached 0-24 hours. More than half,the mortality rate within 24-48 hours began to decline again. With the increase of temperature,density and vibration intensity in simulated transportation,the total mortality rate of turbot with two specifications showed an increasing trend,and the increase of total mortality rate in the adult group was lower than that in the juvenile group;(5) Based on the orthogonal experimental range analysis method,it is concluded that the preferred transportation schemes for juvenile and adult groups of turbot are A1B1C2 under the premise of comprehensive consideration of cost and transportation effect,that is,the temperature is 15 ° C,the density is 40 ind·L-1,the vibration intensity is 200 RPM.
Key words:Scophthalmus maximus;Non-specific immunity;Transport stress;Temperature;Density;Vibration intensity
陸地活魚運輸是現在水產品由濱海城市輸送到內地的最主要方式之一[1]。其中運輸方法有很多,包括傳統的密閉式運輸法、無水濕法運輸、干法運輸、麻醉運輸等,而苗種和較小規格活魚的運輸則較多采用低成本高效的密閉式運輸法[2],但無論哪種運輸方式都會使魚產生相應程度的應激反應[3]。在此過程中機體的免疫力防御機制會受到抑制,導致魚類感染各種病原的可能性增加[4],同時在運輸中的高密度、溫度升高和道路顛簸產生的脅迫作用也會對魚類的免疫和生存產生影響。運輸活魚的方法和運輸中不利條件對魚類生理上造成的影響已為許多著作所證實[5]。國內外已經對草魚[6](Ctenopharyngodon idellus)、美洲鰣[7](Alosa sapidissima)、鱖魚[3](Siniperca chuatsi)、日本黃姑魚[8](Nibea japonica)等進行了運輸脅迫的相關研究,但關于大菱鲆運輸脅迫的相關報道相對較少。
大菱鲆(Scophthalmus maximus)又被稱為鰈魚,屬于脊索動物門硬骨魚綱,鰈形目鲆科[9],是目前品質較好的養殖品種之一。魚體的蛋白質含量非常高[10],味道鮮美,對于美容養顏具有非常好的效果,除此之外可以補腎健腦,提高精氣,在我國很受歡迎,有“多寶魚”的美譽,1992年由黃海水產研究所從英國引進[11]。據不完全統計,我國的大菱鲆總產量已超出其他國家同期水平,養殖面積成倍增加,現已成為我國北方水產經濟養殖的重要支柱。為探究最適的大菱鲆的活魚運輸方案,本研究通過室內模擬車輛運輸條件,分析魚體免疫指標、呼吸排泄等變化,結合運輸后死亡率,得出最適的運輸條件,確定優選運輸方案,以期為選擇適宜的活魚運輸條件提供參考依據。
1 材料與方法
1.1 實驗材料 實驗用魚于2018年4月30日從大連天正實業有限公司采購,平均體質量分別為10.36±5g(幼體組)和50.30±5g(成體組),平均體長分別為4.65±1cm(幼體組)和14.50±1cm(成體組)。實驗時挑選體色正常、行動迅速、生命力強的個體用于脅迫實驗。實驗前在循環養殖水槽中暫養,水溫13℃,鹽度31‰,24h供氧。每天早晚各投喂1次,投餌量為魚體重的2%~3%,每天換水1次,換水量為總水量的2/3,采用虹吸的方式清除殘餌和糞便并保持池內的清潔。
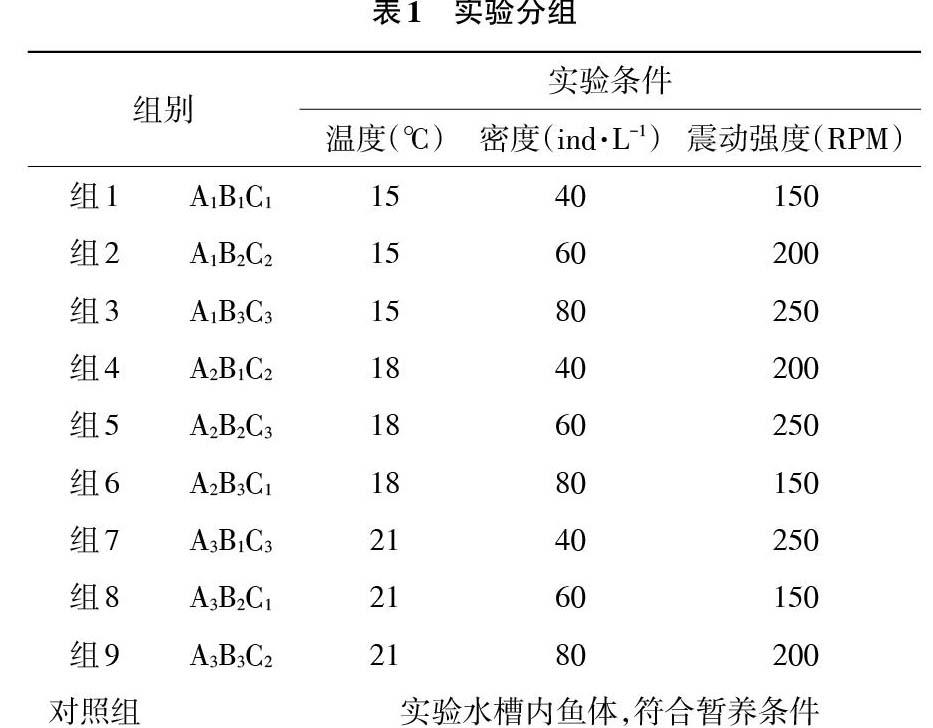
1.2 模擬運輸 實驗采用活魚運輸專用雙層塑料運輸袋,每袋加入過濾清潔海水并放入實驗魚,模擬實際運輸條件,充純氧后打包放入泡沫箱中進行運輸實驗。實驗分為2種規格的大菱鲆進行,實驗采用正交實驗設計,控制溫度、密度和震動強度的變化,分9組進行,重復3次試驗,分組情況見表1。
1.3 樣品采集和處理
1.3.1 樣品采集 在運輸實驗結束之后,將實驗用魚迅速撈起并立即投入MS-222濃度為200mg·L-1的海水中做快速深度麻醉,避免因人為刺激而引起的應激反應。麻醉后立刻取肝臟,進行組織破碎后加入生理鹽水配成10%濃度的組織液,離心(3000R,10min)取上清液,最后把采集的樣品保存在4℃冰柜中保存,并在24h內測量完畢。
1.3.2 酶指標的測定 實驗測定的溶菌酶(LZM),堿性磷酸酶(AKP),谷草轉氨酶(GOT),過氧化氫酶(CAT),谷丙轉氨酶(GPT),總超氧化物歧化酶(T-SOD),丙二醛(MDA)共計7種酶采用試劑盒測定,試劑盒從南京建成生物科技有限公司采購。
1.3.3 耗氧率與排氨率的測定 在進行每組實驗時,分別保存實驗前后的水體樣品(-20℃冷凍保存,在24h內分別利用碘量法和靛酚藍法對溶解氧和水中氨氮進行測定),耗氧率和排氨率公式為:
式中:V—水體體積,L;W—個體體重,g;t—試驗時間,h。R0—單位體重耗氧量,mg·(g·h)-1;RA—單位體重排氨率,μg·(g·h)-1;DO0、DOt—分別為試驗開始和結束時的水體溶氧濃度,mg·L-1;Nt、N0—分別為實驗開始和結束是的水體氨氮濃度,μg·g-1。
1.3.4 死亡率 在實驗結束后0h、24h、48h分別計數大菱鲆死亡數量,其公式為:
CDR(%)=(N1/N2)×100
式中CDR為死亡率,N1為死亡個體數量,N2為種群總數量。
1.3.5 正交實驗極差分析 Rj反映了第j列因素的水平變動時,試驗指標的變動幅度。Rj越大,說明該因素對試驗指標的影響越大,因此也就越重要。極差Rj為第j列因素的極差,即第j列因素各水平下平均指標值的最大值與最小值之差,于是依據Rj的大小,就可以判斷因素的主次。
極差Rj計算公式為:
式中ym為各實驗水平的試驗指標值,Kjm為第j列因素m水平所對應的試驗指標和,[Kjm]為Kjm的平均值。由Kjm的大小可以判斷j因素的優水平和各因素的水平組合,即最優組合。
1.4 數據分析 所得的全部數據均利用SPSS 17.0軟件對測定結果進行統計分析,采用方差分析和Tukey檢驗進行顯著性分析和多重比較,數據在P<0.05時被認為具有顯著性差異。
2 結果與分析
2.1 模擬運輸條件對大菱鲆非特異性免疫的影響 由表2、圖2-A可以看出,隨著模擬運輸條件的加劇,2種規格的大菱鲆體內CAT活性顯著降低(P<0.05),并且成體組體內AKP酶活性的降低程度要較低于幼體組,兩者具有顯著差異性(P<0.05)。由表2、圖2-B可以看出,隨著模擬運輸條件的加劇,2種規格的大菱鲆體內AKP活性顯著降低(P<0.05),并且成體組體內AKP酶活性的降低程度要較低于幼體組,兩者具有顯著差異性(P<0.05)。由表2、圖2-C、2-D可以看出,隨著模擬運輸條件的加劇,2種規格大菱鲆體內的GOT和GPT活性呈現正相關,顯著高于對照組(P<0.05),而幼體組體內GOT和GPT酶活性的上升程度較低于成體組,兩者具有顯著差異性(P<0.05)。由表2、圖2-E、2-F可以看出,隨著模擬運輸條件的加劇,兩種規格的大菱鲆體內SOD活性顯著降低(P<0.05),MDA含量顯著升高(P<0.05),而幼體組體內SOD的降低程度和MDA含量的上升程度較低于成體組,兩者具有顯著差異性(P<0.05)。
由表2可知,這7種酶指標的極差數Rj值,因此可以判斷溫度、密度和震動強度對大菱鲆非特異性免疫的影響的主次要關系。在CAT活性酶中,幼體組的R1=10.68>R2=2.51>R3=0.54,成體組的R1=11.02>R2=2.24>R3=1.06,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。在AKP活性酶中,幼體組的R1=10.05>R2=3.23>R3=0.53,成體組的R1=7.52>R2=1.42>R3=0.79,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。在GOT活性酶中,幼體組的R1=8.14>R2=1.09>R3=1.09,成體組的R1=18.82>R3=2.04>R2=1.25,因此溫度為主要影響因素,密度為幼體組的次要因素,震動強度為成體組的次要影響因素。在GPT活性酶中,幼體組的R1=11.92>R2=2.00>R3=0.58,成體組的R1=13.33>R2=2.11>R3=0.64,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。在SOD活性酶中,幼體組的R1=6.06>R2=1.05>R3=0.51,成體組的R1=5.19>R3=2.19>R2=1.03,因此溫度為主要影響因素,密度為幼體組的次要影響因素,震動強度為成體組的次要影響因素。在MDA含量中,幼體組的R1=4.37>R2=1.55>R3=0.52,成體組的R1=9.96>R2=2.15>R3=0.54,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。在LZM活性酶中,幼體組的R1=0.25>R2=0.08>R3=0.05,成體組的R1=0.18>R2=0.06>R3=0.02,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。
2.2 模擬運輸條件下大菱鲆的呼吸和代謝 由表3、圖3-A可以看出,隨著模擬運輸條件的加劇,2種規格的大菱鲆的耗氧率顯著升高(P<0.05),并且幼體組的耗氧率的升高程度要低于成體組,兩者具有顯著差異性(P<0.05)。由表3、圖3-B以看出,隨著模擬運輸條件的加劇,兩種規格的大菱鲆的排氨率顯著升高(P<0.05),并且幼體組的排氨率的升高程度要低于成體組,兩者具有顯著差異性(P<0.05)。
由表3可知這耗氧率和排氨率的極差數Rj值,因此可以判斷溫度、密度和震動強度對大菱鲆呼吸代謝的影響的主次要關系。在耗氧率中,幼體組的R1=0.041>R3=0.025>R2=0.010,成體組的R1=0.067>R2=0.014>R3=0.003,因此溫度為主要影響因素,震動強度為幼體組的次要影響因素,密度為成體組的次要影響因素。在排氨率中,幼體組的R1=0.219>R2=0.051>R3=0.33,成體組的R1=0.320>R2=0.074>R3=0.031,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。
表3 大菱鲆的耗氧率和排氨率
[分組 ? 耗氧率(mg·(g·h)-1)? ? ?排氨率(μg·(g·h)-1)? ? 幼體組 成體組 幼體組 成體組 組1 A1B1C1 0.134b 0.091c 0.894c 0.916e 組2 A1B2C2 0.087d 0.096c 0.774c 0.983e 組3 A1B3C3 0.091d 0.108c 0.831c 1.017d 組4 A2B1C2 0.099d 0.124b 0.891bc 1.123c 組5 A2B2C3 0.114c 0.137b 0.919b 1.142c 組6 A2B3C1 0.130b 0.129b 0.942b 1.153c 組7 A3B1C3 0.131b 0.153a 1.023ab 1.249b 組8 A3B2C1 0.148a 0.168a 1.030a 1.286b 組9 A3B3C2 0.157a 0.174a 1.101a 1.341a Ka1 0.311 0.295 2.499 2.916 Ka2 0.342 0.390 2.752 3.418 Ka3 0.435 0.495 3.154 3.876 Kb1 0.364 0.368 2.808 3.288 Kb2 0.348 0.401 2.722 3.411 Kb3 0.377 0.411 2.875 3.511 Kc1 0.411 0.388 2.866 3.355 Kc2 0.342 0.394 2.766 3.447 Kc3 0.336 0.398 2.773 3.408 R1 0.041 0.067 0.219 0.320 R2 0.010 0.014 0.051 0.074 R3 0.025 0.003 0.033 0.031 ]
圖3 大菱鲆的耗氧率和排氨率
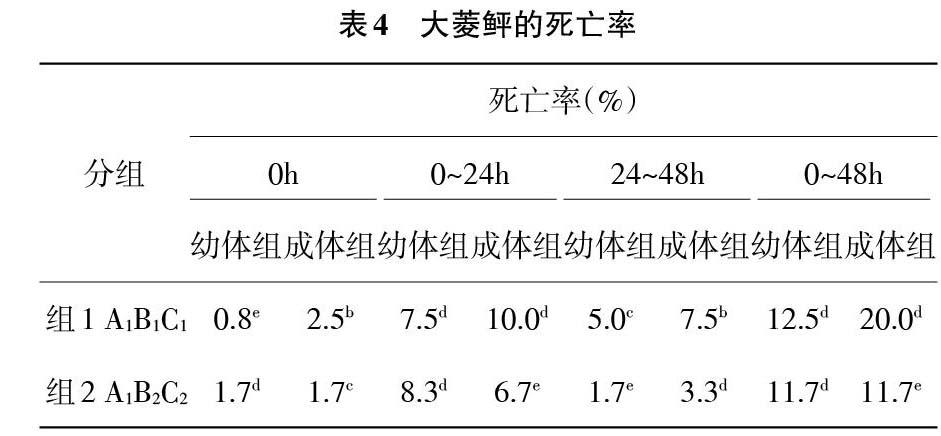
2.3 模擬運輸實驗后大菱鲆的死亡率 由表4、圖4隨著模擬運輸條件的加劇,2種規格的大菱鲆的總死亡率呈現上升趨勢,成體組的總死亡率的升高程度要低于幼體組,兩者差異性顯著(P<0.05)。0h、0~24h和24~48h大菱鲆的死亡率呈現出先升高后降低的趨勢,并且成體組在各個時間段的死亡率均高于幼體組(P<0.05)。
由表4可知死亡率的極差數Rj值,因此可以判斷溫度、密度和震動強度對大菱鲆死亡現象的影響的主次要關系。在0h,幼體組的R1=0.049>R3=0.013>R2=0.011,成體組的R1=0.028>R2=0.008>R3=0.003,因此溫度為主要影響因素,震動強度為幼體組的次要影響因素,密度為成體組的次要影響因素。在0~24h,幼體組的R1=0.158>R2=0.046>R3=0.17,成體組的R1=0.167>R2=0.036>R3=0.031,因此溫度為主要影響因素,密度為次要影響因素,震動強度的影響能力最弱。在24~48h,幼體組的R1=0.068>R3=0.31>R2=0.024,成體組的R1=0.044>R2=0.033>R3=0.022,因此溫度為主要影響因素,密度為成體組的次要影響因素,震動強度為幼體組的次要影響因素。在0~48h,幼體組的R1=0.275>R3=0.053>R2=0.046,成體組的R1=0.239>R2=0.067>R3=0.010,因此溫度為主要影響因素,密度為成體組的次要影響因素,震動強度為幼體組的次要影響因素。
2.4 大菱鲆幼體組和成體組的優選運輸方案
2.4.1 幼體組的優選運輸方案 首先根據各指標下的平均數據和K1、K2、K3,初步確定各因素的最優水平組合(見表5),由于8個指標單獨分析出來的最優條件并不一致,所以必須根據因素對3個指標影響的主次順序,綜合考慮,確定出最優條件。
溫度在各指標中均為主要影響因素,并且其在各指標中表現一致,均為15℃最優;密度在CAT、AKP、GOT、GPT、SOD、MDA、LZM中的影響都排在第2位為次要因素,而對0~48h死亡率的影響則排在第3位,屬第3影響因素。根據表5可以看出在CAT、AKP、GOT、GPT、MDA、LZM中取B1為好,在SOD中取B2為好。當取B1為40ind·L-1時,CAT活性比取B2時提高10.075%,AKP活性比取B2時升高10.421%,GOT活性比取B2時降低1.476%,GPT活性比取B2時降低7.833%,MDA含量比取B2時降低8.201%,LZM活性比取B2時降低22.429%,而在取B2為60ind·L-1時,SOD活性比B1時升高0.578%,因此應該選擇優勢水平更大的B1水平。而震動強度則正好相反,其在0~48h死亡率中的影響都排在第2位,為次要因素,而對CAT、AKP、GOT、GPT、SOD、MDA、LZM的影響則排在第3位,屬第三影響因素。根據表5可以看出在,在0~48h死亡率中取C2為好,因此應該選擇C2水平。
綜上所述,幼體組大菱鲆的優選運輸方案為A1B1C2,即溫度為15℃、密度為40ind·L-1、震動強度為200RPM。
2.4.2 成體組的優選運輸方案 首先根據各指標下的平均數據和K1、K2、K3,初步確定各因素的最優水平組合(見表6),由于8個指標單獨分析出來的最優條件并不一致,所以必須根據因素對3個指標影響的主次順序,綜合考慮,確定出最優條件。
溫度在各指標中均為主要影響因素,并且其在各指標中表現一致,均為15℃最優;密度在CAT、AKP、GPT、MDA、LZM和0~48h總死亡率中的影響都排在第2位為次要因素,而對GOT和SOD的影響則排在第3位,屬第3影響因素。根據表6可以看出在CAT、AKP、MDA、LZM中取B1為好,在GPT中取B2為好,而在0~48h總死亡率取B3為好。當取B1為40ind·L-1時,CAT活性比取B2時提高12.729%,比取B3時升高16.019%,AKP活性比取B2時升高6.488%,比取B3時升高11.490%,MDA含量比取B2時降低6.987%,比取B3時降低16.483%,LZM活性比取B2時降低9.302%,比取B3時降低19.767%;而在取B2為60ind·L-1時,GPT活性比B1時升高0.578%,比取B3時升高10.149%;在取B3為80ind/L時,0~48h總死亡率比B1時降低27.586%,比取B2時降低1.149%。因此應該選擇優勢水平更大的B1水平。而震動強度則正好相反,其在GOP和SOD中的影響都排在第2位,為次要因素,而對CAT、AKP、GPT、MDA、LZM和0~48h總死亡率的影響則排在第3位,屬第3影響因素。根據表6可以看出在,在GOT中取C3為好,在SOD中取C2為好。在取C2為200RPM時,SOD活性比C3升高12.502%,在取C3為250RPM時,GOT活性比C2升高5.372%,因此應該選擇優勢水平更大C2水平。
綜上所述,成體組大菱鲆的優選運輸方案同樣為A1B1C2,即溫度為15℃、密度為40ind·L-1、震動強度為200RPM.
3 討論
3.1 模擬運輸條件對大菱鲆非特異性免疫的影響 一般而言,溫度升高能夠促進魚類的生長發育,但當溫度超過一定限度時,會影響其生長,甚至會引發死亡[12]。溫度對魚類生長的影響具有兩面性,一方面溫度升高導致魚體的能量代謝加快,消耗的能量增加;另一方面,溫度升高可以促進魚體攝入能量轉化為自身的凈能量[13]。酶在動物體內起到促進新陳代謝的作用,也是在動物體內的物質代謝中起到關鍵作用,血清酶一般存在于動物的各種組織器官中,相應組織器官的代謝水平和功能狀態影響著酶活性的高低,各組織器官的機能水平也影響著機體的調節和適應能力[14]。Cheng等[15]研究發現斜帶石斑魚(Epinepheluscoioides)在高于最適飼養溫度時免疫力明顯受到抑制。
而高密度養殖會對水產業的產量和成本提供有利的幫助,但是當密度的逐漸增加時,養殖種群內個體對資源、空間的競爭加劇,產生高壓環境,導致動物生理和免疫功能等方面產生不利的變化,最終可能會降低動物的生存能力[16-17]。對擁擠脅迫的應激反應在生理上的表現為血液中白細胞和紅細胞數量發生變化,肝臟和脾臟指數明顯降低,免疫功能受到抑制[18]。強俊等[19]發現短期高密度脅迫可使尼羅羅非魚(Oreochromis niloticus)血清葡萄糖與甘油三酯提高,并誘發肝損傷。
運輸脅迫會使魚體內的多項生理生化指標發生變化。震動強度則是由于運輸過程中車輛行駛帶來的顛簸,是活魚運輸中不可避免的影響因素之一。車輛的顛簸經過傳導,最終致使運輸魚類的水體也產生震蕩,對其中的魚類產生影響。大量的研究表明運輸脅迫會使魚類的生理指標發生變化。Brian等發現運輸后的尖吻鱸(Lates calcarifer)的紅細胞出現變形膨脹,血液pH值降低且影響血液輸氧能力[20]。在運輸條件下,牙鲆的肌肉氨基酸組成發生變化,體內ATP含量下降,乳酸含量升高[21];頭石脂鯉(Brycon cephalus)幼魚血糖含量升高[22];大西洋鮭魚(Salmo salar)血漿腎上腺素、血液乳酸和血糖合量都有明顯變化[23];紅鱒魚(Salmo gairdneri)血液腎上腺素濃度增加[24]。
過氧化氫酶(CAT)是一種生物防御體系的關鍵酶,在機體內穩定的起到分解過氧化氫的作用,使過氧化氫分解成水和氧氣,減少機體的-OH的積累,使細胞免于H2O2的破壞[25]。而實驗組大菱鲆的CAT活性均出現下降趨勢,表明大菱鲆體內清除超氧自由基、H2O2和過氧化物以及阻止或減少羥基自由基形成等方面的能力大幅度降低[26],這與徐冬冬等[13]將褐牙鲆(Paralichthys olivaceus)進行不同溫度的高溫實驗結果相似。
堿性磷酸酶(AKP)是一種磷酸單酯酶,可催化磷酸單酯及磷酸基團的轉移反應,并直接參與磷的代謝,與RNA、DNA、脂質和蛋白質的代謝有關[27],它也是巨噬細胞溶酶體中的非特異性磷酸水解酶,在血液中能防御外界微生物入侵[28]。而且AKP是一種特殊的膜結合蛋白,能夠控制魚體的代謝,還用于維持生物體內鈣磷比相對穩定,并且能參與蛋白質和脂類的代謝[29]。AKP活力受生物體生長階段、攝食狀況、環境等因素影響而發生相應變化[30-31]。實驗組2種規格的大菱鲆體內AKP活性均呈現下降趨勢,導致魚體相關代謝的紊亂,減弱魚體對防御外界微生物入侵能力。
谷草轉氨酶(GOT)和谷丙轉氨酶(GPT)是反應魚體肝臟健康情況的2種酶,活性高低和肝臟健康直接相關。2種轉氨酶主要存在于細胞線粒體,尤以肝組織中最為豐富,可用于分析肝功能是否健康[32]。正常情況下,在肝組織中轉氨酶活性值相對較小[33]。當GOT和GPT濃度上升或活性突然持續性增強時,表明組織中毒發生病變或者受損傷的組織范圍較大[34]。實驗組2種規格大菱鲆體內的GOT和GPT活性顯著上升,說明運輸脅迫對大菱鲆的肝臟造成損傷,并且這種損傷還在不斷加劇。
超氧化物歧化酶(SOD)與丙二醛(MDA)一起反應了魚類機體抗氧化能力的情況,SOD具有清除陰離子自由基的作用,是機體中免疫系統的重要組成部分[35],還能促進免疫細胞的吞噬能力,控制細胞膜脂質過氧化并保護機體正常的生理功能。SOD活性的高低反應了機體清除氧自由基的能力的高低,也表明魚體對炎癥的抵抗能力的強弱[35];MDA丙二醛是膜脂過氧化的產物之一,具有很強的毒性,因此MDA含量的高低與細胞受迫程度有很大的關系,MDA主要損傷生物膜結構,改變膜的通透性,影響生化反應,其含量側面反映機體細胞受損程度[36]。試驗組2種規格的大菱鲆體內SOD活性顯著下降,MDA含量顯著升高,其機體抗氧化能力大幅度下降,體內MDA迅速堆積。
溶菌酶(LZM),由巨型吞噬細胞分泌,并且廣泛存在于魚體血液及一些淋巴細胞中,具有抗菌、消炎、抗病毒等作用,是體液免疫的第一道防線[37-38]。實驗組兩種規格的大菱鲆體內LZM活性呈現下降,說明大菱鲆在運輸條件下對細菌和病毒的清除能力受到較強的抑制,免疫防線受損,更容易受到感染,但由于運輸水體封閉,水質較差,易滋生病菌,大菱鲆很有可能已經處于感染中。
3.2 模擬運輸條件下大菱鲆的呼吸和代謝 在養殖過程中,大菱鲆的耗氧、氨氮排泄是要著重考慮的要素,而且耗氧率、氨氮排泄率也是反映大菱鲆生理狀況的重要指標[39]。這些生理指標受溫度、體重等的影響,國內外學者對成魚做了大量的工作[40],并且普遍認為溫度高低和耗氧率、氨氮排泄率成正比,這是變溫動物的特性[41]。實驗組2種規格大菱鲆耗氧率和排氨率的升高可以表明大菱鲆進入了應激反應狀態,其機體正在抵抗運輸脅迫帶來的損傷。并且隨水溫的升高,水體中的飽和溶解氧含量降低,魚體要獲得等量的氧氣其鰓部就要過濾更多的高溫水[42],即在高溫時魚用于呼吸的能量將增加。過高的密度會導致種魚類對空間競爭,運輸帶來的震動強度也會使魚類處于運動狀態,這些都是促使大菱鲆呼吸和代謝上升的原因。
3.3 模擬運輸實驗后大菱鲆的死亡率 在模擬運輸試驗后的0~48h內,大菱鲆出現了死亡現象。實驗結束后的大菱鲆死亡率隨著時間的增加先升高后降低,而大菱鲆在0h的死亡率極低,在0~24h里大菱鲆的死亡率達總死亡率的一半以上,之后在24~48h內的死亡率又開始下降。由此可見,運輸脅迫對大菱鲆的生理免疫方面造成了較大的損傷,這種損傷會在結束后的48h內表現出來,并且大部分為不可逆損傷,直至引發了魚體的死亡。
3.4 菱鲆幼體組和成體組的優選運輸方案 由正交實驗極差分析中綜合平衡法分析得出:幼體組大菱鲆的最優運輸方案為A1B1C2,即溫度為15℃、密度為40ind·L-1、震動強度為200RPM;成體組大菱鲆的最優運輸方案同樣為A1B1C2,即溫度為15℃、密度為40ind·L-1、震動強度為200RPM。雖然2種規格組在不同指標下的各因素的最優水平有差異,但根據分析方法分析得出的最優方案卻是一致的,這表明溫度、密度和震動強度3個因素對大菱鲆生理免疫方面的影響與這2種大菱鲆規格并沒有較大關聯性。此次正交實驗對CAT、AKP、GOT、GPT、SOD、MDA、LZM和總死亡率共8種指標進行分析,未對耗氧率、排氨率和各時間段的獨立死亡率進行分析,因為耗氧率和排氨率的變化不能單獨的作為分析魚體生理性能的參考,多種因素可以引起它們的變化,不能一概而論,需要具體分析,而各時間段的獨立死亡率由總死亡率代替,為了避免死亡率的重復分析,故而未對其進行分析。
綜上所述,運輸脅迫對大菱鲆的生理免疫方面造成了影響,隨著模擬運輸條件的加劇,2種規格的大菱鲆體內這7種非特異性免疫酶呈現出上升和下降,均反應其免疫水平存在不同程度的下降。根據實驗數據可以看出7種非特異性免疫酶在溫度變化帶來的損傷大于密度和震動強度變化帶來的損傷。2種規格的大菱鲆在運輸脅迫下表現出了不同的免疫能力,幼體組大菱鲆中的GOT、GPT、SOD、MDA的表現優于成體組的大菱鲆,成體組大菱鲆中的CAT、AKP、LZM和總死亡率的表現優于幼體組的大菱鲆。同時耗氧率和排氨率的升高也表明大菱鲆處于運輸脅迫的應激反應中。通過正交實驗分析,幼體組與成體組大菱鲆的最優運輸方案一致,均為A1B1C2,即溫度為15℃、密度為40ind·L-1、震動強度為200RPM。
本實驗通過對大菱鲆的生理免疫、呼吸排泄等方面受到運輸脅迫的影響進行了探究,探明了運輸條件中各因子對大菱鲆的影響程度,并且確定了2種規格大菱鲆短途運輸的最優方案。這為深入探究運輸脅迫對大菱鲆的影響提供了基礎數據,也為大菱鲆短途活魚運輸提供了參考依據。
參考文獻
[1]米紅波.活魚運輸箱內水質的控制及降低運輸脅迫的方法[A].中國食品科學技術學會.中國食品科學技術學會第十一屆年會論文摘要集[C].中國食品科學技術學會:中國食品科學技術學會,2014:2.
[2]管維良,劉天天,梁中永,等.活魚運輸的研究進展[J].輕工科技,2016,32(06):3-5.
[3]程守坤.鱖魚活體運輸技術基礎研究[D].上海:上海海洋大學,2015.
[4]ROBERTSON OH,HANE S,WEXLER BC,et al. THE EFFECT OF HYDROCORTISONE ON IMMATURE RAINBOW TROUT (SALMO GAIRDNERII)[J]. General and Comparative Endocrinology,1963,3(4):422-436.
[5]陳仙標.模擬運輸期間影響遮目魚卵成活率和孵化率的主要因素[J].漁業信息與戰略,1989(11):24-27.
[6]王文博,李愛華,汪建國,等.擁擠脅迫對草魚非特異性免疫功能的影響[J].水產學報,2004,28(2):139-144.
[7]張勇.空氣暴露及運輸脅迫對美洲鰣親魚生理生化指標及hsp70基因表達的影響[D].南京:南京農業大學,2016.
[8]孫鵬,柴學軍,尹飛,等.運輸脅迫下日本黃姑魚肝臟抗氧化系統的響應[J].海洋漁業,2014,36(5):469.
[9]Ruyet P L. Turbot (Scophthalmus maximus) grow out in Europe: practices,results and prospects[J]. Turkish Journal of Fisheries and Aquatic Sciences,2002,2:29-39.
[10]雷霽霖.鲆鰈類養殖新形勢和發展動向[J].科學養魚,2005(01):38-39.
[11]雷霽霖,門強.大菱鲆人工繁殖與養殖技術講座(Ⅱ)[J].齊魯漁業,2002(10):47-48.
[12]陳全震,曾江寧,高愛根,等.魚類熱忍耐溫度研究進展[J].水產學報,2004,28(5):562-567.
[13]徐冬冬,樓寶,詹煒,等. 高溫脅迫對褐牙鲆生長及肝臟抗氧化酶活性的影響[J].水產學報,2010,34(7):1099-1105.
[14]王美垚.急性低溫脅迫及恢復對吉富羅非魚血清生化、免疫以及應激蛋白HSP70基因表達的影響[D].南京:南京農業大學,2009.
[15]Cheng AC,Cheng SA,Chen YY,et al. Effects of temperature change on the innate cellular and humoral immune responses of orange-spotted grouper Epinephelus coioides and its susceptibility to Vibrio alginolyticus[J]. Fish and Shellfish Immunology,2009,26(5):768-772.
[16]Pickering A D,Pottinger T G. Stress responses and disease resistance in salmonid fish: Effects of chronic elevation of plasma cortisol.[J]. Fish Physiology & Biochemistry,1989,7(1-6):253-258.
[17]Lynne S. Procarione,Terence P. Barry,Jeffrey A. Malison. Effects of High Rearing Densities and Loading Rates on the Growth and Stress Responses of Juvenile Rainbow Trout[J]. North American Journal of Aquaculture,1999,61(2):91-96.
[18]陳欣然,牛翠娟,蒲麗君. 水產動物密度脅迫研究進展[J].中國水產科學,2007,14(s1):138-146.
[19]強俊,楊弘,何杰,等.3種品系尼羅羅非魚生長及高密度脅迫后生理響應變化的比較[J].中國水產科學,2014,21(01):142-152.
[20]Thomas P M ,Pankhurst N W ,Bremner H A . The effect of stress and exercise on post﹎ortem biochemistry of Atlantic salmon and rainbow trout[J]. Journal of Fish Biology,2005,54(6):1177-1196.
[21]Cataldi E ,Marco P D ,Mandich A ,et al. Serum parameters of Adriatic Sturgeon Acipenser naccarii (Pisces: Acipenseriformes): effects of temperature and stress[J]. Comparative Biochemistry and Physiology - Part A Molecular & Integrative Physiology,1998,121(4):351-354.
[22]Cláudia Maria Domingues Alvarenga,Volpato G L . Agonistic profile and metabolism in alevins of the Nile tilapia[J]. Physiology & Behavior,1995,57(1):75-80.
[23]Cláudia Maria Domingues Alvarenga,Volpato G L . Agonistic profile and metabolism in alevins of the Nile tilapia[J]. Physiology & Behavior,1995,57(1):75-80.
[24]Ishioka H.Live fish transportation,series of fisheries book[M].Tokyo:Kosesha Kosekaku,1982.
[25]Del Maestro R F. An approach to free radicals in medicine and biology.[J]. Acta Physiologica Scndinavica Supplementum,1980,492(492):153-68.
[26]榮志江.過氧化氫酶的電化學研究[D].太原:山西大學,2006.
[27]Chen Q X,Zhang W,Zheng W Z,et al. Kinetics of inhibition of alkaline phosphatase from green crab (Scylla serrata )by N-bromosuccinimide[J]. Journal of Protein Chemistry,1996,15(4):345-350.
[28]彭小玉,沈明浩.蒲公英水提物對鯽魚生長、魚體成分、消化酶和免疫系統的影響[J].中國畜牧獸醫,2010,37(5):13-17.
[29]孟曉林,冷向軍,李小勤,等.杜仲對草魚魚種生長和血清非特異性免疫指標的影響[J].上海海洋大學學報,2007,16(4):329-333.
[30]Mingchun Ren,Bo Liu,Habte-Michael Habte-Tsion,Xianping Ge,Jun Xie,Qunlan Zhou,Hualiang Liang,Zhenxin Zhao,Liangkun Pan. Dietary phenylalanine requirement and tyrosine replacement value for phenylalanine of juvenile blunt snout bream,Megalobrama amblycephala[J]. Aquaculture,2015,442.
[31]Qi-hui Yang,Bei-ping Tan,Xiao-hui Dong,Shu-yan Chi,Hong-yu Liu. Effects of different levels of Yucca schidigera extract on the growth and nonspecific immunity of Pacific white shrimp(Litopenaeus vannamei) and on culture water quality[J]. Aquaculture,2015,439.
[32]王香麗,麥康森,徐瑋,等.蛋氨酸對瓦氏黃顙魚幼魚肝臟及血漿中谷草轉氨酶和谷丙轉氨酶活力的影響[J].中國海洋大學學報:自然科學版,2015,46(9):49-53.
[33]N. ?ner,E. ?zcan Oru?,M. Canli,et al. Effects of Cypermethrin on Antioxidant Enzyme Activities and Lipid Peroxidation in Liver and Kidney of the Freshwater Fish,Oreochromis niloticus,and Cyprinus carpio,(L.)[J]. Bulletin of Environmental Contamination & Toxicology,2001,67(5):657-664.
[34]鄭永華,蒲富永.汞對鯉鯽魚組織轉氨酶活性的影響[J].西南農業大學學報,1997(01):43-47.
[35]Callewaert L,Michiels CW. Lysozymes in the animal kingdom.[J]. Journal of Biosciences,2010,35(1):127-160.
[36]顧軍,龔錦涵,殷岳保,等.高壓氧間斷暴露及氧驚厥對大鼠抗氧化酶活力及脂質過氧化物含量的影響[J].中華航海醫學雜志,1995(04):31-34.
[37]狄瑜,徐奕,李姍敏,等.捕捉脅迫對暗紋東方鲀肝臟非特異性免疫指標的影響[J].浙江海洋學院學報(自然科學版),2015,34(4):314-317.
[38]蘇鵬,潘金露,韓雨哲,等.殼寡糖對紅鰭東方鲀血液指標和非特異性免疫指標的影響[J].大連海洋大學學報,2016,31(1):37-43.
[39]劉鵬,宋協法,葛長字.溫度、體重和晝夜節律對大菱鲆幼魚代謝的影響[J].河北漁業,2009(05):1-4+27.
[40]朱松泉.中國條鰍志[M].南京:江蘇科學技術出版社,1989.
[41]林肇信,劉天齊,劉逸農.環境保護概論修訂版[M].北京:高等教育出版社,1983.
[42]成慶泰,鄭葆珊.中國魚類系統檢索(上,下)[M].北京:科學出版社,1987.
(責編:王慧晴)

