纖維蛋白為載體的BMP-4/7對骨質疏松性骨缺損愈合過程的影響
袁紹輝,博超剛,李洪濤,韓雪松
(哈爾濱醫科大學附屬第一醫院骨科,哈爾濱 150001)
進入更年期后的女性,隨著體內雌激素水平的逐漸下降,椎體會出現骨質疏松以及局部骨缺損,其嚴重影響更年期后女性的骨骼質量[1]。骨質疏松通常采用補鈣及其他一些保守治療方法,但治療效果往往不理想,并易引起病理性骨缺損,脊柱尤為顯著。近年來骨形態發生蛋白(bone morthogenetic protein,BMP)的出現引起了組織工程研究學者的廣泛關注。大量基礎實驗已證實BMP在骨缺損愈合過程中可以引起骨骼細胞發生與再生、加速骨骼纖維的交織與礦化[1-4]。其中,Ⅰ型骨膠原蛋白是骨缺損愈合過程中促進骨細胞分化和增強成骨細胞黏附能力的主要因素[5-7]。同時,纖維蛋白是一種良好的蛋白附著載體,可以攜載多種BMP同源異構體,因此可作為理想的藥物緩釋載體,促進骨缺損愈合[8-10]。
目前以纖維蛋白為載體的BMP-4/7對骨質疏松性椎體骨缺損愈合的相關報道較少見。本研究通過觀察以纖維蛋白為載體的BMP-4/7對大鼠骨質疏松性椎體骨缺損愈合過程中Ⅰ型骨膠原蛋白含量及局部生物力學強度的變化,探討以纖維蛋白為載體的BMP4/7對骨質疏松性椎體骨缺損愈合的作用。
1 材料與方法
1.1材料 實驗動物:選擇雌性Sprague-Dawley(SD)大鼠84只,8個月齡,體重180~200 g,由哈爾濱醫科大學附屬第一醫院實驗動物中心提供,為無特定病原體動物,醫學實驗動物管理委員會合格證號:13-067。實驗對動物的處理方法符合《關于善待實驗動物的指導性意見》(中華人民共和國科學技術部)。
主要儀器及試劑:Fax itron樣本放射系統(美國Itron公司);AG-I生物力學測量系統(日本島津公司);DPX2L型雙能X線骨密度儀(美國Lunar公司);WDW-10KN型計算機電子萬能力學試驗系統(日本松下公司);X-TIRE361T光譜微孔板光密度儀(美國Bio-Rad公司);Fax itron樣本放射系統(美國Faxitron公司);Bradford試劑盒、G250染色液、二喹啉甲酸標準蛋白(美國Invitrogen公司);鼠抗人Ⅰ型膠原單克隆一抗(美國Invitrogen公司);兔抗鼠二抗IgG(美國Santa Cruz公司)。
1.2實驗方法
1.2.1實驗分組 84只大鼠依據隨機數字法分為4組,每組21只。A組:骨質疏松性骨缺損+(BMP-4/7 24 μg+纖維蛋白20 mg);B組:骨質疏松性骨缺損+胎牛血清;C組:正常骨質骨缺損+(BMP-4/7 24 μg+纖維蛋白20 mg);D組:正常骨質骨缺損+胎牛血清。
1.2.2骨缺損模型的建立 麻醉采用腹腔注射麻醉(氯氨酮0.1 g/kg)。A組、B組大鼠切除雙側卵巢,C組、D組切除少量腹部脂肪組織。所有大鼠于術后3個月在麻醉下建立骨缺損模型。大鼠取側臥位,消毒后逐步顯露橫突韌帶、坐骨神經,保護神經,充分顯露椎體,于L5椎體側面中心行開窗術,面積為1.5 mm×3.0 mm,深度約為椎體松質骨直徑,刮除術區內所有松質骨,A組和C組注入BMP-4/7(前期工作構建)[6]和纖維蛋白混合物;B組和D組注入等量胎牛血清(購于哈爾濱宏博生物技術有限公司),封閉骨窗,逐層縫合。嚴格無菌環境下進行所有手術,術后飼養于完全清潔級環境中(哈爾濱醫科大學附屬第一醫院實驗動物中心清潔級動物室)。全部實驗大鼠于術后當日立即行放射系統拍攝,判斷骨缺損模型建立情況。
1.2.3免疫印跡法在蛋白水平檢測Ⅰ型骨膠原蛋白 制備蛋白:各組動物分別于骨缺損建模后第1、2、4、5、8、12周各處死3只大鼠[8]。將L5骨缺損標本常規脫鈣7 d(置于200 g/L的乙二胺四乙酸中4 ℃下脫鈣)。組織裂解法[11]:利用蛋白酶,溶菌酶或細胞壁分解酶在一定條件下作用于生物標本,而使細胞膜或細胞壁破碎,釋放胞內蛋白質;利用蛋白質-染料結合的原理,定量測定微量蛋白質濃度。二喹啉甲酸標準蛋白濃度已稀釋至500 μg/mL,-20 ℃保存[9]。
免疫印跡法分析骨痂中Ⅰ型膠原蛋白水平:機械碎裂法裂解標本,準備好硝酸纖維素膜(nitrocellulose filter membrane,NC膜),在半干電轉緩沖液中浸泡15 min。按雙層濾紙→分離膠→NC膜→雙層濾紙的順序疊放,用濕玻棒輕輕滾過,凝膠靠近負極,而NC膜靠近正極。設定電流100 mA,轉移約35 min,轉移完畢,蒸餾水沖洗,將NC膜放放已盛有TBST(TBS+0.05%的吐溫)的培養皿中在搖床約 4 min。在培養皿中加入體積為10~15 mL的含5%的脫脂奶粉的TBST,放入NC膜,室溫下搖動封閉30 min以上,用膠膜蓋好培養皿,置膠膜蓋好培養皿,置冰箱中過夜,上一抗(Ⅰ型膠原一抗為鼠抗人Ⅰ型膠原單克隆抗體,稀釋度為1∶1 500)(10 μL IgG加TBST 15 mL):將NC膜TBST洗滌搖洗3次,每次5 min。室溫在搖床上雜交2 h。洗滌,上二抗[兔抗鼠二抗(IgG),稀釋度為1∶2 000](10 μL IgG加TBST 20 mL)雜交1 h。用TBST洗滌NC膜4次,每次10 min,將配好的發光液化學發光試劑 1 mL 滴到NC膜上,并確保發光液均勻布在膜上,反應3~5 min。曝光4 min,顯影8 s,定影,晾干,記錄,保存實驗結果。將X線膠片置于Gel Doc2000圖像分析系統。測定目的條帶的平均吸光度值,每個組進行5次重復實驗,取平均值作為Ⅰ型膠原蛋白含量的相對值。
1.2.4骨痂組織的骨密度測定 于骨缺損建模后第4、8、12、16周每組各處死3只大鼠,嚴格無菌消毒。充分暴露腰椎,取出腰椎標本,以腰椎骨骼結痂為中心,進行掃描(DPX2L 型雙能X線骨密度儀)。將標本繼續封閉保存于冷凍冰箱內(-20 ℃),進一步進行力學實驗測定。
1.2.5力學性能測試 于骨缺損建模后第4、8、12、16周每組各處死3只大鼠,嚴格無菌消毒。充分暴露腰椎,取出椎體,保護椎體及其外殼皮質,剔除周邊脂肪組織及筋膜,磨平椎體表面,制成柱形標本,使其接力面積約為9 mm2(長、寬、高分別為 5 mm、3 mm、2 mm),進行椎體緊壓測試,以2 mm/min速度進行緊壓。記錄生物力學相關指標,包括最大負載荷量、最大應變量和彈性模量。
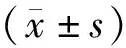
2 結 果
2.1實驗入組情況 84只大鼠中,6只因感染和過度進食而死亡未進入實驗分析,其余78只均進入結果分析。并于實驗結束后,補充相應組別的實驗鼠進行對應相同處理,獲取相應的實驗數據。實驗大鼠姿勢、步態、精神、食欲正常、營養良好、被毛光澤、體溫、呼吸、反射、二便未見明顯異常。
2.2Ⅰ型骨膠原蛋白含量變化 A組和C組Ⅰ型骨膠原蛋白含量于第2周開始逐漸升高,在第4周時達峰值,之后維持較高水平;B組和D組在第2周即達到峰值,4周后Ⅰ型骨膠原蛋白含量逐漸下降,呈現時間依賴性。在第1周時,A組和B組、C組和D組間比較差異無統計學意義(P>0.05),C組和D組Ⅰ型骨膠原蛋白含量均低于A組和B組(P<0.05);在第2周時,A組和C組比較差異無統計學意義(P>0.05),B組和D組比較差異無統計學意義(P>0.05),但B組和D組均顯著高于A組,C組低于B組,D組高于C組(P<0.05);在4、5、8、12周時,B組和D組低于A組,C組均高于B組,D組低于C組(P<0.05),A組與C組比較差異無統計學意義(P>0.05),D組高于B組(P<0.05)。見圖1、表1。
2.3骨痂組織的骨密度變化 4組骨密度值均在第8組時達到高峰,8周后骨密度值隨著時間延長逐漸下降,呈時間依賴性。在第4周時,B組和C組骨密度值低于A組(P<0.05),D組均高于B組和C組(P<0.05),B組與C組比較差異無統計學意義(P>0.05),D組低于A組(P<0.05);第8周、12周、16周時,B組和D組低于A組,C組高于B組,D組低于C組(P<0.05),A組與C組比較差異無統計學意義(P>0.05),D組高于B組(P<0.05)。見表2。
Mr:分子量;A組:骨質疏松性骨缺損+(BMP-4/7 24 μg+纖維蛋白20 mg);B組:骨質疏松性骨缺損+胎牛血清;C組:正常骨質骨缺損+(BMP-4/7 24 μg +纖維蛋白20 mg);D組:正常骨質骨缺損+胎牛血清
圖1 Ⅰ型膠原蛋白的含量
2.4檢測骨缺損椎體生物力學性狀 第4周時,最大載荷量:B組和D組低于A組,C組高于B組,D組低于C組(P<0.05),A組與C組比較差異無統計學意義(P>0.05),D組高于B組(P<0.05);最大應變力:D組大于A組、B組、C組(P<0.05),C組均高于B組,B組低于A組,A組和C組比較差異無統計學意義(P>0.05);彈性模量:C組高于A組、B組,D組低于C組(P<0.05),A組、B組、D組間比較差異無統計學意義(P>0.05)。第8周、12周、16周時,最大載荷量、最大應變力、彈性模量:B組和D組低于A組,C組均高于B組,D組低于C組(P<0.05),A組與C組間比較差異無統計學意義(P>0.05),D組高于B組(P<0.05)。見表3。
2.5骨痂組織中Ⅰ型骨膠原蛋白含量與骨痂組織生物力學指標關聯性分析 A組Ⅰ型骨膠原蛋白含量與最大載荷量、最大應變量、彈性模量呈正相關(r=0.684,P=0.004;r=0.715,P=0.005;r=0.869,P=0.009;B組Ⅰ型骨膠原蛋白含量與最大負載荷量、最大應變量、彈性模量呈正相關(r=0.613,P=0.021;r=0.752,P=0.032;r=0.674,P=0.029);C組Ⅰ型骨膠原蛋白含量與最大載荷、最大應變量、彈性模量呈正相關(r=0.592,P=0.005;r=0.727,P=0.008;r=0.806,P=0.006);D組Ⅰ型骨膠原蛋白含量與最大載荷、最大應變量、彈性模量呈正相關(r=0.684,P=0.004;r=0.882,P=0.007;r=0.712,P=0.003)。

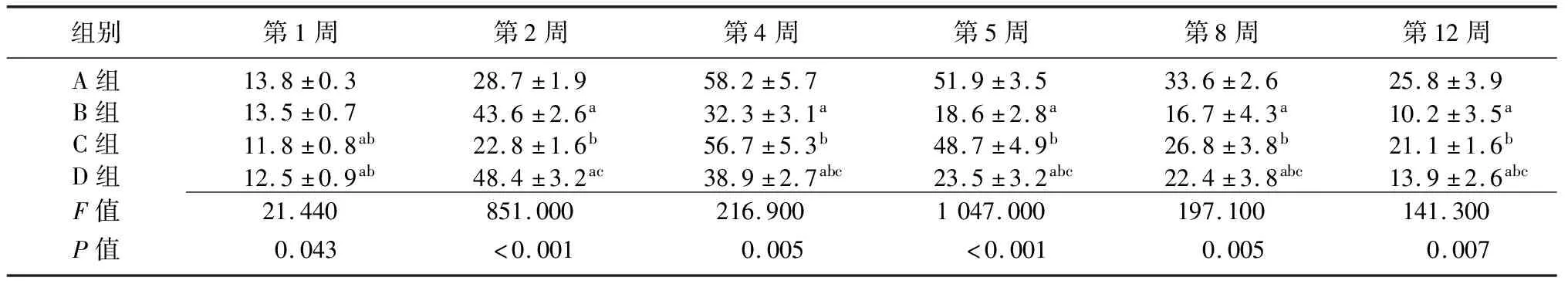
組別第1周第2周第4周第5周第8周第12周A組13.8±0.328.7±1.958.2±5.751.9±3.533.6±2.625.8±3.9B組13.5±0.743.6±2.6a32.3±3.1a18.6±2.8a16.7±4.3a10.2±3.5aC組11.8±0.8ab22.8±1.6b56.7±5.3b48.7±4.9b26.8±3.8b21.1±1.6bD組12.5±0.9ab48.4±3.2ac38.9±2.7abc23.5±3.2abc22.4±3.8abc13.9±2.6abcF值21.440851.000216.9001047.000197.100141.300P值0.043<0.0010.005<0.0010.0050.007
A組:骨質疏松性骨缺損+(BMP-4/7 24 μg+纖維蛋白20 mg);B組:骨質疏松性骨缺損+胎牛血清;C組:正常骨質骨缺損+(BMP-4/7 24 μg+纖維蛋白20 mg);D組:正常骨質骨缺損+胎牛血清;a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05
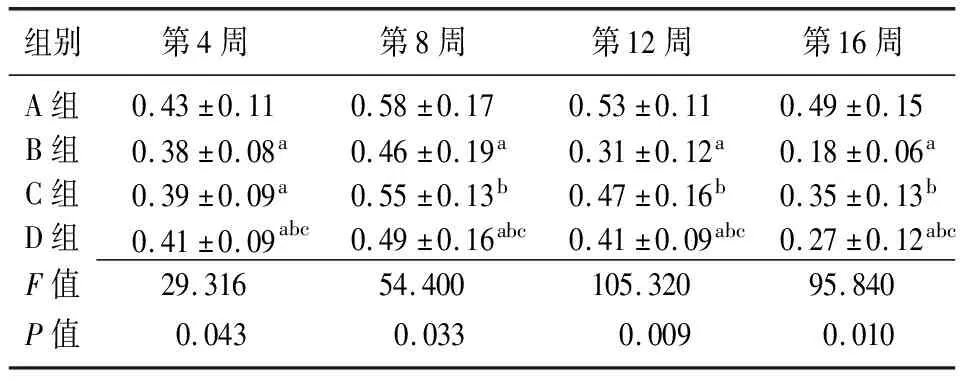
組別第4周第8周第12周第16周A組0.43±0.110.58±0.170.53±0.110.49±0.15B組0.38±0.08a0.46±0.19a0.31±0.12a0.18±0.06aC組0.39±0.09a0.55±0.13b0.47±0.16b0.35±0.13bD組0.41±0.09abc0.49±0.16abc0.41±0.09abc0.27±0.12abcF值29.31654.400105.32095.840P值0.0430.0330.0090.010
A組:骨質疏松性骨缺損+(BMP-4/7 24 μg+纖維蛋白 20 mg);B組:骨質疏松性骨缺損+胎牛血清;C組:正常骨質骨缺損+(BMP-4/7 24 μg +纖維蛋白20 mg);D組:正常骨質骨缺損+胎牛血清;a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05
3 討 論
隨著我國人口的老齡化,在臨床上由骨質疏松引起的椎體病理性骨缺損越來越常見[11]。但目前除手術治療外,尚無其他明確而有效的治療措施。故尋找有效減緩骨質疏松進程,早期預防和根本治療骨質疏松性骨缺損的方法迫在眉睫。研究證實,BMP可以促進骨膜細胞向成骨細胞的分化,骨骼形成[12]。同時,有學者發現[13],纖維粘連蛋白(fibronectin,FN)對體外培養骨纖維細胞的胞外基質的表達具有明確的調節傾向,參與骨細胞分化,在維持組織形態和調節細胞的黏附性、生長及分化、增殖周期、基因表達中有重要作用。同時FN也是一種重要的連接元素,可有效促進骨細胞與材料之間的黏合。
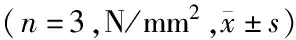
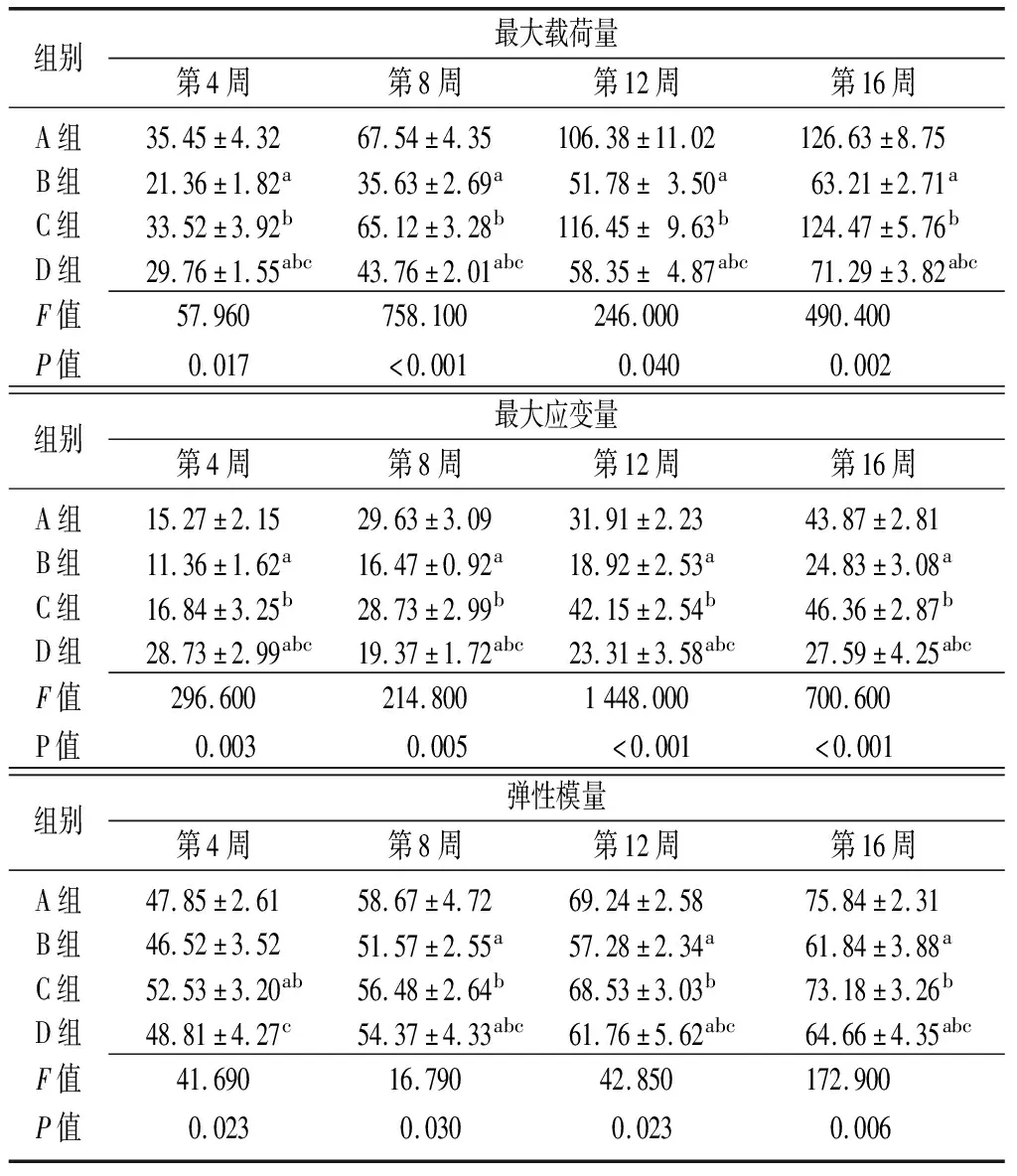
組別最大載荷量第4周第8周第12周第16周A組35.45±4.3267.54±4.35106.38±11.02126.63±8.75B組21.36±1.82a35.63±2.69a51.78±3.50a63.21±2.71aC組33.52±3.92b65.12±3.28b116.45±9.63b124.47±5.76bD組29.76±1.55abc43.76±2.01abc58.35±4.87abc71.29±3.82abcF值57.960758.100246.000490.400P值0.017<0.0010.0400.002組別最大應變量第4周第8周第12周第16周A組15.27±2.1529.63±3.0931.91±2.2343.87±2.81B組11.36±1.62a16.47±0.92a18.92±2.53a24.83±3.08aC組16.84±3.25b28.73±2.99b42.15±2.54b46.36±2.87bD組28.73±2.99abc19.37±1.72abc23.31±3.58abc27.59±4.25abcF值296.600214.8001448.000700.600P值0.0030.005<0.001<0.001組別彈性模量第4周第8周第12周第16周A組47.85±2.6158.67±4.7269.24±2.5875.84±2.31B組46.52±3.5251.57±2.55a57.28±2.34a61.84±3.88aC組52.53±3.20ab56.48±2.64b68.53±3.03b73.18±3.26bD組48.81±4.27c54.37±4.33abc61.76±5.62abc64.66±4.35abcF值41.69016.79042.850172.900P值0.0230.0300.0230.006
A組:骨質疏松性骨缺損+(BMP-4/7 24 μg+纖維蛋白 20 mg);B組:骨質疏松性骨缺損+胎牛血清;C組:正常骨質骨缺損+(BMP-4/7 24 μg +纖維蛋白20 mg);D組:正常骨質骨缺損+胎牛血清;a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05
本研究結果顯示,A組與C組Ⅰ型骨膠原蛋白含量趨勢基本相同,B組和D組Ⅰ型骨膠原蛋白含量均明顯低于A組和C組,并于第4周即開始下降。提示FN可作為BMP-4/7的良好黏附和緩釋載體,可維持較長時間的BMP水平,使BMP-4/7更好地發揮成骨效應[14]。同時,通過纖維蛋白為載體,BMP可在骨質疏松環境下充分發揮促進骨愈合的功能。本研究D組略高于B組,也符合骨質疏松影響病理性骨缺損的愈合力能力的理論。
有研究報道,Ⅰ型骨膠原蛋白的合成峰過早和提前衰落可刺激機體破骨細胞的功能亢進,促進由成骨細胞引發的破骨細胞前體分化與融合,誘導破骨細胞凋亡,抑制成骨作用[15]。因BMP-4/7與FN復合物在骨質疏松性骨缺損愈合過程中可長時有效維持骨吸收和骨形成的動態平衡,因此具有更好的成骨功效,本實驗結果也驗證了這一點[16]。本研究結果顯示,A組骨密度在各時點間與C組比較其峰值和下降幅度未出現明顯差異,而B組骨密度值明顯下降,在傷后16周時最低。說明BMP4/7與FN復合物可有效改善骨質疏松性骨缺損骨密度狀態。這與文獻中報道的BMP可抑制骨缺損骨纖維骨小梁間隙的增大,增加骨量,促進骨形成的原理相一致[17-18]。
本研究中,A組最大載荷、最大應變量、彈性模量較同時期(8、12、16周)和C組等同,B組和D組顯著低于A組。表明BMP4/7與FN復合物可明顯改善小鼠局部骨痂生物學性能。骨質疏松性椎體骨骨小梁厚度及連續性增加,骨缺損愈合質量明顯提高,致骨缺損區張力增強,椎體的力學性能增加,骨小梁抗載荷能力提高,不易骨折,可明確改善骨質疏松性骨缺損愈合的骨強度和骨痂形狀,抗張力明顯增強[19]。本研究加入BMP-4/7與FN復合物后,Ⅰ型膠原蛋白的含量與骨痂組織的最大載荷、最大應變量、彈性模量均呈高度直線相關,其相關性明顯高于未加入BMP-4/7與FN復合物組。提示融合基因BMP-4/7可以通過纖維蛋白作為有效載體,在一定程度上逆轉Ⅰ型膠原在骨質疏松性骨缺損骨愈合過程骨礦化能力的下降,并提供良好的生物支架,減少BMP基因蛋白的丟失。這可能與纖維蛋白能夠充分作用于骨缺損的愈合骨痂表面,而加速鈣鹽等無機質的沉積,增加骨缺損愈合的骨痂的抗張力、提升骨缺損愈合質量等性能相關[20]。
綜上所述,以纖維蛋白為載體的BMP-4/7對大鼠椎體骨質疏松性骨缺損愈合過程具有較強的促進骨愈合作用。

