守恒法在高中化學解題中的應用分析
古幼先
(浙江省臺州市三門中學 317100)
化學作為高中階段重要的教學內容,化學知識的有效學習通常對學生邏輯分析以及科學思考的能力提升有著重要作用.同時,化學學科不僅是現實生活中運用較廣泛的一門學科,而且在理科生高考中也占據著很大的比重,由此可知,化學知識對學生的學習及生活都有著重要意義.新課改下,高中化學的教學不僅要求提升學生應用化學知識的能力,而且還要求深化學生對化學過程的有效理解,而對化學過程進行理解必備的就是學習守恒定律.化學守恒法主要就是指把守恒定律有效地運用于化學解題中,其不僅能夠深化學生對守恒定律的有效理解與學習,而且還能使學生的解題速率得到有效提高.
一、化學守恒法概述
自然界中的物質變化形式通常是豐富多樣的,但是都遵循著一定的守恒定律.所謂的化學守恒法,主要是根據相關的自然規律,依據化學物質出現化學反應元素的總體質量與基本類型不變的原則對有關化學問題進行處理.高中階段的化學解題中,通過化學守恒法的運用,通常可以使解題的速度及其正確性得到有效提高.基于此,學生在具體學習中,需充分掌握守恒法的相關知識,并對學生的發散思維進行培養,充分理解化學發生反應的全過程及反應中的守恒關系,從而對相關化學問題進行精準的解答.對于高中化學而言,其教材內容中通常會設計不同的化學反應,學生需根據化學題目的特點進行分析與理解,并通過合理運用守恒法,確保化學問題的正確、高效解決.當前,高中階段較為常見的守恒法有電荷守恒法、質量守恒法、原子守恒法等等,對于各種類型化學反應的計算與分析,都能夠通過這些方法進行有效解決.
二、守恒法在高中化學解題中的應用
1.原子守恒法
所謂的原子守恒法,其主要是根據化學反應過程前后的原子種類與個數均不變的原理,通過計算或者推導的方法.該方法運用于化學解題中,通常不需要進行運用化學方程式,只要確定反應的起始以及終點反應時的離子關系,也就是通過相應的守恒關系,對化學試題進行計算,并獲得結果.
例1一定溫度下,1 L的密封容器當中加入1 mol N2與3 mol H2,促使化學反應實現平衡,檢測可得平衡混合物當中的N2H2NH3的物質量分別是M、N、Q,如果溫度持續不變,只是對初始的物質量進行改變,而M、N、Q保持不變,N2、H2、NH3的具體加入量通過x、y、z進行表示,需滿足的條件為:
(1)如果x=0,且y=0,那么z=____.
(2)如果x=0.75 mol,那么y=____,z=____.
(3)x、y、z需滿足的條件為____.
該題目解決的常用思路為等效平衡.如果通過原子守恒進行解決該問題,其就會變得更加簡單,且更易解決.容器內部增加的物質需包含2 mol N原子以及6 mol H原子.即(1)如果x=0,且y=0,那么z=2 mol;(2)如果x=0.75 mol,根據N原子守恒可知,z=2 mol-0.75 mol×2=0.5 mol;根據H原子守恒可知,y=(6 mol-3×0.5 mol)/2=2.25 mol;(3)根據N原子守恒可知,2x+z=2;根據H原子守恒可知2x+3z=6.
2.質量守恒法
所謂的質量守恒,其基本的原理就是物質在出現化學反應前后,各化學物質的總質量持續不變.通過質量守恒對化學反應過程中相關化學物質的關系進行計算與推算,通常可以高效、準確的解讀各類型的化學問題.

該類型的化學題作為高中化學具體學習中較長出現的題型,其主要是對質量守恒法應用的靈活性進行考察,經過分析顯示,C2H8N2在產生化學反應的前后時,原子個數需確保一致,產生化學反應之后,式子中一共有氧原子、氫原子分別為8個,以及氮原子6個,碳原子2個,經過質量守恒法的運用,可知2X當中有氮原子4個與氧原子8個,即X化學式為N2O4.
3.電子守恒法

4.電荷守恒法
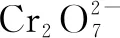
綜上所述,守恒法作為高中階段化學學習中的重點內容,在高中化學的解題過程中,通過守恒法的應用,通常可以使復雜且難度大的化學問題解答變得更加的快速化與簡單化,不僅可以節省解題的時間,而且對化學知識的學習也有著重要作用.守恒法具體運用于化學解題中,首先需對化學題目中隱藏的條件進行尋找,并將其與守恒法相結合實施解題,從而使化學解題的正確性及解題效率得到有效提高.

