明膠復合羥基磷灰石支架材料促進大鼠骨髓干細胞增殖與分化
郭雨晴,張 菁,李 頌
骨缺損是常見的臨床問題或某些疾病的并發癥,是指破壞骨的結構完整性。臨床上修復骨缺損的方法有骨移植、骨組織工程等。骨組織工程是指將具有成骨能力的種子細胞接種在具有骨傳導能力的支架材料上,經體外培養使細胞與支架材料融合,再植入人體缺損組織部位,最終達到修復或替代缺損組織的目的。
明膠是膠原蛋白的水解產物,由于其良好的生物相容性和不存在免疫原反應等特點,有望成為支架材料的理想選擇[1]。但是明膠力學性能差,生物降解性過快,單純明膠材料缺乏足夠的生物活性來刺激骨形成能力[2],因此單獨使用難以滿足組織構建的要求。羥基磷灰石(hydroxyapatite,HA)是動物及人體骨骼的主要無機成分,HA植入后能與骨組織形成很強的化學結合,是目前公認的最理想的人工骨的硬組織替代材料[3]。從仿生學的角度看,HA與明膠復合不但可以提高生物相容性,而且從成分和結構上能更好地模擬天然骨,所以明膠/HA復合物有望成為新型骨組織工程支架材料。該研究擬利用自然沉淀法將HA和明膠制備成與天然骨組織成分相似的仿生多孔支架材料,并探討其對大鼠骨髓間充質干細胞增殖分化的影響,旨在為其在骨缺損修復領域中的臨床應用提供實驗依據。
1 材料與方法
1.1 材料
1.1.1實驗動物 SPF級雄性SD大鼠,4周齡,購自安徽醫科大學實驗動物中心,動物許可證號:scxk (皖) 2017-001。
1.1.2主要試劑和儀器 無水氯化鈣粉末、氟化鈉粉末和無水磷酸氫二鈉粉末均為上海國藥集團化學試劑有限公司產品;明膠是上海晶純實業有限公司產品;冷凍干燥機系美國Labconco公司產品;掃描電鏡(Sirion200)系荷蘭FEI公司產品;X射線衍射儀(X'Pert PRO)系荷蘭飛利浦公司;CCK-8試劑為日本同仁公司產品;堿性磷酸酶試劑盒系南京建成生物工程研究所產品;酶標儀(MQX200)為美國Bio-tek公司生產。
1.2 方法
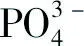
1.2.2掃描電鏡(scanning electron microscope,SEM)觀察表面結構及微形貌 將冷凍干燥后的四組支架材料修整成小塊,用導電膠粘于圓形金屬板上,噴金鍍膜后用Sirion200環境掃描電子顯微鏡觀察四組支架材料的微形貌、孔徑大小等結構。
1.2.3支架材料的X射線衍射(X-ray diffraction,XRD) 將冷凍干燥后的復合材料碾碎成粉末狀,在X射線衍射儀(荷蘭X'Pert PRO)上分析粉末狀支架。繪制出HA的2θ值以及強度,以確定復合支架材料中HA的存在。
1.2.4支架材料孔隙率的測定 用改良的液體位移法進行材料孔隙率的測定。將同等大小不同配比的支架分別放入含有20 ml無水乙醇的量筒內, 記放入前體積為V1, 支架浸泡1 d后, 待空氣溢出記體積為V2, 取出樣品后剩余乙醇體積記為V3, 每組測定3個樣品, 取平均值。最后計算材料孔隙率[4]:P=(V1-V3) / (V2-V3) ×100%。
1.2.5支架材料降解率的測定 將四組支架材料修整成厚度約2 mm,直徑約8 mm的大小,放置于15 ml的離心管中,分析了支架的降解情況。記錄每個支架材料的初始干重W0,注入15 ml PBS,放置在37 ℃環境中。每周用新鮮的PBS溶液代替之前的PBS。在第1、7、14、28、42天這5個時間點,小心地將支架材料轉移到一個24孔板中,用去離子水振蕩沖洗5次。然后將支架材料轉移到無菌棉紗上5 min以吸盡多余的去離子水,最后冷凍干燥48 h。將支架材料完全干燥后,記錄各時間點的干重W1,并與相應支架材料的初始重量進行除法,計算體外相對失重率:P=(W0-W1)/W0(n=4)。
1.2.6SD大鼠的骨髓間充質干細胞的原代培養和傳代 取4周齡SD雄性大鼠,脫頸處死,用75%酒精浸泡15 min,在超凈臺中剔除軟組織,暴露股骨和脛骨,露出骨骺端,用含10%胎牛血清的DMEM培養液沖出骨髓,充分混勻,將原代細胞置于37 ℃、5% CO2及飽和濕度孵箱內培養,接種72 h后首次換液去除未貼壁細胞。當原代細胞匯合90%后,用0.25%胰蛋白酶消化傳代。
1.2.7材料浸提液的制備及細胞死活染實驗檢測 將消毒滅菌處理過的四組支架材料明膠/HA復合材料,按質量/浸提介質=1 g/10 ml的比例加入含10%胎牛血清的DMEM培養液浸泡,置于37 ℃環境下72 h,離心,過濾,即得材料浸提液,于4 ℃保存備用。取生長狀態良好的第2代鼠骨髓間充質干細胞,按每孔2×105個細胞接種到6孔板中的細胞爬片上,每孔接種細胞懸液2 ml。在37 ℃、5% CO2及飽和濕度環境下培養24 h。細胞貼壁24 h后,吸去上清液,加入浸提液2 ml,陰性對照為含明膠浸提液的DMEM培養液、普通DMEM培養液,于37 ℃、5% CO2飽和濕度環境下培養。在培養第1、3、5天時,吸棄培養液,加入吖啶橙/碘化丙啶混合染色液1 ml,于37 ℃、5% CO2及飽和濕度環境下繼續孵育30 min,在熒光顯微鏡下觀察細胞的死活情況。
1.2.8細胞增殖實驗檢測 取生長狀態良好的第2代鼠骨髓間充質干細胞, 按每孔5×103個細胞接種到96孔板中,每孔接種細胞懸液150 μl。在37 ℃、5% CO2及飽和濕度環境下培養24 h。細胞貼壁24 h后,吸去上清液,加入浸提液100 μl,陰性對照為含明膠浸提液的DMEM培養液,每組同時設5個平行孔,于37 ℃、5% CO2飽和濕度環境下培養。在培養第1、3、5、7天時,每孔加入CCK-8溶液10 μl,于37 ℃、5% CO2及飽和濕度環境下繼續孵育1 h,在酶標儀450 nm波長下測定各孔吸光度值。
1.2.9細胞與材料的共培養 將消毒滅菌后的材料置入24孔培養板中,加入含10%胎牛血清的DMEM培養基,置于37 ℃、5% CO2及飽和濕度環境下浸泡3 d后吸去大部分培養基,待材料表面微干后準備接種細胞。取生長狀態良好的第2代鼠骨髓間充質干細胞,以2×105/20 μl個細胞高濃度的接種到支架材料上,于37 ℃、5% CO2及飽和濕度環境下孵育30 min后,加入適量的培養液,每2 d換液1次。細胞接種第2、5天后各取1片材料,用2.5%戊二醛固定24 h,PBS沖洗3次,乙醇梯度脫水后用臨界點干燥,將干燥后的復合材料修整成小塊,粘于小圓形金屬板上,離子濺射儀噴金鍍膜后用Sirion200環境掃描電鏡觀察細胞在材料上的黏附及伸展情況。
按上述方法接種細胞,分別于細胞接種后第1、3、5、7天吸去孔內培養液,PBS洗3次,然后加入1% Triton X-100 0.5 ml,置于4 ℃冰箱30~40 min,按照堿性磷酸酶檢測試劑盒操作說明,檢測堿性磷酸酶活性。

圖1 明膠、1HA、2HA、3HA組掃描電鏡下的微形貌A、B:明膠組的表面和截面形狀 ×100;C:可見1HA材料截面的孔洞壁上沉積著大小不一的HA晶體 ×974;D~F:明膠/HA組表面沉積不同顆粒級別的HA晶體 ×20 000
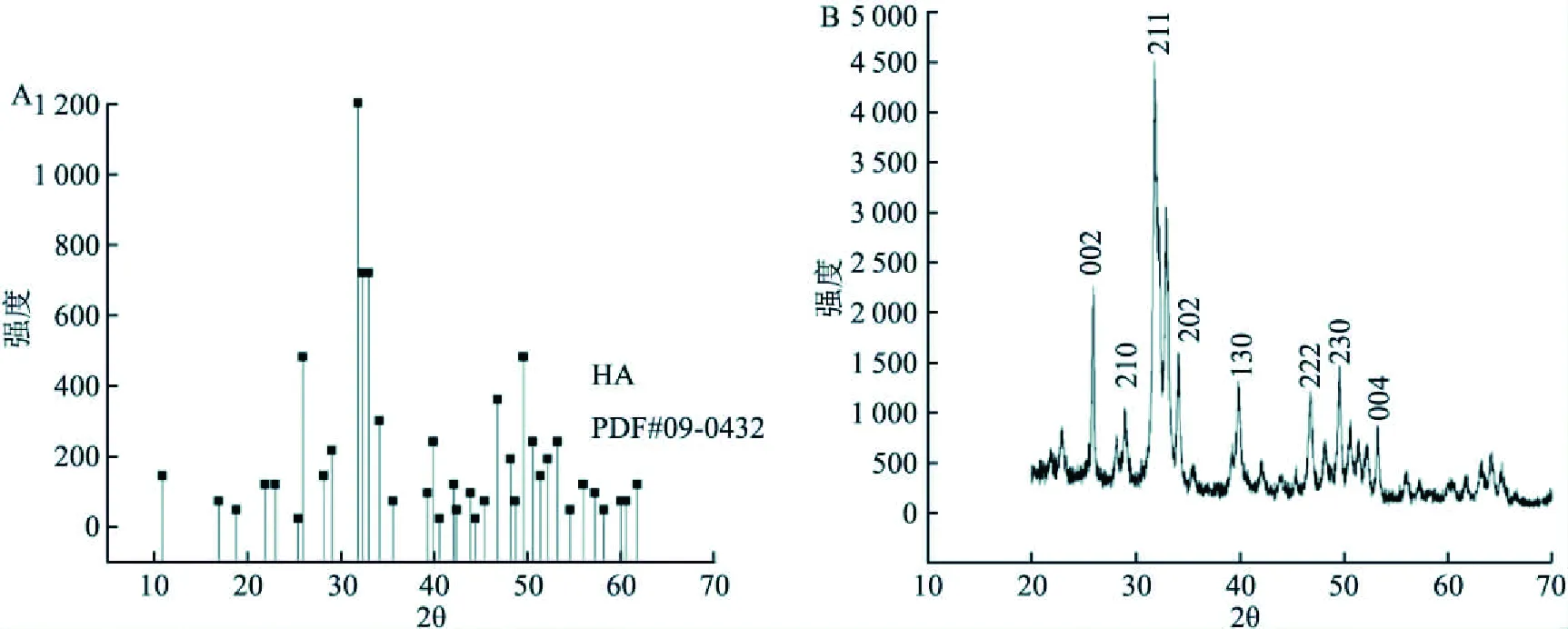
圖2 樣品的XRD圖譜A:羥基磷灰石的標準XRD圖譜; B:支架材料的XRD圖譜
2 結果
2.1 支架材料的電鏡觀察明膠支架材料明膠組表面光滑(圖1A),其截面呈三維多孔狀,孔洞豐富,孔徑200~400 μm(圖1B)。在低倍鏡下,可見1HA截面的孔洞壁上沉積著大小不一的類似HA的晶體顆粒(圖1C)。明膠/HA支架材料三組復合材料組表面沉積的晶體顆粒數量,隨著礦化循環次數的增加而增多,其形態類似于HA的晶體顆粒(圖1D、E、F)。
2.2 支架材料的X射線衍射在圖2B中,支架材料在2θ為25.94°、28.92°、31.8°、34.08°、39.84°、46.76°、49.54°、53.26°處出現強度不同的衍射峰,與圖2A羥基磷灰石的XRD標準卡片對比,分別歸屬于羥基磷灰石晶體的(002)、(210)、(211)、(202)、(130)、(222)、(230)、(004)面,可以推定出復合支架材料上沉積的晶體顆粒為羥基磷灰石晶體。
2.3 支架材料孔隙率的測定與合成的明膠組(74.23±0.019)孔隙率對比,1HA、2HA、3HA孔隙率分別為(71.11±0.077)%、(42.06±0.084)%、(37.62±0.157)%、(26.67±0.012)%,隨著離子共沉淀次數增加,材料的孔隙率逐漸降低,差異有統計學意義(F=10.966,P<0.05)。
2.4 支架材料的體外降解檢測四組支架材料的質量隨時間的延長均逐漸降低,前期階段,失重率較大是由于明膠材料的降解,后期主要的羥基磷灰石的降解,雖然降解速率減慢,但仍可降解。在第42天后,應用SPSS 17.0軟件對四組支架材料的重量減少率進行χ2檢驗,兩兩比較,在0.05水平下,6周后四組支架材料降解率的差異有統計學意義(P<0.05),見圖3。由圖可知,復合材料中明膠的含量不同,其降解速率也不同。
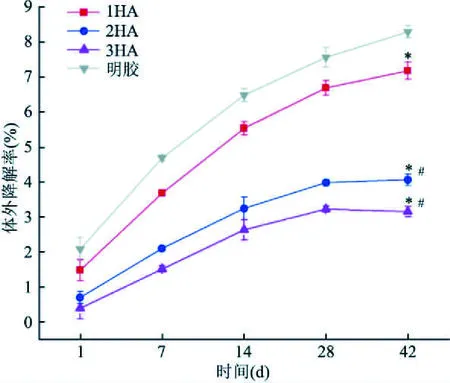
圖3 四組循環支架材料的體外降解實驗與明膠組比較:*P<0.05;與1HA組比較:#P<0.05
2.5 細胞在材料上的黏附、伸展情況細胞接種后第2天,在復合支架材料上細胞呈梭形或多角形;細胞接種后第5天,與2HA、3HA和明膠支架材料對比,1HA支架材料上的細胞數量較多,細胞形態良好,聚集成片,呈多角形或三角形(圖4)。
2.6 細胞的死活染色采用AO/PI染色劑檢測在浸提液中培養細胞的死活染實驗結果顯示:隨著培養時間的延長,在第1、3、5天這3個時間點,1HA和明膠組的活細胞數量均多于2HA、3HA組,與第1、3天明膠組比較,1HA組的活細胞數量略少,在第5天,1HA組的活細胞數量略多于明膠組,見圖5。
2.7 細胞在材料上的增殖情況CCK-8法檢測細胞在支架材料浸提液中增殖的結果,材料組和明膠組吸光度值隨時間延長而逐漸升高,第1天和第3天,明膠組均大于材料組,第5天和第7天時,1HA組大于2HA、3HA組,且也大于明膠組。材料組與明膠組之間的差異有統計學意義(P<0.05),見圖6。
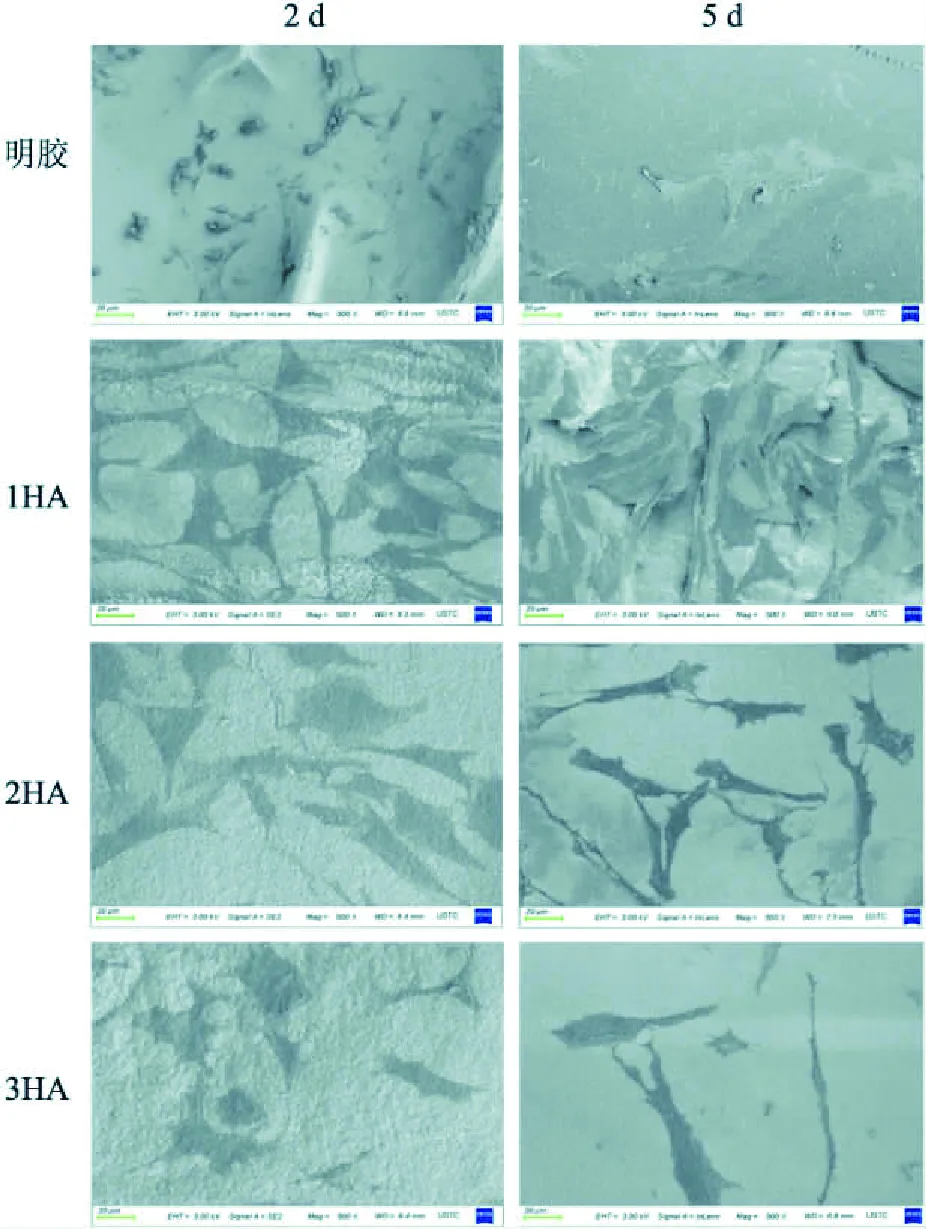
圖4 掃描電鏡下鼠骨髓間充質干細胞在支架材料上的黏附、伸展情況 ×500
2.8 細胞在材料上的分化采用堿性磷酸酶試劑盒檢測細胞在支架材料上的堿性磷酸酶活性表達的結果顯示:隨著時間的延長,材料組和明膠組堿性磷酸酶活性都升高,第1、3、5、7天,1HA組活性均高于對照組;第3、5、7天對照組活性均高于2HA、3HA組,接種后四組之間比較差異有統計學意義(P<0.05),見圖7。
3 討論
復合材料是把幾種材料復合在一起使其中各個材料同時發揮它們各自的優勢,可以滿足人體機體多樣性的要求,更好地實現其在生物體內的修復功能,成為近幾年研究和應用最為廣泛的一種新型修復材料。目前,文獻報道中HA和明膠復合物的制備方法主要有懸浮法、共沉淀法和模擬體液SBF浸泡法。懸浮法制備支架材料易導致HA顆粒的分布不均勻;SBF浸泡法制備支架材料時HA形成緩慢且過程不可控[5];電泳沉積制備HA涂層時存在HA涂層與基底材料結合強度低的問題。該實驗是采用離子自然交替共沉淀法,將交聯好的明膠材料交替放入含有高濃度的磷酸根離子溶液和鈣離子溶液中,使磷酸根離子和鈣離子自然沉淀在明膠材料上,更容易結合生成相對均質的HA顆粒,最后通過冷凍干燥技術制備出所需要的明膠/HA三維多孔狀結構的復合支架材料。2015年,Suzawa et al[6]采用離子自然交替共沉淀法在瓊脂糖材料上沉積HA,并在瓊脂/HA復合材料上種植骨髓間充質干細胞,實驗結果顯示采用該方法制備出的支架材料與細胞結合可修復臨界骨缺損。與瓊脂相比,膠原具有更好的生物相容性和降解性,但其機械強度較低,誘導骨再生能力差,明膠是一種膠原蛋白的水解產物,有較低的抗原性,與HA的復合材料具有一定的機械強度等優點,被廣泛應用于生物材料的合成。因此,該實驗利用離子交替共沉淀法合成明膠/HA支架材料。
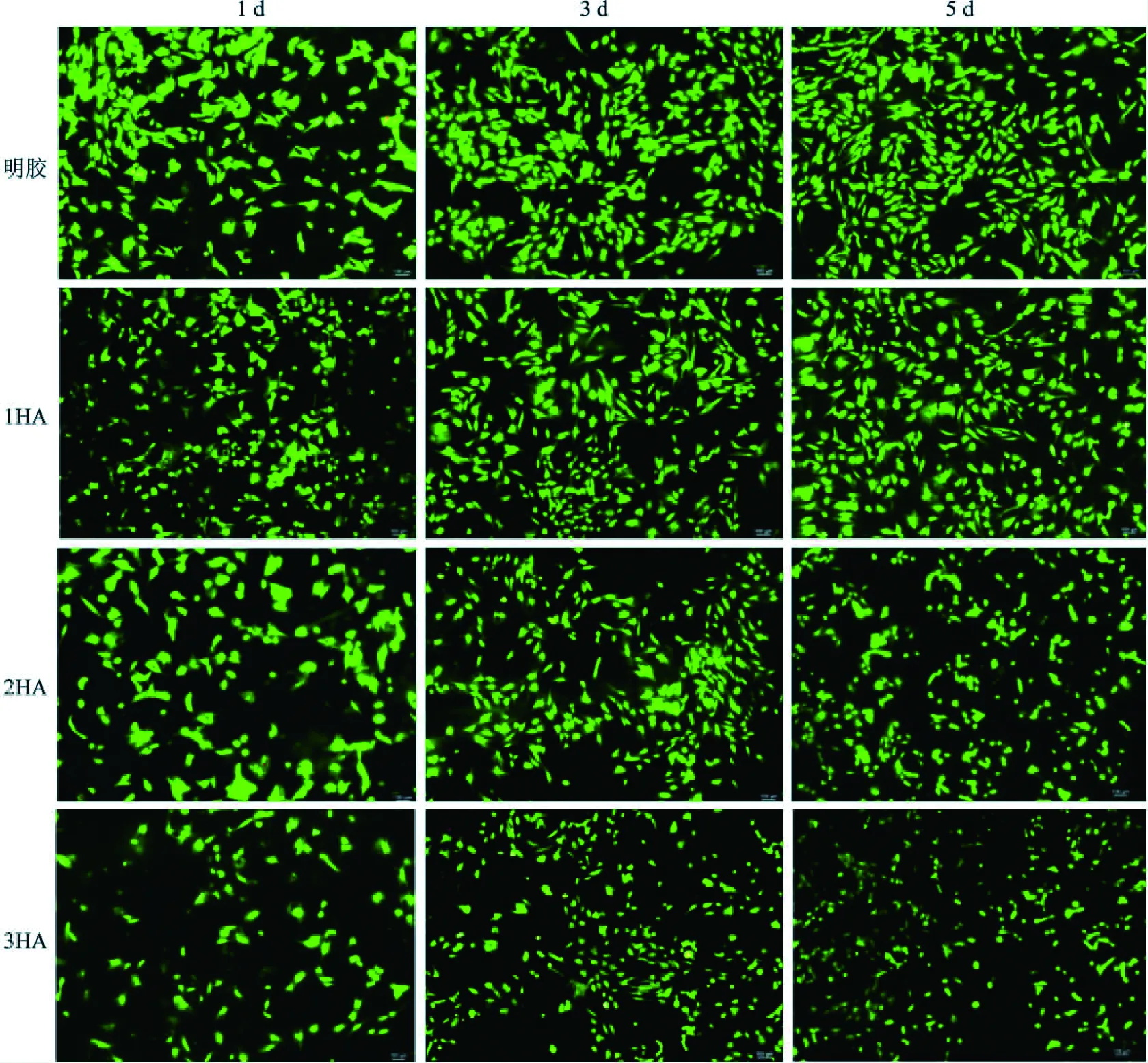
圖5 細胞在支架材料浸提液中的死活染色倒置熒光顯微鏡下觀察 ×50
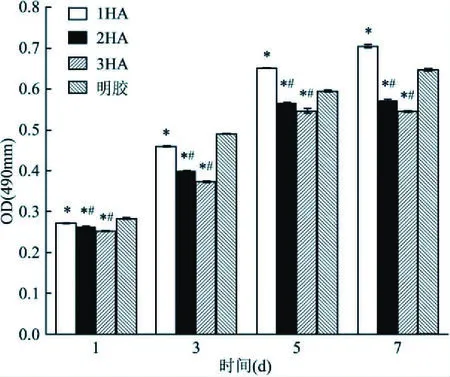
圖6 細胞在浸提液中增殖情況與明膠組比較:*P<0.05;與1HA組比較:#P<0.05
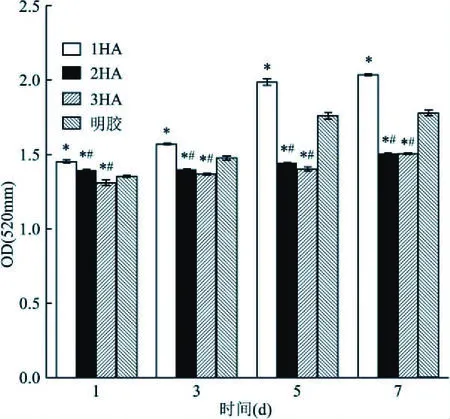
圖7 細胞在支架材料上的分化情況與明膠組比較:*P<0.05;與1HA組比較:#P<0.05
掃描電鏡結果顯示,單純明膠材料表面光滑,截面呈多孔狀,實驗組材料表面沉積顆粒數及大小與其礦化循環次數成正比。通過XRD檢測,證實其沉積物是HA晶體顆粒。1HA和明膠支架材料孔徑約為200 μm,孔隙分布較均勻,但2HA和3HA支架材料的孔徑隨著HA晶體顆粒的增大而變小。It?l? et al[7]通過將不同孔徑的鈦種植體植入兔的股骨,發現孔徑在50~125 μm范圍內都適合兔新生骨組織的生長。小鼠前成骨細胞在可降解的聚乳酸支架材料上最適合生長的孔徑為70 μm[8],但在陶瓷材料上最適合生長的孔徑為150 μm[9]。由此可見,除了支架材料的孔徑結構,其材料類型以及在其上培養的細胞類型也是影響細胞增殖能力的重要參數。支架材料雖然能為缺損部位提供三維結構,但其在體內仍是一種異物存在,通過體外降解實驗顯示,1HA和明膠組在6周后的降解率分別高達(7.18±0.24)%和(8.29±0.17)%,表明該支架材料具有生物降解性。通過與人松質骨的孔徑和孔隙率比較,該實驗合成的1HA和明膠支架材料基本符合植骨材料要求,有利于體液和營養因素的傳遞、間充質干細胞的長入和組織的形成。
有研究[6]表明,除了孔徑大小、孔隙率及相互連通的結構、化學組成等理化特性外,組成材料的顆粒級別也影響材料與細胞之間的相互作用。研究[10]表明100 nm以上的HA有利于促進細胞生長,本實驗制備出的明膠/HA支架材料表面沉積不同顆粒級別的HA晶體,1HA晶體成棒狀,大小為100~200 nm;2HA晶體成圓團狀,大小為200~600 nm;3HA晶體成花簇狀,大小約大于600 nm。通過比較三組HA不同顆粒級別的支架材料,SEM結果顯示大鼠骨髓間充質干細胞在1HA材料細胞分布廣泛,形態均勻。死活染色和CCK-8結果證實,與對照組相比,1HA材料組增強大鼠骨髓間充質細胞的增殖能力,而3HA明顯抑制rBMSC的增殖能力,說明1HA材料組具有良好的生物相容性和促進rBMSC的增殖能力。
組織工程包括細胞、細胞因子和支架材料,骨髓間充質干細胞具有成血管[11]、成軟骨[12]和成骨[13]等多向分化潛能,本實驗以SD大鼠骨髓間充質干細胞為種子細胞,通過堿性磷酸酶(alkaline phosphatase,ALP)的活力檢測實驗結果證明了1HA支架材料在體外礦化誘導條件下,顯著增強ALP的分泌,說明利用離子自然交替共沉淀法合成的明膠/HA材料有良好的細胞相容性,且可促進鼠骨髓間充質細胞的增殖體外分化能力。Xia et al[14]利用rBMSC與多孔HA生物瓷材料修復大鼠顱骨缺損,以明膠為基質的HA支架材料復合生長因子,促進前成骨細胞在腹部肌肉袋囊中形成骨類似組織[15]。結合本實驗的體外結果,1HA明膠復合支架材料有望為后續的動物體內實驗提供理論依據。
該課題在前期研究基礎上,利用共沉淀法,在明膠材料上交替沉淀鈣磷離子,根據循環次數制備出不同顆粒級別的三維多孔結構的羥基磷灰石復合材料。實驗結果表明該方法制備出的1HA復合支架材料具有良好的生物相容性,促進rBMSC的增殖和分化,其有可能成為新型的骨組織工程支架材料。

