微囊藻毒素誘導細胞自噬的研究進展
何麗,劉林,林長高,隗黎麗
江西農(nóng)業(yè)大學動物科學技術(shù)學院,南昌 330045
隨著工農(nóng)業(yè)的迅速發(fā)展,由水體富營養(yǎng)化引起的藍藻水華不僅會惡化水質(zhì),更為嚴重的是,藍藻細胞死亡后所釋放的藻毒素可富集于水生生物體內(nèi),隨后通過食物鏈的傳遞危害人類健康[1]。在眾多藻毒素中,微囊藻毒素(microcystins, MCs)為毒性最強、分布范圍最廣的毒素之一,其主要由微囊藻屬(Microcystis)、魚腥藻屬(Anabaena)、念珠藻屬(Nostoc)、束絲藻屬(Aphanizomenon)以及顫藻屬(Oscillatoria)等藍藻產(chǎn)生[2-3]。MCs進入機體內(nèi)依靠多種有機陰離子轉(zhuǎn)運多肽(organic anion transporting polypeptides, OATPs)的轉(zhuǎn)運,研究顯示,OATPs在肝臟、腎臟、性腺和腦等組織中均存在表達[4]。因此,MCs能進入肝臟、腎臟、性腺及腦組織中而發(fā)揮其肝毒性[5]、腎毒性[6]、生殖毒性[7]及神經(jīng)毒性[8]作用。
自噬在所有真核生物的進化上高度保守,是細胞內(nèi)一種重要的溶酶體依賴性降解機制[9]。根據(jù)內(nèi)容物質(zhì)運輸?shù)饺苊阁w途徑的不同,細胞自噬可以分為微自噬(microautophagy)、分子伴侶介導的自噬(chaperone mediated autophagy, CMA)和巨自噬(macroautophagy)[10]。微自噬是溶酶體膜直接內(nèi)陷吞噬胞質(zhì)成分,而分子伴侶介導的自噬是在分子伴侶(HSC70)的作用下溶酶體降解含有KFERQ序列的可溶性胞質(zhì)蛋白底物[11]。巨自噬即通常所說的自噬,是指具有雙層膜結(jié)構(gòu)的自噬體(autophosome)包裹著胞漿成分與溶酶體融合形成自噬溶酶體(autopholysome),最終胞漿成分被溶酶體酶降解的過程。基礎水平的自噬能清除細胞內(nèi)衰老細胞器及長壽蛋白以維持細胞穩(wěn)態(tài)[12]。然而,過低或過高水平的細胞自噬都會導致細胞不可逆死亡即Ⅱ型程序性細胞死亡(programmed cell death Ⅱ, PCDⅡ)[13]。本文就MCs誘導細胞自噬的相關(guān)研究進行綜述,并總結(jié)其可能存在的誘導機制,以期為進一步明確自噬在MCs的細胞毒性中發(fā)揮的作用提供理論基礎。
1 微囊藻毒素及其毒性機制(Microcystins and their mechanisms of toxicity)
MCs是一類相對分子質(zhì)量在800~1 100 Da之間的單環(huán)七肽化合物,其主要由非核糖體肽合成酶(nonribosomal peptide synthetases, NRPSs)、聚酮合成酶(polyketide synthases, PKSs)和其他雜合酶等多功能蛋白復合體合成[14]。該化合物的結(jié)構(gòu)通式為環(huán)(D-Ala1-L-X2-D-isoMeAsp3-L-Z4-Adda5-D-isoGlu6-Mdha7),其中,2、4號位的X、Z為2種可變的L型氨基酸[15-16]。在已鑒別的100多種MCs異構(gòu)體中,MC-LR、MC-RR和MC-YR為分布廣泛且毒性較強的3種異構(gòu)體,其中L、R和Y分別代表亮氨酸、精氨酸和酪氨酸[17]。MCs理化性質(zhì)穩(wěn)定,耐酸堿、紫外線輻射及高溫,常規(guī)處理方法(如混凝、沉淀、絮凝和過濾等)很難有效去除水體中的MCs[18]。因此,MCs對水體環(huán)境和人群健康的危害已成為全球關(guān)注的重大環(huán)境問題。
2 微囊藻毒素誘導細胞自噬的研究(Studies on autophagy induced by microcystins)
現(xiàn)有報道主要以肝細胞、腎細胞、性腺細胞和神經(jīng)細胞為研究對象,開展了MCs誘導細胞自噬的研究。下面將主要從MCs對不同細胞自噬的影響以及機制進行綜述。
2.1 微囊藻毒素誘導細胞自噬
2.1.1 微囊藻毒素誘導肝細胞自噬
肝臟是MCs作用的靶器官,主要是由于肝臟中存在多種高表達的OATPs,如OATPl Bl、OATPl B3和OATPl A2等,MCs在這些OATPs的主動轉(zhuǎn)運作用下進入肝細胞,造成嚴重的肝損傷[27]。大量報道表明,MCs可導致哺乳類[28-29]、魚類[30-31]和兩棲類[32]等動物肝臟超微結(jié)構(gòu)和多種酶活性的改變,并誘導肝細胞凋亡或壞死,從而導致機體肝功能障礙。近年來,研究者發(fā)現(xiàn)MCs在造成肝細胞損傷的同時啟動了細胞自噬。如Dabholkar和Carmichael[33]發(fā)現(xiàn)MC-LR除了可誘導小鼠肝細胞內(nèi)質(zhì)網(wǎng)和線粒體腫大、空泡化及脂滴的形成之外,還誘導了含顆粒狀物質(zhì)或碎片的自噬泡的產(chǎn)生,推測MC-LR誘導了肝細胞自噬。Menezes等[34]將人肝癌(HepG2)細胞暴露于MC-LR(6、12和25 mg·L-1)24 h后,利用透射電鏡可觀察到MC-LR誘導HepG2細胞自噬體的產(chǎn)生,但數(shù)量隨著濃度的增加而減少,而高濃度MC-LR誘導的細胞凋亡及壞死顯著增加。吳珍等[35]在飲用水中添加MC-LR對小鼠染毒3個月,發(fā)現(xiàn)MC-LR誘導的小鼠肝臟自噬相關(guān)基因LC3α轉(zhuǎn)錄水平的增加與線粒體膜電位的下降存在相關(guān)性,認為在線粒體膜電位消失的同時,細胞啟動了自我保護機制。由以上報道可知,MCs可誘導肝細胞自噬的發(fā)生。
2.1.2 微囊藻毒素誘導腎細胞自噬
研究表明,腎臟中也存在多種OATPs,致使MCs容易造成腎臟損傷[36]。非洲綠猴腎(Vero-E6)細胞經(jīng)5、20和40 mg·L-1MC-LR(LMECYA113提取物)脅迫24、48和72 h后,MC-LR對Vero-E6細胞溶酶體、內(nèi)質(zhì)網(wǎng)、線粒體和細胞骨架的損傷具有時間-劑量依賴性,低濃度的MC-LR能誘導Vero-E6細胞內(nèi)質(zhì)網(wǎng)和線粒體自噬,而較高濃度則會導致Vero-E6細胞凋亡及壞死[37]。Menezes等[34]將Vero-E6細胞分別經(jīng)6、12、25和50 mg·L-1MC-LR (LMECYA110提取物)暴露24 h,發(fā)現(xiàn)低濃度MC-LR誘導Vero-E6細胞自噬,而高濃度主要導致Vero-E6細胞壞死。綜上所述,MC-LR能誘導腎細胞自噬且自噬水平與MC-LR的濃度有關(guān)。
2.1.3 微囊藻毒素誘導性腺細胞自噬
MC-LR可作為一種內(nèi)分泌干擾物造成機體生殖系統(tǒng)功能紊亂而影響動物機體的繁殖、生長和發(fā)育[38],而細胞自噬與MC-LR的生殖毒性密切相關(guān)。Adegoke等[39]報道MC-LR可引起牛睪丸支持(Sertoli)細胞線粒體損傷并誘導線粒體自噬。Chen等[26]利用不同濃度MC-LR對大鼠Sertoli細胞染毒后,發(fā)現(xiàn)低濃度MC-LR能誘導細胞自噬,而高濃度MC-LR可通過影響溶酶體的功能而導致自噬體堆積,隨后下調(diào)Bcl-2蛋白表達水平促進Sertoli細胞凋亡。另有學者發(fā)現(xiàn),MC-LR可顯著抑制中國倉鼠卵巢(Chinese hamster ovary, CHO)細胞增殖,并誘導CHO細胞自噬[40]。在Liu等[41]的研究中,不同濃度(8.5、17和34 mg·L-1)MC-LR可促進小鼠卵巢顆粒(KK-1)細胞內(nèi)ATG5、ATG12、Beclin1及LC3 Ⅱ/LC3 Ⅰ的蛋白表達而誘導細胞自噬。
2.1.4 微囊藻毒素誘導神經(jīng)細胞自噬
MC-LR具有神經(jīng)毒性,可通過血腦屏障進入腦組織[8]。慢性MC-LR暴露可引起小鼠神經(jīng)細胞凋亡、記憶喪失和學習障礙,從而引起阿爾茨海默病樣癥狀[42]。研究顯示,自噬在神經(jīng)系統(tǒng)疾病中具有重要的調(diào)控作用,而MC-LR誘導神經(jīng)細胞自噬的研究也有相應報道。為確定MC-LR誘導的自噬是否為神經(jīng)毒性的潛在機制,Yang等[43]利用人神經(jīng)母細胞瘤(SK-N-SH)細胞經(jīng)15 mg·L-1和30 mg·L-1MC-LR處理48 h后,發(fā)現(xiàn)MC-LR可顯著抑制SK-N-SH細胞活性,自噬相關(guān)蛋白LC3 Ⅱ/LC3 Ⅰ和p62表達的升高均呈濃度依賴性,此外,與對照組相比,MC-LR處理組細胞內(nèi)游離Ca2+濃度顯著升高,認為由MC-LR引起的細胞存活率降低可能與自噬通量的抑制和細胞內(nèi)游離Ca2+濃度的增加有關(guān)。對神經(jīng)細胞株P(guān)C12細胞進行MC-LR(1、25和50 mg·L-1)染毒24 h后,發(fā)現(xiàn)MC-LR處理組細胞內(nèi)ROS水平顯著升高,線粒體膜電位顯著降低,線粒體自噬相關(guān)基因PINK1和Parkin表達呈劑量依賴性上升,推測MC-LR通過氧化應激激活PINK1/Parkin線粒體自噬,參與MC-LR致PC12細胞損傷[44]。然而,MC-LR引發(fā)的自噬在神經(jīng)系統(tǒng)中的作用機制還有待深入研究。
2.2 微囊藻毒素誘導細胞自噬的機制
細胞自噬發(fā)生過程由多種蛋白參與,首先機體受到刺激后在ULK1-ATG13-ATG101和Beclin1-Vps34蛋白復合物的作用下自噬體成核延伸,隨后在ATG12-ATG5-ATG16L1和ATG8(LC3)-PE這2個泛素結(jié)合系統(tǒng)的參與下形成自噬體,最終通過相關(guān)蛋白識別機制與溶酶體融合形成自噬溶酶體進行底物降解[45]。該過程受多條上游信號通路的調(diào)控,如哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通過AMPK-mTORC1、PI3K/AKT/mTORC1和Ras/ERK/RSK/mTORC1等信號通路調(diào)控自噬相關(guān)蛋白ULK1復合物,從而進一步調(diào)節(jié)自噬水平[46]。Beclin1(酵母Atg6同源物)信號通路在自噬調(diào)節(jié)中發(fā)揮重要作用,Beclin1蛋白中BH3(Bcl-2-homology3)、中央螺旋區(qū)(CCD)和進化保守區(qū)(ECD)3個結(jié)構(gòu)域可與其他因子如Bcl-2/XL、DAPK、Mst1、JNK1和ClassⅢ PI3K等相互作用,影響細胞自噬[47]。而P53作為一個主要的抑癌基因,可通過調(diào)控AMPK和Akt/mTOR通路及ATG12的表達來調(diào)節(jié)自噬[48]。此外,細胞應激通路也參與細胞自噬的調(diào)控[49]。其中,細胞應激通路主要包括線粒體氧化應激和內(nèi)質(zhì)網(wǎng)應激2條途徑。目前,認為MCs對細胞自噬效應的誘導主要通過誘發(fā)細胞應激而實現(xiàn),即與線粒體氧化應激和內(nèi)質(zhì)網(wǎng)應激途徑有關(guān)。
2.2.1 線粒體氧化應激途徑
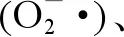
2.2.2 內(nèi)質(zhì)網(wǎng)應激途徑
內(nèi)質(zhì)網(wǎng)(endoplasmic reticulum, ER)參與細胞內(nèi)如蛋白質(zhì)合成與修飾、多肽鏈折疊、鈣代謝和脂代謝等多種生物學功能[57-58]。當機體受到刺激(有毒物質(zhì)等)時,因內(nèi)質(zhì)網(wǎng)應激(endoplasmic reticulum stress, ERs)產(chǎn)生過多的未折疊或錯誤折疊的蛋白致使機體啟動未折疊蛋白反應(unfold protein reaction, UPR)[59]。UPR主要由存在于內(nèi)質(zhì)網(wǎng)膜上的3個跨膜分子PERK(pancreatic ER kinase-PKR-like kinase)、ATF6(activating transcription factor 6)、IRE1(inositol-requiring enzyme 1)參與調(diào)控。目前,越來越多的研究表明PERK、ATF6和IRE1與自噬的發(fā)生密不可分[60]。證據(jù)表明,PERK-eIF2α-ATF4途徑及PERK-AMPK-mTORC途徑參與ERs介導的細胞自噬[61-62]。其中,PERK-eIF2α-ATF4途徑可激活一系列自噬相關(guān)基因(autophagy related genes, ATGs)包括LC3B、ATG3、ATG7、ATG10、ATG12、ATG16L1和Beclin1等的表達而促進自噬[63]。此外,IRE1-JNK/XBP1-Beclin1途徑誘導的自噬也得到了驗證[64]。而ERs可導致機體內(nèi)Ca2+平衡紊亂,誘導Ca2+從內(nèi)質(zhì)網(wǎng)釋放到細胞質(zhì)中,從而激活mTOR和AMPK等自噬上游信號通路[65]。為探討ERs與自噬之間的關(guān)系,Zhang等[40]分別應用MC-LR聯(lián)合ERs抑制劑4-PBA或自噬抑制劑3-MA共同處理CHO細胞24 h,結(jié)果顯示,抑制ERs后,自噬標志性蛋白Beclin1 和LC3 Ⅱ表達降低,LC3 Ⅰ表達升高,而細胞凋亡率明顯下降;抑制自噬后,ERs標志蛋白如GRP78、ATF6、PERK、IRE1和CHOP表達升高而細胞凋亡率顯著增加。由此可知,ERs是MC-LR誘導自噬的重要因素之一,ERs促進細胞凋亡,而自噬作為保護機制能抑制細胞凋亡的發(fā)生。Liu等[41]的研究結(jié)果表明,MC-LR能夠通過上調(diào)ERs相關(guān)蛋白eIF2α、CHOP、XBP-1、GRP78及PERK和自噬相關(guān)蛋白ATG16、ATG12、ATG5、LC3 Ⅱ/LC3 Ⅰ及Beclin1的表達,誘導KK-1細胞ERs和自噬,推測MC-LR誘發(fā)的ERs可通過PERK/eIF2α/ATG12和XBP-1/Beclin1信號通路誘導細胞自噬,而細胞經(jīng)NAC預處理后,MC-LR通過下調(diào)上述蛋白的表達抑制ERs和自噬,這表明氧化應激介導了MC-LR誘導的ERs,隨后通過ERs相關(guān)途徑調(diào)控自噬。然而ERs在MCs誘導細胞自噬的具體信號調(diào)控機制有待今后進一步研究。
3 結(jié)論及展望(Conclusions and prospects)
目前,水質(zhì)惡化日趨嚴重,廣泛存在于水體中的MCs備受人們關(guān)注,因此,深入研究MCs的毒性機理及自噬在機體受MCs脅迫時發(fā)揮的具體作用具有重要意義。研究表明,MCs能夠通過線粒體氧化應激和內(nèi)質(zhì)網(wǎng)應激2種途徑誘導細胞自噬,細胞自噬可能是機體應對MCs毒性的早期反應,通過自噬清除受損細胞器以提高細胞的生存,而隨著暴露時間延長及暴露濃度的上升,細胞凋亡及壞死被誘導。
目前針對MCs誘導細胞自噬的研究已逐漸開展,但還存在很多不足,今后可從以下幾個方面進行深入研究。(1)現(xiàn)階段的研究主要集中于高等哺乳動物,而要真正全面地揭示調(diào)控MCs誘導細胞自噬的機制,還需對長期暴露于MCs中的低等水生生物如魚類等進行更深入細致的研究。(2)現(xiàn)有研究表明,MC-LR的轉(zhuǎn)運和代謝途徑基因的多態(tài)性可以影響毒素的轉(zhuǎn)運和代謝,導致MC-LR暴露機體敏感性存在差異,從而致使MC-LR進入細胞內(nèi)發(fā)揮的毒性作用存在差異[5,66],這可能是目前MC-LR誘導細胞自噬的研究主要集中在肝細胞、腎細胞、生殖細胞和神經(jīng)細胞等上,而還未在其他組織細胞深入開展的原因之一。因此,后續(xù)可以從MC-LR是否誘導其他不同組織細胞自噬以及誘導機制是否存在差異等方面進行探索,以期全面剖析MC-LR的毒性機理。(3)MCs種類繁多,已鑒定的100多種異構(gòu)體之間存在差異,而目前的研究主要針對MC-LR對動物機體的影響,而其他種類MCs的毒性作用機理的異同尚未可知。(4)自噬的調(diào)控機制錯綜復雜,而現(xiàn)有MCs誘導細胞自噬機制的研究主要針對自噬體形成過程,其上游調(diào)控信號通路及自噬溶酶體的降解途徑未見詳細報道,對自噬流的研究尚不系統(tǒng),且自噬在機體受MCs脅迫時具體發(fā)揮的作用以及途徑還需進一步研究。

