基于PPARγ途徑探討桑葉總黃酮對妊娠期糖尿病模型大鼠糖脂代謝、炎癥和氧化應激的改善作用
史紀芳 潘佳琪 陳夢 馬敬 王華偉


摘 要 目的:研究桑葉總黃酮對妊娠期糖尿病(GDM)模型大鼠糖脂代謝、炎癥和氧化應激的改善作用,并探討其可能機制。方法:雌性SD大鼠連續喂養高脂飼料8周后,將空腹血糖(FBG)<6.67 mmol/L的雌鼠與雄性SD大鼠合籠;將妊娠大鼠隨機分為對照組、GDM組以及桑葉總黃酮低、中、高劑量組(50、100、200 mg/kg),每組10只。除對照組外,其余各組均單次腹腔注射鏈脲佐菌素25 mg/kg以復制GDM模型。于注射后,各給藥組大鼠均灌胃相應藥物,對照組和GDM組大鼠均灌胃生理鹽水(10 mL/kg);每日1次,連續18 d。分別于孕第3、7、18天(G3 d、G7 d、G18 d)檢測其FBG水平;于G18 d檢測其血脂[三酰甘油(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)]和血清炎癥細胞因子[腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)、IL-8、]、氧化應激指標[丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH)、過氧化氫酶(CAT)]水平,采用熒光定量聚合酶鏈反應法和Western blotting法分別檢測其胎盤組織中過氧化物酶增殖體激活受體γ(PPARγ)和核因子κB(NF-κB)蛋白及mRNA,AMP依賴的蛋白激酶(AMPK)mRNA以及磷酸化AMPK(p-AMPK)蛋白的表達情況。結果:與對照組比較,GDM組大鼠FBG(G3 d、G7 d、G18 d)、TG、TC、LDL-C、TNF-α、IL-6、IL-8、MDA水平以及NF-κB蛋白及mRNA的表達量均顯著升高,而SOD、GSH、CAT水平以及PPARγ蛋白及mRNA、AMPK mRNA、p-AMPK蛋白的表達量均顯著降低(P<0.01)。與GDM組比較,桑葉總黃酮中、高劑量組大鼠FBG(G3 d、G7 d、G18 d)、TG、TC、LDL-C水平以及各劑量組TNF-α、IL-6、IL-8、MDA水平,NF-κB蛋白及mRNA的表達量均顯著降低,而桑葉總黃酮各劑量組大鼠SOD、GSH、CAT水平以及PPARγ蛋白及mRNA、AMPK mRNA、p-AMPK蛋白的表達量均顯著升高(P<0.05或P<0.01)。結論:桑葉總黃酮對GDM模型大鼠的糖脂代謝、炎癥和氧化應激均具有一定的改善作用,其機制可能與PPARγ途徑的激活有關。
關鍵詞 妊娠期糖尿病;桑葉總黃酮;過氧化物酶增殖體激活受體γ;糖脂代謝;炎癥;氧化應激;大鼠
ABSTRACT? ?OBJECTIVE: To study the improvement effects of total flavonoids from Morus alba on glycolipid metabolism, inflammation and oxidative stress in gestational diabetes mellitus (GDM) model rats, and to investigate the potential mechanism. METHODS: After feeding high fat diet for 8 weeks, female SD rats with FBG<6.67 mmol/L were caged with male SD rats. Pregnant female rats were randomly divided into control group, GDM group, M. alba total flavonoids low-dose, medium-dose and high-dose groups (50, 100, 200 mg/kg), with 10 rats in each group. Except for control group, other groups were given intraperitoneal injection of streptozotocin 25 mg/kg once to induce GDM model. After injection, rats in each administration group were given corresponding drugs intragastrically, control group and GDM group were given normal saline 10 mL/kg intragastrically, once a day, for consecutive 18 days. The levels of FBG were determined on the 3rd, 7th and 18th day of pregnancy (G3 d, G7 d and G18 d); the levels of blood lipids (TG, TC, LDL-C, HDL-C) and inflammatory factors (TNF-α, IL -6, IL-8), oxidative stress indicators (MDA, SOD, GSH, CAT) in serum were determined on G18 d. The protein and mRNA expressions of PPARγ and NF-κB, the expression of AMPK mRNA and p-AMPK protein were measured by Real-time-PCR and Western blotting. RESULTS: Compared with control group, the levels of FBG (G3 d, G7 d, G18 d), TG, TC, LDL-C, TNF-α, IL-6, IL-8 and MDA, protein and mRNA expression of NF-κB in GDM group were significantly increased, while the levels of SOD, GSH and CAT, the expressions of PPARγ protein and mRNA, AMPK mRNA and p-AMPK protein were significantly decreased (P<0.01). Compared with GDM group, the levels of FBG (G3 d, G7 d, G18 d), TG, TC, LDL-C in M. alba total flavonoids medium-dose and high- dose groups and the levels of TNF-α, IL-6, IL-8 and MDA, protein and mRNA expression of NF-κB in M. alba total flavonoids groups were significantly decreased; the levels of SOD, GSH and CAT, the expressions of PPARγ protein and mRNA, AMPK mRNA and p-AMPK protein were significantly increased (P<0.05 or P<0.01). CONCLUSIONS: Total flavonoids from M. alba can improve the glycolipid metablism, inflammation and oxidative stress in GDM model rats, the mechanism of which may be related to the activation of PPARγ pathway.
KEYWORDS? ?Gestational diabetes mellitus; Total flavonoids from Morus alba; PPARγ; Glycolipid metabolism; Inflammation; Oxidative stress; Rat
妊娠期糖尿病(Gestational diabetes mellitus,GDM)為妊娠期的常見合并癥,是指妊娠期首次發生或發現的糖代謝異常,可增加母胎風險[1]。胰島素抵抗加重是GDM患者重要的病理生理特征[2],但導致妊娠期胰島素抵抗加重的因素尚未完全闡明。有研究指出,脂代謝紊亂、炎癥和氧化應激反應的過度激活均有可能影響胰島素信號的轉導,進而誘導胰島素抵抗的發生,上述因素可能與GDM的發生有關[3-5]。
桑葉是桑科桑屬植物桑(Morus alba L.)的干燥葉。歷代中醫典籍中均記載該藥可治療消渴癥。現代藥理研究證實,桑葉中的有效成分桑葉總黃酮無致畸作用,且具有降脂、降糖的作用,在2型糖尿病的治療中具有一定價值[6-7]。由于GDM與2型糖尿病具有類似的病理生理特征(即胰島素抵抗)[2],故本課題組推測桑葉總黃酮可能對GDM具有一定的治療作用。
過氧化物酶增殖體激活受體γ(PPARγ)是細胞內調節炎癥和氧化應激反應的重要分子,可通過抑制下游核因子κB(NF-κB)的活化來減輕炎癥反應的程度,亦可通過促進下游腺苷一磷酸依賴的蛋白激酶(AMPK)的活化來減少氧化應激反應的發生[8]。已有研究報道,GDM患者胎盤中PPARγ途徑受到明顯抑制,從而使得炎癥細胞因子、氧化應激產物的釋放增加,母體炎癥反應和氧化應激反應被激活,最終導致母體糖脂代謝紊亂[9]。鑒于此,本研究以GDM模型大鼠為對象,基于胎盤中PPARγ途徑的改變來探討桑葉總黃酮對大鼠糖脂代謝、炎癥、氧化應激的改善作用,旨在挖掘桑葉總黃酮在GDM治療中的潛在價值。
1 材料
1.1 儀器
Selectra E型全自動生化分析儀(上海玉研科學儀器有限公司);Labserv K3型酶標儀(上海沃元科技有限公司);Veriti 96型熒光定量聚合酶鏈反應(PCR)儀(美國ABI公司);5200型蛋白電泳系統及凝膠成像儀(上海天能科技有限公司);卓越纖巧型血糖儀(瑞士Roche公司);X6型智能掃描紫外分光光度計(上海元析儀器有限公司);TGL-16K型臺式離心機(湖南湘儀實驗室儀器開發有限公司);YM-T2000CT型超聲儀(上海豫明儀器有限公司)。
1.2 藥材與試劑
桑葉飲片(批號:20170937)購自四川省中藥飲片有限責任公司,經昆明醫科大學第一附屬醫院生殖遺傳科王華偉副研究員鑒定為桑科桑屬植物桑(M. alba L.)的葉。
鏈脲佐菌素(STZ,美國Sigma公司);pH 4.5的枸櫞酸緩沖液(青島捷世康生物科技有限公司,批號:T2607);腫瘤壞死因子α(TNF-α)(批號:ml002859)、白細胞介素6(IL-6)(批號:ml028583)、IL-8(批號:ml028580)酶聯免疫吸附法(ELISA)試劑盒均購自上海酶聯生物科技有限公司;丙二醛(MDA)硫代巴比妥酸法試劑盒(批號:A003-1-1)、超氧化物歧化酶(SOD)羥胺法試劑盒(批號:A001-1-2)、谷胱甘肽過氧化物酶(GSH)微板法試劑盒(批號:A006-2-1)、過氧化氫酶(CAT)可見光法試劑盒(批號:A007-1-1)均購自南京建成生物工程研究所;超純RNA提取試劑盒(批號:CW0597)、SuperRT cDNA第一鏈合成試劑盒(批號:CW0741)、UltraSYBR Mixture試劑盒(批號:CW2601S)均購自北京康為世紀生物科技有限公司;RIPA裂解液(批號:P0013E)、BCA蛋白定量試劑盒(批號:P0012)、上樣緩沖液(批號:P0015L)均購自上海碧云天生物技術有限公司;兔源PPARγ一抗(批號:ab23673)、兔源NF-κB一抗(批號:ab32360)、兔源AMPK一抗(批號:ab80039)、兔源磷酸化AMPK(p-AMPK)一抗(批號:ab133448)、兔源β-肌動蛋白(β-actin)一抗(批號:ab8827)、Alexa Fluor?488標記的山羊抗兔IgG二抗(批號:ab150081)、ECL化學發光試劑(批號:ab65223)均購自美國Abcam公司;D101型大孔吸附樹脂(0.3~1.2 mm,上海穎心實驗室設備有限公司);63428-84-2型聚酰胺(60~80目,上海萌芽生物科技有限公司);生理鹽水(本實驗室自制);其余試劑均為分析純,水為蒸餾水。
1.3 動物
SPF級雌、雄性SD大鼠,6周齡,體質量120~150 g,由北京維通利華實驗動物公司提供,動物使用許可證號:SYXK(京)2017-0022。高脂飼料(含標準飼料59.8%、白糖15%、豬油10%、食鹽2%、膽固醇0.2%、酪蛋白7%、蛋黃粉5%)購自上海睿安生物科技有限公司。
2 方法
2.1 桑葉總黃酮的制備
取桑葉飲片500 g,加入25倍量(g/mL)70%乙醇浸泡1 h,超聲(功率:1 200 W,頻率:20 kHz)處理30 min后,加熱回流提取1.5 h,濾過,藥液減壓回收至無醇味。將上述提取物經70%乙醇稀釋后,用聚酰胺和大孔吸附樹脂進行聯合精制,依次以水、20%乙醇洗脫后,再以80%乙醇洗脫,得桑葉總黃酮[經紫外分光光度法以紫外分光光度計測得其含總黃酮含量為58.7 g/L(以生藥量計)],于4 ℃保存,備用。
2.2 GDM模型制備
雌性SD大鼠連續喂養高脂飼料8周后,禁食、不禁水12 h,以血糖儀測定其空腹血糖(FBG)水平,剔除FBG≥6.67 mmol者;剩余雌性SD大鼠按2 ∶ 1的比例與雄性大鼠合籠,次日經陰道涂片鏡檢,發現有精子的雌性SD大鼠即認定為妊娠,并記為孕第0天(G0 d)。妊娠大鼠禁食、不禁水12 h后,單次腹腔注射STZ(25 mg/kg)以復制GDM模型,于G3 d同法檢測其FBG水平,若為6.67~16.67 mmol/L則判定為GDM模型復制成功[10]。
2.3 分組與給藥
將妊娠大鼠隨機分為對照組、GDM組以及桑葉總黃酮低、中、高劑量組,每組10只。對照組大鼠予高脂飼料并于G0 d時腹腔注射等劑量枸櫞酸緩沖液;其余各組大鼠按“2.2”項下方法復制GDM模型,并于STZ注射后灌胃相應藥物,給藥劑量參考穆曉燕等[7]的研究,低、中、高劑量分別為50、100、200 mg/kg(以桑葉總黃酮提取物質量計);對照組和GDM組大鼠分別灌胃生理鹽水(10 mL/kg);每日1次,連續18 d。分別于G3 d、G7 d、G18 d時,空腹采集尾尖血,采用血糖儀測定其FBG水平。
2.4 標本采集
于G18 d測定FBG水平后,腹腔注射3%戊巴比妥鈉溶液進行麻醉,經大鼠心臟取血,以3 000 r/min離心15 min,分離血清,置于-80 ℃冰箱中保存,備用;采血后處死各組大鼠,取胎盤組織適量,經生理鹽水反復清洗后,放入液氮中短暫凍存20~30 min,隨后置于-80 ℃冰箱中保存,備用。
2.5 血清指標檢測
取“2.4”項下血清適量,采用全自動生化分析儀檢測各組大鼠血清中三酰甘油(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)的水平,采用試劑盒檢測各組大鼠血清中TNF-α、IL-6、IL-8、MDA、SOD、GSH、CAT的水平,均嚴格按照試劑盒說明書方法操作。
2.6 PPARγ、NF-κB、AMPK mRNA表達檢測
2.7 PPARγ、NF-κB、p-AMPK蛋白表達檢測
采用Western blotting法。取“2.4”項下胎盤組織適量,剪碎后加入RIPA裂解液,充分裂解后,于4 ℃下以12 000 r/min離心15 min,收集上清液后以BCA蛋白定量試劑盒測定總蛋白含量。取蛋白30 μg,與上樣緩沖液混合后,行十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),并于電泳后轉移至硝酸纖維素酶(NC)膜上,以5%脫脂牛奶室溫封閉2 h,加入相應一抗(PPARγ、NF-κB、AMPK、p-AMPK的稀釋度均為1 ∶ 1 000,β-actin的稀釋度為1 ∶ 5 000),于4 ℃孵育過夜;用三羥甲基氨基甲烷鹽酸鹽(TBST)溶液清洗10 min×3次,加入相應二抗(稀釋度為1 ∶ 2 000),室溫孵育1 h;用TBST溶液清洗10 min×3次,以ECL化學發光試劑顯色后置于蛋白電泳系統及凝膠成像儀上成像,使用Image J v1.8.0軟件處理,以PPARγ、NF-κB與內參β-actin條帶灰度值的比值作為PPARγ、NF-κB蛋白的表達量,以p-AMPK與AMPK條帶灰度值的比值作為p-AMPK蛋白的表達量。
2.8 統計學方法
采用SPSS 22.0軟件對數據進行統計分析。計量資料均以x±s表示,經Levene法檢驗后,方差齊的數據的多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗;方差不齊的組間比較采用非參數秩和檢驗。P<0.05為差異有統計學意義。
3 結果
3.1 各組大鼠糖脂代謝指標比較
G0 d時,各組大鼠FBG水平組間比較差異均無統計學意義(P>0.05)。與對照組比較,GDM組大鼠G3 d、G7 d、G18 d時的FBG水平均顯著升高(P<0.01)。與GDM組比較,桑葉總黃酮中、高劑量組大鼠G3 d、G7 d、G18 d時的FBG水平均顯著降低(P<0.05或P<0.01);而桑葉總黃酮低劑量組大鼠上述時間點FBG水平與GDM組比較,差異均無統計學意義(P>0.05),詳見表1。
G18 d時,與對照組比較,GDM組大鼠血清中TG、TC、LDL-C水平均顯著升高(P<0.01);而HDL-C水平與對照組比較,差異無統計學意義(P>0.05)。與GDM組比較,桑葉總黃酮中、高劑量組大鼠血清中TG、TC、LDL-C水平均顯著降低(P<0.05或P<0.01);而桑葉總黃酮低劑量組TG、TC、LDL-C以及各給藥組HDL-C水平與GDM組比較,差異均無統計學意義(P>0.05),詳見表2。
3.2 各組大鼠血清中TNF-α、IL-6、IL-8水平比較
與對照組比較,GDM組大鼠血清中TNF-α、IL-6、IL-8水平均顯著升高(P<0.01)。與GDM組比較,桑葉總黃酮各劑量組大鼠上述指標水平均顯著降低(P<0.05或P<0.01),詳見表3。
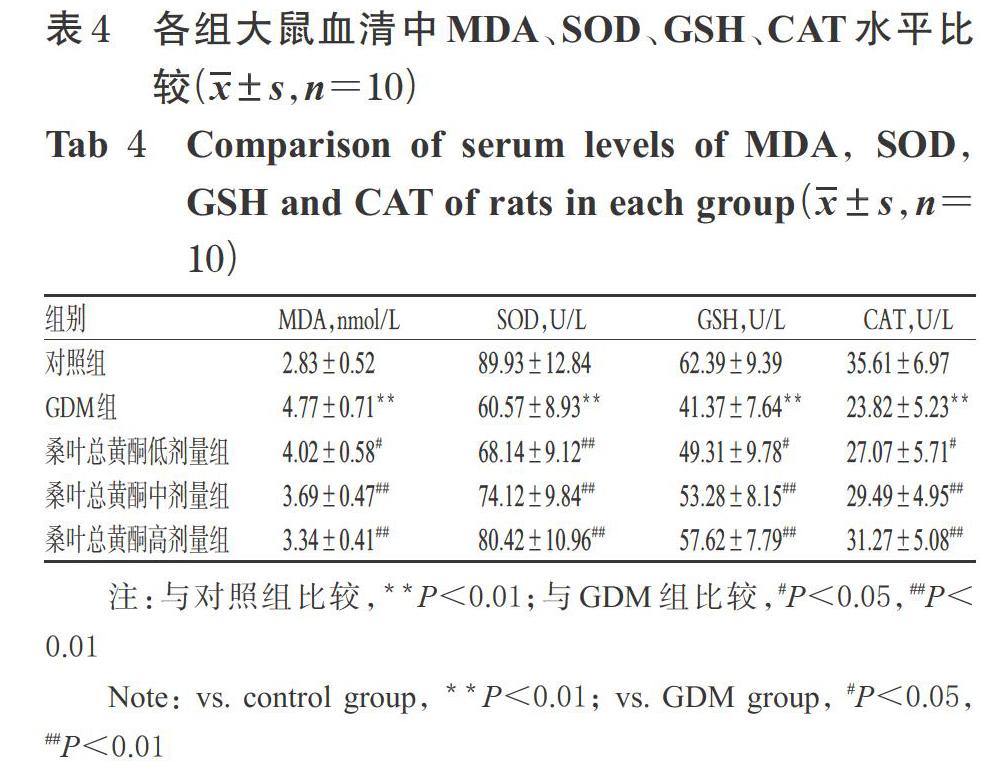
3.3 各組大鼠血清中MDA、SOD、GSH、CAT水平比較
與對照組比較,GDM組大鼠血清中MDA水平顯著升高,SOD、GSH、CAT水平均顯著降低(P<0.01)。與GDM組比較,桑葉總黃酮各劑量組大鼠血清中MDA水平均顯著降低,SOD、GSH、CAT水平均顯著升高(P<0.05或P<0.01),詳見表4。
3.4 各組大鼠胎盤組織中PPARγ、NF-κB、AMPK mRNA表達量比較
與對照組比較,GDM組大鼠胎盤組織中PPARγ、AMPK mRNA的表達量均顯著降低,NF-κB mRNA的表達量顯著升高(P<0.01)。與GDM組比較,桑葉總黃酮各劑量組大鼠胎盤組織中PPARγ、AMPK mRNA的表達量均顯著升高,NF-κB mRNA的表達量均顯著降低(P<0.05或P<0.01),詳見表5。
3.5 各組大鼠胎盤組織中PPARγ、NF-κB、p-AMPK蛋白表達量比較
與對照組比較,GDM組大鼠胎盤組織中PPARγ、p-AMPK蛋白的表達量均顯著降低,NF-κB蛋白的表達量顯著升高(P<0.01)。與GDM組比較,桑葉總黃酮各劑量組大鼠胎盤組織中PPARγ、p-AMPK蛋白的表達量均顯著升高,NF-κB蛋白表達量均顯著降低(P<0.05或P<0.01),詳見圖1、表6。
4 討論
GDM的病理生理特征與2型糖尿病相似,主要表現為明顯的胰島素抵抗以及胰島素分泌相對不足,該病的發生雖受脂代謝紊亂、炎癥和氧化應激反應異常激活的影響,但具體機制仍未完全闡明[2]。臨床上治療GDM的主要方式包括生活方式干預和胰島素注射,而口服降糖藥由于存在潛在的致畸風險,故并不適用于GDM的治療[11]。桑葉具有治療消渴癥的作用,桑葉總黃酮是該藥材中主要的活性成分,可用于2型糖尿病的治療,并可改善機體糖脂代謝,增加胰島素敏感性,同時也具有抗炎和抗氧化的作用[6-7,12]。鑒于此,本研究初步考察了桑葉總黃酮對GDM模型大鼠糖脂代謝、炎癥、氧化應激的影響。由于口服降糖藥大多存在致畸風險,故本研究暫未設置陽性對照組。
本研究通過高脂飼料喂養及STZ腹腔注射的方式建立GDM大鼠模型。結果發現,GDM組大鼠FBG(G3 d、G7 d、G18 d時)以及TC、TG、LDL-C(G18 d時)水平均顯著升高,這一結果與既往研究[3-4]基本一致。在給予桑葉總黃酮干預后,中、高劑量組大鼠FBG(G3 d、G7 d、G18 d時)以及TC、TG、LDL-C水平均顯著降低,提示桑葉總黃酮可明顯改善GDM模型大鼠的糖脂代謝。
雖然目前GDM的發病機制仍未完全闡明,但已有多項研究證實,母體炎癥反應和氧化應激反應的過度激活能夠影響自身胰島素信號的轉導,引發胰島素抵抗,繼而導致糖脂代謝紊亂[13-15]。TNF-α、IL-6、IL-8是炎癥反應中具有促炎作用的炎癥細胞因子,可在炎癥局部召集多種炎癥細胞,并介導炎癥反應級聯放大,從而使得多種炎癥細胞因子呈瀑布式釋放;與此同時,大量釋放進入母體血液循環中的炎癥細胞因子可進一步拮抗胰島素的生物學作用,最終引發胰島素抵抗[16-17]。此外,有研究指出,持續高胰島素血癥以及炎癥反應的刺激能夠使自由基生成增多,后者可造成全身多處臟器發生氧化應激損傷,進而產生脂質過氧化產物MDA并消耗抗氧化酶SOD、GSH、CAT[18-19]。本研究結果顯示,GDM組大鼠血清中TNF-α、IL-6、IL-8、MDA水平均顯著升高,而SOD、GSH、CAT水平均顯著降低,提示GDM模型大鼠體內存在炎癥反應和氧化應激因子的過度激活。桑葉總黃酮的抗炎和抗氧化作用已經在2型糖尿病模型大鼠中得以證實[12,20]。鑒于此,本研究使用桑葉總黃酮對GDM模型大鼠進行干預,以觀察炎癥和氧化應激反應相關因子的變化情況。結果顯示,桑葉總黃酮各劑量組大鼠血清中TNF-α、IL-6、IL-8、MDA水平均顯著降低,而SOD、GSH、CAT水平均顯著升高,提示桑葉總黃酮具有一定的抗炎和抗氧化應激作用。
胎盤作為妊娠過程中的特殊器官,在GDM患者胰島素抵抗的發生中具有重要作用;且胎盤娩出后,約超過50%的GDM患者的胰島素抵抗明顯減輕[21]。胎盤不僅具有母胎間物質交換的功能,同時還具有強大的內分泌作用,能夠釋放多種炎癥細胞因子、自由基等進入母體血液循環并參與胰島素抵抗的發生[21]。其中,PPARγ是胎盤中物質代謝以及炎癥反應、氧化應激反應的重要調節因子。一方面,其可通過抑制NF-κB的活化來減少炎癥細胞因子的表達和釋放,進而減輕炎癥反應的程度[22-23];另一方面,PPARγ可通過促進下游AMPK的活化來增加多種抗氧化酶的表達,進而加快自由基的清除并減輕氧化應激反應[24]。有研究指出,胎盤中PPARγ表達明顯下調、聯合使用PPARγ激動藥羅格列酮均與GDM模型大鼠糖脂代謝、炎癥和氧化應激反應的改善密切相關[25]。本研究結果顯示,GDM組大鼠胎盤組織中PPARγ蛋白及mRNA、AMPK mRNA(mRNA檢測無法區分總蛋白及磷酸化產物)以及p-AMPK蛋白的表達量均顯著降低,NF-κB蛋白及mRNA的表達量均顯著增加,提示GDM模型大鼠的PPARγ途徑受到了抑制,與相關研究的結果[9]一致。經桑葉總黃酮干預后,各給藥組大鼠胎盤組織中PPARγ蛋白及mRNA、AMPK mRNA以及p-AMPK蛋白的表達量均顯著升高,NF-κB蛋白及mRNA的表達量均顯著降低,提示桑葉總黃酮能夠促進PPARγ途徑的激活,這可能是桑葉總黃酮發揮抗炎和抗氧化應激作用的可能機制之一。
綜上所述,桑葉總黃酮對GDM模型大鼠的糖脂代謝、炎癥和氧化應激均具有一定的改善作用,其機制可能與激活PPARγ途徑有關。本研究首次闡明了桑葉總黃酮用于治療GDM的價值,為該癥的防治提供了新思路。本課題組后續將在應用桑葉總黃酮的基礎上聯合PPARγ抑制劑,以進一步驗證桑葉總黃酮通過激活PPARγ途徑來改善GDM的作用機制。
參考文獻
[ 1 ] LAW KP,ZHANG H. The pathogenesis and pathophysiology of gestational diabetes mellitus:deductions from a three-part longitudinal metabolomics study in China[J]. Clin Chim Acta,2017. DOI:10.1016/j.cca.2017.02.008.
[ 2 ] CHATUPHONPRASERT W,JARUKAMJORN K,ELLIN- GER I. Physiology and pathophysiology of steroid biosynthesis,transport and metabolism in the human placenta[J]. Front Pharmacol,2018. DOI:10.3389/fphar.2018.01027.
[ 3 ] WHITE SL,PASUPATHY D,SATTAR N,et al. Metabolic profiling of gestational diabetes in obese women during pregnancy[J]. Diabetologia,2017,60(10):1903-1912.
[ 4 ] TASCHEREAU-CHARRON A,DA SILVA MS,BILODE- AU JF,et al. Alterations of fatty acid profiles in gestational diabetes and influence of the diet[J]. Maturitas,2017. DOI:10.1016/j.maturitas.2017.01.014.
[ 5 ] SK?RZY?SKA-DZIDUSZKO KE,KIMBER-TROJNAR ?,PATRO-MA?YSZA J,et al. An interplay between obesity and inflammation in gestational diabetes mellitus[J]. Curr Pharm Biotechnol,2016,17(7):603-613.
[ 6 ] 孫鑫,馬志,孟慶海,等.桑酮堿對2型糖尿病db/db小鼠血糖及肝臟胰島素抵抗的影響[J].中成藥,2017,39(5):885-890.
[ 7 ] 穆曉燕,李先佳.桑葉總黃酮對2型糖尿病大鼠胰島B細胞的影響[J].中國實驗方劑學雜志,2013,19(11):213- 216.
[ 8 ] GAO Y,SHE R,SHA W. Gestational diabetes mellitus is associated with decreased adipose and placenta peroxisomeproliferator-activator receptor γ expression in a Chinese population[J]. Oncotarget,2017,8(69):113928- 113937.
[ 9 ] KNABL J,H?TTENBRENNER R,HUTTER S,et al. Peroxisome proliferator-activated receptor-gamma (PPARγ) is down regulated in trophoblast cells of gestational diabetes mellitus (GDM) and in trophoblast tumour cells BeWo in vitro after stimulation with PPARγ agonists[J]. J Perinat Med,2014,42(2):179-187.
[10] 湯夢雨,徐文婷,王彩紅,等.高脂飼料聯合鏈脲佐菌素誘導妊娠期糖尿病大鼠模型的優化方案[J].江蘇大學學報(醫學版),2018,28(5):393-396.
[11] 中華醫學會婦產科學分會產科學組,中華醫學會圍產醫學分會妊娠合并糖尿病協作組.妊娠合并糖尿病診治指南:2014[J].中華婦產科雜志,2014,49(8):561-569.
[12] 劉冬戀,凌保東,譚林,等.桑葉總黃酮對2型糖尿病大鼠肝臟過氧化物酶體增殖物激活受體α和腺苷酸活化蛋白激酶α2蛋白表達的影響[J].中國老年學雜志,2017,37(22):5521-5523.
[13] KHAMBULE L,GEORGE JA. The role of inflammation in the development o GDM and the use of markers of inflammation in GDM screening[J]. Adv Exp Med Biol,2019. DOI:10.1007/978-3-030-12668-1-12.
[14] JONES ML,BUHIMSCHI IA,ZHAO G,et al. Acute glucose load,inflammation,oxidative stress,nonenzymatic glycation,and screening for gestational diabetes[J]. Reprod Sci,2019. DOI:10.1177/1933719119831772.
[15] ZAMBON M,MAND? C,LISSONI A,et al. Inflammatory and oxidative responses in pregnancies with obesity and periodontal disease[J]. Reprod Sci,2018. DOI:10.1177/1933719117749758.
[16] SIWETZ M,BLASCHITZ A,El-Heliebi A,et al. TNF-α alters the inflammatory secretion profile of human first trimester placenta[J]. Lab Invest,2016,96(4):428-438.
[17] KHOSROWBEYGI A,REZVANFAR MR,AHMADVAND H. Tumor necrosis factor-α,adiponectin and their ratio in gestational diabetes mellitus[J]. Caspian J Intern Med,2018,9(1):71-79.
[18] ZHANG C,YANG Y,CHEN R,et al. Aberrant expression of oxidative stress related proteins affects the pregnancy outcome of gestational diabetes mellitus patients[J]. Am J Transl Res,2019,11(1):269-279.
[19] MAGED AM,TORKY H,FOUAD MA,et al. Role of antioxidants in gestational diabetes mellitus and relation to fetal outcome:a randomized controlled trial[J]. J Matern Fetal Neonatal Med,2016,29(24):4049-4054.
[20] CAI S,SUN W,FAN Y,et al. Effect of mulberry leaf (Folium Mori) on insulin resistance via IRS-1/PI3K/Glut-4 signalling pathway in type 2 diabetes mellitus rats[J]. Pharm Biol,2016,54(11):2685-2691.
[21] WEI J,LI X,GAO J. Insulin secretion and tolerance of women with different gestational glucose regulation one year postpartum[J]. Int J Clin Exp Med,2015,8(4):6384-6387.
[22] ZHANG Y,HUANG X,ZHOU J,et al. PPARγ provides anti-inflammatory and protective effects in intrahepatic cholestasis of pregnancy through NF-κB pathway[J]. Biochem Biophys Res Commun,2018,504(4):834-842.
[23] PHAM J,ARUL NAMBI RAJAN K,LI P,et al. The role of Sirtuin1-PPARγ axis in placental development and fun- ction[J]. J Mol Endocrinol,2018,60(4):R201-R212.
[24] KOHAN-GHADR HR,KILBURN BA,KADAM L,et al. Rosiglitazone augments antioxidant response in the human trophoblast and prevents apoptosis[J]. Biol Reprod,2019,100(2):479-494.
[25] 徐夢,馬艷玲,趙奇紅,等. PPARγ激動劑對妊娠期糖尿病小鼠氧化應激和炎癥水平的影響[J].中華疾病控制雜志,2018,22(2):195-198.
(收稿日期:2019-06-21 修回日期:2020-01-06)
(編輯:張元媛)

