二甲雙胍抑制賴氨酸特異性組蛋白去甲基化酶1介導的卵巢癌細胞增殖和遷移
韓田田, 孟紅霞, 趙康容, 孫愛琴, 楊萬年, 邵根寶
(江蘇大學醫學院, 江蘇 鎮江 212013)
二甲雙胍是治療2型糖尿病的一線藥物[1]。近來研究表明,二甲雙胍具有抗癌、免疫調節和抗衰老作用[2]。有文獻報道二甲雙胍可以抑制卵巢癌細胞增殖和遷移[3]。然而,其具體機制仍未闡明。賴氨酸特異性組蛋白去甲基化酶1(lysine specific demethylase 1,LSD1)是第一個鑒定出的組蛋白去甲基化酶,其通過對單甲基化和二甲基化的組蛋白H3第4位賴氨酸(H3K4me1/2)去甲基化抑制基因轉錄[4]。LSD1在多種腫瘤中呈高表達,如卵巢癌[5]、肺癌[6]、乳腺癌[7]和胃癌[8]等,其過表達與患者生存率呈負相關[9]。臨床已將LSD1確定為癌癥治療靶標[10]。關于抑制LSD1表達對于卵巢癌的靶向治療影響尚不清楚。本研究擬通過免疫印跡檢測二甲雙胍抑制LSD1蛋白表達和PI3K/AKT通路蛋白表達,并進一步敲低LSD1,觀察其在二甲雙胍抑制卵巢癌細胞增殖和遷移中的作用。
1 材料和方法
1.1 細胞和細胞培養
卵巢上皮癌HO8910和SKOV3細胞株為本實驗室長期保存;多西環素誘導型穩定敲低LSD1的HO8910和SKOV3細胞株(HO8910-shLSD1和SKOV3-shLSD1)是用pLKO-Tet-puro慢病毒誘導型載體構建,參考文獻[11]。HO8910和SKOV3細胞在含有10%胎牛血清的高糖DMEM中,于37 ℃、5%CO2的培養箱中培養。
1.2 抗體和試劑
兔單克隆抗體LSD1、凋亡抑制蛋白(Survivin)、組蛋白H3、組蛋白H3第4位賴氨酸二甲基化(H3K4me2)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,PKB/AKT)、磷酸化蛋白激酶B(p-AKT)、E-鈣黏蛋白、波形蛋白和鋅指轉錄蛋白(Snail)均為美國Cell Signaling 公司產品;兔單克隆抗體β-微管蛋白(美國Bioworld公司);兔單克隆抗體P21(美國Abcam公司);HRP標記的羊抗兔抗體、總RNA抽提試劑盒(上海Sangon公司);二甲雙胍(北京索萊寶公司);多西環素(美國Sigma-Aldrich公司);5-乙炔基-2′脫氧尿嘧啶核苷(5-Ethyny1-2′-deoxyuridine,EdU)檢測試劑盒(廣東銳博公司);Transwell小室(美國Corning公司);2×SYBR Green PCR預混液、反轉錄試劑盒(日本TaKaRa公司);PVDF膜(美國Millipore公司);ECL顯影試劑(上海碧云天公司)。
1.3 EdU染色法檢測不同濃度二甲雙胍處理后細胞的增殖能力
取HO8910和SKOV3兩種卵巢癌細胞株,每種細胞以5×103個/孔密度接種于96孔板,按二甲雙胍不同處理濃度(0、5、10和20 mmol/L)分為4組,每組設3個復孔。培養24 h后細胞貼壁,嚴格按照EdU檢測試劑盒說明書對細胞進行染色,EdU綠色熒光代表正處于DNA復制期的細胞,DAPI熒光代表所有的活細胞。顯微鏡下觀察并計數EdU陽性細胞數。細胞增殖率(%)=EdU陽性細胞數/所有活細胞×100%。實驗重復3次。
1.4 EdU實驗檢測二甲雙胍處理和敲低LSD1后卵巢癌細胞的增殖能力
取HO8910-shLSD1和SKOV3-shLSD1兩種細胞株,每種細胞分為對照組、二甲雙胍處理組和敲低LSD1組,分別予以PBS,10 mmol/L二甲雙胍,100 ng/mL多西環素處理48 h。采用EdU實驗檢測細胞增殖能力。具體實驗操作方法同“1.3”。實驗重復3次。
1.5 遷移實驗檢測細胞遷移能力
取“1.3”和“1.4”分組細胞,制備成不含血清的細胞懸液,每個Transwell小室上室接種2×104個細胞,Transwell下室加入500 μL含血清的DMEM。在37 ℃、5%CO2培養箱中孵育24 h;用棉簽擦拭膜表面未遷移的細胞;4%低聚甲醛固定30 min;室溫下用0.1%結晶紫染色20 min。顯微鏡下隨機選擇5個視野細胞,拍照并計數。實驗重復3次。
1.6 實時熒光定量PCR檢測LSD1 mRNA表達水平
取“1.3”分組細胞,嚴格按照RNA抽提試劑盒說明書提取細胞RNA,并用紫外分光光度計檢測RNA濃度和純度。采用反轉錄試劑盒將RNA反轉錄為cDNA。然后以cDNA為模板進行PCR擴增。LSD1引物序列:上游,5′-CAAGTGTCAATTTGTTCGGG-3′;下游,5′-TTCTTTGGGCTGAGGTACTG-3′;GAPDH引物序列:上游,5′-GCAAATTCCATGGCACCGTC-3′,下游,5′-TCGCCCCACTTGATTTTGG-3′,以GAPDH為內參。PCR擴增條件: 95 ℃初始變性30 s,95 ℃變性5 s,60 ℃退火30 s,共40個循環。基因的相對表達量用2-ΔΔCt值表示。實驗重復3次。
1.7 免疫印跡檢測LSD1、增殖相關蛋白、遷移相關蛋白及PI3K/AKT通路蛋白的表達
取“1.3”和“1.4”分組細胞,PBS洗2次,用含蛋白酶抑制劑的蛋白裂解液裂解細胞30 min;4℃行12 000×g離心15 min,上清液即為蛋白樣品。將蛋白樣品行10% SDS-PAGE,80 V電壓30 min,110 V電壓100 min;300 mA恒流130 min轉移至PVDF膜;5%脫脂奶粉室溫封閉1 h;加入一抗和β-微管蛋白于4℃搖床孵育過夜;次日TBST洗滌3遍,每次8 min;加入二抗室溫反應1 h;ECL顯影,用Image J軟件定量,與內參β-微管蛋白比較。一抗LSD1、Survivin、P21、組蛋白H3、H3K4me2、E-鈣黏蛋白、波形蛋白、Snail、PI3K、p-AKT、AKT稀釋比均為1 ∶1 000、β-微管蛋白稀釋比為1 ∶5 000;二抗稀釋比為1 ∶5 000。實驗重復3次。
1.8 統計分析
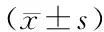
2 結果
2.1 二甲雙胍抑制卵巢癌細胞增殖
EdU結果顯示,與0 mmol/L組相比,卵巢癌HO8910細胞和SKOV3細胞5、10、20 mmol/L組細胞增殖率顯著降低(P均<0.01),二甲雙胍處理組細胞增殖受到明顯抑制,呈濃度依賴性。見圖1。免疫印跡結果顯示,與0 mmol/L組相比,HO8910和SKOV3細胞中10、20 mmol/L組Survivin 表達顯著降低(P<0.01或P<0.05),P21表達顯著升高(P均<0.01)。見圖2。
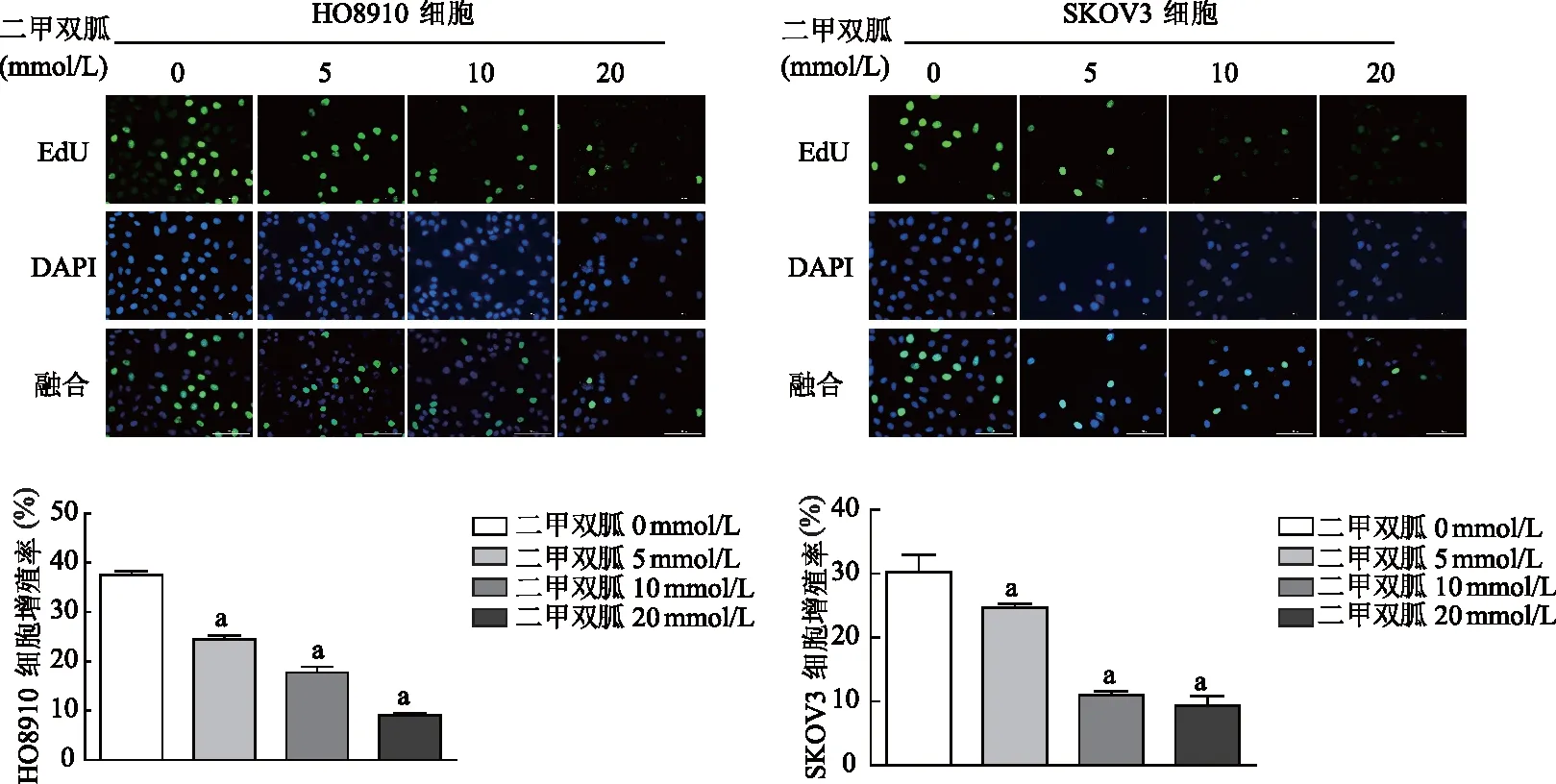
a:P<0.01,與0 mmol/L組比較
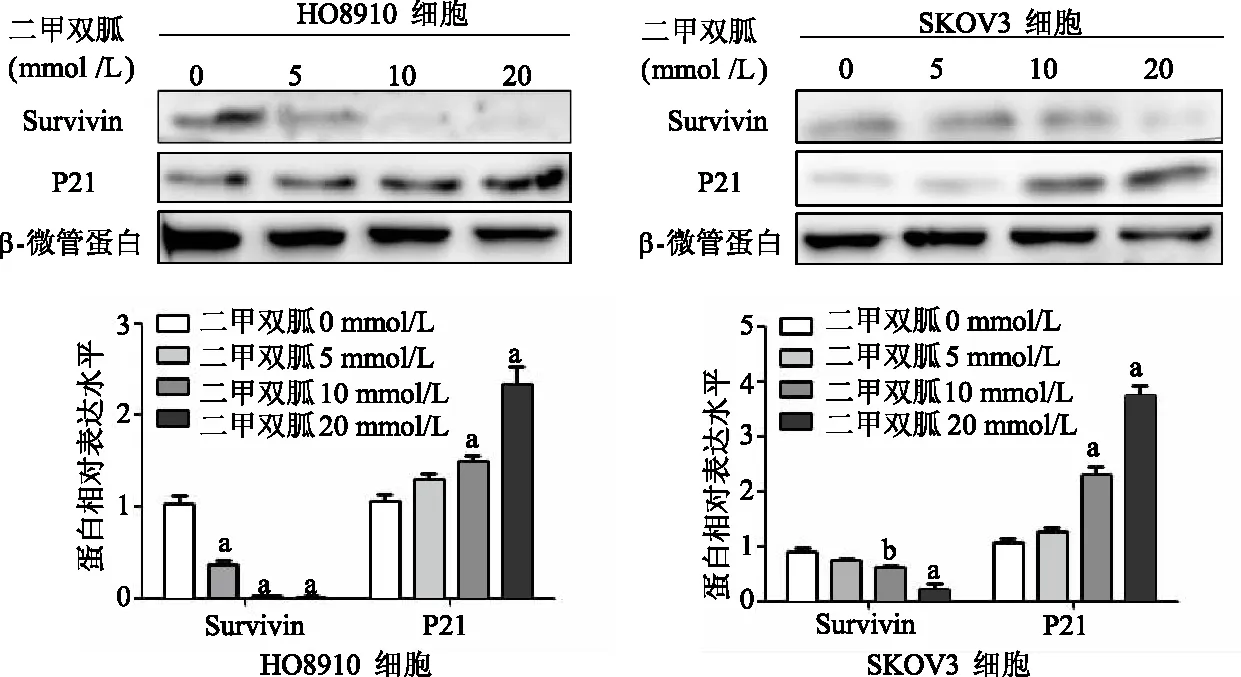
a:P<0.01,b:P<0.05,與0 mmol/L組比較
2.2 二甲雙胍抑制卵巢癌細胞遷移
遷移實驗結果顯示,與0 mmol/L組相比,HO8910細胞和SKOV3細胞中5、10、20 mmol/L組細胞遷移數均顯著減少(P均<0.01),二甲雙胍處理組細胞遷移受到明顯抑制,呈濃度依賴。見圖3。免疫印跡結果顯示,HO8910細胞中,與0 mmol/L組相比,5、10、20 mmol/L組E-鈣黏蛋白表達顯著升高(P均<0.01),波形蛋白和Snail表達顯著降低(P均<0.01)。SKOV3細胞中,與0 mmol/L組相比,10、20 mmol/L組E-鈣黏蛋白表達顯著升高(P均<0.01),波形蛋白和Snail表達顯著降低(P均<0.01)。見圖4。
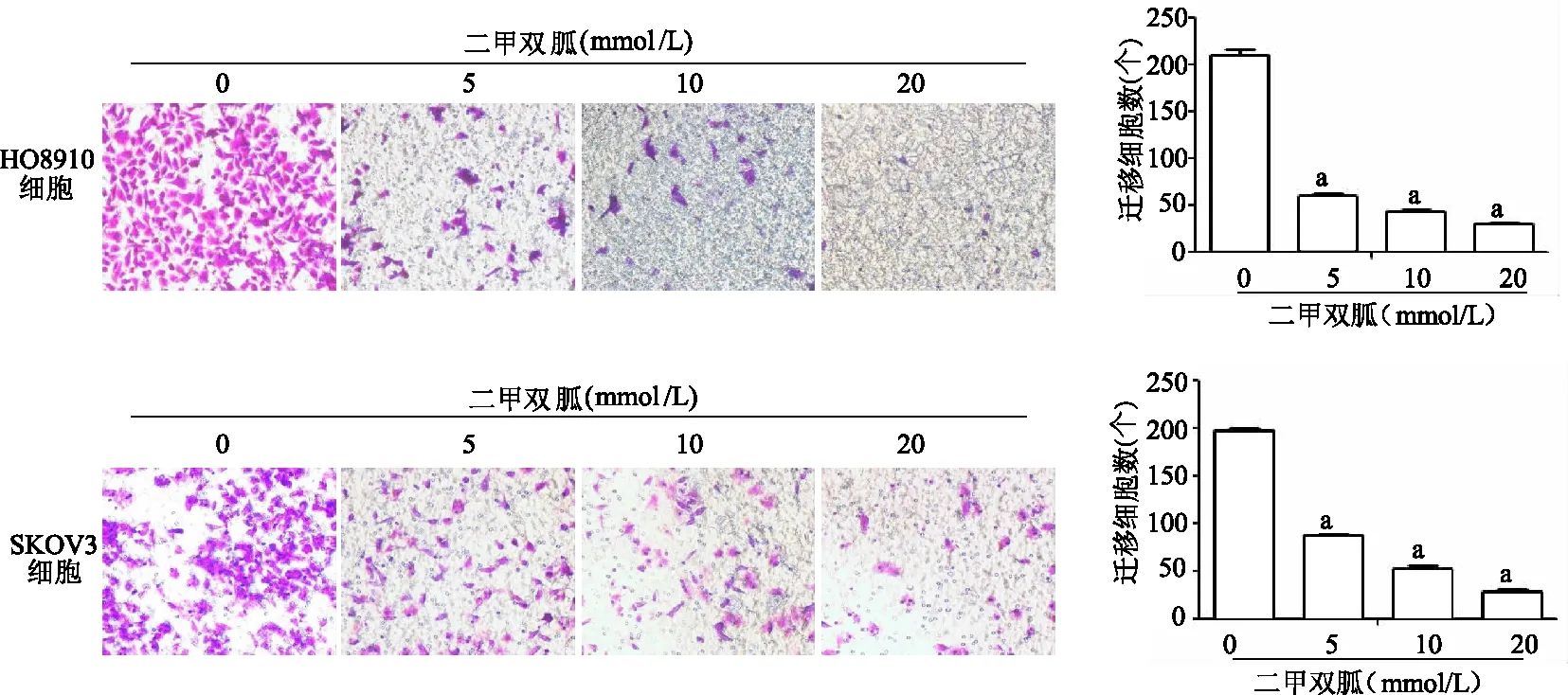
a:P<0.01,與0 mmol/L組比較

a:P<0.01,與對照組比較
2.3 二甲雙胍下調LSD1蛋白表達
免疫印跡結果顯示,隨著二甲雙胍濃度升高,HO8910細胞和SKOV3細胞中5、10、20 mmol/L組LSD1蛋白表達水平較0 mmol/L組明顯降低(P<0.05或P<0.01),其底物H3K4me2蛋白表達水平明顯升高(P均<0.01)。見圖5。qRT-PCR結果顯示,與0 mmol/L處理組相比,HO8910和SKOV3細胞中5、10、20 mmol/L處理組LSD1 mRNA表達水平無明顯變化(P均>0.05)。見圖6。
2.4 二甲雙胍抑制PI3K/AKT信號通路
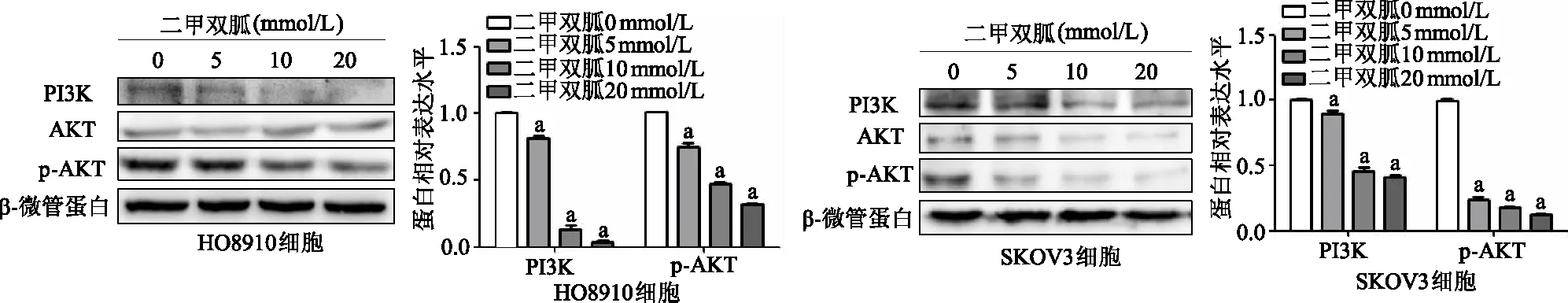
免疫印跡結果顯示,隨著二甲雙胍濃度升高,HO8910和SKOV3細胞中5、10、20 mmol/L組p-AKT 和PI3K 蛋白表達均較0 mmol/L組明顯降低(P均<0.01)。見圖7。

a:P<0.05,b:P<0.01,與0 mmol/L組比較
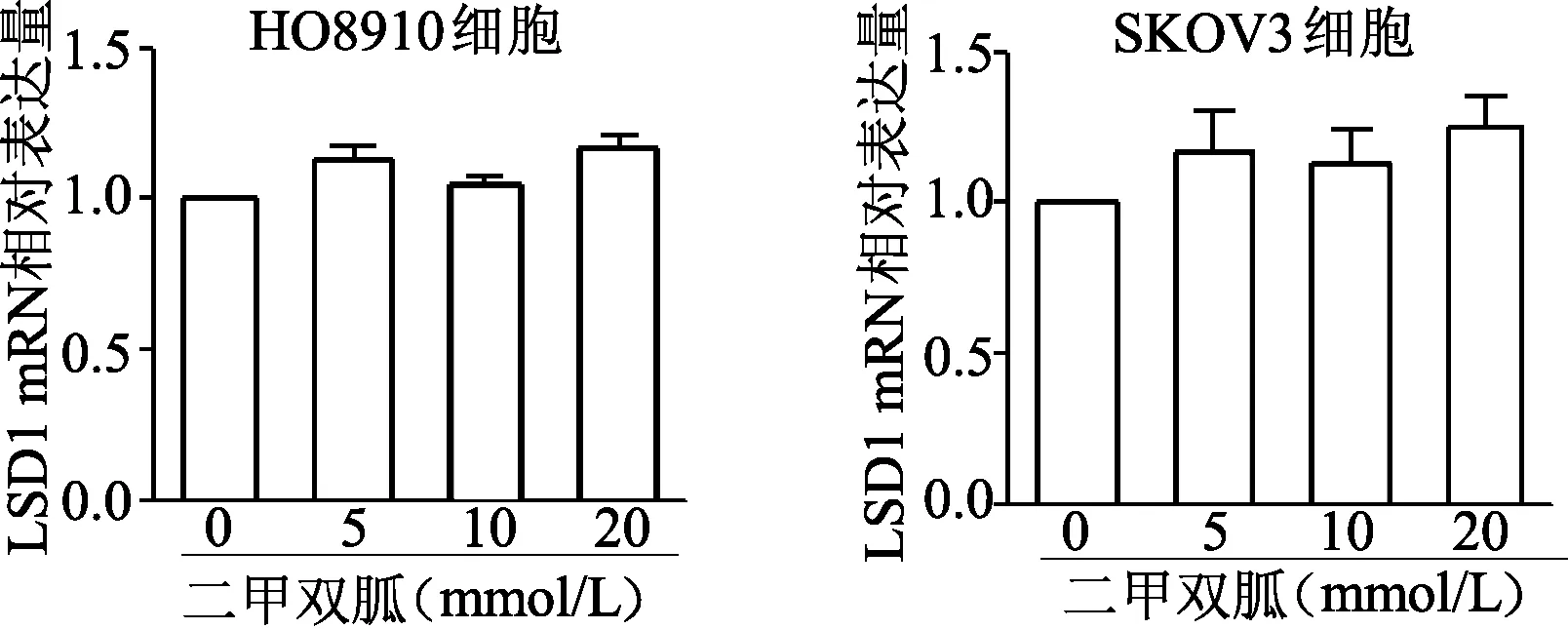
圖6 實時定量PCR檢測不同濃度二甲雙胍處理后各組細胞LSD1 mRNA水平
2.5 二甲雙胍處理和敲低LSD1均抑制細胞增殖
EdU結果顯示,HO8910-shLSD1細胞和SKOV3-shLSD1細胞中對照組細胞增殖率均顯著高于二甲雙胍處理組和敲低LSD1組(P均<0.01)。見圖8。免疫印跡結果顯示,與對照組相比,HO8910-shLSD1細胞和SKOV3-shLSD1細胞中二甲雙胍處理組和敲低LSD1組Survivin表達顯著降低(P均<0.01),P21表達顯著升高(P均<0.01)。見圖9。
a:P<0.01,與0 mmol/L組比較
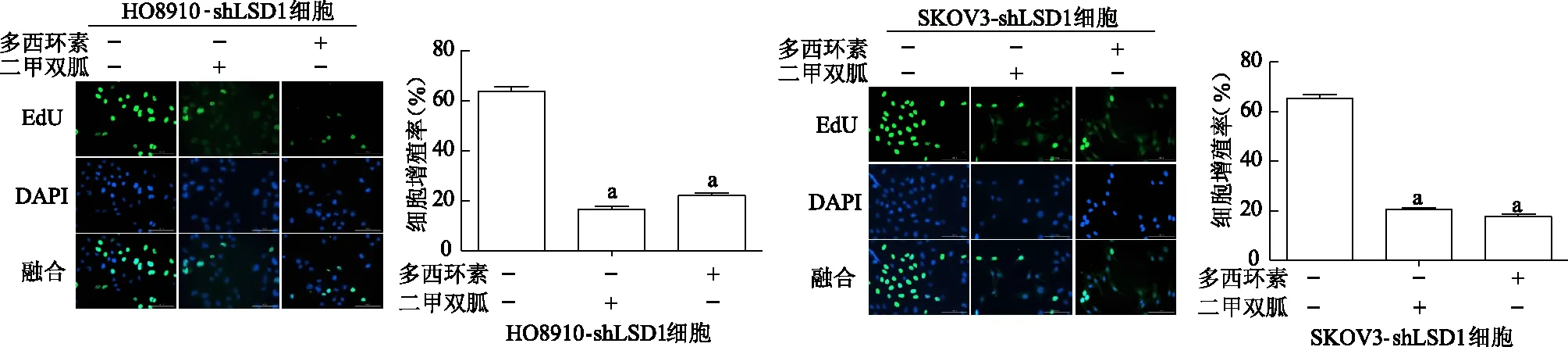
a:P<0.01,與對照組比較
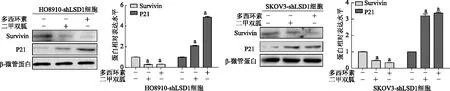
a:P<0.01,與對照組比較
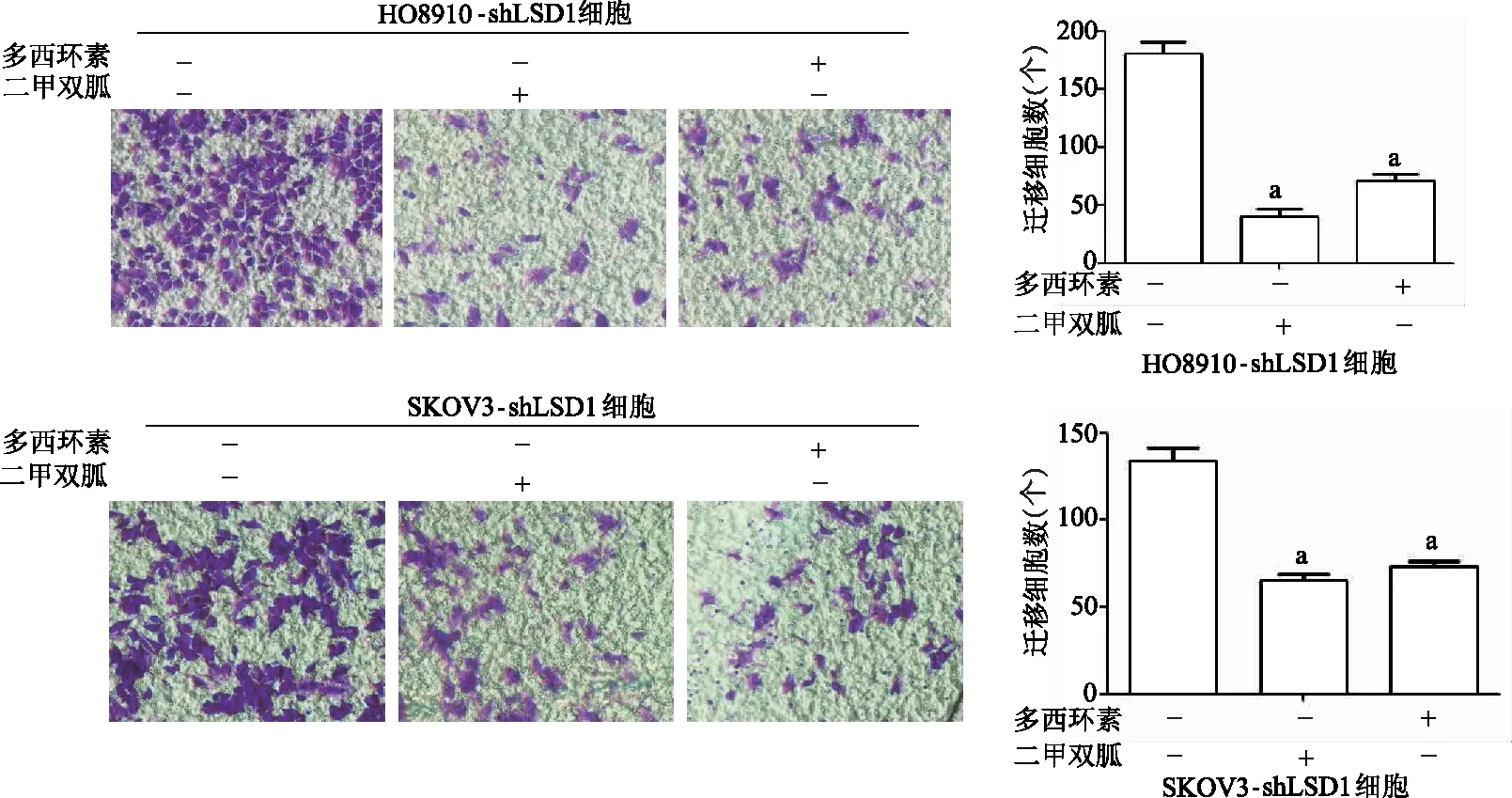
2.6 二甲雙胍處理和敲低LSD1均抑制細胞遷移
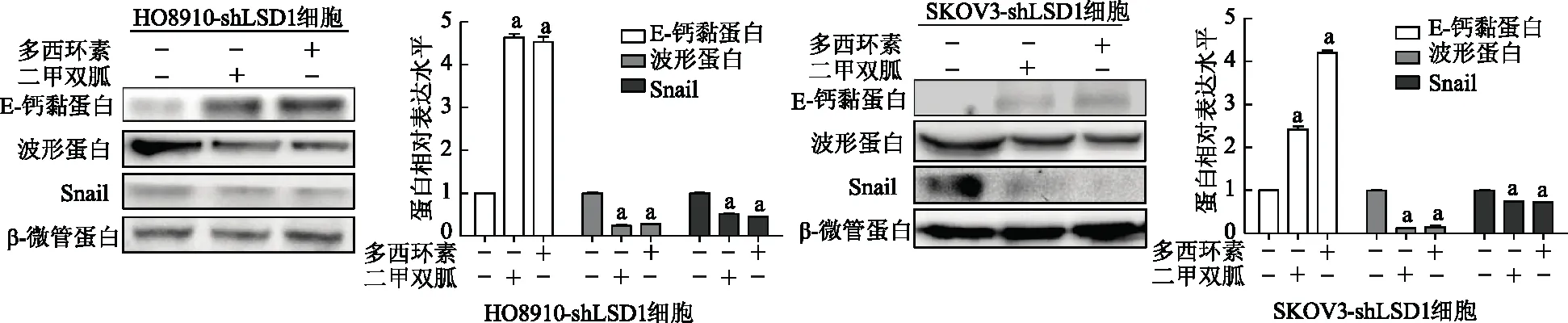
遷移實驗結果顯示,HO8910-shLSD1細胞和SKOV3-shLSD1細胞中對照組細胞遷移數均顯著高于二甲雙胍處理組和敲低LSD1組(P均<0.01)。見圖10。免疫印跡結果顯示,與對照組相比,HO8910-shLSD1細胞和SKOV3-shLSD1細胞中二甲雙胍處理組和敲低LSD1組E-鈣黏蛋白表達顯著升高(P均<0.01),波形蛋白和Snail蛋白表達顯著降低(P均<0.01)。見圖11。
3 討論
本研究采用HO8910和SKOV3兩種卵巢癌細胞株,通過EdU實驗和遷移實驗證實二甲雙胍抑制卵巢癌細胞增殖和遷移,PI3K/AKT/LSD1信號軸介導二甲雙胍對卵巢癌細胞的增殖和遷移。
研究報道,卵巢癌患者經二甲雙胍治療可降低疾病死亡率和復發率[12]。也有研究發現,二甲雙胍可改變卵巢癌細胞代謝并抑制腫瘤生長[13]。另有研究表明,Survivin表達降低、P21表達升高代表腫瘤細胞增殖能力降低,E-鈣黏蛋白表達降低、波形蛋白和Snail表達升高代表腫瘤細胞遷移能力增強[8]。本研究結果顯示二甲雙胍對卵巢癌HO8910和SKOV3細胞增殖和遷移具有抑制作用,且呈濃度依賴性。用不同濃度二甲雙胍處理HO8910和SKOV3細胞后,細胞增殖率明顯降低,且Survivin表達顯著升高,P21表達顯著降低。與0 mmol/L相比,細胞在二甲雙胍作用下遷移能力顯著降低,且E-鈣黏蛋白表達顯著降低,波形蛋白和Snail表達顯著升高。由此表明,二甲雙胍可以抑制卵巢癌細胞增殖和遷移。
a:P<0.01,與對照組比較
a:P<0.01 ,與對照組比較
關于二甲雙胍抗腫瘤作用的研究多集中于AMPK信號通路[14]。也有研究發現二甲雙胍可通過PI3K/AKT信號通路影響細胞增殖[15],但具體機制仍不清楚。研究發現,LSD1在卵巢癌細胞中呈高表達[16],其可通過多種作用方式調控卵巢癌的發生發展[9]。本研究結果顯示,HO8910和SKOV3細胞經不同濃度二甲雙胍處理后,5、10、20 mmol/L組LSD1蛋白表達水平較對照組逐漸降低,且呈濃度依賴性,其底物H3K4me2蛋白表達水平逐漸升高。由此表明,二甲雙胍可抑制卵巢癌細胞中LSD1蛋白表達以及LSD1去甲基化酶活性。我們之前的研究表明,LSD1受PI3K/AKT信號通路調控[16]。本研究結果顯示,不同濃度二甲雙胍處理細胞后,p-AKT和PI3K蛋白表達水平顯著降低,且呈濃度依賴性。由此表明,二甲雙胍可負調控PI3K/AKT信號通路,進而抑制LSD1蛋白表達及其去甲基化酶活性。
研究表明,過表達LSD1可促進卵巢癌細胞增殖[16]。另有研究發現,LSD1介導的表觀遺傳修飾促進卵巢癌細胞遷移和侵襲[17]。為進一步驗證LSD1與二甲雙胍抑制卵巢癌細胞增殖和遷移的相關性,本實驗采用誘導性穩定敲低LSD1的細胞株檢測二甲雙胍處理和敲低LSD1后細胞的增殖和遷移能力。根據上述結果,選擇10 mmol/L二甲雙胍作為實驗濃度。結果顯示,二甲雙胍處理和敲低LSD1后,細胞增殖率均顯著降低,且Survivin表達均顯著降低,P21表達均顯著升高。此外,E-鈣黏蛋白表達均顯著升高,波形蛋白和Snail表達均顯著降低。由此表明,二甲雙胍處理和敲低LSD1產生的作用相似,均顯著抑制卵巢癌細胞增殖和遷移,提示LSD1可能是二甲雙胍抑制卵巢癌細胞增殖和遷移的靶標。
綜上所述,二甲雙胍在卵巢癌細胞中通過抑制PI3K/AKT信號通路及LSD1蛋白表達進而抑制卵巢癌細胞增殖和遷移。PI3K/AKT通路對LSD1的調控作用是否與表觀遺傳修飾有關仍要進一步研究。

