miR-155-5p對急性髓系白血病細胞凋亡的影響及可能機制
鄧之奎, 朱偉
(1. 江蘇大學醫學院, 江蘇 鎮江 212013; 2. 淮安市第一人民醫院血液科實驗室, 江蘇 淮安 223300)
近年來,隨著化療、造血干細胞移植、免疫治療、分子靶向治療等技術的進步,急性髓系白血病(acute myeloid leukemia,AML)患者大多能獲得完全緩解,標準的一線誘導化療方案能夠使60%~80%的年輕患者以及40%~60%的老年患者獲得緩解,然而,仍有60%的患者緩解后面臨復發的風險[1]。耐藥是AML患者治療失敗、生存率低的關鍵因素[2],然而AML耐藥的確切機制尚不完全明確。近年來,AML耐藥機制的研究主要集中在耐藥相關蛋白及酶異常、基因突變、miRNAs的改變以及耐藥相關信號通路的異常活化[3]。本研究以AML患者骨髓單個核細胞(BMMNC)以及AML細胞系為研究對象,探討miR-155-5p對AML細胞凋亡的影響及可能機制,為臨床克服AML患者化療耐藥、提高療效提供實驗依據。
1 材料和方法
1.1 BMMNC采集
收集本院2016年1月至2018年12月43例AML患者,診斷標準參照WHO急性白血病臨床分型(2016),所有患者均經細胞形態學、免疫分型、細胞遺傳學和分子學(MICM)確診。患者的中位年齡36(18~75)歲,男24例,女19例。采用Ficoll密度梯度離心法分離出BMMNC,分裝至1.5 mL EP管內(每管細胞數約1×106),保存于-80 ℃低溫冰箱。對照組為21例缺鐵性貧血患者。標本采集經淮安市第一人民醫院醫學倫理委員會批準,并獲得患者本人知情同意。
1.2 細胞系及培養
HL-60、THP-1細胞系購于美國ATCC細胞庫(美國Virginia公司),用含有10%胎牛血清、100 mg/mL鏈霉素和100 U/mL青霉素的RPMI-1640培養基(美國Invitrogen公司)于37℃、5% CO2的飽和濕度培養箱中培養,每隔48~72 h換培養液1次,取對數生長期細胞用于后續實驗。
1.3 試劑
Bcl-2抗體(美國Proteintech公司);NF-κB(p65)抗體、β-肌動蛋白抗體、羊抗鼠IgG-HRP抗體、羊抗兔IgG-HRP抗體(美國Cell signaling Technology公司);ECL檢測發光試劑盒(美國Bioworld Technology公司);細胞凋亡試劑盒(德國MiltenyiBiotec公司);總蛋白提取試劑盒(南京諾唯贊公司);qRT-PCR相關的逆轉錄及擴增試劑盒(中國Vazyme公司);PVDF膜(中國凱基生物科技有限公司);CCK-8試劑盒(日本同仁生物科技有限公司);miR-155-5p轉染試劑盒(上海生工生物科技有限公司)。
1.4 qRT-PCR檢測BMMNC中miR-155-5p和Bcl-2 mRNA的表達
Trizol法提取BMMNC的總RNA,通過逆轉錄試劑盒,Oligo引物及逆轉錄酶將總RNA逆轉錄為cDNA。miR-155-5p特異引物為5′-TTAATGCTAATCGTGATAGGGGT-3′;Bcl-2上游引物為5′-CCCCACAGTCTACTGTAAG-3′,下游引物為5′-GCATTGCCGATGGTACTGATT-3′;β-肌動蛋白上游引物為5′-GGCATCGTGATGGACTCCG-3′,下游引物為5′-GCTGGAAGGTGGACAGCGA-3′。定量PCR(美國應用生物系統公司7300擴增儀)反應程序為95℃ 3 min,95℃ 30 s,40個循環,62℃ 40 s。擴增結果以β-肌動蛋白作為內參基因,采用ΔΔCt法計算相對定量。
1.5 細胞轉染
miR-155-5p類似物:5′-GAUAGUUCGGUGUGCACA-3′,miR-155-5p類似物對照:5′-AUGGUCGUUAAGCCAGUG-3′;miR-155-5p抑制劑:5′-CGGAUAUGUGCAGUGCUA-3′,miR-155-5p 抑制劑對照:5′-AGGCAGUGUCGUCAAUUG-3′。依據轉染試劑盒說明書,取對數生長期的HL-60、THP-1細胞分別接種于6孔板,次日細胞匯合度達30%~50%時,加入混勻后的脂質體2000和miR-155-5p類似物或抑制劑,室溫孵育30 min,置于37℃、5%CO2的孵育箱中轉染6 h后換液,繼續培養48 h。qRT-PCR驗證轉染效率,方法同步驟“1.4”。
1.6 CCK-8法檢測HL-60和THP-1轉染細胞的活性
取轉染后處于對數生長期的HL-60、THP-1細胞,以4×104/mL的密度接種于96孔培養板中,每孔體積為100 μL。加入不同濃度的化療藥物阿糖胞苷(終濃度為0、0.01、0.02、0.04、0.08、0.16、0.32、0.64和1.28 μg/mL),置于37℃、5% CO2的培養箱中孵育48 h,棄去上清液,每孔中加入100 μL PBS和10 μL的WST-8試劑,避光37℃溫箱孵育2 h后用酶標儀檢測光密度(D)值,檢測波長為480 nm。每個濃度設置3個復孔。
1.7 流式細胞術檢測HL-60和THP-1轉染細胞的凋亡率
將轉染后的HL-60、THP-1細胞以每孔1×105個的密度接種于6孔板中,各設3個復孔,待細胞貼壁后,加入阿糖胞苷(0.16 μg/mL)處理48 h后,用酶消化法收集細胞于1.5 mL EP管中,1 000 r/min離心10 min,PBS洗滌1次,每管加入200 μL結合液、5 μL Annexin V試劑和10 μL PI試劑,避光室溫孵育10 min后置于冰上。流式細胞儀檢測細胞凋亡率。
1.8 qRT-PCR法檢測轉染miR-155-5p抑制劑后HL-60和THP-1細胞NF-κB、Bcl-2的mRNA表達
Trizol法提取轉染miR-155-5p抑制劑后HL-60和THP-1細胞的總RNA,通過逆轉錄試劑盒,Oligo引物及逆轉錄酶將總RNA逆轉錄為cDNA。NF-κB上游引物為5′-CCTATGTGGAGATCATTGAGCA-3′,下游引物為5′-CAAAGATGGGATGAGAAAGGAC-3′;Bcl-2上游引物為5′-CCCCACAGTCTACTGTAAG-3′,下游引物為5′-GCATTGCCGATGGTACTGATT-3′;β-肌動蛋白上游引物為5′-GGCATCGTGATGGACTCCG-3′,下游引物為5′-GCTGGAAGGTGGACA GCGA-3′。定量PCR(美國應用生物系統公司7300擴增儀)反應體系:上下游引物各1 μL、Taq DNA聚合酶12.5 μL、模板cDNA 2 μL、去離子水8.5 μL,總反應體系25 μL。擴增條件:95℃預變性3 min,94℃ 30 s,66℃ 30 s,72℃ 1 min,共35個循環,72℃ 5 min。擴增結果以β-肌動蛋白作為內參基因,采用ΔΔCt法計算相對定量。
1.9 蛋白質印跡法檢測轉染miR-155-5p抑制劑后HL-60和THP-1細胞NF-κB、Bcl-2的蛋白表達
6孔板每孔用1 mL PBS洗滌1次,置于冰上,每孔加入70 μL含蛋白酶抑制劑的細胞裂解液,細胞刮刀順同一方向將轉染miR-155-5p抑制劑后的AML細胞輕輕刮下,吸取每孔中的蛋白裂解液至1.5 mL EP管中,振蕩器振蕩混勻1 min,置于冰上10 min后繼續振蕩1 min,重復3次,4℃、12 000×g離心15 min后吸取上清液至新EP管中,按照4 ∶1的比例加入5×上樣緩沖液,水浴煮沸8 min,-20℃短期保存。取50 μg蛋白質為上樣量,先經80 V恒壓電泳,當蛋白進入積層膠時將電壓調至100 V恒壓電泳,待蛋白跑至膠底部后以350 mA恒流電轉2 h,將PVDF膜浸于5%脫脂牛奶中封閉1 h,分別加入一抗(NF-κB、Bcl-2、β-肌動蛋白,稀釋比例1 ∶1 000),4℃孵育過夜。次日以TBST洗滌3次,每次10 min,加入HRP標記的羊抗兔IgG二抗(稀釋比例1 ∶2 000),37 ℃溫育1 h,最后,加入Millipore的曝光液(A液和B液按1 ∶1的比例混合),采用化學發光凝膠成像系統進行檢測。
1.10 統計學處理
2 結果
2.1 miR-155-5p、Bcl-2在AML患者BMMNC中高表達
qRT-PCR結果顯示AML患者較缺鐵性貧血患者BMMNC的miR-155-5p和Bcl-2 mRNA表達明顯升高(圖1)。

圖1 miR-155-5p、Bcl-2在AML患者BMMNC中高表達
2.2 miR-155-5p對阿糖胞苷處理的HL-60和THP-1細胞活性和凋亡的影響
HL-60細胞轉染miR-155-5p類似物或抑制劑后,qRT-PCR檢測轉染效率,miR-155-5p表達較對照組有明顯差異(F=124.7,P<0.01),見圖2A。CCK-8及流式檢測結果顯示轉染miR-155-5p類似物的HL-60細胞經阿糖胞苷處理后細胞活性較對照組增加,細胞凋亡率明顯減少(t=6.806,P<0.01);而轉染miR-155-5p抑制劑組細胞活性降低,凋亡率明顯增加(t=3.790,P<0.01),見圖2B、C。qRT-PCR檢測THP-1細胞轉染miR-155-5p類似物或抑制劑轉染效率,miR-155-5p表達較對照組有明顯差異(F=295.3,P<0.01),見圖3A。阿糖胞苷處理后轉染miR-155-5p類似物的THP-1細胞活性增強,凋亡率減少(t=4.487,P<0.01);轉染miR-155-5p抑制劑的THP-1細胞活性降低,凋亡率增加(t=16.01,P<0.01),見圖3B、3C。
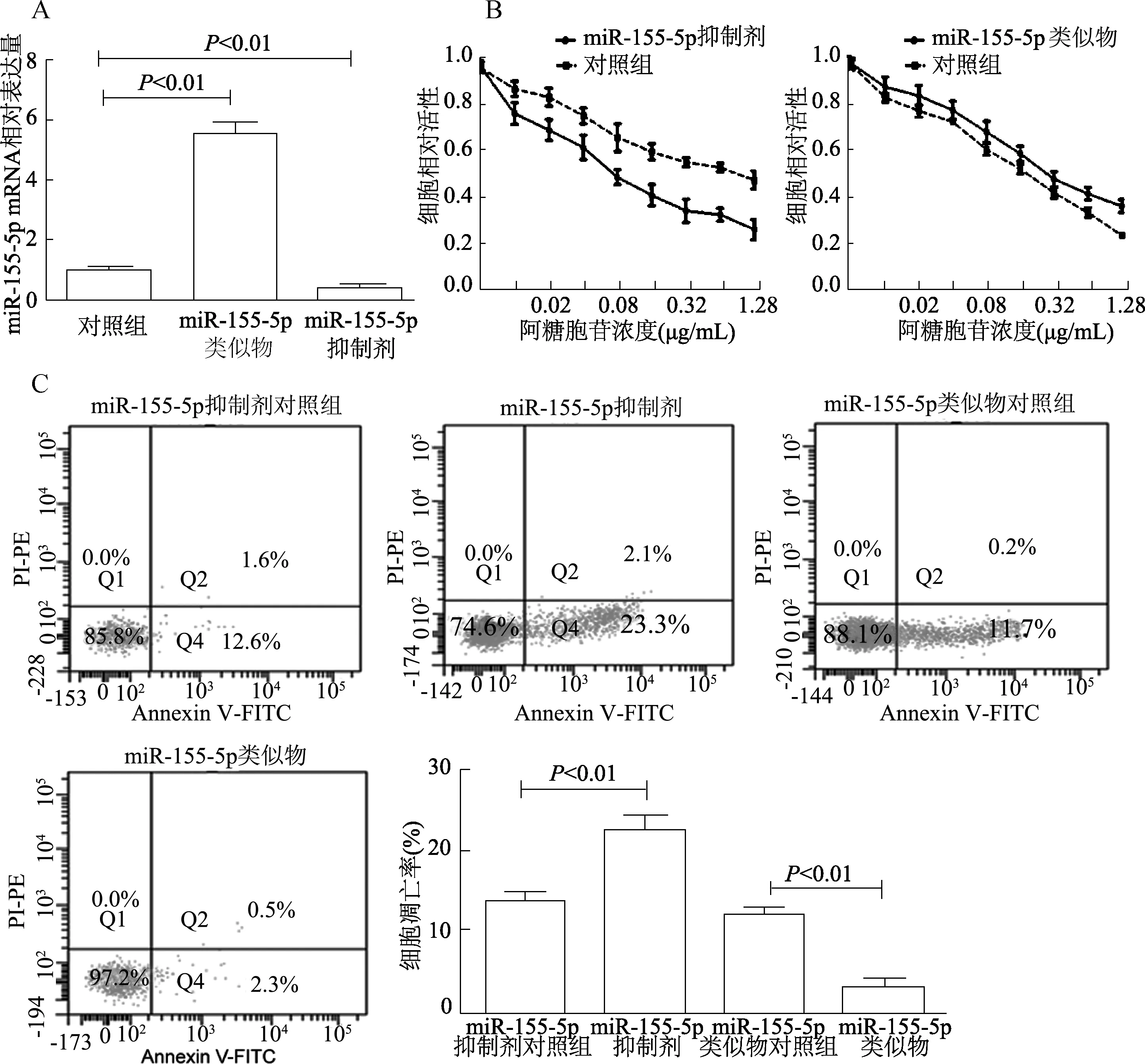
圖2 miR-155-5p對阿糖胞苷處理的HL-60細胞活性和凋亡的影響
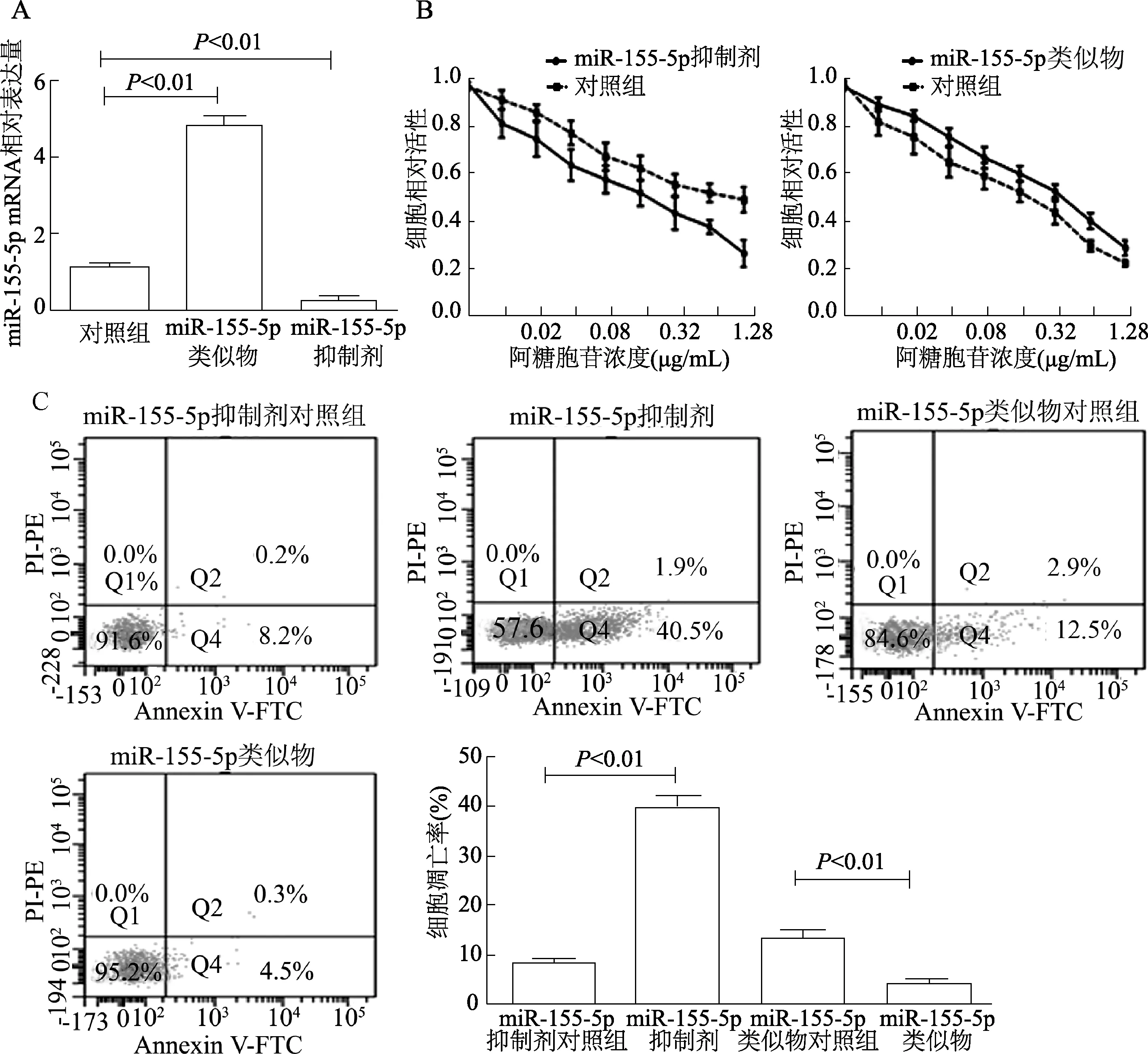
圖3 miR-155-5p對阿糖胞苷處理的THP-1細胞活性和凋亡的影響
2.3 抑制miR-155-5p后HL-60和THP-1細胞NF-κB、Bcl-2表達減少
qRT-PCR和蛋白質印跡結果顯示,HL-60細胞轉染miR-155-5p抑制劑后,NF-κB、Bcl-2在mRNA水平與蛋白水平的表達均下降(P均<0.05),見圖4A、4B。用THP-1細胞重復上述實驗進行驗證也發現同樣的結果(P均<0.05),見圖4C、4D。表明miR-155-5p可能通過上調NF-κB、Bcl-2抑制AML細胞凋亡。
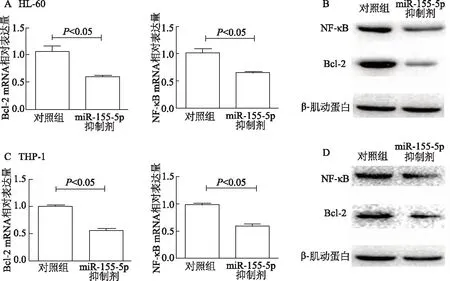
圖4 抑制miR-155-5p對HL-60、THP-1細胞NF-κB、Bcl-2表達的影響
3 討論
研究發現miRNAs主要通過調控DNA損傷、細胞周期以及細胞凋亡等介導腫瘤耐藥[4-6]。研究表明,miR-155在多種腫瘤組織中表達異常,并與臨床病理標志物、腫瘤分型和較低的存活率相關,能夠介導多種信號通路,包括NF-κB信號通路,NF-κB可直接結合miR-155的啟動子調控miR-155的表達。miR-155參與多種生理學過程,包括造血細胞分化、免疫反應、炎癥以及腫瘤治療耐藥[7-8]。miR-155在多種實體腫瘤的發病機制中起著至關重要的作用,Bayraktar等[7]通過對乳腺癌、結腸癌、肺癌、胰腺癌、前列腺癌和胃癌6個實體腫瘤的540個樣本的miRNA表達譜進行分析,發現miR-155的表達在乳腺癌、肺癌和結腸癌樣本中上調,并可促進包括乳腺癌和肺癌在內的幾種癌癥的腫瘤細胞生長、細胞遷移、侵襲以及上皮間質轉化。
miR-155除了在實體瘤的發生及耐藥中發揮重要作用外,也參與多種血液腫瘤的發病及耐藥。miR-155是血液系統腫瘤最具有特征性的致癌miRNA,包括彌漫大B細胞淋巴瘤、濾泡淋巴瘤、慢性淋巴細胞白血病、霍奇金淋巴瘤、合并FLT3-ITD基因突變的AML[9-12]。高表達的miR-155可以顯著增強腫瘤細胞活性,同時降低白血病細胞對化療藥物的敏感性[7]。研究證實miR-155在成人與兒童AML中高表達,特別是FLT3-ITD突變的AML,且高表達miR-155的AML患者預后較差[13]。本研究通過分析AML患者臨床樣本發現miR-155-5p、Bcl-2在AML患者BMMNC中表達明顯增高。
為了進一步驗證miR-155-5p在AML細胞生長及凋亡中的作用,在AML細胞系中,分別轉染miR-155-5p類似物與miR-155-5p抑制劑,發現轉染miR-155-5p類似物組細胞活性增加、凋亡減少,而轉染miR-155-5p抑制劑組細胞活性降低、凋亡增加,提示miR-155-5p可以提高AML細胞活性、抑制其凋亡。同時,在轉染miR-155-5p抑制劑的AML細胞中,NF-κB、Bcl-2的mRNA和蛋白水平表達均降低,提示miR-155-5p促進抗凋亡蛋白Bcl-2表達,并抑制AML細胞凋亡。
綜上,本研究結果顯示miR-155-5p、Bcl-2在AML患者BMMNC中高表達,在AML細胞中miR-155-5p可以促進AML細胞對阿糖胞苷的抗性、抑制其凋亡,miR-155-5p可能通過促進NF-κB、Bcl-2的表達抑制AML細胞凋亡。因此,miR-155-5p或可作為提高AML治療效果的分子靶標。

