CDCP1基因重組慢病毒表達(dá)載體的構(gòu)建及其對(duì)宮頸癌細(xì)胞增殖與遷移的影響
戚曉瑜, 王青霞, 李婉, 盧春
(南京醫(yī)科大學(xué)病原微生物學(xué)系, 江蘇 南京 211166)
CUB結(jié)構(gòu)域包含蛋白1(CDCP1)是一種細(xì)胞表面糖蛋白[1],可以在造血干細(xì)胞、間充質(zhì)干細(xì)胞和神經(jīng)元祖細(xì)胞中表達(dá)[2]。研究表明,CDCP1在多種癌癥細(xì)胞中高表達(dá),包括黑色素瘤[3]、肺癌[4]、胰腺癌[5]、腎細(xì)胞癌[6]和前列腺癌[7]等。CDCP1的異常表達(dá)與細(xì)胞的存活、遷移和侵襲能力密切相關(guān)[4-5,8],但其在宮頸癌發(fā)病過(guò)程中是否發(fā)揮作用目前并不清楚。
宮頸癌為女性子宮頸部形成的惡性腫瘤,是繼乳腺癌和結(jié)直腸癌后全球女性中第三大常見(jiàn)癌癥,由宮頸癌誘發(fā)的死亡病例中有86%發(fā)生在發(fā)展中國(guó)家。目前針對(duì)宮頸癌的治療方案主要包括手術(shù)治療、放射治療和化學(xué)治療[9]。基因靶向治療因?yàn)樾Ч@著且不良反應(yīng)小等優(yōu)勢(shì),已成為目前研究的重點(diǎn),其在宮頸癌治療領(lǐng)域也具有廣泛應(yīng)用前景[10],因此,鑒定宮頸癌發(fā)病過(guò)程中異常表達(dá)的基因在宮頸癌的預(yù)防、診斷和治療中具有重要的意義。
本研究中我們將CDCP1基因序列構(gòu)建到pHAGE-CMV-MCS-IzsGreen慢病毒載體上,通過(guò)慢病毒包裝系統(tǒng)獲得pHAGE-CDCP1重組慢病毒,進(jìn)一步感染宮頸癌HeLa細(xì)胞,獲得穩(wěn)定高表達(dá)CDCP1的HeLa細(xì)胞系,并通過(guò)CCK-8實(shí)驗(yàn)、劃痕實(shí)驗(yàn)和Transwell細(xì)胞遷移實(shí)驗(yàn)評(píng)估CDCP1對(duì)宮頸癌細(xì)胞增殖和遷移能力的影響。
1 材料與方法
1.1 材料
1.1.1 細(xì)胞和質(zhì)粒 慢病毒包裝系統(tǒng),包括包膜質(zhì)粒pMD2.G、包裝質(zhì)粒psPAX2以及慢病毒表達(dá)載體pHAGE-CMV-MCS-IzsGreen均為本實(shí)驗(yàn)室保存。人胚腎上皮293 T細(xì)胞、人宮頸癌HeLa細(xì)胞和人臍靜脈內(nèi)皮細(xì)胞(human umbilical vein endothelial cells,HUVECs)購(gòu)于中國(guó)科學(xué)院細(xì)胞庫(kù),均于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng),所用培養(yǎng)基為含有10%或20%的滅活胎牛血清(美國(guó) Gibco公司)的DMEM(美國(guó)Hyclone公司),其中分別加入100 μg/mL鏈霉素和100 U/mL氨芐西林。
1.1.2 試劑 本研究中所用PCR引物由生工生物工程(上海)股份有限公司合成;總RNA 提取試劑盒、RNA反轉(zhuǎn)錄試劑盒、PCR高保真酶(phanta酶)、質(zhì)粒小提試劑盒及凝膠純化試劑盒購(gòu)自南京諾唯贊科技有限公司;限制性內(nèi)切酶購(gòu)自日本TaKaRa公司;T4DNA連接酶、質(zhì)粒轉(zhuǎn)染試劑LipofectamineTM2000購(gòu)自美國(guó)Thermo Scientific公司;感受態(tài)大腸埃希菌DH5α、瓊脂粉購(gòu)自南京擎科生物科技有限公司;CCK-8試劑為日本Dojindo公司產(chǎn)品;基因組DNA提取試劑盒購(gòu)自天根生化科技有限公司;Flag標(biāo)簽抗體、辣根過(guò)氧化物酶標(biāo)記的羊抗鼠IgG為南京巴傲得生物科技有限公司產(chǎn)品;Transwell小室購(gòu)于Millipore公司。
1.2 方法
1.2.1 cDNA的提取 以HUVECs的cDNA作為CDCP1 編碼序列PCR擴(kuò)增的模板。首先,選取匯合度為90%的HUVECs,經(jīng)胰蛋白酶消化后,使用含有20%血清的完全DMEM終止消化,離心后棄去上清,PBS重懸洗滌后再次離心棄去上清液,根據(jù)總RNA提取試劑盒說(shuō)明書提取293 T細(xì)胞中的總RNA,之后根據(jù)RNA反轉(zhuǎn)錄試劑盒說(shuō)明書獲得HUVECs的cDNA。
1.2.2 PCR擴(kuò)增CDCP1編碼序列 在NCBI數(shù)據(jù)庫(kù)中查找CDCP1 編碼序列,并設(shè)計(jì)PCR引物。上游引物:5′-CGGAATTCATGGCCGGCCTGAACTGCG-GGGTCTCTATCGCACTGCTAGGGGTTCTGCTGCTGG-GT-3′(波浪線部分為保護(hù)性堿基,橫線部分為EcoR Ⅰ限制性核酸內(nèi)切酶識(shí)別序列),下游引物:5′-TT-GCGGCCGCTTATTTGTCGTCGTCATCCTTGTAGTCTT-CTGCTGGCTCCATGGGCTCCTGAGTGTTTTGCGGCCGC-TTATTTGTCGTCGTCATCCTTGTAGTCTTCTGCTGGC-TCCATGGGCTCCTGAGTGTT-3′(波浪線部分為保護(hù)性堿基,橫線部分為NotⅠ限制性核酸內(nèi)切酶識(shí)別序列,虛線部分為Flag標(biāo)簽序列)。以HUVECs cDNA為模版,PCR擴(kuò)增CDCP1 編碼序列,通過(guò)1%瓊脂糖凝膠電泳確定PCR產(chǎn)物條帶在位置正確后進(jìn)行切膠回收純化。
1.2.3 pHAGE-CDCP1質(zhì)粒的構(gòu)建及鑒定 將上述切膠回收產(chǎn)物和pHAGE-CMV-MCS-IzsGreen載體分別用EcoR Ⅰ和NotⅠ雙酶切后,進(jìn)行瓊脂糖凝膠電泳分離、切膠回收純化和T4DNA連接酶連接。將連接產(chǎn)物轉(zhuǎn)化感受態(tài)大腸埃希菌DH5α,涂布于含有氨芐西林的LB平板,37 ℃倒置培養(yǎng)過(guò)夜。次日,隨機(jī)挑選單克隆菌落于具有氨芐西林的LB培養(yǎng)基中振蕩培養(yǎng)12~16 h,大量擴(kuò)增并提取質(zhì)粒。將提取的重組質(zhì)粒進(jìn)行雙酶切鑒定,同時(shí)進(jìn)行核酸序列測(cè)定,并利用ApE軟件比對(duì)測(cè)序結(jié)果。
1.2.4 慢病毒pHAGE-CDCP1的包裝及滴度測(cè)定 將293T細(xì)胞鋪入直徑為10 cm的細(xì)胞培養(yǎng)皿中,于37 ℃、5% CO2培養(yǎng)箱內(nèi)培養(yǎng)過(guò)夜。次日當(dāng)細(xì)胞匯合度為70%~80%時(shí),利用LipofectamineTM2000將包裝質(zhì)粒psPAX2、包膜質(zhì)粒 pMD2.G與目的質(zhì)粒pHAGE-CDCP1共轉(zhuǎn)染入293T細(xì)胞,轉(zhuǎn)染8 h后更換10%新鮮完全培養(yǎng)基,收取48~72 h的病毒液,經(jīng)0.45 μm濾器過(guò)濾,將包裝好的重組慢病毒命名為L(zhǎng)v-CDCP1。同時(shí)包裝對(duì)照質(zhì)粒pHAGE的病毒液,命名為L(zhǎng)v-Mock。采用梯度稀釋法稀釋Lv-CDCP1和對(duì)照Lv-Mock病毒液,感染293T細(xì)胞。48 h 后于熒光顯微鏡下觀察綠色熒光蛋白(GFP)的表達(dá),并統(tǒng)計(jì)發(fā)出綠色熒光的細(xì)胞個(gè)數(shù),采用以下公式計(jì)算病毒滴度: 病毒滴度(pfu/mL)=(綠色熒光細(xì)胞數(shù)/視野)×(視野數(shù)/孔數(shù))×病毒稀釋倍數(shù)÷病毒液體積。
1.2.5 重組慢病毒Lv-CDCP1感染宮頸癌HeLa細(xì)胞及免疫印跡檢測(cè)Flag標(biāo)簽蛋白 將HeLa細(xì)胞鋪入6孔板中,于37℃、5% CO2培養(yǎng)箱內(nèi)培養(yǎng)過(guò)夜。第2天當(dāng)細(xì)胞匯合度約50%時(shí),用相同滴度的Lv-Mock和Lv-CDCP1慢病毒分別感染HeLa細(xì)胞,4~6 h后,將病毒液更換為10%完全培養(yǎng)基。感染48 h后,于熒光顯微鏡下觀察GFP的表達(dá)。SDS-PAGE提取總蛋白,取100 μg樣品進(jìn)行電泳并轉(zhuǎn)膜于PVDF膜上;5%脫脂牛奶封閉1 h后,將PVDF膜孵育在Flag(1 ∶1 000)和α-微管蛋白(1 ∶1 000)一抗中,4℃孵育過(guò)夜;次日,TBST洗膜3次,每次5 min,用相應(yīng)二抗于37℃孵育1 h后,TBST 洗膜3次,每次5 min,于化學(xué)發(fā)光儀下顯影。
1.2.6 CCK-8實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞增殖的影響 分別將 Mock-HeLa與CDCP1-HeLa以每孔2 000個(gè)細(xì)胞接種于96孔板中(每組3個(gè)重復(fù)孔),共鋪7塊。分別在培養(yǎng)1、2、3、4、5、6及7 d后,取出一塊檢測(cè)。吸棄原培養(yǎng)基,向每孔加入100 μL純DMEM和10 μL CCK-8液,于37℃、5% CO2培養(yǎng)箱孵育 1 h,以純DMEM調(diào)零,波長(zhǎng)為450 nm,用全自動(dòng)酶標(biāo)讀數(shù)儀測(cè)出每孔D值。
1.2.7 劃痕實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞遷移的影響 取Mock-HeLa和CDCP1-HeLa兩組細(xì)胞,接種于6孔板,每孔1×105個(gè)細(xì)胞,第2天長(zhǎng)至70%~80%匯合度。用直徑為5 mm的槍頭垂直于背后的橫線劃痕,用PBS洗滌細(xì)胞3次,去除劃下的細(xì)胞,加入無(wú)血清的培養(yǎng)基置于37℃、5% CO2培養(yǎng)箱中培養(yǎng),24 h后取樣拍照。
1.2.8 Transwell遷移實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞遷移影響 取24孔板每孔加入500 μL細(xì)胞完全培養(yǎng)基,將Transwell小室置于24孔板中,小室內(nèi)接種1×104個(gè)細(xì)胞,置于37℃、5% CO2培養(yǎng)箱培養(yǎng),6 h與12 h將小室置于一個(gè)新的24孔板中,浸泡于甲醇中固定15 min,再用結(jié)晶紫染色15 min。用棉簽攪去小室內(nèi)部底部多余細(xì)胞,將小室倒置晾干后,于顯微鏡下拍攝小室上、下、左、右、中5個(gè)視野,進(jìn)行計(jì)數(shù)統(tǒng)計(jì)。
1.3 統(tǒng)計(jì)學(xué)方法
應(yīng)用統(tǒng)計(jì)學(xué)軟件SPSS 19.0對(duì)數(shù)據(jù)進(jìn)行,各組間差異比較采用兩樣本t檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。所有實(shí)驗(yàn)結(jié)果均獨(dú)立重復(fù)3次。
2 結(jié)果
2.1 重組質(zhì)粒pHAGE-CDCP1的構(gòu)建與鑒定
通過(guò)查詢NCBI數(shù)據(jù)庫(kù),獲得CDCP1 編碼序列,根據(jù)該序列設(shè)計(jì)擴(kuò)增引物,以HUVECs的cDNA為模板進(jìn)行PCR擴(kuò)增,1%瓊脂糖凝膠電泳結(jié)果顯示,擴(kuò)增片段約2 549 bp且條帶單一,與預(yù)期相符(圖1A)。以EcoR Ⅰ和NotⅠ雙酶切重組質(zhì)粒pHAGE-CDCP1,酶切產(chǎn)物經(jīng)1%瓊脂糖凝膠電泳驗(yàn)證,在7 742 bp和2 549 bp處有明顯條帶(圖1B),分別為慢病毒載體 pHAGE-CMV-MCS-IzsGreen和CDCP1基因。對(duì)重組質(zhì)粒pHAGE-CDCP1進(jìn)行核酸序列測(cè)定,經(jīng)ApE軟件比對(duì),插入的CDCP1基因片段與理論序列一致(圖1C),表明 pHAGE-CDCP1重組質(zhì)粒構(gòu)建成功。
2.2 重組慢病毒Lv-CDCP1的包裝及感染
利用LipofectamineTM2000將包裝質(zhì)粒、包膜質(zhì)粒與目的質(zhì)粒pHAGE-CDCP1共轉(zhuǎn)染293T細(xì)胞,獲得重組慢病毒Lv-CDCP1及其對(duì)照病毒Lv-Mock。采用梯度稀釋法測(cè)定病毒滴度后,以相同病毒滴度分別感染宮頸癌細(xì)胞HeLa。48 h后觀察到約95%細(xì)胞表達(dá)GFP,且細(xì)胞狀態(tài)良好(圖2A)。蛋白免疫印跡實(shí)驗(yàn)結(jié)果表明,過(guò)表達(dá)CDCP1的宮頸癌HeLa細(xì)胞構(gòu)建成功(圖2B)。


A:CDCP1基因的擴(kuò)增;B:重組質(zhì)粒pHAGE-CDCP1的雙酶切鑒定;C:重組質(zhì)粒測(cè)序結(jié)果
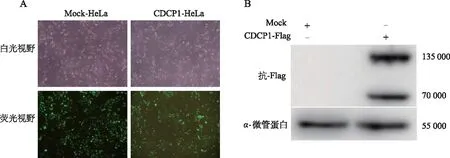
A:Lv-Mock和Lv-CDCP1分別感染HeLa細(xì)胞后GFP的表達(dá)(×200);B:蛋白印跡檢測(cè)重組慢病毒CDCP1感染HeLa細(xì)胞后相關(guān)蛋白的表達(dá)
2.3 CCK-8實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1基因?qū)m頸癌HeLa細(xì)胞增殖的影響
實(shí)驗(yàn)結(jié)果顯示,從第4天起,CDCP1-HeLa組細(xì)胞在450 nm處D值明顯高于Mock-HeLa組(P<0.05或P<0.01),見(jiàn)圖3。提示宮頸癌HeLa細(xì)胞中過(guò)表達(dá)CDCP1可以促進(jìn)細(xì)胞的增殖。
2.4 劃痕實(shí)驗(yàn)檢測(cè)重組慢病毒CDCP1感染對(duì)HeLa細(xì)胞遷移能力的影響
采用劃痕實(shí)驗(yàn)法評(píng)價(jià)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞遷移的影響。結(jié)果顯示,第24小時(shí),感染CDCP1病毒液組的HeLa細(xì)胞的遷移能力顯著高于對(duì)照病毒液感染組(P<0.01),見(jiàn)圖4。結(jié)果提示,過(guò)表達(dá)CDCP1能夠促進(jìn)HeLa細(xì)胞的遷移。
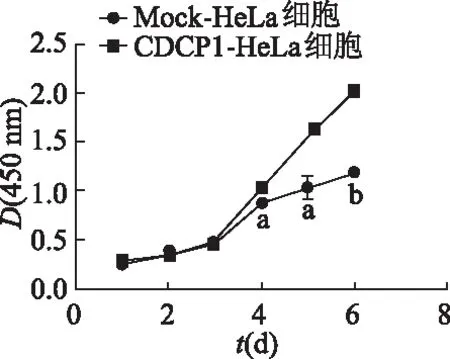
a: P<0.05, b: P<0.01,與Mock-HeLa細(xì)胞比較
2.5 Transwell遷移實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞的遷移能力的影響
Transwell遷移實(shí)驗(yàn)結(jié)果顯示,過(guò)表達(dá)CDCP1組的HeLa細(xì)胞,6 h和12 h遷移數(shù)量明顯多于對(duì)照組(P<0.05或P<0.01),見(jiàn)圖5。該結(jié)果表明CDCP1表達(dá)水平的提高可以增強(qiáng)HeLa細(xì)胞的遷移能力。

圖4 劃痕實(shí)驗(yàn)法檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞遷移的影響(×200)
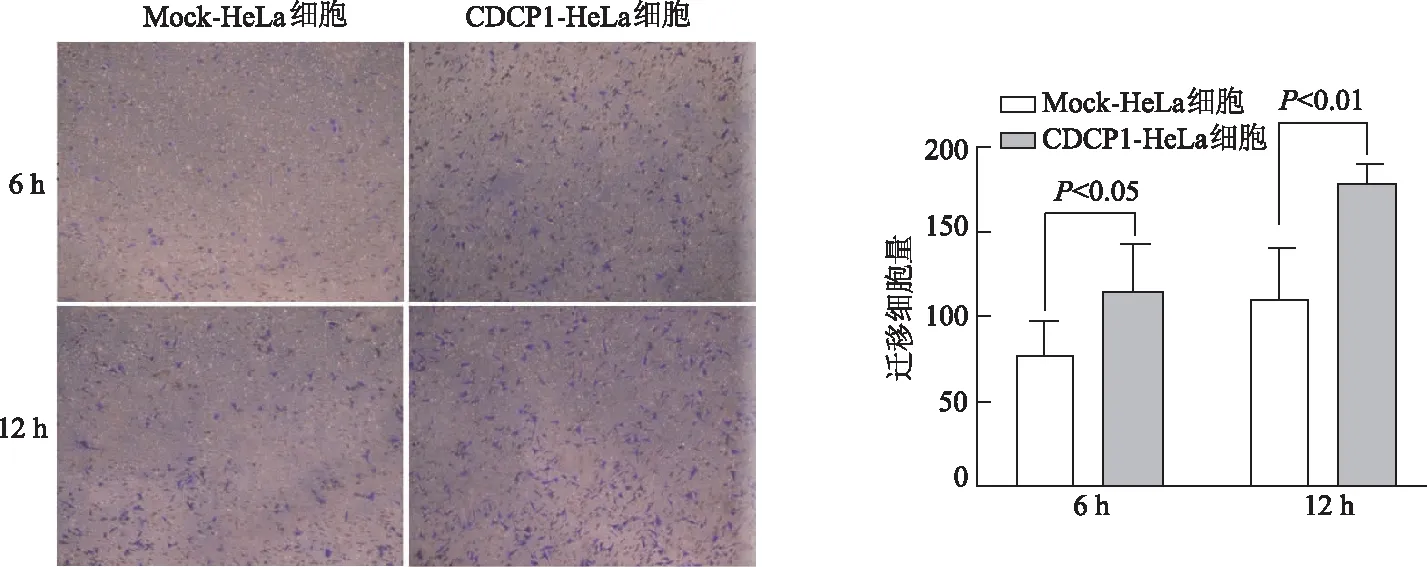
圖5 Transwell遷移實(shí)驗(yàn)檢測(cè)過(guò)表達(dá)CDCP1對(duì)HeLa細(xì)胞遷移的影響
3 討論
作為女性第三大常發(fā)癌癥,宮頸癌仍然是重要的全球性公共衛(wèi)生問(wèn)題[10]。大多數(shù)發(fā)展中國(guó)家婦女確診宮頸癌時(shí)已是晚期,通常無(wú)法治療或僅可進(jìn)行姑息治療,5年生存率很低[9]。因此,深入研究宮頸癌發(fā)生、發(fā)展過(guò)程中的分子機(jī)制,尋找差異表達(dá)的基因,可為宮頸癌診斷提供新的生物標(biāo)志物,為其治療提供特異性靶點(diǎn)。
CDCP1是包含836個(gè)氨基酸的蛋白質(zhì),由29個(gè)殘基的氨基末端信號(hào)肽、細(xì)胞外結(jié)構(gòu)域、跨膜結(jié)構(gòu)域和含有150個(gè)氨基酸的細(xì)胞質(zhì)結(jié)構(gòu)域組成[11]。已有研究表明[12],表達(dá)異常的CDCP1與多種癌癥有關(guān),其在腎癌、肺腺癌中的異常表達(dá)與疾病進(jìn)展指標(biāo)(腫瘤分期,組織學(xué)分級(jí)和轉(zhuǎn)移等)顯著相關(guān)。CDCP1高表達(dá)可促進(jìn)腫瘤淋巴轉(zhuǎn)移和復(fù)發(fā),CDCP1高表達(dá)患者總體生存率明顯降低。
本研究中,我們通過(guò)分子克隆技術(shù)獲得pHAGE-CDCP1重組質(zhì)粒,經(jīng)慢病毒包裝系統(tǒng)獲取Lv-CDCP1重組慢病毒并感染宮頸癌HeLa細(xì)胞,構(gòu)建了穩(wěn)定過(guò)表達(dá)CDCP1的HeLa細(xì)胞系。進(jìn)一步功能學(xué)CCK-8結(jié)果表明,CDCP1可以促進(jìn)宮頸癌HeLa細(xì)胞的增殖,細(xì)胞劃痕實(shí)驗(yàn)和細(xì)胞遷移實(shí)驗(yàn)結(jié)果均顯示,CDCP1可以促進(jìn)宮頸癌HeLa細(xì)胞的遷移能力,提示CDCP1在宮頸癌中可能是促癌基因。本研究為后續(xù)進(jìn)一步研究CDCP1在宮頸癌等相關(guān)腫瘤發(fā)生中的作用奠定了基礎(chǔ),有望為探索和治療宮頸癌發(fā)生機(jī)制提供潛在的藥物靶點(diǎn)。
 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2020年2期
江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2020年2期
- 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)的其它文章
- 超聲引導(dǎo)股神經(jīng)阻滯復(fù)合丙泊酚靶控輸注在髕骨骨折手術(shù)患者中的臨床應(yīng)用
- NT-proBNP聯(lián)合腎小球?yàn)V過(guò)率對(duì)慢性心功能不全患者心衰程度的預(yù)測(cè)價(jià)值
- 抑郁癥家族史陽(yáng)性首發(fā)患者和健康者腦血流灌注的變化
- EUROPattern全自動(dòng)免疫熒光核型和滴度判讀系統(tǒng)檢測(cè)抗核抗體的應(yīng)用評(píng)價(jià)
- OmpR對(duì)傷寒沙門菌巨噬細(xì)胞內(nèi)生存能力的影響
- 新型冠狀病毒肺炎重癥患者的心肌酶譜分析
