C1q/C3比值與冠心病關系的研究
(青島大學附屬醫院心內科,山東 青島 266003)
冠心病(CHD)是一種嚴重威脅人類健康的疾病,世界范圍內發病率與死亡率較高[1]。大多數情況下,CHD是由動脈粥樣硬化引起的,盡管動脈粥樣硬化的發病機制還未明確,但基本被認為是一種膽固醇所致的慢性炎癥反應[2]。目前越來越多的證據表明動脈粥樣硬化有明顯的免疫性疾病特征,補體系統作為免疫系統的重要組成部分,多種補體成分通過介導免疫和炎癥反應可能參與了動脈粥樣硬化的過程[3-6]。早期研究發現補體系統是加重炎癥、促進斑塊進展的危險因素,但另有研究發現其在動脈粥樣硬化進展中也起到保護作用[7]。既往關于補體循環水平的研究多孤立地考量單個指標,而補體系統作為一個復雜的網絡,補體組分間的相對水平較單一指標可能對CHD有更高的預測價值,目前C1q/C3比值與CHD關系的研究暫無報道,因此本研究旨在探討C1q/C3比值與CHD患者發病的關系。現將結果報告如下。
1 對象與方法
1.1 對象與分組
本研究納入2018年12月1日—2019年3月31日在我院心內科住院并擬行冠狀動脈造影術的患者總共101例,其中男71例,女30例,平均年齡(62.84±10.04)歲。排除標準:①既往行經皮冠狀動脈球囊擴張術、冠狀動脈支架植入術或冠狀動脈旁路移植術者;②患有先天性心臟病或心肌病者;③患有其他慢性疾病者,如慢性阻塞性肺疾病、腫瘤、肝腎功能不全等;④凝血功能嚴重異常者;⑤患有自身免疫性疾病者,如風濕性心臟病、系統性紅斑狼瘡(SLE)、類風濕關節炎等;⑥近期有感染或外傷史者;⑦近期糖皮質激素、免疫抑制劑應用者等。其中因胸痛、胸悶及憋氣等癥狀住院但經冠狀動脈造影及其他檢查排除CHD的34例患者為對照組(A組),經冠脈造影診斷為CHD的67例患者為CHD組;CHD組又依據Gensini評分分為2個亞組,Gensini評分≤45分的36例為冠狀動脈輕度狹窄組(B組),男25例,女11例;Gensini評分>45分的31例為冠狀動脈重度狹窄組(C組),男25例,女6例。A組中男21例,女13例,年齡(60.38±8.34)歲,吸煙比例26.5%,體質量指數(BMI)(25.79±3.68)kg/m2;CHD組中男50例,女17例,年齡(64.09±10.65)歲,吸煙比例35.8%,BMI(25.70±2.83)kg/m2。兩組性別、年齡、吸煙比例、BMI比較均無顯著差異性(P>0.05)。
1.2 研究方法
對納入研究的患者入院當天詳細采集病史,記錄患者年齡、性別、BMI、糖尿病史、高血壓史、吸煙史等,所有患者清晨空腹狀態下采集靜脈血,采用日立7600型全自動生化分析儀(日立,日本)檢測血清中C1q、C3、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、甘油三酯(TG)、總膽固醇(TC)、尿酸、肌酐、血糖水平,并計算C1q/C3比值。
1.3 統計學處理
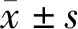
2 結 果
2.1 CHD組與A組患者臨床相關指標比較
CHD組與A組血清中TC、TG、LDL-C、C3、尿酸水平比較,差異均無顯著意義(P>0.05)。與A組比較,CHD組患者高血壓、糖尿病的比例較高,血清中肌酐、空腹血糖水平升高而HDL-C、C1q水平以及C1q/C3比值降低,差異均具有顯著意義(χ2=4.224、5.002,Z=-2.693、-3.611,t=2.365~3.971,P<0.05)。見表1。
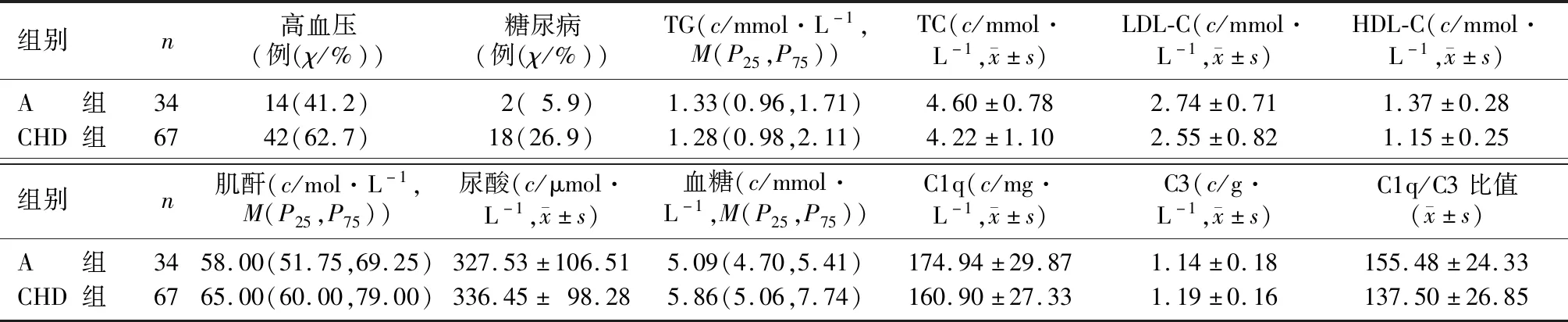
表1 A組與CHD組一般資料的比較
2.2 CHD亞組與A組患者血清中C1q、C3水平及C1q/C3比值比較
C組C1q水平、C1q/C3比值明顯低于A組,差異具有顯著性(F=3.931、8.053,P<0.01),同時C組C1q/C3比值與B組相比較,差異亦具有顯著意義(P<0.05)。見表2。

表2 各組間C1q、C3水平及C1q/C3比值比較
2.3 C1q水平、C1q/C3比值等與CHD發病關系的多因素Logistic回歸分析
為排除年齡、吸煙等其他因素影響,將所研究對象以是否為CHD作為因變量(CHD患者賦值為1,非CHD患者賦值為0),對C1q、C1q/C3比值依次進行多因素Logistic回歸分析。將表1中兩組間有差異的因素(P<0.1)以及既往證實的CHD危險因素年齡、性別、高血壓、糖尿病、吸煙、血清中膽固醇、肌酐、血糖、HDL納入二分類Logistic回歸分析,以P<0.05為有顯著性,根據二項Logistic回歸分析結果顯示C1q/C3比值和HDL-C是CHD的保護因素(95%CI=0.947~0.994、0.009~0.892,P<0.05),而空腹血糖的水平則是CHD的危險因素(95%CI=1.046~3.946,P<0.05)。見表3。
3 討 論
補體系統不僅廣泛參與機體對病原微生物的防御反應以及免疫調節,而且在動脈粥樣硬化的進程中有重要的作用。C1q作為補體經典途徑中的模式識別受體,通過識別斑塊中酶修飾的低密度脂蛋白(E-LDL)等補體激活物,激活補體經典途徑[8-10],活化的C3轉化酶裂解血清中補體C3,通過級聯放大反應產生大量的裂解產物(例如C3a、C5a以及C5b-9等)及炎癥因子,最終促進了斑塊炎癥進展、斑塊破裂及血栓形成[11-12]。
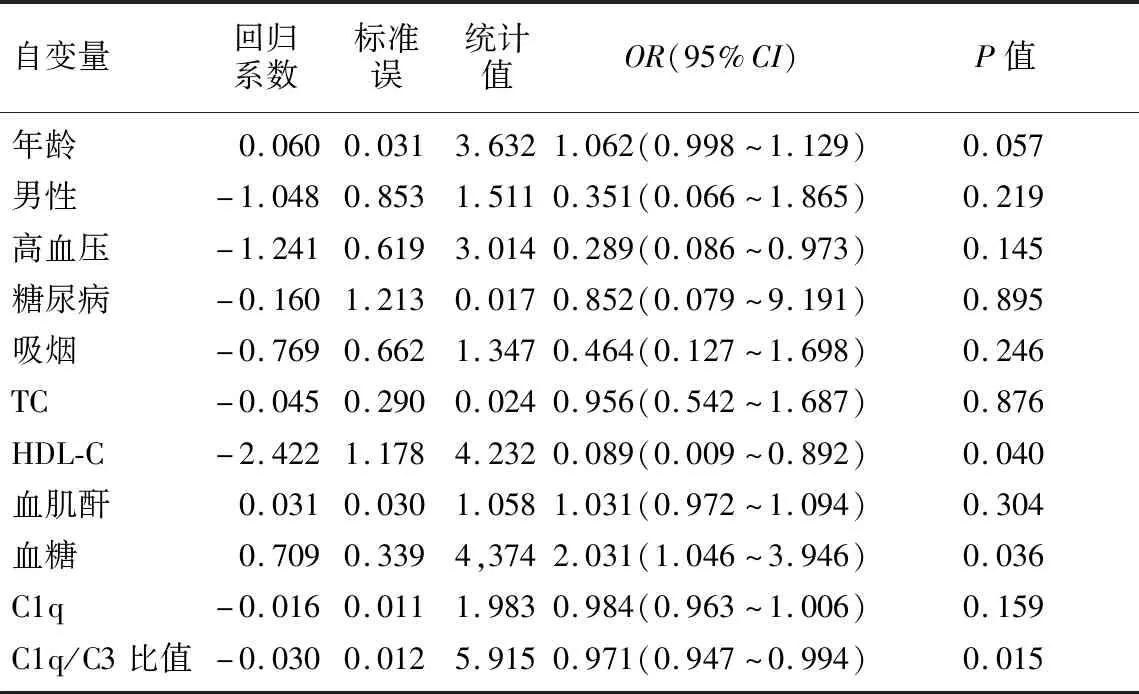
表3 C1q水平、C1q/C3比值等與CHD發病關系的多因素Logistic回歸分析
BHATIA等[13]研究發現缺失C1q基因的小鼠相比正常小鼠粥樣斑塊更大、更不穩定,提示C1q還可能存在抑制動脈粥樣硬化的保護機制。近年的研究發現,這種抑制動脈粥樣硬化進展的保護機制主要是通過抑制細胞凋亡與促進有效吞噬而實現,而且獨立于經典途徑的補體激活[7]。C1q可以直接地抑制JAK-STAT信號通路的激活,下調CASP8、BCL2L11、TNFSF10等凋亡基因的表達[14-16],C1q還可作為橋梁分子促進吞噬細胞對凋亡細胞的有效吞噬[17]。同時C1q可趨化巨噬細胞向抗炎型轉變,釋放IL-10、IL-13等抑炎因子,并抑制IL-1β等炎性因子的表達[18-20]。
研究發現CHD、心肌梗死患者血清中C3水平明顯升高,血清中C3a、C5a水平能夠預測冠狀動脈支架植入術后動脈內膜再狹窄風險,血清中C1q水平也與糖尿病患者未來10年心血管事件死亡風險密切相關[21-27]。HONG等[28]報道了CHD患者血清中C1q水平明顯下降,與本研究結果一致,但目前CHD患者血清中C1q水平下降的原因暫不明確。值得思考的是CHD與SLE在補體激活的機制中有相似之處,許多SLE患者因為補體激活導致了血清中C1q降低,而C1q缺乏也最終導致SLE的進展[29-30],因此C1q與補體激活物(ELDL、凋亡小體、C反應蛋白等)結合消耗可能是CHD患者血清中C1q水平降低的重要原因[8,10]。同時C1q作為結合蛋白、橋梁分子等而被消耗[14,17],為冠心病患者血清中C1q水平降低提供了更多的理論依據。
補體激活與細胞凋亡對于機體內環境的動態平衡發揮著極為重要的作用。但動脈粥樣硬化所導致的補體激活打破了這種平衡,導致血清中C1q水平下降,C3水平上升,以致堆積的凋亡細胞進一步加劇了補體激活[10],如此往復,最終導致動脈粥樣硬化不可逆的進展,以上研究提示補體組分相對水平的變化(如C1q/C3比值)趨向可能決定了動脈粥樣硬化的方向。
本研究中CHD組與A組間血清中C1q、C3變化雖有差異,但多因素回歸分析顯示C1q/C3比值在CHD組與A組間顯示出更好的差異性,C1q/C3比值成為反映動脈粥樣硬化嚴重程度的更好指標,也從側面表明了C1q/C3比值降低的水平反映了補體激活的嚴重程度。目前關于血清中補體與CHD嚴重程度的研究比較少,本研究是國內外首次報道C1q/C3比值與CHD的關系。然而,本研究也存在一定的局限性與不足,如本研究通過冠狀動脈造影結果計算Gensini評分以評估冠狀動脈狹窄程度可能不如聯合血管內超聲、冠狀動脈CT造影更準確;同時所收集病例僅來自于單中心,樣本量相對較少,還需要在以后的研究中不斷完善。
綜上所述,補體系統在動脈粥樣硬化的進程中有重要的生理作用,血清中補體C1q/C3比值有望成為協助診斷CHD以及反映動脈粥樣硬化的嚴重程度的指標。C1q、C3之間的動態平衡可能在動脈粥樣硬化的過程中起關鍵作用,但具體機制還有待進一步的研究。

