兩種培養基對新生SD大鼠神經干細胞增殖的影響*
漆國棟 漆 偉 江 瓊 楊 琴 杜岵駿
1 重慶市中醫骨科醫院骨科 400010; 2 重慶醫科大學,中醫藥學院,中醫藥防治代謝性疾病重慶市重點實驗室
神經干細胞(Neural stem cells,NSCs)是一種組織特異性干細胞,發育上來源于神經上皮,分為中樞神經干細胞與外周神經干細胞。兩種細胞皆具有自我更新和定向分化為神經細胞的潛能[1-2]。作為干細胞治療神經類疾病中最有前景的細胞類型,目前的基礎與臨床研究廣泛集中于治療帕金森[3-4]、脊髓損傷[5-6]、腦中風[7-8]等疾病。由于數量及損傷后局部微環境的影響,單純靠這類細胞自身增殖修復的可能性微乎其微[9]。因此采用外源性的神經干細胞移植作用于損傷部位更具有治療效果。本研究針對新生鼠大腦皮層來源的神經干細胞,比較兩種經驗培養基,建立一種更優的培養體系。
1 材料與方法
1.1 材料 Neural basal培養基(Gibco,10888022)、B-27(Gibco,A3582801)、Acctuase酶(Gibco,A1110501)、胎牛血清(Gibco,16140071);bFGF(Peprotech,400-29)、EGF(Peprotech,400-25);小鼠單克隆抗Nestin抗體(Millipore,MAB353)DyLight488標記山羊抗小鼠二抗(博士德,BA1126);CCK-8(索來寶,CK04)。
1.2 方法
1.2.1 實驗分組:依據培養過程中使用的兩種不同配方的NSCs增殖培養基,設立對照組(Neural basal+2%B-27)與實驗組(DMEM/F12+2%B-27+20ng/ml EGF+20ng/ml bFGF)。
1.2.2 原代培養:取新生24h內的SD大鼠,無菌條件下仔細剝離干凈大腦皮層上的腦膜及血管,眼科鑷前緣解剖分離大腦皮層組織。鋒利剪刀剪成1mm3的小塊。加入適量0.25%胰酶,37℃消化15~20min。胎牛血清終止消化,藍槍頭均勻用力吹打10~15次,200目細胞篩過濾形成單細胞懸液。離心,棄上清液,加適量培養基吹打、重懸。重復一次離心、重懸步驟。細胞計數,以2×105/ml接種于6cm培養皿中,置培養箱中培養, 每2~3d半量換液1次, 6~7d傳代1次。
1.2.3 傳代培養:細胞懸液離心,棄上清液。Acctuase酶吹打、重懸,37℃消化10min。離心,去Acctuase酶,加培養基,均勻用力吹打30~50次,加入適量增殖培養基重懸。傳代后培養方式同原代。
1.2.4 CCK-8檢測NSCs初期增殖情況:取相應增殖培養基培養的第二代傳代后的單細胞懸液,隨機接種于96孔板中,每孔細胞數約為7 000個,每孔培養基100μl。各組同時培養24、48、72h后,每孔加入培養基10%體積的CCK-8原液,繼續培養4h,之后用酶標儀在450nm處測吸光度反映細胞數情況。每組5孔,重復3次。
1.2.5 免疫熒光檢測NSCs整體增殖情況:取相應增殖培養基培養的第二代傳代后的單細胞懸液,培養7d后接種于多聚賴氨酸包被后的6孔板無菌爬片中培養4h以貼壁。經4%多聚甲醛固定,0.5%tritonX-100破膜,10%正常山羊血清封閉后。孵一抗抗Nestin(1∶200)4℃過夜。孵二抗Dylight488標記山羊抗小鼠(1∶100)37℃1h。DAPI染核,抗熒光淬滅封片劑封片。激光共聚焦下觀,每組隨機收集4張細胞爬片進行染色,物鏡為20X下按時鐘的3 點、6點、9 點、12 點和圓心5 個方位選取5個視野拍攝照片,并統計直徑>100μm的神經球數量。統計同一視野內平均直徑。
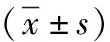
2 結果
2.1 原代培養形態 原代細胞接種后, 對照組與實驗組皆可見分為幾層懸浮的單個圓形細胞,邊界清, 折光強,也可能有少量未吹打完全的組織存在。2~3d后,對照組少部分細胞成球生長,大部分仍為單細胞,死亡細胞較多,可見較多細胞碎片(見圖1A)。實驗組見大多數細胞顯著增殖呈懸浮聚集成球生長,單個神經球的直徑不超過50μm,少數單個細胞并見少量死亡的細胞(見圖1a)。6~7d后,神經球通過增殖和融合周圍小的神經球變大,其中對照組神經球較小且數量較少,大多數大球中心顏色暗淡,營養不良(見圖1B)。實驗組單個神經球直徑可達到150~300μm,多呈球形、桑葚狀,且透光性強(見圖1b)。

圖1 不同培養基及時間下原代NSCs形態
A.對照組原代培養第3天 B.對照組原代培養第7天 a.實驗組原代培養第3天 b.實驗組原代培養第7天
2.2 初期增殖 CCK-8結果表明,培養24h、48h、72h后,對照組OD值各個時間點均低于實驗組OD值(P<0.05)。通過OD值可表明,實驗組在初期增殖的細胞數明顯大于對照組。具體統計數據見表1。
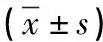
表1 CCK-8結果OD值
2.3 整體增殖 首先,細胞Nestin表達呈陽性,證明兩組培養的細胞皆為NSCs。其次,對照組的神經球數量為(9.15±3.58)個,實驗組的神經球數量為(20.75±5.06)個,實驗組數量明顯高于對照組(P<0.05)。最后,對照組神經球平均直徑為(122.50±40.72)μm,實驗組神經球平均直徑為(193.50±29.54)μm,實驗組平均直徑明顯大于對照組(P<0.05)。代表性圖見圖2。

圖2 免疫熒光圖
綠色熒光標記Nestin陽性細胞,藍色熒光標記細胞核 A.實驗組,神經球形態正常 B.對照組,可見部分神經球內部細胞開始凋亡無法被Nestin抗體標記,呈黑色
3 討論
外源性神經干細胞培養的來源較多,少部分來源于成體細胞[10],大部分以胚胎來源為主,因為其干細胞比例較大,細胞增殖較快[11]。我們往期也選用胚胎來源的細胞[12-14],然而多年實際操作中發現存在細胞絕對量少需要殺死多個胚胎,血管及腦膜分離難度大,雜質細胞較多,取材過程煩瑣細胞死亡量大等問題。在查閱近期相關文獻后[15],我們決定嘗試更接近胚鼠的24h新生鼠,并選擇適宜培養基。
表皮生長因子(Epidermal growth factor,EGF)和堿性成纖維生長因子(Basic fibroblast growth factor,bFGF)主要用于維系干細胞特性的絲裂原[16]。EGF可促進長期存活,而bFGF可對分化起一定作用[17]。當它們共同添加到培養基時可促進分裂增殖并且抑制分化,其作用與兩者濃度呈協同關系,20ng/ml時其促分裂作用最強[18]。不含生長因子的Neurobasal培養基已被我們證明適用于胎鼠來源。因此我們猜測,針對新生鼠來源,不含生長因子的Neurobasal培養基與含生長因子的DMEM∶F12培養基二者是否存在差異,哪種培養基更適合新生鼠來源。
巢蛋白(Nestin)被認為是神經干細胞的特異性標志蛋白之一,被廣泛應用于鑒定,因為只要細胞開始向神經元和膠質細胞分化時,該蛋白便會停止表達。本實驗通過形態學分析與Nestin鑒定表明兩種培養基皆可成功培養出新生鼠大腦皮層來源的神經干細胞。通過CCK-8與神經球數量的統計學分析,含有因子的培養基更能促進細胞的增殖。總體上說,本實驗旨在建立一套成熟的新生鼠大腦皮層來源的神經干細胞原代、傳代培養體系,提供具有良好增殖與活性的神經干細胞,為之后進一步的相關增殖、凋亡、分化、移植等實驗打下良好的基礎。

