DCAF家族蛋白研究進展
童柏陸,劉曉倩,汪 洌
(浙江大學基礎醫學院感染與免疫研究中心,中國浙江 杭州 310058)
DCAF (DDB1- and CUL4-associated factor)全稱DNA 損傷結合蛋白1 和CUL4 相關因子。2006年,Jin 等[1]在人源胚胎腎細胞系293T 中首次發現18 種之前未被鑒定的蛋白質,這些蛋白質都可被CRL4-DDB1 (cullin-ring ligase 4-DNA damage-binding protein 1)復合物識別并構成E3 泛素連接酶復合物,因此將其命名為DCAF 蛋白。隨著串聯親和純化或標準免疫純化技術的發展,人們通過對DDB1 底物受體的系統性搜索,已累計發現60 種新的DCAF 蛋白[2]。本文主要就DCAF家族蛋白的主要成員DCAF1~DCAF17 的功能及其作用機制展開論述。
1 DCAF家族蛋白簡介
從分子結構上來看,大多數DCAF 蛋白擁有WD40 重復序列,該序列由40~60 個氨基酸構成,并以色氨酸-天冬氨酸二肽終止。WD40 重復序列后面通常連接有單個非保守的氨基酸或保守的精氨酸殘基,因此也稱之為“WDXR”基序。DCAF 家族蛋白通過“WDXR”基序與DDB1 識別并相互作用構成復合物[3]。
就功能上而言,DCAF 家族蛋白通常與CRL4、DDB1 共同構成 E3 泛素連接酶(圖 1),從而對靶蛋白進行泛素化修飾。DCAF 家族蛋白廣泛參與調控細胞的生長、發育、分化、凋亡等各種生命活動,并與腫瘤、發育障礙等一系列疾病的發生、進展密切相關。表1 總結了DCAF 家族蛋白成員DCAF1~DCAF17 的主要功能。
2 DCAF家族蛋白的主要作用
2.1 DCAF1
DCAF1,又名 VprBP (Vpr binding protein),其最早是作為人類免疫缺陷病毒1 型(HIV-1)病毒蛋白R (viral protein regulatory,Vpr)的結合蛋白被報道[4]。目前,針對DCAF1 的研究主要集中在以下3 個方面:1) DCAF1 在HIV 感染中的作用;2) DCAF1 對細胞周期的調控機制; 3) DCAF1 與腫瘤的相關性及其機制。
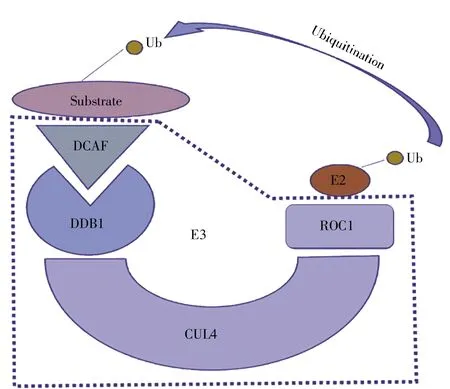
圖1 CRL4-DDB1-DCAF E3 泛素連接酶DCAF 家族蛋白可以和DDB1、CUL4、ROC1 構成E3 泛素連接酶,將泛素分子連接到靶蛋白上,從而對底物進行泛素化修飾。Fig.1 CRL4-DDB1-DCAF E3 ligaseE3 ligase complex is composed of DDB1,CUL4 and ROC1,which recognizes and ubiquitinates the substrate.
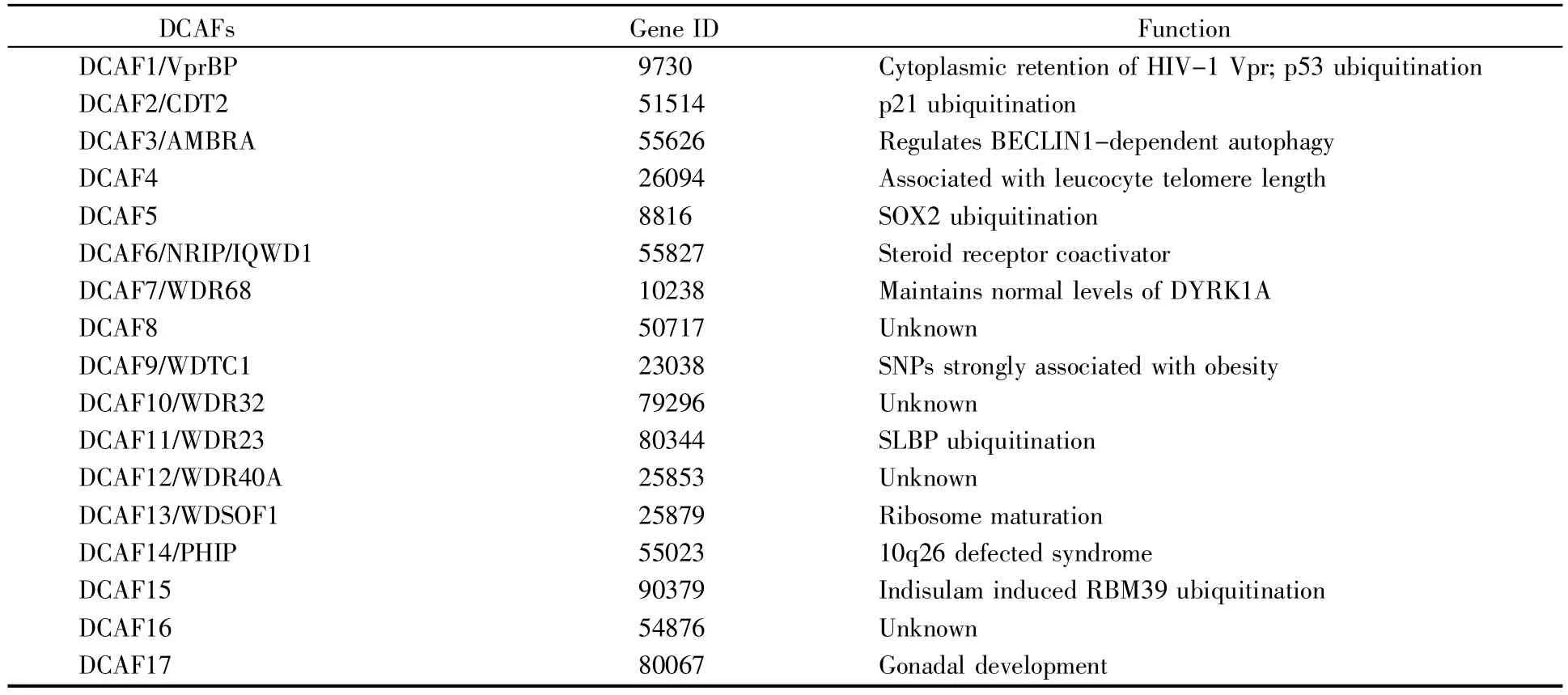
表1 DCAF 家族蛋白的主要功能Table 1 The main functions of DCAF family proteins
DCAF1 參與HIV 體內感染復制。Vpr 參與協助HIV-1 整前復合物(HIV-1 pre-integration comp-lex,PIC)的細胞核轉運,對HIV-1 在其宿主細胞中的復制具有重要的意義[5]。研究發現,Vpr 可以通過結合DCAF1,調控CRL4-DDB1-DCAF1 E3泛素連接酶的活性,進而對DNA 修復酶ExoI、SAMHD1 和HLTF 進行泛素化降解,以此來拮抗ExoI、SAMHD1 和 HLTF 等對 HIV-1 體內復制的抑制功能[6~7]。
DCAF1 參與細胞周期的調控。研究發現,DCAF1 的缺陷會引起G2 期組蛋白突變體H2A.X的磷酸化水平顯著升高,造成細胞周期阻滯在G1、G2 期[6]。進一步的研究報道,DCAF1 是通過調控p53 介導的靶基因轉錄來影響細胞周期的[8]。當細胞處于應激條件下時,p53 會招募組蛋白乙酰轉移酶(histone acetyltransferase,HAT),對靶基因啟動子區的組蛋白實施乙酰化,提高靶基因的轉錄活性。DCAF1 可識別未被乙酰化的組蛋白H3尾,并通過其C 端的LisH 結構域與組蛋白H3 尾結合,招募組蛋白去乙酰化酶(histone deacetylase,HDAC),從而阻礙p300 介導的H3 組蛋白乙酰化,而H3 的乙酰化被認為是p53 介導的靶基因活化的關鍵標志[9]。
在臨床腫瘤研究中,DCAF1 被視為一個癌基因。研究發現,DCAF1 可抑制由抑癌基因p53 介導活化的 p21、Noxa 的表達[8],而 p21、Noxa 參與細胞周期阻滯和早期細胞凋亡。所以,DCAF1 是p53 抑制腫瘤發展的關鍵。已有研究發現,DCAF1還參與原癌基因YAP 的活化,在抑癌基因merlin缺陷的細胞系中,DCAF1 復合物可促進Lats1/2的泛素化,并有效地抑制YAP 的磷酸化,提高YAP 的活性,促進TEAD 依賴的細胞增殖相關基因的活化,這也促進了腫瘤的發生、進展、轉移[10]。
2.2 DCAF2
DCAF2,又名CDT2,其功能與DCAF1 類似,同樣參與細胞周期的調控。化學藥物、紫外線、輻射等一系列可引起DNA 損傷的刺激,會引起細胞內p21 表達水平的上升。p21 高表達可抑制周期蛋白依賴性激酶2 (cyclin dependent kinase 2,CDK2),阻滯細胞周期進入S 期并進行DNA 損傷修復。研究表明在低劑量的UV 照射下,CRL4-DDB1-DCAF2 E3 泛素連接酶會誘導S 期的p21泛素化[11]。近期研究發現,C/EBPα 可通過影響DCAF2 的表達水平,調控CRL4-DDB1-DCAF2 E3 泛素連接酶介導的p21 泛素化。在UVB 誘導DNA 損傷時,細胞 C/EBPα 表達水平上升,后者通過與E2F1 互作阻礙E2F1 介導的DCAF2 的轉錄,進而抑制CRL4-DDB1-DCAF2 E3 泛素連接酶介導的p21 泛素化[12]。
DCAF2 也是一個腫瘤相關蛋白質。研究報道,DCAF2 在肝細胞癌(hepatocellular carcinoma,HCC)患者中的表達水平較高,且其表達水平與疾病的嚴重程度以及預后密切相關[13]。Pan 等[13]在對242 位肝細胞癌患者的長期隨訪中發現,在p53基因突變的患者中高表達DCAF2 往往伴隨有較大的腫塊、較低的腫瘤分化度以及較低的10年生存率,然而在p53 基因正常的患者中這種趨勢則不明顯。雖然該研究團隊當時只是驗證了DCAF2與PTTG1、CDT1 等腫瘤相關基因的聯系,并未給出DCAF2 高表達的成瘤機制,但是在一定程度上指出了DCAF2 與腫瘤發生、進展、預后的相關性。除了肝細胞癌,DCAF2 在乳腺癌[14]、胃癌[15]患者中也存在異常高表達。這一系列研究表明,DCAF2 在腫瘤的形成、進展中具有重要的作用,且這種作用是普遍的。遺憾的是,根據目前的研究結果,我們只能推斷DCAF2 高表達可能會影響細胞周期調控基因的異常表達,從而導致細胞的惡性增殖,具體分子機制仍有待進一步探索。
2.3 DCAF3
DCAF3,又名AMBRA,主要參與調控細胞的自噬和發育。DCAF3 的缺陷或突變會引起小鼠神經胚形成期間細胞的過度增殖,進而造成中腦、后腦的神經管缺陷、外翻甚至脊柱裂[16]。同時,該研究發現,DCAF3 與 BECLIN1、Vps34 自噬相關因子互作構成穩定復合物,DCAF3 蛋白水平下調會影響BECLIN1 與Vps34 互作的穩定性,導致BECLIN1 介導的細胞自噬水平顯著降低[16]。DCAF3促進細胞自噬的功能可以被線粒體上的Bcl-2 拮抗。抗凋亡因子Bcl-2 可通過NAF-1 對BECLIN1/Vps34 誘導的細胞自噬進行負調控。正常情況下,DCAF3 會優先與線粒體上的Bcl-2 相結合,但當細胞自噬啟動時,這種互作會被破壞,DCAF3 大量與BECLIN1 結合,促進BCEN1/Vps34誘導的細胞自噬[17]。此外,相關研究報道,正常狀態下DCAF3 與動力蛋白輕鏈1(dynein light chains 1)結合,當誘導自噬后,自噬信號ULK1 使DCAF3磷酸化,從而使其與動力蛋白輕鏈1 解離,并在內質網富集,隨后 DCAF3 通過與 BECLIN1、Vps34 構成穩定復合物誘導自噬體的形成,所以DCAF3 是連接自噬信號和自噬體形成的關鍵因子[18]。另有研究表明,自噬的誘導需要BECLIN1的K63 泛素化,而該泛素化過程依賴CRL4-DDB1-DCAF3 E3 泛素連接酶的參與[19]。
在腫瘤形成早期,癌基因的異常表達和抑癌基因的突變往往會抑制異常細胞凋亡程序的啟動,導致腫瘤進展。DCAF3 作為調控細胞自噬的關鍵因子,與腫瘤的進展有著密切的聯系。DCAF3 可通過促進c-Myc 的去磷酸化和降解來抑制腫瘤的進展[20]。此外,DCAF3 還可通過調控ATG12 的表達來改善乳腺癌細胞對表阿霉素的敏感性,提高治愈率[21]。總的來講,根據目前研究報道,DCAF3 作為抑癌因子可通過對癌基因的修飾、降解或者提高癌細胞的自噬凋亡水平來抑制癌癥的發生與進展。
2.4 DCAF4
目前,關于DCAF4 的研究報道相對較少。DCAF4 被認為與腫瘤形成相關,GWAS 分析提示,DCAF4 的rs2535913 單核苷酸突變常常與散發性黑色素瘤等疾病相關聯[22]。此外,有研究報道,DC-AF4 在rs12587742 的單核苷酸點突變與肺鱗狀細胞癌密切相關[23]。但是,DCAF4 在腫瘤發生或進展中的具體作用及其分子機制仍未明確,有待進一步研究。
2.5 DCAF5
DCAF5 可與CRL4-DDB1 構成 E3 泛素連接酶,從而對靶蛋白進行泛素化降解調控。SOX2(sex determining region Y-related HMG-box 2)是調控胚胎干細胞自我更新和分化的關鍵蛋白質,CRL4-DDB1-DCAF5 E3 泛素連接酶在L3MBTL3(lethal 3 malignant brain tumor-like protein 3)的招募下,可與Lys-42 甲基化的SOX2 結合,從而促進SOX2 的泛素化降解[24]。此外,DNMT1(DNA methyltransferase 1)、E2F1 (E2F transcription factor 1)的泛素化降解也依賴DCAF5。L3MBTL3 在識別單甲基化的DNMT1、E2F1 后,會招募CRL4-DDB1-DCAF5 E3 泛素連接酶,從而對它們進行泛素化降解,抑制由DNMT1、E2F1 介導的非組蛋白的甲基化引發的蛋白質降解,以此調控許多甲基化非組蛋白的穩定性[25]。
2.6 DCAF6
DCAF6,又稱 NRIP、IQWD1,最早是作為轉錄輔助因子被發現的[26],可與DDB2 競爭性地結合雄激素受體,從而提高雄激素受體的穩定性,防止其被蛋白酶體降解,進而促進前列腺癌的發生和進展[27]。同時,DCAF6 還是人乳頭瘤病毒(human papillomavirus,HPV) E2 的互作蛋白質,可使E2去磷酸化,從而抑制E2 的多聚泛素化和降解,維持E2 穩定性,進而提高HPV 的表達水平[28]。
2.7 DCAF7
DCAF7 的研究相對較少,目前發現DCAF7主要參與調控細胞的增殖和分化。雙特異性酪氨酸磷酸化調節激酶1A(dual-specificity tyrosine phosphorylation-regulated kinase 1A,DYRK1A)是調節細胞增殖和分化之間的平衡的一個重要激酶,研究發現DCAF7 與DYRK1A 互作,參與維持其穩定性[29]。同時,該研究進一步排除了DCAF7 對DYRK1A 在mRNA 轉錄水平以及蛋白質降解方面的影響,但對其具體調控機制并沒有給出合理的解釋。后續研究發現,亨廷頓相關蛋白1 (Hap1)可以與 DYRK1A 競爭性結合DCAF7,并抑制DCAF7 的核轉運,在Hap1 敲除的小鼠中DYRK1A的表達水平明顯增加,這進一步說明DCAF7 對DYRK1A 存在穩定性調控[30]。至于DCAF7 參與DYRK1A 穩定性調控的分子機制,目前尚不清楚。
2.8 DCAF9
DCAF9,又名WDTC1。群體遺傳學研究發現,DCAF9 的單核苷酸突變與肥胖存在顯著相關性,因此該研究認為DCAF9 的突變體可以作為一種肥胖標志物[31]。相關研究認為,DCAF9 的表達可導致那些與脂肪生成(Fasn、Dgat1 和 Dgat2)、脂解(Agtl)和長鏈脂肪β-氧化相關的基因的表達適度降低。進一步研究發現,DCAF9 通過與CRL4-DDB1 構成E3 泛素連接酶,對組蛋白H2A 在K119進行單泛素化,從而抑制這些基因的表達,發揮其抑制脂肪生成的功能[32]。
2.9 DCAF11
DCAF11 與 CRL4-DDB1 復合物構成 E3 泛素連接酶,通過在S 期末對莖環結構結合蛋白(Stem-loop binding protein,SLBP)進行泛素化降解來抑制組蛋白合成,從而保障細胞周期的正常進行。SLBP 在Thr61/Ala 上的點突變會影響DCAF11的識別,阻礙SLBP 的降解,導致突變體細胞大量死亡[33]。DCAF11 還參與 p21 的單泛素化降解,從而調控細胞周期[32]。
2.10 DCAF13
目前關于DCAF13 的研究主要集中在功能定位上。DCAF13 是RNA 結合蛋白[34],其表達下降會導致40S 核糖體亞基前體的成熟障礙[35]。最近研究發現,小鼠卵母細胞中DCAF13 的條件性敲除,會引起卵母細胞發育停滯。DCAF13 參與卵母細胞的18S rRNA 加工及成熟過程,其缺失導致卵母細胞的核糖體組裝紊亂,引起蛋白質合成減少,最終導致卵母細胞發育停滯[36]。
2.11 DCAF14
DCAF14 又名 WDR11。目前,DCAF14 的研究方向主要集中于DCAF14 與腫瘤及發育障礙等疾病的相關性。DCAF14 基因位于染色體10q25~26。10q25~26 位置上基因的缺失所造成的疾病被稱為10q26 缺失綜合征,患者表現出顱面畸形、智力障礙、心臟結構缺損、生長遲緩等一系列生長發育障礙。研究提示,DCAF14 基因無義突變是導致10q26 缺失綜合征的重要原因[37]。同時,10q25~26和19q13.3~13.4 的等位基因缺失是神經膠質瘤中最常見的遺傳改變,Chernova 等[38]在腫瘤細胞系上證實這種遺傳改變往往伴隨DCAF14 基因的缺失,提示DCAF14 可能是一個重要的腫瘤抑制基因,但其抑制腫瘤形成的機制仍有待探索。
2.12 DCAF15
目前關于DCAF15 的研究比較少。現有文獻報道,DCAF15 可與CRL4-DDB1 復合物構成 E3泛素連接酶,并參與抗癌藥物indisulam 介導的對RBM39 的泛素化降解,從而靶向破壞前體mRNA的剪接,抑制癌細胞發生發展[39]。
2.13 DCAF17
DCAF17 參與維持正常的精卵細胞的生長發育。研究發現,在DCAF17 敲除的小鼠模型中,其精卵細胞數目明顯減少并伴隨功能缺陷,無法正常繁殖出子代[40]。進一步的研究證實,DCAF17 的缺陷會引起生殖細胞凋亡增加,但DCAF17 不參與配子形成減數分裂這一過程的調控[41]。總的來講,DCAF17 調控生殖細胞生長發育的分子機制仍不明確,有待進一步探究。
3 結語
自2006年發現DCAF 家族蛋白到現在,針對DCAF 家族蛋白的研究已經取得了很大的進展。就目前研究結果而言,DCAF 家族蛋白是機體維持正常生長發育所需的重要蛋白質,其功能涉及細胞的增殖、分化、凋亡等一系列調控; 同時,DCAF 蛋白通過與CRL4-DDB1 復合物構成E3泛素連接酶,對p21、p53 進行泛素化修飾,參與細胞周期的調控。例如:DCAF1、DCAF2、DCAF6、DCAF13 的缺陷會引起細胞增殖能力下降,相反DCAF3、DCAF6 的缺失則會引起細胞的大量異常增殖。此外,DCAF 家族蛋白的過表達或缺失與臨床上很多腫瘤、發育障礙等疾病的發生、進展密切相關。總的來講,DCAF 家族蛋白的研究,可以加深我們對細胞周期調控分子機制的認識,為今后腫瘤的臨床治療提供新方向。當然,關于DCAF家族蛋白的研究仍有很多問題需要完善。首先,截至目前,仍有許多DCAF 家族蛋白的功能及其分子機制未被發現; 其次,目前關于DCAF 家族蛋白的研究大多集中在其對機體生長發育的影響(比如對細胞周期的調控),而關于其在代謝、免疫等其他方面的研究相對較少,既然DCAF 蛋白與腫瘤和HIV 感染等一些疾病存在密切的相關性,那它在機體免疫過程中是否發揮重要的角色?或許也值得進一步探索。

