人冠狀病毒治療藥物研究進展
全彥妮,王宜軒,李艷萍
·新型冠狀病毒專欄·
人冠狀病毒治療藥物研究進展
全彥妮,王宜軒,李艷萍
100050 北京,中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院醫(yī)藥生物技術(shù)研究所中國醫(yī)學(xué)科學(xué)院抗病毒藥物研究重點實驗室
冠狀病毒(coronaviruses,CoVs)是人畜共患病毒,廣泛存在于自然界,最早從鼠身上分離得到。因為大多在家畜、鳥禽等脊椎動物間傳播,主要會對農(nóng)業(yè)和畜牧業(yè)造成明顯影響[1-2]。動物冠狀病毒進化后實現(xiàn)跨物種傳播,感染人導(dǎo)致人冠狀病毒(human coronavirus,HCoV)的出現(xiàn)[3]。較早出現(xiàn)的人冠狀病毒如 HCoV-229E 和 OC43 病毒感染癥狀較輕,一般表現(xiàn)為類似感冒的上呼吸道感染,且多數(shù)能自愈,藥物研究也較少,未被人類重視[4-5]。然而在近二十年,陸續(xù)出現(xiàn)了多種新型人冠狀病毒,而且傳染力和致病力明顯增強,病毒感染導(dǎo)致的嚴(yán)重下呼吸道疾病對患者生命健康構(gòu)成了巨大威脅。2003 年的嚴(yán)重急性呼吸窘迫綜合征(severe acute respiratory syndrome,SARS)疫情導(dǎo)致全球 20 多個國家共計8000 多病例報告和 10% 的死亡率,中東呼吸綜合征(Middle East respiratory syndrome,MERS)死亡率更是高達(dá) 30%,而我國武漢暴發(fā)的新型冠狀病毒肺炎(COVID-19)疫情自 2019 年 12 月發(fā)現(xiàn)至今已經(jīng)導(dǎo)致了超過三十萬的全球確診病例。遺憾的是,到目前為止,針對這些高致病力病毒還沒有明確有效的疫苗或特異性抗病毒藥物上市。突發(fā)的疫情一次次刷新人類對于冠狀病毒的了解和態(tài)度,也推動了冠狀病毒預(yù)防和治療方法的研究進度。本文對現(xiàn)有冠狀病毒藥物研究文獻進行梳理,希望能夠為突發(fā)性人冠狀病毒感染治療藥物研究提供思路。
1 冠狀病毒生物學(xué)特征
CoVs 是一類有包膜的正性單鏈 RNA 病毒,病毒顆粒直徑 80 ~ 120 nm,其結(jié)構(gòu)由外到內(nèi)依次為:刺突、外膜、包膜、衣殼、基因組。從膜表面伸出的刺突使病毒表面近似王冠,因而得名冠狀病毒[6]。冠狀病毒基因組長度為 26 ~32 kb,5' 端有兩個重疊的開放讀碼框 ORF1a 和 ORF1b,編碼兩個復(fù)制酶多蛋白前體 pp1a 和 pp1ab,在多蛋白 pp1ab 中含有蛋白酶,能夠?qū)⒍嗟鞍浊绑w裂解為生成新病毒顆粒必需的一系列非結(jié)構(gòu)蛋白(non-structural protein,nps);而剩余的讀碼框則編碼病毒結(jié)構(gòu)蛋白,包括刺突糖蛋白(spike glycoprotein,S)、膜蛋白(membrane protein,M)、包膜蛋白(envelop protein,E)和核衣殼蛋白(nucleocapsid protein,N)以及病毒復(fù)制輔助蛋白。國際病毒委員會的 2018 版病毒分類將冠狀病毒暫歸為 α、β、γ 和 δ-四個屬,近40 個毒種。其中感染人的冠狀病毒共有 6 種(HCoV-229E、OC43、NL63、HKU1、SARS-CoV 和 MERS-CoV)(表 1)。加上我國 2019 年 12 月新出現(xiàn)的 SARS-CoV-2 病毒,目前發(fā)現(xiàn)的人冠狀病毒共有 7 種。除 HCoV-229E 和 NL63 屬于 α 冠狀病毒屬外,其他 5 種人冠狀病毒均屬于 β 冠狀病毒屬。
冠狀病毒的生命周期可以分為病毒進入、病毒復(fù)制和蛋白合成、組裝和出胞釋放等基本步驟。在病毒進入的過程中,刺突糖蛋白 S 發(fā)揮著重要作用。S 蛋白的兩個亞單位 S1 和 S2 分別負(fù)責(zé)與細(xì)胞受體結(jié)合以及病毒與細(xì)胞膜融合,二者協(xié)同介導(dǎo)病毒與細(xì)胞表面受體結(jié)合,啟動病毒 S 蛋白構(gòu)象變化,完成內(nèi)化和病毒進入;同時,宿主半胱氨酸組織蛋白酶和跨膜絲氨酸蛋白酶(transmembrane protease serines,TMPRRS)已經(jīng)被證實參與介導(dǎo)病毒進入過程中S 蛋白水解和完成膜融合的過程;病毒進入細(xì)胞后,多蛋白前體在胞漿中被蛋白酶(chymotrypsin-like protease,3CLpro和 papain-like protease,PLpro)裂解生成功能性非結(jié)構(gòu)蛋白,催化病毒基因組復(fù)制和蛋白合成,在病毒的十余個非結(jié)構(gòu)蛋白中,目前只對依賴 RNA 的 RNA 聚合酶(RNA-dependent RNA polymerse,RdRp)、解旋酶和外切核糖核酸酶的功能有了較為明確的認(rèn)識,大部分非結(jié)構(gòu)蛋白的功能還并不清楚;最后病毒蛋白和基因組 RNA 整合成新的病毒顆粒,通過芽生或胞吐的方式排出,這兩個環(huán)節(jié)的具體機制也研究較少。
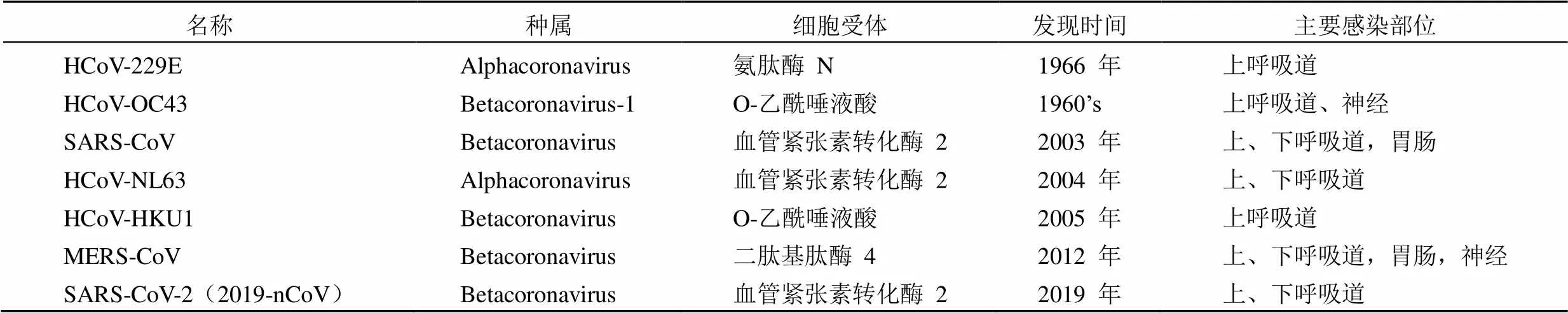
表 1 目前已證實的人冠狀病毒
2 冠狀病毒感染治療藥物研究
雖然冠狀病毒發(fā)現(xiàn)時間早,種類多樣,但針對人冠狀病毒的研究是從 SARS 病毒出現(xiàn)后才得到越來越多的關(guān)注。目前的文獻報道中,大部分是針對 SARS 或 MERS 等高致病病毒的研究結(jié)果。而且,多數(shù)抗病毒化合物都是源自對已上市藥物或生物活性化合物庫的高通量篩選。在病毒蛋白結(jié)晶結(jié)構(gòu)得到證實之后,全新藥物設(shè)計開始嶄露頭角。在病毒的整個生命周期中,每一個環(huán)節(jié)以及參與其中發(fā)揮作用的功能蛋白都可能成為研發(fā)抗病毒藥物的靶點。因此,本文首先把目前文獻結(jié)果依據(jù)所針對的病毒生命周期中的不同環(huán)節(jié)進行分類,然后再細(xì)化描述每類藥物中涉及的作用靶點及相關(guān)藥物研究進展;同時補充分析機制不明確的抗病毒活性化合物,但對完全虛擬篩選的研究結(jié)果不做討論。
2.1 病毒進入抑制劑
2.1.1 靶向刺突蛋白與受體相互作用的抗體藥物 S 蛋白具有免疫原性,能夠誘導(dǎo)宿主免疫反應(yīng),因此,作為抗體藥物研究靶點受到一定關(guān)注。公開的文獻報道大部分是以 SARS 或 MERS 病毒 S 蛋白的特定序列或相應(yīng)細(xì)胞受體的部分結(jié)合區(qū)域作為抗原表位開發(fā)的單克隆抗體,這類抗體能夠直接中和病毒或者通過阻止刺突蛋白與細(xì)胞受體結(jié)合來實現(xiàn)預(yù)防或治療病毒感染[7-8]。多個單抗藥物已經(jīng)在動物模型上被證實具有強病毒中和活性,比如抗 MERS 病毒的 m336,作為預(yù)防用藥能夠降低兔體內(nèi)病毒滴度達(dá)到 40 ~ 9000 倍[9],還有研究表明,當(dāng)靶向 S 蛋白 HR1 結(jié)構(gòu)域的多肽 HR2P-M2 與 m336 聯(lián)合使用時,其抗 MERS-CoV 活性比單藥使用時更高[10]。我國科學(xué)家從 MERS 恢復(fù)者血漿中提取得到的單克隆抗體 MCA1能夠阻斷病毒與細(xì)胞受體 DPP4 之間的相互作用,動物實驗顯示其不僅明顯改善了病毒感染動物的肺部病理,而且完全抑制了猴體內(nèi) MERS 病毒的復(fù)制[11]。另外,兩個靶向病毒 S 蛋白受體結(jié)合域(receptor binding domain,RBD)表位的單克隆抗體 REGN3051 和 3048 不僅在動物模型上顯示出對 MERS 病毒的預(yù)防和治療效果,并且已經(jīng)完成 I 期臨床研究[12]。Luke 等[13]通過實驗發(fā)現(xiàn),多克隆抗體 SAB-301 能使 MERS-CoV 感染的 Ad5-hDPP4 受體轉(zhuǎn)導(dǎo)小鼠的肺病毒滴度接近或低于檢測極限。由于不同冠狀病毒 S1 上與受體結(jié)合的基因差異,導(dǎo)致靶向 S 蛋白 S1 受體結(jié)合域 RBD 的抗體藥物也會不同,因此以 RBD 區(qū)域設(shè)計的抗體藥物不具有廣譜應(yīng)用的特性[14]。Wrapp 等[15]也證實靶向 SARS 病毒RBD 的三種單克隆抗體(S230、m396 和 80R)與新型冠狀病毒 SARS-CoV-2 之間缺乏交叉反應(yīng)活性。因此,對于新出現(xiàn)的突發(fā)冠狀病毒,基于刺突蛋白的治療抗體需要依靠分離自身病毒來制備。
2.1.2 刺突蛋白與宿主細(xì)胞受體結(jié)合抑制劑 不同冠狀病毒刺突蛋白的 S1 上 RBD 差異大,因此通過識別不同的宿主細(xì)胞膜受體并發(fā)生相互作用來實現(xiàn)病毒穿入(表 1)[16]。HCoV-NL63、SARS-CoV 和 SARS-CoV-2 的 S 蛋白均結(jié)合人表皮細(xì)胞膜上的血管緊張素轉(zhuǎn)化酶 2(angiotensin converting enzyme 2,ACE2);MERS 病毒和 229E 病毒的細(xì)胞表面受體分別是二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)和氨肽酶N(APN);而 HCoV-OC43 和 HKU1 的 S 蛋白則通過結(jié)合 O-乙酰唾液酸來啟動進入[17-21]。這類病毒-宿主相互作用闡釋也促進了治療藥物的發(fā)現(xiàn)研究。Kao 等[22]發(fā)現(xiàn)VE607(1,圖 1)能夠阻斷 SARS-CoV 的 S 蛋白與 ACE2 結(jié)合介導(dǎo)的病毒進入,其抑制 SARS-CoV 的 EC50值為 1.6 μmol/L。SARS-CoV-2 與 SARS 病毒類似,也是利用 ACE2 實現(xiàn)病毒進入宿主細(xì)胞[23]。而且,最新 SPR(surface plasmon resonance)實驗研究顯示,新病毒的S 蛋白與 ACE2 的親和力是 SARS 病毒的 10 ~ 20 倍[15]。研究者發(fā)現(xiàn),陽離子衍生殼聚糖聚合物 HTCC (N-(2-hydroxypropyl)-3-trimethylammonium chitosan chloride, 2,圖 1)及其疏水衍生物能夠與刺突蛋白結(jié)合,從而阻止冠狀病毒 NL63 與細(xì)胞受體 ACE2 的相互作用而產(chǎn)生抑制病毒復(fù)制的活性,通過 CPE 方法測定HTCC 抑制 NL63 病毒復(fù)制的 IC50為 10 μg/ml[24]。而且 HTCC 不同聚合物對幾種低致病力冠狀病毒(冠狀病毒 OC43、229E 和 HKU1)分別顯示出體外抗病毒活性[25]。
2.1.3 肽類病毒融合抑制劑 冠狀病毒刺突蛋白是一個病毒融合蛋白,其被酶水解切割后生成 S1 和 S2 兩個亞單位。S1 亞單位上的 RBD 與受體結(jié)合后,S2 亞單位負(fù)責(zé)介導(dǎo)病毒與細(xì)胞膜的融合。研究顯示,在 SARS 病毒刺突蛋白 S2 上含有兩個七肽重復(fù)序列 HR1 和 HR2,HR1 和 HR2 能夠通過相互作用使 S2 發(fā)生結(jié)構(gòu)變化,形成與細(xì)胞膜類似的六聚體結(jié)構(gòu),介導(dǎo)病毒與細(xì)胞膜融合。因此,根據(jù)這兩個七肽重復(fù)序列可以設(shè)計抗病毒肽,通過抑制 HR1 和 HR2 介導(dǎo)的刺突蛋白結(jié)構(gòu)變化,阻斷膜融合。Liu 等[26]分別針對 HR1 和 HR2 的氨基酸序列設(shè)計了不同長度的肽段,通過測定這些肽段對 SARS 病毒復(fù)制的影響以及分子結(jié)合實驗,發(fā)現(xiàn)了一個由 HR2 的 1153-1189 殘基衍生的抗病毒肽先導(dǎo)物 CP-1(IC50= 19 μmol/L)。在 MERS 病毒出現(xiàn)后,該研究組解析了 MERS 病毒刺突蛋白 S2 亞單位的蛋白結(jié)晶結(jié)構(gòu),并在此基礎(chǔ)上基于上述類似的原理,構(gòu)建了多個能夠覆蓋 HR1 和HR2 結(jié)合區(qū)域的新肽段,發(fā)現(xiàn)其中一個 HR2 衍生肽段 HR2P 能夠有效抑制 MERS 病毒的復(fù)制(IC50= 0.6 μmol/L)以及刺突蛋白介導(dǎo)的膜融合(IC50= 0.8 μmol/L),同時發(fā)現(xiàn)在 HR2P 的結(jié)構(gòu)中引入親水氨基酸能夠改善溶解性、穩(wěn)定性和抗病毒活性[27]。
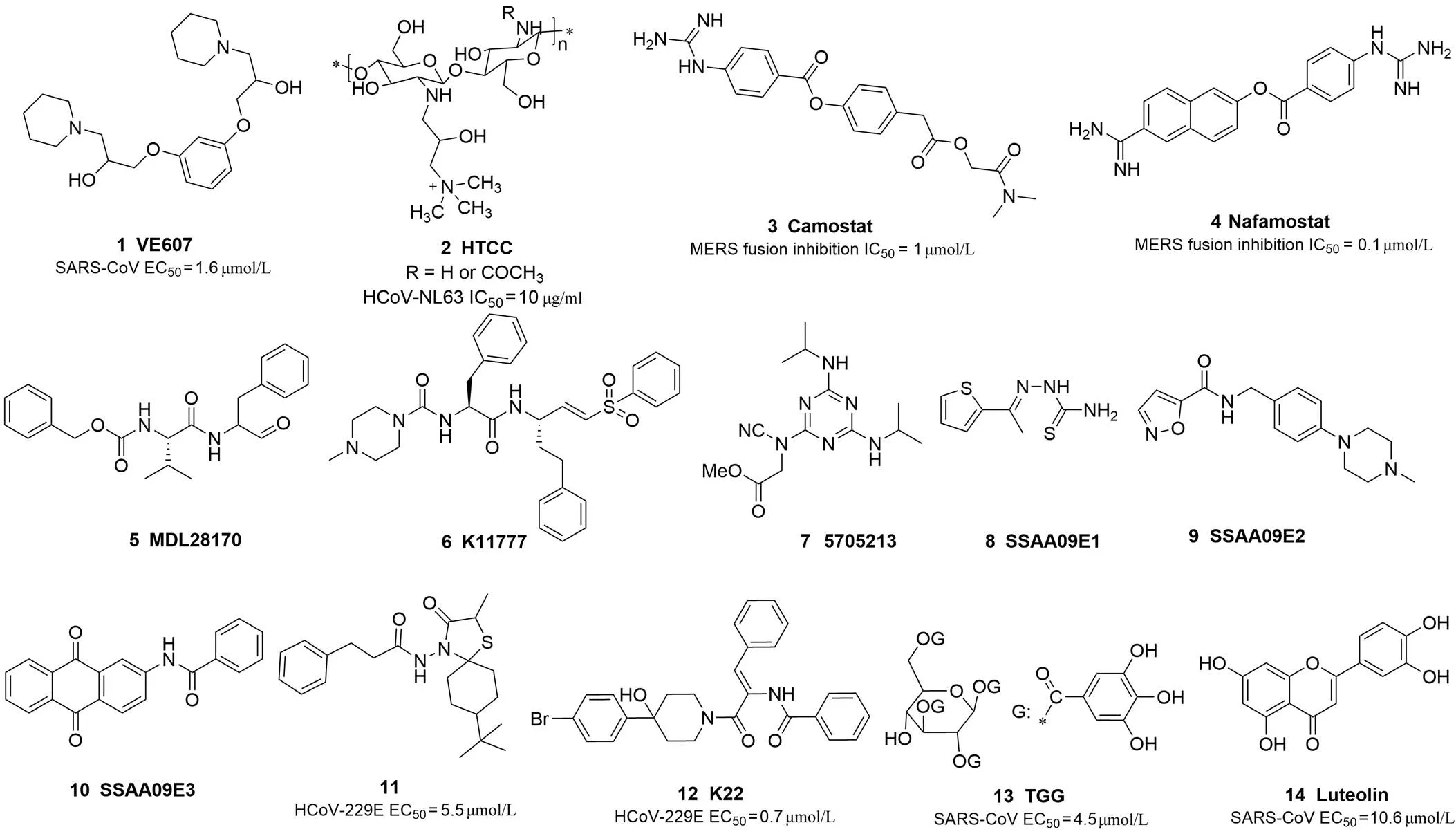
圖 1 冠狀病毒進入抑制劑
2.1.4 II 型跨膜絲氨酸蛋白酶 TMPRRS2 介導(dǎo)的融合抑制劑 TMPRRS2 是一種在呼吸道表皮細(xì)胞表達(dá)的宿主細(xì)胞跨膜絲氨酸蛋白酶,具有活化病毒表面糖蛋白,促進病毒以非內(nèi)吞途徑進入細(xì)胞的作用。已有研究顯示,TMPRRS2 能夠活化 SARS、MERS 和 NL63 病毒通過非內(nèi)吞途徑進入細(xì)胞的膜融合過程[28-29]。而且,冠狀病毒 229E 臨床分離株可能更多依賴 TMPRRS2 介導(dǎo)的融合方式進入人呼吸道表皮細(xì)胞[30-31]。因此,TMPRRS2 抑制劑具有抗冠狀病毒藥物的研究潛力。甲磺酸卡莫司他是一個用于治療胰腺炎的小分子絲氨酸蛋白酶抑制劑上市藥物。卡莫司他(camostat,3,圖 1)不僅在表達(dá) ACE2 和 TMPRSS2 酶的細(xì)胞模型上阻止了 SARS 病毒和 NL63 病毒與細(xì)胞膜的融合,動物實驗結(jié)果顯示,卡莫司他可有效保護小鼠受 SARS-CoV 感染所致的死亡,存活率為 60%[32-33]。Yamamoto 等[34]通過建立特定的 MERS-細(xì)胞融合模型篩選 1000 多個 FDA 上市藥物后,發(fā)現(xiàn)并確證絲氨酸蛋白酶抑制劑萘莫司他(nafamostat,4,圖 1)具有依賴 TMPRRS2 酶活性,阻止 MERS 病毒膜融合的作用,IC50為 0.1 μmol/L。而且,在病毒感染體外模型上,萘莫司他在 1 nmol/L 濃度下顯示出明顯的抗 MERS-CoV 復(fù)制的活性,活性強度是化合物卡莫司他的 100 倍。近日,最新藥物篩選研究證實萘莫司他對SARS-CoV-2 病毒也具有一定的抑制活性(EC50= 22.50 μmol/L,CC50> 100 μmol/L,SI > 4.44)[35]。
2.1.5 組織蛋白酶抑制劑 針對 SARS-CoV 的蛋白酶抑制劑研究顯示,組織蛋白酶L 抑制劑 MDL28170(5,圖 1)抑制了 S 蛋白介導(dǎo)的病毒感染,同時認(rèn)為相比組織蛋白酶 B,組織蛋白酶 L的蛋白水解作用對于病毒進入和感染可能更重要。Zhou 等[33]在高通量藥物再評價篩選中發(fā)現(xiàn)小分子組織蛋白酶B 和 L雙重抑制劑 K11777(6,圖 1)能夠抑制多種冠狀病毒(SARS-CoV、MERS-CoV、HCoV-NL63)進入細(xì)胞,體外 IC50在納摩爾濃度水平。同時,該研究報道顯示,聯(lián)合組織蛋白酶抑制劑K11777 和蛋白酶抑制劑卡莫司他能夠明顯增強體外抗病毒作用,但遺憾的是,在 SARS-CoV 感染動物實驗中K11777 衍生物單用或與卡莫司他聯(lián)合均沒有得到陽性結(jié)果。Elshabrawy 等[36]通過高通量篩選發(fā)現(xiàn)小分子廣譜抗病毒化合物5705213(7,圖 1)及其衍生物能特異性地抑制組織蛋白酶 L 水解蛋白的作用,抑制 SARS-CoV 假病毒進入細(xì)胞。并且,7與 TMPRSS2 抑制劑聯(lián)用具有協(xié)同作用。
2.1.6 其他病毒進入抑制劑 Adedeji 等[37]曾通過帶有 SARS 病毒表面糖蛋白的假病毒模型,對化合物庫進行篩選得到三個 SARS 病毒進入抑制劑(SSAA09E1、SSAA09E2 和 SSAA09E3,圖 1),并且發(fā)現(xiàn)這三個化合物擁有三種不同的作用機制。SSAA09E1(8)通過抑制組織蛋白酶 L 的活性阻止病毒 S 蛋白水解;SSAA09E2(9)抑制了病毒與細(xì)胞受體 ACE2 的相互作用;SSAA09E3(10)則抑制了病毒的膜融合。Apayd?n 等[38]合成了一系列以 1-硫雜-4-氮雜螺[4.5]癸-3-酮為骨架的流感病毒融合抑制劑化合物,同時發(fā)現(xiàn)這類化合物還具有抗冠狀病毒的活性,化合物11(圖 1)體外抗 HCoV-229E 病毒的 EC50為 5.5 μmol/L。Lundin 等[39]在篩選抗 HCoV-229E 病毒化合物時,從一萬多化合物中發(fā)現(xiàn)化合物 K22(12,圖 1)能夠有效抑制病毒復(fù)制,體外 EC50為 0.7 μmol/L,并且發(fā)現(xiàn)K22 在病毒進入階段的后期顯示出最強的抗病毒活性。機制研究顯示,K22 通過抑制病毒進入細(xì)胞后雙層膜囊泡的形成,而阻斷了病毒 RNA 合成。雖然K22 耐藥變異出現(xiàn)在 nsp6 蛋白殘基,但是其作用靶點是否就是 nsp6 還不清楚;另外,K22 在體外還顯示出廣譜抗冠狀病毒活性,對 SARS-CoV 和 MERS-CoV 均具有抑制活性。Yi 等[40]通過篩選中草藥提取物庫,發(fā)現(xiàn)小分子葡萄糖四沒食子酸酯TGG(Tetra--β-D-glucose,13,圖 1)和木犀草素(luteolin,14,圖 1)能夠阻止帶有 SARS 表面刺突糖蛋白的假病毒進入細(xì)胞,并在野生病毒感染細(xì)胞模型上證實了這兩個化合物的抗病毒活性(EC50值分別為 4.5 和 10.6 μmol/L)。
2.2 病毒復(fù)制抑制劑
2.2.1 病毒蛋白酶 3CLpro抑制劑 3C樣蛋白酶(3-chymotrypsin-like protease,3CLpro)是位于冠狀病毒非結(jié)構(gòu)蛋白 nsp5 上的半胱氨酸蛋白酶,負(fù)責(zé)催化冠狀病毒前體多蛋白水解為病毒功能蛋白。3CLpro單體無活性,二聚體具有催化活性。其酶活性結(jié)構(gòu)中含有 Cys-His 二元催化單元,His 幫助 Cys 脫去氫質(zhì)子產(chǎn)生親核性的半胱氨酸,開始對目標(biāo)蛋白水解加工。SARS 病毒 3CLpro與六肽基氯甲基酮(Cbz-Val-Asn-Ser-Thr-Leu-Gln-CMK,15,圖 2)復(fù)合物的 X 射線晶體結(jié)構(gòu)顯示:3CLpro單體含有三個結(jié)構(gòu)域(I、II 和 III),抑制劑的結(jié)合區(qū)域位于 I 和 II 之間的狹縫處,3CLpro的底物結(jié)合亞單位 S1 對底物 P1 區(qū)的谷氨酰胺有特異性的要求[41]。3CLpro作為冠狀病毒主要蛋白酶具有較高保守性,因此成為廣譜抗病毒藥物的重要靶點[42]。Pillaiyar 等[43]在 2016 年曾對 SARS 病毒 3CL 蛋白酶抑制劑做了非常系統(tǒng)的綜述,詳細(xì)闡述了近 200 個肽類似物或小分子抑制劑的研究結(jié)果。因此,本文將不再贅述,僅在其基礎(chǔ)上對近幾年的新進展進行闡述。
首先,蛋白酶抑制劑 GC376(16,圖 2)已經(jīng)被證明可以用于貓的冠狀病毒感染治療,Galasiti Kankanamalage等[44]從 GC376 與 MERS-CoV 的 3CLpro蛋白復(fù)合物結(jié)晶出發(fā),基于增加化合物與 S3 位點作用力和改善化合物溶解性質(zhì)的目的,設(shè)計合成了 P4 位置含有取代哌啶基團的一系列新型肽模擬物,在生化和細(xì)胞水平上證實了這類化合物對 MERS-CoV 蛋白酶的抑制活性以及抗 MERS-CoV 活性,同時用 X 射線衍射證明了活性化合物17(圖 2)靶向 3CLpro的作用機制。AG7088(18,圖 2)是已知的小 RNA 病毒3C蛋白酶抑制劑,但是對 MERS-CoV 沒有抑制活性。Kumar 等[45]通過化學(xué)改造得到了一類帶醛基彈頭的肽類似物。在篩選抗 MERS-CoV 化合物的過程中,發(fā)現(xiàn)這類化合物的抗病毒潛力,其中有三個類似物(19,圖 2)對 MERS-CoV、HCoV-229E 和 OC43 均有抗病毒活性,EC50在微摩爾濃度,而且對 MERS-CoV 的活性最強。以六肽 CMK 衍生物為起點的肽或擬肽類 3CLpro抑制劑結(jié)構(gòu)優(yōu)化一直在進行,研究進展主要體現(xiàn)在彈頭連接和共價失活的優(yōu)化策略變化上。最近,Zhang 等[46]在前期研究基礎(chǔ)上通過在 P1 位置引入 α-酮酰胺(圖2),設(shè)計合成了一類新型的肽模擬物,并在復(fù)制子細(xì)胞模型上證實多個化合物(20,圖 2)對 α 和 β 兩個種屬的冠狀病毒(HCoV-NL63、MERS-CoV、SARS-CoV)均顯示明顯抑制活性,體外 IC50在低微摩爾水平;更值得一提的是,在 MERS 病毒感染的 Huh7 細(xì)胞模型上,這類化合物的抗病毒活性達(dá)到了低納摩爾水平。盡管有較多的前期研究,可能是因為肽類化合物成藥性低的原因,至今還沒有進入臨床試驗,動物實驗也比較少見報道,多數(shù)還僅限于生化或細(xì)胞水平的結(jié)果。
日本 Akaji 研究組一直在進行 R188I 突變 SARS 病毒 3CLpro抑制劑研究,為了降低肽鏈酶解和共價結(jié)合毒性問題,他們以前期研究的肽類抑制劑21(圖 3)為起點,致力于設(shè)計新型骨架來替換肽鏈和更安全的彈頭基團替代醛基[47-48]。通過在 P2 區(qū)擴展引入大體積疏水性骨架先后設(shè)計合成了新型含有氫化異喹啉骨架(22,圖 3)和八氫異色烯骨架(23,圖 3)的擬肽類酶抑制劑;在氫化異喹啉骨架類化合物的研究中,分別在提高溶解性和安全性方面取得了相應(yīng)的進展,發(fā)現(xiàn)了親水性增強的衍生物24(圖 3)和更安全的新型硫縮醛彈頭衍生物25(圖 3)。但上述工作只考察了化合物對酶的抑制活性,沒有抗病毒活性的數(shù)據(jù),目前的酶活性數(shù)據(jù)還有待改善。另外,他們采用骨架躍遷還設(shè)計了基于絲氨酸骨架的新擬肽化合物 SK23(26,圖 3)以及苯基異絲氨酸化合物 SK80(27,圖 3),為后期的小分子 3CLpro抑制劑發(fā)現(xiàn)奠定了基礎(chǔ)[49-50]。苯并三唑已經(jīng)被證實是小分子 3CLpro抑制劑的活性骨架。Karypidou 等[51]通過對合成的庫篩選發(fā)現(xiàn)了一個對 HCoV-E229 具有微摩爾級抑制活性的稠環(huán)三唑類新結(jié)構(gòu)化合物(28,圖 3),體外 EC50在 10 μmol/L 左右。他們通過計算機模擬和對接分析確定活性化合物的靶點可能是 3CLpro。此外,黃酮類化合物草棉黃素(29,圖 3)和漆葉苷(30,圖 3)也曾被證實對 SARS 和 MERS-3CLpro具有抑制活性,從而發(fā)揮抗病毒復(fù)制的作用[52-53]。
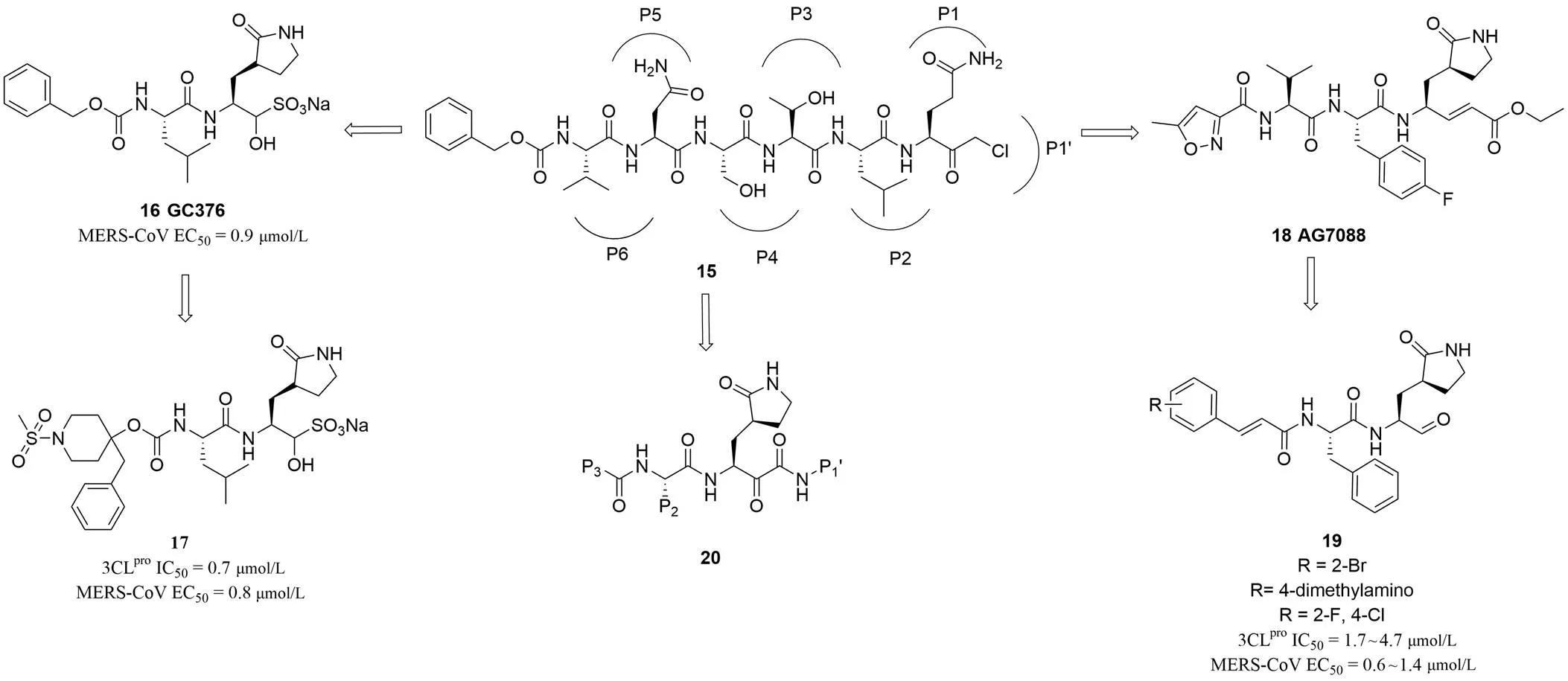
圖2 擬肽類3CLpro抑制劑的發(fā)現(xiàn)和主要結(jié)構(gòu)類型
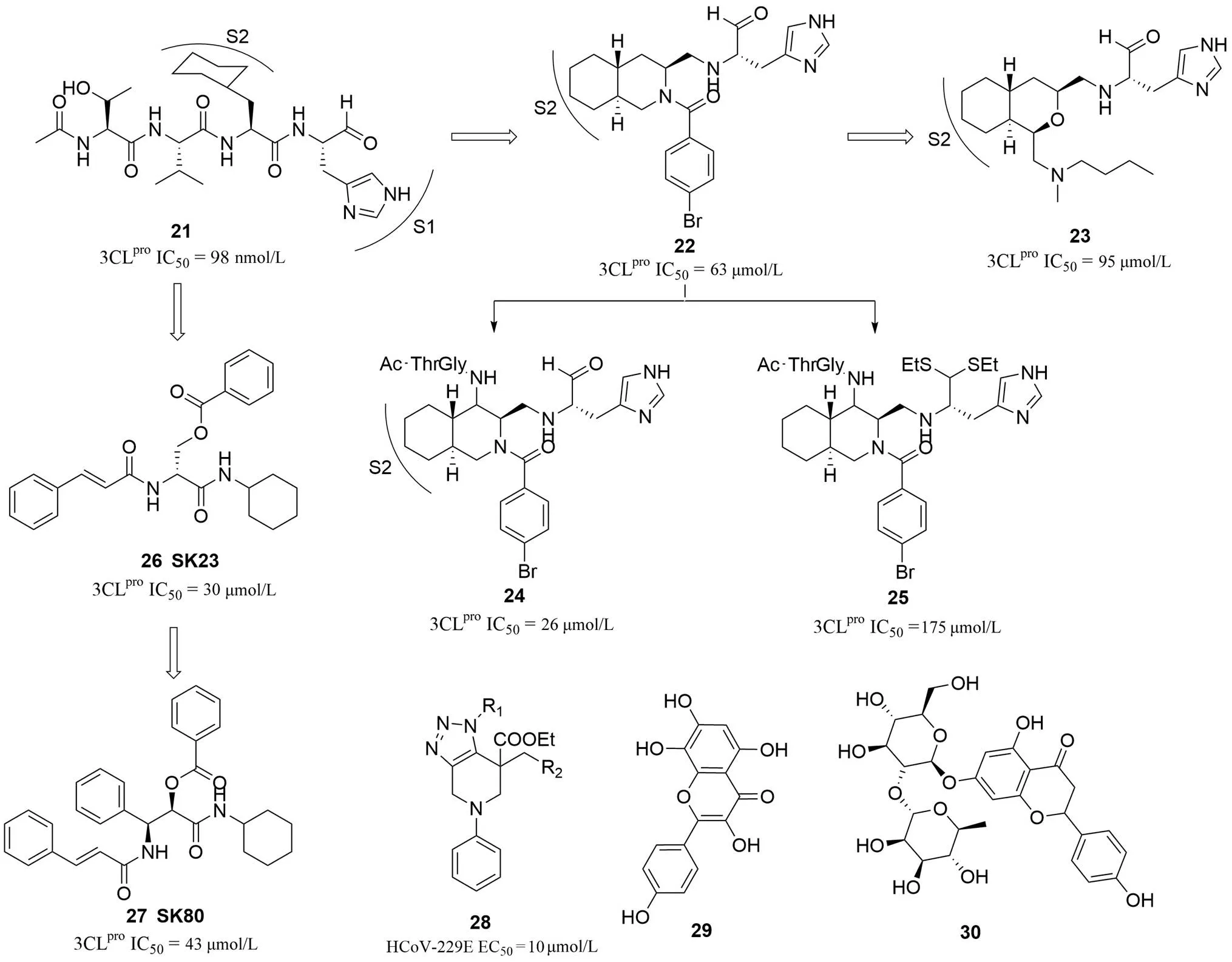
圖 3 抗耐藥冠狀病毒3CLpro蛋白酶抑制劑及小分子3CLpro抑制劑
2.2.2 木瓜樣蛋白酶抑制劑 冠狀病毒木瓜樣蛋白酶(papain-like protein,PLpro)位于 nsp3 上的半胱氨酸蛋白酶,具有去泛素化功能[54]。一般冠狀病毒編碼兩個木瓜樣蛋白酶 PLP1 和 PLP2,但是 SARS 和 MERS 病毒編碼一個木瓜樣蛋白 PLpro。現(xiàn)在 PL 蛋白酶抑制劑的研究大都是針對 SARS-CoV 和 MERS-CoV 的 PLpro進行的,SARS 病毒 PLpro的活性位點含有一個與 3CLpro二元催化單元類似的 Cys112-His273-Asp287 三元催化單位,其中的 Asp287 的功能是協(xié)助 His273 催化 Cys112 脫氫,酶催化原理與 3CLpro類似,均是 Cys 由 His 協(xié)助催化脫氫后通過親核進攻實現(xiàn)對目標(biāo)底物水解切割[55]。在 SARS 病毒的 PL 蛋白結(jié)晶結(jié)構(gòu)被解析之前,尋找 PLpro蛋白酶抑制劑的主要途徑是高通量篩選。2011 年,F(xiàn)rieman 等[56]首先建立了一個 PLP 酶活性誘導(dǎo)的慢生長酵母篩選體系,并對 NIH 化合物庫中的 2000 個結(jié)構(gòu)多樣化合物進行了篩選。雖然化合物NSC158362(31,圖 4)和 NSC158011(32,圖 4)被證實能逆轉(zhuǎn) PLP 酶誘導(dǎo)的慢生長,而且31在細(xì)胞水平對SARS-CoV 也具有明顯的抑制活性,但對 PLP 酶活性卻沒有直接抑制作用;而32沒有抑制病毒生長的作用,但存在對PLP 酶活性的抑制。Ratia 等[57-58]先建立了一個高靈敏度帶有熒光報告基團的 PLpro抑制劑篩選模型,通過對 50 080 個化合物篩選發(fā)現(xiàn)化合物 7724772(33,圖 4)和 6577871(34,圖 4)能劑量依賴地抑制 PLpro活性,IC50為 20 和 59 μmol/L,以這兩個化合物為起點,先后結(jié)構(gòu)優(yōu)化衍生出兩個選擇性 PLpro非共價抑制劑GRL0617(35,IC50= 0.6 ± 0.1 μmol/L,圖 4)和36(IC50=0.32 ± 0.01 μmol/L,圖 4),同時證實35和36具有抗SARS-CoV 復(fù)制活性,EC50分別為(14.5 ± 0.8)和(9.1±0.5)μmol/L。該研究還獲得了多個活性化合物與 PLpro復(fù)合物結(jié)晶,為后期結(jié)構(gòu)優(yōu)化奠定了基礎(chǔ)[59]。雙硫侖(disulfilam,37,圖 4)是一種硫醇反應(yīng)性化合物,可以共價修飾半胱氨酸殘基。Lin 等[60]通過實驗得出,雙硫侖對 SARS 和 MERS 的 PLpro酶均表現(xiàn)出劑量依賴性抑制作用,但作用機制不同,它是 SARS-PLpro的共價不可逆抑制劑,同時是 MERS-PLpro的變構(gòu)調(diào)節(jié)抑制劑。IC50分別是(24.1 ± 1.8)、(14.6 ± 1.3)μmol/L。巰嘌呤類腫瘤治療藥物 6-巰基嘌呤(6-MP,38,圖 4)和 6-硫鳥嘌呤(6-TG,39,圖 4)也曾被發(fā)現(xiàn)是 SARS-PLpro的競爭性抑制劑,同時具有抗 SARS-CoV 活性,IC50分別為(26.9 ± 7.5)和(24.4 ± 4.3)μmol/L[61]。后續(xù)研究進一步證實這兩個化合物也是 MERS-PLpro抑制劑,它們與免疫抑制劑霉酚酸聯(lián)合還具有協(xié)同的抗 MER-CoV 活性[62]。但是,可以預(yù)測這類抗腫瘤化合物的毒性問題最終會限制它們的抗病毒應(yīng)用前景。
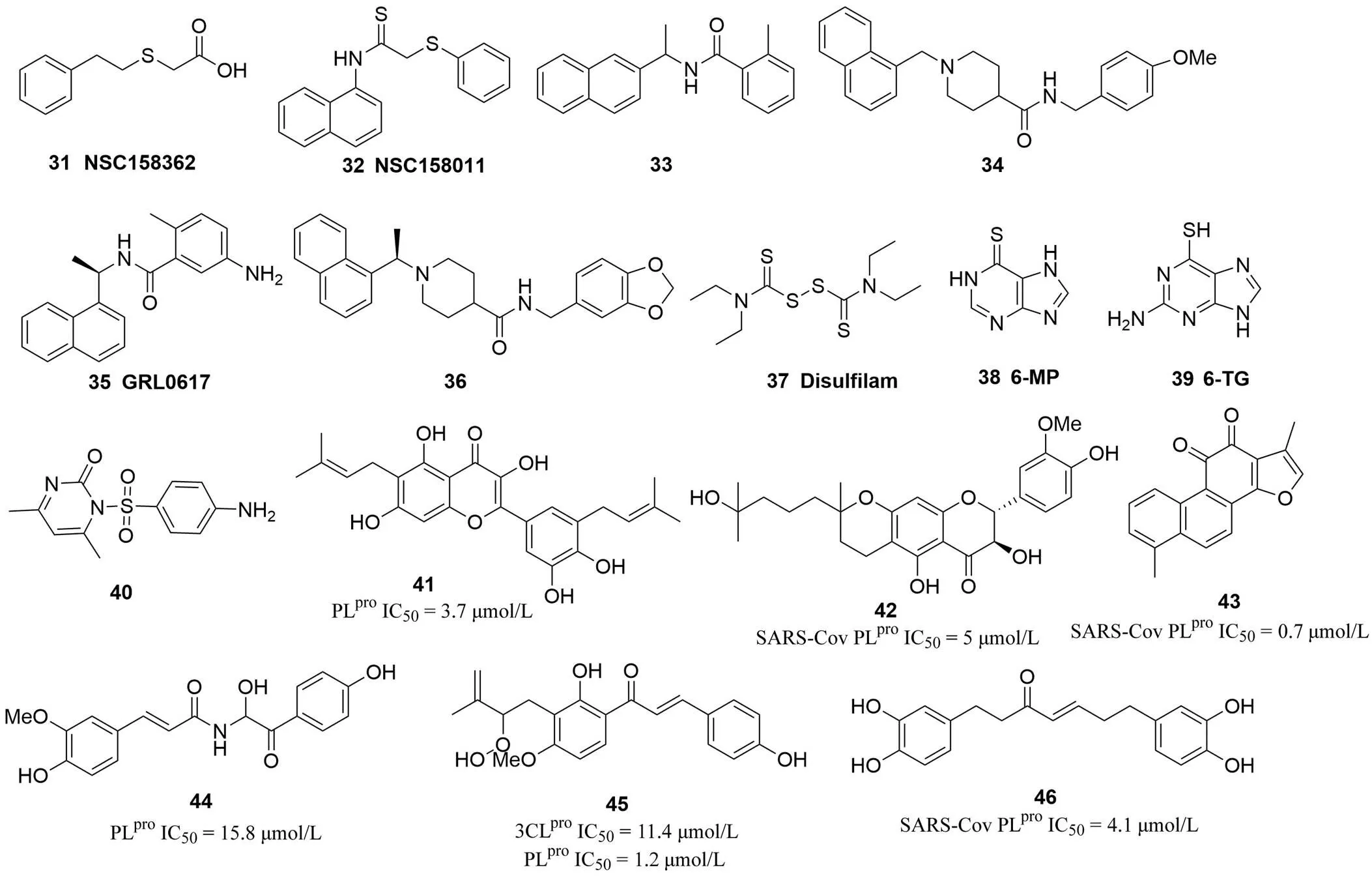
圖 4 冠狀病毒PLpro蛋白酶抑制劑
Lee 等[63]通過測定 MERS-PLpro蛋白結(jié)晶發(fā)現(xiàn)其與 SARS-PLpro蛋白結(jié)構(gòu)大致相同,也具有去泛素化活性,但是在抑制劑結(jié)合位點存在明顯不同。得出這兩個病毒的 PLpro酶抑制劑可能不具有交叉效應(yīng)的結(jié)論,并在對 25 000 個化合物同時進行 SARS-PLpro和 MERS-PLpro抑制活性篩選后,證實了這個推測。而且,篩選還發(fā)現(xiàn)了具有不同作用機制的雙重酶抑制劑小分子片段。從而再次證明 MERS 病毒的 PLpro酶與 SARS 病毒的 PLpro酶對抑制劑具有不同的識別模式。采用類似的方法,該研究小組又對 30 000 個商業(yè)化合物開展了 MERS-PLpro抑制劑的定向篩選,并對得到的陽性化合物進行多輪活性和機制的驗證,確定了先導(dǎo)化合物40(圖 4)。目前他們計劃將這兩部分工作結(jié)合起來以發(fā)現(xiàn)新結(jié)構(gòu)的 MERS-PLpro抑制劑[64]。
另外,多個具有廣泛的生物活性的天然產(chǎn)物被研究證實具有 PLpro抑制活性,如多酚類(41,圖 4)[65]、黃酮天竺葵酯(42,圖 4)[66]、丹參酮(43,圖 4)[67]、肉桂酰胺(44,圖 4)[68]、查爾酮(45,圖 4)[69]、姜黃素類化合物(46,圖 4)[70]。上述天然產(chǎn)物的研究結(jié)果多數(shù)是基于生化水平分析方法的酶抑制活性,缺少對于細(xì)胞水平病毒復(fù)制的影響數(shù)據(jù),用于抗病毒藥物研究的潛力有待開發(fā)。
2.2.3 依賴 RNA 的 RNA 聚合酶(RdRp)抑制劑 RdRp 位于非結(jié)構(gòu)蛋白 nsp12 內(nèi),是 RNA 病毒基因復(fù)制的關(guān)鍵酶。因為是病毒特異性蛋白,所以作為抗病毒藥物的重要靶點,具有副作用小的優(yōu)勢[71]。Remdesivir(RDV,GS-5734,47,圖 5)是一個腺苷單磷酸酯前藥,在體內(nèi)能快速生成活性三磷酸形式摻入病毒 RNA 合成,抑制 RdRp 活性,終止病毒復(fù)制,發(fā)揮抗 RNA 病毒作用[72]。目前已經(jīng)完成治療埃博拉病毒感染的 II 期臨床研究。除了埃博拉病毒,RDV在體外對 MHV、MERS-CoV 和 SARS-CoV 等復(fù)制均顯示出顯著抑制活性,EC50分別為 0.03、0.074 和0.069 μmol/L,在恒河猴動物模型上對 MERS 病毒感染顯示出預(yù)防和治療的雙重效果[73-74]。而且,RDV 對病毒 RdRp 和核酸外切酶均有抑制活性,具有耐藥屏障高的優(yōu)勢[75]。我國的篩選研究也證實,RDV 對新型冠狀病毒SARS-CoV-2 復(fù)制有抑制活性,在 SARS-CoV-2 感染的 VeroE6 細(xì)胞體系中 EC90值為 1.76 μmol/L[35]。目前,RDV 正在武漢開展治療新冠肺炎的 III 期臨床,預(yù)計不久會有結(jié)果公布。Galidesivir(BCX4430,48,圖 5)也是一種腺嘌呤核苷類似物,Warren 等[76]通過實驗證實,其能通過誘導(dǎo) RNA 鏈終止來抑制病毒 RNA 聚合酶的功能,并評估了 galidesivir 對多種 RNA 病毒的抑制活性,其中抑制 MERS-CoV 的 EC50為 68.4 μmol/L,抑制 SARS-CoV 的 EC50為 57.7 μmol/L。通過靶向RdRp 和 S-腺苷-I-同型半胱氨酸水解酶(SAH)的雙重抑制劑設(shè)計,一系列 6'-氟代芒霉素類似物也被合成并證實了抗冠狀病毒的活性。其中,代表化合物49(圖 5)表現(xiàn)出廣譜的抗病毒活性,其抗 SARS-CoV 和 MERS-CoV活性的 EC50分別為 0.5 和 0.2 μmol/L[77]。
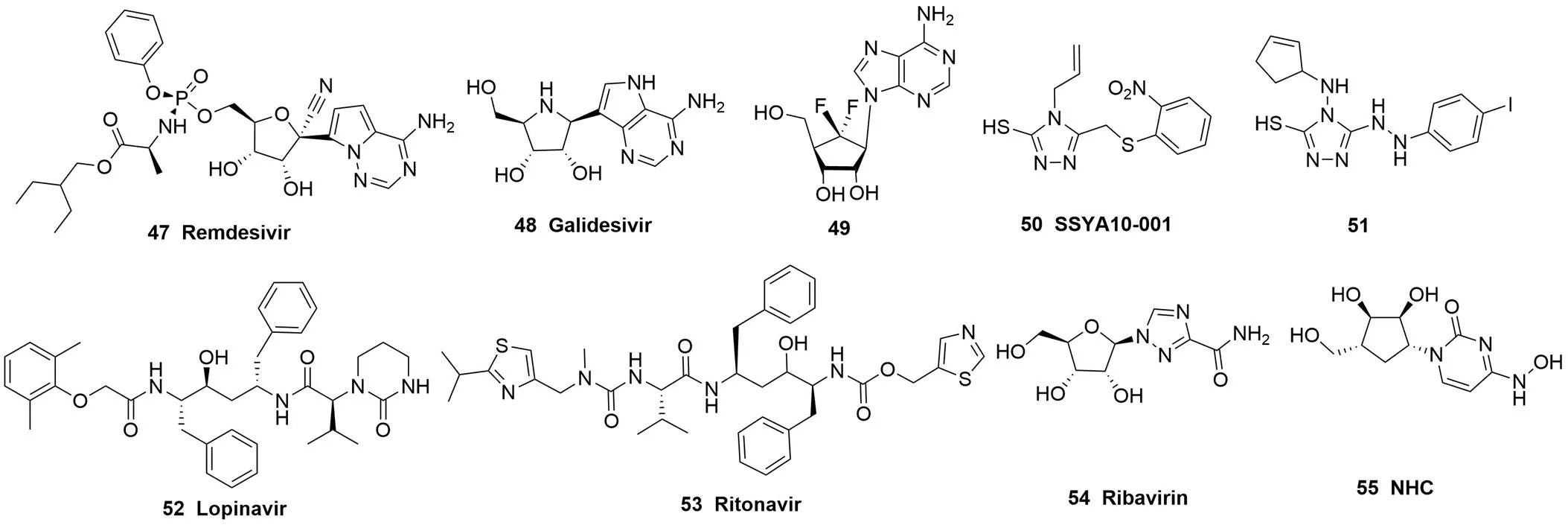
圖 5 冠狀病毒復(fù)制抑制劑
2.2.4 解旋酶抑制劑 解旋酶是一種利用 ATP 水解產(chǎn)生的能量催化分離雙核苷鏈的機動蛋白,冠狀病毒也編碼解旋酶,位于基因組 nsp13 位置,在病毒 mRNA 轉(zhuǎn)錄和翻譯等多個環(huán)節(jié)發(fā)揮作用[78]。SSYA10-001(50,圖 5)是一個解旋酶非競爭性抑制劑,通過特異性阻斷冠狀病毒 nsp13 蛋白對雙鏈 RNA 和雙鏈 DNA 的解鏈活性(IC50分別為 5.70 和 5.30 μmol/L),發(fā)揮抗多種冠狀病毒(SARS-CoV、MHV 和 MERS-CoV)的活性,SSYA10-001 體外抑制 SARS-CoV 和 MERS-CoV 復(fù)制的 EC50分別為 7 和25 μmol/L[79-80]。在此基礎(chǔ)上,Zaher 等[81]利用基于解旋酶活性的熒光共振能量轉(zhuǎn)移模型,合成并考察了一系列三唑類衍生物對 MERS-CoV 解旋酶的抑制活性,化合物51(圖 5)對 MERS-CoV 解旋酶抑制活性最強,IC50為2.5 μmol/L,同時文獻采用虛擬對接進行了靶點驗證,但未進行細(xì)胞水平抗病毒活性的考察。
2.2.5 其他病毒復(fù)制抑制劑 洛匹那韋(lopinavir,LPV,52,圖 5)和利托那韋(ritonavir,RTV,53,圖 5)都是 HIV 病毒蛋白酶抑制劑,二者的復(fù)方片(克力芝)通過 RTV 抑制細(xì)胞色素 P450 代謝活性,實現(xiàn)了增強藥效的目的。克力芝抗 CoV 的潛力源于對抗病毒藥物的經(jīng)驗篩選和醫(yī)院內(nèi)服藥艾滋病人抵抗 SARS 病毒的臨床發(fā)現(xiàn)[82-84]。在 MERS 疫情出現(xiàn)時,LPV-RTV 組合也顯示出治療潛力,被應(yīng)用于臨床研究。而我國針對 SARS-CoV-2 感染引發(fā)的新冠肺炎應(yīng)急治療也納入了該藥物組合,多項克力芝聯(lián)合干擾素、利巴韋林或其他抗病毒藥物的治療方案正在進行臨床研究。盡管有研究將這兩個抗 HIV 藥物與 SARS-CoV 的 3CLpro進行了結(jié)合動力學(xué)模擬和對接分析,表明它們能夠與 3CLpro的活性位點發(fā)生相互作用,但確切的抗冠狀病毒機制至今未明[85-86]。
利巴韋林(ribavirin,RBV,54,圖 5)是致突變核苷類似物,能夠作為非天然核苷摻入 RNA 合成,導(dǎo)致基因突變,從而起到降低病毒毒力和抑制病毒復(fù)制的作用。RBV 已經(jīng)被證實具有廣譜抗病毒活性,臨床上用于呼吸合胞病毒和 HCV 病毒感染治療。雖然 RBV 在 SARS 和 MERS 疫情暴發(fā)期間都曾與干擾素聯(lián)合用于抗病毒治療,但其臨床療效并不顯著[87]。原因可能有兩個:第一,RBV 的體外抗冠狀病毒活性并不強,因此正常給藥劑量下的血藥濃度不能達(dá)到其抗病毒藥效濃度,導(dǎo)致臨床效果不佳[87-90];第二,冠狀病毒含有校對功能的核酸外切酶,能夠糾正 RBV 摻入 RNA 引起的致突變效應(yīng),導(dǎo)致其效力降低[91-92]。另外一個致突變核苷類似物β-d-4-羥基胞苷(NHC,55,圖 5)在十幾年前被 Barnard 等通過篩選發(fā)現(xiàn),其在 6 μmol/L 給藥濃度下對一株 SARS 病毒生成的抑制率達(dá)到 90%,但后期在 SARS 病毒感染小鼠模型上沒有得到活性驗證[93-94]。最近,另外一個獨立的研究組發(fā)現(xiàn)NHC 具有抗鼠肝炎冠狀病毒(MHV)和 MERS-CoV 的活性,體外抗病毒的EC50分別為 0.17 ?和 0.56 μmol/L,而且發(fā)現(xiàn)病毒核酸外切酶對 NHC 的抗病毒強度影響不大,此外,NHC 具有耐藥屏障高的優(yōu)勢[95]。
2.3 基于宿主細(xì)胞因子的抗病毒藥物
病毒的整個生命周期都離不開宿主細(xì)胞因子的參與,而且,特定的宿主因子能對生物學(xué)特征類似的病毒產(chǎn)生相同的影響,因此,宿主靶向抗病毒藥物也通常被證實具有廣譜抗病毒活性。干擾素(IFNs)是宿主靶向抗病毒藥物的典型代表,IFN 是宿主細(xì)胞受到病毒感染后產(chǎn)生的能夠抑制病毒的抵抗蛋白質(zhì),主要功能是抑制病毒的轉(zhuǎn)錄及 mRNA 的合成、翻譯,阻止病毒蛋白合成并影響病毒的成熟和釋放。因此,重組 IFNs 的使用能夠增強宿主免疫反應(yīng),在多種病毒感染,特別是沒有治療藥物的突發(fā)或未知病毒的治療過程中起到重要作用。在 SARS 和 MERS 疫情期間,IFNs 被用于臨床治療,但是臨床受益存在爭議[87, 96]。有研究者考察了不同亞型干擾素的體外抗 MERS 病毒活性,結(jié)果顯示,不同亞型的干擾素對 MERS 病毒敏感性存在顯著差異,IFN-β(IC50= 1.37 U/ml)的體外抗 MERS 病毒活性最強,分別是其他亞型干擾素的數(shù)十甚至上百倍[97]。因此,采用 IFN-β 進行臨床治療可能更有利[98]。
硝唑尼特(nitazoxanide,NTZ,56,圖 6)是一個治療寄生蟲感染的特效藥物,也是具有廣譜抗病毒活性的多功能分子[99]。作用機制研究顯示,NTZ 及其代謝產(chǎn)物能夠增強宿主抗病毒反應(yīng),提高干擾素刺激因子的表達(dá)[100-101]。最近我國的科學(xué)家發(fā)現(xiàn) NTZ 對新冠病毒 SARS-CoV-2 也具有一定的抑制活性,體外 EC50為 2.12 μmol/L。
多個研究結(jié)果顯示,次黃嘌呤核苷-5'-單磷酸脫氫酶(IMPDH)抑制劑霉酚酸(mycophenolic acid,MPA,57,圖 6)是一個廣譜抗病毒化合物,除了抑制多種病毒復(fù)制的活性外,MPA 還能誘導(dǎo)干擾素刺激因子的表達(dá),增敏病毒對干擾素的反應(yīng)性[102]。研究分別證實,MPA 對 MERS 病毒的復(fù)制有抑制活性,體外 EC50在微摩爾水平,并顯示出與 INF-β 的協(xié)同增效作用[90, 97]。然而,免疫抑制活性以及致畸毒性問題對于體外抗病毒活性并不強的 MPA 來說是作為抗病毒藥物應(yīng)用的極大障礙。
親環(huán)蛋白(cyclophilins,Cyps)是一類肽-脯氨酰異構(gòu)酶,人體表達(dá) 7 種主要的親環(huán)蛋白(CypA、CypB、CypC、CypD、CypE、Cyp40 和 CypNK),其中 CypA 參與多種病毒復(fù)制,是病毒復(fù)制伴侶蛋白。CypA 抑制劑環(huán)孢素 A(cyclosporin A,58,圖 6)能夠抑制多種冠狀病毒,如 SARS-CoV、HCoV-229E 和 NL-63 的復(fù)制,體外 EC50分別為 3.3、2.3 和 2.3 μmol/L。同時它在SARS 病毒的復(fù)制子模型上也表現(xiàn)出劑量依賴的抗病毒作用,說明環(huán)孢素 A 作用于病毒基因組復(fù)制階段[103]。Ma-Lauer 等[104]則進一步證實環(huán)孢素 A 通過阻止 CypA 與病毒核衣殼蛋白的相互作用,抑制病毒核衣殼脫衣和基因組復(fù)制。
抗瘧藥氯喹(chloroquine,59,圖 6)曾多次被研究者在高通量篩選中發(fā)現(xiàn)具有抗冠狀病毒的活性,對不同病毒類型的體外 EC50都在微摩爾級[84, 105-107]。氯喹通過提高細(xì)胞內(nèi) pH 值而抑制了細(xì)胞內(nèi)吞作用,從而起到降低病毒進入的作用[108]。還有研究顯示,氯喹的抗冠狀病毒 229E 活性可能與抑制細(xì)胞 p38-MAPK 激酶活化有關(guān)[107]。但遺憾的是,氯喹在 SARS 病毒感染的動物模型上并沒有顯示出活性[94]。在針對 2019 新冠病毒的藥物篩選中,氯喹也被證實具有體外抑制病毒復(fù)制的活性[35],Yao 等[109]通過實驗測定了氯喹和羥氯喹抗 SARS-CoV-2 的活性,體外 EC50分別為 5.47 和 0.72 μmol/L。目前,我國正在開展氯喹用于新冠肺炎治療的臨床研究(ChiCTR2000029609)。
2.4 蛋白激酶抑制劑
蛋白激酶是細(xì)胞信號通路的重要調(diào)節(jié)因子,在病毒-宿主發(fā)生相互作用的過程中,多種蛋白激酶被證實參與病毒復(fù)制。2014 年,Sisk 等[110-111]在尋找抗 MERS 病毒藥物時,通過篩選發(fā)現(xiàn) Abelson(Abl)激酶抑制劑伊馬替尼(imatinib,60,圖 6)和達(dá)沙替尼(dasatinib,61,圖 6)對 SARS 和 MERS 病毒復(fù)制具有微摩爾級抑制活性。后期的研究表明伊馬替尼能夠抑制病毒進入階段的膜融合環(huán)節(jié)從而抑制病毒生成,并且證實其作用靶點 Abelson 酪氨酸蛋白激酶2(Abl2)是 MERS 和 SARS 病毒復(fù)制的輔助因子。Src 家族酪氨酸激酶抑制劑塞卡替尼(saracatinib,62,圖 6)對MERS 病毒復(fù)制也顯示出抑制活性,并且同樣是在病毒復(fù)制的早期發(fā)揮作用[112]。

圖 6 宿主靶向抗冠狀病毒活性化合物
2.5 具有抗病毒活性的神經(jīng)受體調(diào)節(jié)劑
在針對上市藥物再評價的高通量篩選研究中,多個神經(jīng)遞質(zhì)抑制劑被發(fā)現(xiàn)具有抗 SARS 或 MERS 病毒活性。在de Wilde 等[84]的研究中,多種神經(jīng)遞質(zhì)抑制劑,如氯丙嗪(chlorpromazine,63,圖 6)、氟奮乃靜(fluphenazine,64,圖 6)、異丙嗪(promethazine,65,圖 6)、三氟丙嗪(triflupromazine,66,圖 6)、阿司咪唑(astemizole,67,圖 6)和氯丙咪嗪(clomipramine,68,圖 6)等,在微摩爾水平抑制了 MERS 病毒復(fù)制和 MERS 假病毒的內(nèi)吞,同時,氯丙嗪、氟奮乃靜和異丙嗪還顯示出抑制細(xì)胞膜融合的作用[113]。氯丙嗪和阿片受體激動劑洛哌丁胺(loperamide,69,圖 6)還被證實對 SARS、MERS 和 229E 三種冠狀病毒均具有抗病毒活性。
2.6 傳統(tǒng)中藥治療 SARS-CoV-2 感染的效果
SARS-CoV-2 引起的新冠肺炎具有中醫(yī)寒疫病特征,因此,傳統(tǒng)中藥治療也被我國納入《新型冠狀病毒肺炎診療方案》,并分別針對醫(yī)學(xué)觀察期人群和確診病例制定了不同的給藥方案。醫(yī)學(xué)觀察期人群推薦使用藿香正氣膠囊和連花清瘟顆粒等清熱解毒中成藥進行預(yù)防干預(yù),而確診病例則根據(jù)癥狀分型給予不同處方的清肺排毒湯方劑治療。連花清瘟顆粒由連翹、金銀花、麻黃(炙)等 13 味中藥組成,能夠有效緩解病毒性呼吸系統(tǒng)疾病,對 SARS 和 MERS 冠狀病毒也具有明顯的抑制和殺傷作用。最新研究表明,連花清瘟顆粒能夠明顯改善 SARS-CoV-2 感染患者的發(fā)熱、咳嗽、乏力、氣短等臨床癥狀,降低輕癥患者向重癥轉(zhuǎn)移比例[114-115]。“清肺排毒湯”出自張仲景所著的《傷寒雜病論》,主要由麻杏石甘湯、射干麻黃湯、小柴胡湯、五苓散組成,此外融合了大青龍湯、橘枳姜湯和茯苓杏仁甘草湯等方意[116]。王饒瓊等[117]通過分析清肺排毒湯治療98 例新型冠狀病毒肺炎患者的臨床療效得出,清肺排毒湯能顯著改善患者的異常生化指標(biāo)和臨床癥狀,而且患者不良反應(yīng)發(fā)生率低,其治療 9 d 后的總有效率為 92.09%。
由于中藥成分復(fù)雜,作用機制不能像單體化學(xué)藥那樣得到清楚的闡述,因此我國傳統(tǒng)中藥一直受到國外研究者的質(zhì)疑,特別是在臨床試驗的設(shè)計和結(jié)果判定上難以得到國際認(rèn)可。但在本次疫情中,傳統(tǒng)中藥對于 COVID-19 的治療起到了非常積極的作用。相信隨著中西醫(yī)結(jié)合和網(wǎng)絡(luò)藥理學(xué)的發(fā)展,無論是中藥有效單體分離還是傳統(tǒng)方劑的科學(xué)推廣都將得到更多研究者的關(guān)注,我國中醫(yī)藥也將會在人類健康領(lǐng)域得到更多突破性的成果。
3 總結(jié)
在近 20 年間,冠狀病毒新變種不斷出現(xiàn),致病力變強的同時呈現(xiàn)出從局地暴發(fā)向全球擴散的特點,給全球健康帶來極大威脅。在沒有疫苗可用的情況下,抗病毒藥物研究對于病毒防控至關(guān)重要。令人遺憾的是,目前還沒有治療冠狀病毒感染的特效藥物被批準(zhǔn)上市。通過對現(xiàn)有文獻的整理分析可以看出,針對冠狀病毒的研究自 2003 年 SARS 疫情出現(xiàn)后才逐漸受到關(guān)注,到目前為止 PUBMED 上能檢索到 1 萬多篇關(guān)于冠狀病毒的研究論文或綜述,其中超過 60% 的文獻是圍繞 SARS 及 MERS 病毒的生物學(xué)特點或防控手段進行的。抗冠狀病毒的藥物研究多數(shù)始于篩選,篩選模型既有病毒感染的細(xì)胞模型也有酶水平的生化模型,篩選范圍大的可以包括數(shù)萬個上市藥物或已知化合物,小的僅包括定向選擇的數(shù)個廣譜抗病毒化合物,得到的陽性化合物結(jié)構(gòu)類型較多,且更多出現(xiàn)在抗病毒劑或免疫調(diào)節(jié)劑中。隨著人類對于冠狀病毒結(jié)構(gòu)和生物學(xué)性質(zhì)的認(rèn)識不斷深入,基于病毒生命周期的全新藥物設(shè)計逐漸顯露,一類是基于在病毒與受體結(jié)合以及融合過程中發(fā)揮重要作用的刺突蛋白關(guān)鍵結(jié)構(gòu)域,設(shè)計靶向病毒進入的單克隆抗體藥物和抗病毒融合肽;另一類是基于冠狀病毒 3CL 蛋白酶的催化結(jié)構(gòu)域設(shè)計靶向病毒復(fù)制的擬肽類或小分子蛋白酶抑制劑。這兩大類抗病毒化合物具有機制清楚、抗病毒活性強的優(yōu)勢,有些單克隆抗體的抗病毒活性已經(jīng)在動物模型上得到了驗證,因此研究進展相對更深入。但是,單抗藥物的研發(fā)成本高、肽類藥物的藥學(xué)性質(zhì)差都是毋庸置疑的問題。因此,肽類藥物向小分子抑制劑的優(yōu)化研究是現(xiàn)在有些團隊的研究方向。除此之外,病毒存在抗原漂移和耐藥突變的問題,很容易導(dǎo)致疫苗失效和特異性抗病毒藥物耐受。宿主靶點具有相對保守和廣譜抗病毒的特點,因此,在應(yīng)對新毒種或未知病毒突發(fā)狀況時,宿主靶向抗病毒藥物可能具有更廣闊的應(yīng)用空間。總之,隨著新病毒變種的不斷暴發(fā),抗冠狀病毒藥物研究必將吸引科學(xué)家和政府更多的研究投入,首個抗冠狀病毒特效藥物獲批上市值得期待。
[1] Cheever FS, Daniels JB, Pappenheimer AM, et al. A murine virus (JHM) causing disseminated encephalomyelitis with extensive destruction of myelin. J Exp Med, 1949, 90(3):181-210.
[2] Bailey OT, Pappenheimer AM, Cheever FS, et al. A murine virus (JHM) causing disseminated encephalomyelitis with extensive destruction of myelin: II. pathologY. J Exp Med, 1949, 90(3):195-212.
[3] Weiss SR, Navas-Martin S. Coronavirus pathogenesis and the emerging pathogen severe acute respiratory syndrome coronavirus. Microbiol Mol Biol Rev, 2005, 69(4):635-664.
[4] Hamre D, Procknow JJ. A new virus isolated from the human respiratory tract. Proc Soc Exp Biol Med, 1966, 121(1):190-193.
[5]Larson HE, Reed SE, Tyrrell DA. Isolation of rhinoviruses and coronaviruses from 38 colds in adults. J Med Virol, 1980, 5(3):221-229.
[6] Lai MM, Cavanagh D. The molecular biology of coronaviruses. Adv Virus Res, 1997, 48:1-100.
[7] Coughlin MM, Prabhakar BS. Neutralizing human monoclonal antibodies to severe acute respiratory syndrome coronavirus: target, mechanism of action, and therapeutic potential. Rev Med Virol, 2012, 22(1):2-17.
[8] Du L, Yang Y, Zhou Y, et al. MERS-CoV spike protein: a key target for antivirals. Expert Opin Ther Targets, 2017, 21(2):131-143.
[9] Houser KV, Gretebeck L, Ying T, et al. Prophylaxis with a middle east respiratory syndrome coronavirus (MERS-CoV)-specific human monoclonal antibody protects rabbits from MERS-CoV infection.J Infect Dis, 2016, 213(10):1557-1561.
[10] Wang C, Hua C, Xia S, et al. Combining a fusion inhibitory peptide targeting the MERS-CoV S2 protein HR1 domain and a neutralizing antibody specific for the S1 protein receptor-binding domain (RBD) showed potent synergism against pseudotyped MERS-CoV with or without Mutations in RBD. Viruses, 2019, 11(1):E31.
[11] Chen Z, Bao L, Chen C, et al. Human neutralizing monoclonal antibody inhibition of middle east respiratory syndrome coronavirus replication in the common marmoset. J Infect Dis, 2017, 215(12): 1807-1815.
[12] de Wit E, Feldmann F, Okumura A, et al. Prophylactic and therapeutic efficacy of mAb treatment against MERS-CoV in common marmosets. Antiviral Res, 2018, 156:64-71.
[13] Luke T, Wu H, Zhao J, et al. Human polyclonal immunoglobulin G from transchromosomic bovines inhibits MERS-CoV in vivo. Sci Transl Med, 2016, 8(326):326ra21.
[14] Menachery VD, Yount BJ, Debbink K, et al. A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence. Nat Med, 2015, 21(12):1508-1513.
[15] Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science, 2020, 367(6483):1260-1263.
[16] Li F. Structure, function, and evolution of coronavirus spike proteins. Annu Rev Virol, 2016, 3(1):237-261.
[17] Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 2003, 26(6965):450-454.
[18] Raj VS, Mou H, Smits SL, et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature, 2013, 495(7440):251-254.
[19] Yeager CL, Ashmun RA, Williams RK, et al. Human aminopeptidase N is a receptor for human coronavirus 229E. Nature, 1992, 357(6377): 420-422.
[20] Hofmann H, Pyrc K, van der Hoek L, et al. Human coronavirus NL63 employs the severe acute respiratory syndrome coronavirus receptor for cellular entry. Proc Natl Acad Sci U S A, 2005, 102(22):7988-7993.
[21] Huang X, Dong W, Milewska A, et al. Human coronavirus HKU1 spike protein uses O-acetylated sialic acid as an attachment receptor determinant and employs hemagglutinin-esterase protein as a receptor-destroying enzyme. J Virol, 2015, 89(14):7202-7213.
[22] Kao RY, Tsui WH, Lee TS, et al. Identification of novel small- molecule inhibitors of severe acute respiratory syndrome-associated coronavirus by chemical genetics. Chem Biol, 2004, 11(9):1293-1299.
[23] Wan Y, Shang J, Graham R, et al. Receptor recognition by novel coronavirus from Wuhan: An analysis based on decade-long structural studies of SARS. J Virol, 2020, 94(7):e00127-20.
[24] Milewska A, Ciejka J, Kaminski K, et al. Novel polymeric inhibitors of HCoV-NL63. Antiviral Res, 2013, 97(2):112-121.
[25] Milewska A, Kaminski K, Ciejka J, et al. HTCC: broad range inhibitor of coronavirus entry. PLoS One, 2016, 11(6):e156552.
[26] Liu S, Xiao G, Chen Y, et al. Interaction between heptad repeat 1 and 2 regions in spike protein of SARS-associated coronavirus: implications for virus fusogenic mechanism and identification of fusion inhibitors. Lancet, 2004, 363(9413):938-947.
[27] Lu L, Liu Q, Zhu Y, et al. Structure-based discovery of Middle East respiratory syndrome coronavirus fusion inhibitor. Nat Commun, 2014, 5:3067.
[28] Matsuyama S, Nagata N, Shirato K, et al. Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. J Virol, 2010, 84(24):12658-12664.
[29] Shirato K, Kawase M, Matsuyama S. Middle East respiratory syndrome coronavirus infection mediated by the transmembrane serine protease TMPRSS2. J Virol, 2013, 87(23):12552-12561.
[30] Shirato K, Kanou K, Kawase M, et al. Clinical isolates of human coronavirus 229E bypass the endosome for cell entry. J Virol, 2017, 91(1):e01387-16.
[31] Bonnin A, Danneels A, Dubuisson J, et al. HCoV-229E spike protein fusion activation by trypsin-like serine proteases is mediated by proteolytic processing in the S2' region. J Gen Virol, 2018, 99(7): 908-912.
[32] Kawase M, Shirato K, van der Hoek L, et al. Simultaneous treatment of human bronchial epithelial cells with serine and cysteine protease inhibitors prevents severe acute respiratory syndrome coronavirus entry. J Virol, 2012, 86(12):6537-6545.
[33] Zhou Y, Vedantham P, Lu K, et al. Protease inhibitors targeting coronavirus and filovirus entry. Antiviral Res, 2015, 116:76-84.
[34] Yamamoto M, Matsuyama S, Li X, et al. Identification of nafamostat as a potent inhibitor of middle east respiratory syndrome coronavirus S protein-mediated membrane fusion using the split-protein-based cell-cell fusion assay. Antimicrob Agents Chemother, 2016, 60(11): 6532-6539.
[35] Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res, 2020, 30(3):269-271.
[36] Elshabrawy HA, Fan J, Haddad CS, et al. Identification of a broad-spectrum antiviral small molecule against severe acute respiratory syndrome coronavirus and Ebola, Hendra, and Nipah viruses by using a novel high-throughput screening assay. J Virol, 2014, 88(8):4353- 4365.
[37] Adedeji AO, Severson W, Jonsson C, et al. Novel inhibitors of severe acute respiratory syndrome coronavirus entry that act by three distinct mechanisms. J Virol, 2013, 87(14):8017-8028.
[38] Apayd?n ?B, Cesur N, Stevaert A, et al. Synthesis and anti-coronavirus activity of a series of 1-thia-4-azaspiro[4.5]decan- 3-one derivatives. Arch Pharm (Weinheim), 2019, 352(6):e1800330.
[39] Lundin A, Dijkman R, Bergstr?m T, et al. Targeting membrane-bound viral RNA synthesis reveals potent inhibition of diverse coronaviruses including the middle East respiratory syndrome virus. PLoS Pathog, 2014, 10(5):e1004166.
[40] Yi L, Li Z, Yuan K, et al. Small molecules blocking the entry of severe acute respiratory syndrome coronavirus into host cells. J Virol, 2004, 78(20):11334-11339.
[41] Yang H, Yang M, Ding Y, et al. The crystal structures of severe acute respiratory syndrome virus main protease and its complex with an inhibitor. Proc Natl Acad Sci U S A, 2003, 100(23):13190-13195.
[42] Anand K, Ziebuhr J, Wadhwani P, et al. Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs. Science, 2003, 300(5626):1763-1767.
[43] Pillaiyar T, Manickam M, Namasivayam V, et al. An overview of severe acute respiratory syndrome-coronavirus (SARS-CoV) 3CL protease inhibitors: peptidomimetics and small molecule chemotherapy. J Med Chem, 2016, 59(14):6595-6628.
[44] Galasiti Kankanamalage AC, Kim Y, Damalanka VC, et al. Structure-guided design of potent and permeable inhibitors of MERS coronavirus 3CL protease that utilize a piperidine moiety as a novel design element. Eur J Med Chem, 2018, 150:334-346.
[45] Kumar V, Shin JS, Shie JJ, et al. Identification and evaluation of potent Middle East respiratory syndrome coronavirus (MERS-CoV) 3CL(Pro) inhibitors. Antiviral Res, 2017, 141:101-106.
[46] Zhang L, Lin D, Kusov Y, et al. α-ketoamides as broad-spectrum inhibitors of coronavirus and enterovirus replication Structure-based design, synthesis, and activity assessment. J Med Chem, 2020 Feb 24. [Epub ahead of print]
[47] Ohnishi K, Hattori Y, Kobayashi K, et al. Evaluation of a non-prime site substituent and warheads combined with a decahydroisoquinolin scaffold as a SARS 3CL protease inhibitor. Bioorg Med Chem, 2019, 27(2):425-435.
[48] Yoshizawa SI, Hattori Y, Kobayashi K, et al. Evaluation of an octahydroisochromene scaffold used as a novel SARS 3CL protease inhibitor. Bioorg Med Chem, 2020, 28(4):115273.
[49] Konno H, Wakabayashi M, Takanuma D, et al. Design and synthesis of a series of serine derivatives as small molecule inhibitors of the SARS coronavirus 3CL protease. Bioorg Med Chem, 2016, 24(6):1241-1254.
[50] Konno H, Onuma T, Nitanai I, et al. Synthesis and evaluation of phenylisoserine derivatives for the SARS-CoV 3CL protease inhibitor. Bioorg Med Chem Lett, 2017, 27(12):2746-2751.
[51] Karypidou K, Ribone SR, Quevedo MA, et al. Synthesis, biological evaluation and molecular modeling of a novel series of fused 1,2,3-triazoles as potential anti-coronavirus agents. Bioorg Med Chem Lett, 2018, 28(21):3472-3476.
[52] Jo S, Kim H, Kim S, et al. Characteristics of flavonoids as potent MERS-CoV 3C-like protease inhibitors. Chem Biol Drug Des, 2019, 94(6):2023-2030.
[53] Jo S, Kim S, Shin DH, et al. Inhibition of SARS-CoV 3CL protease by flavonoids. J Enzyme Inhib Med Chem, 2020, 35(1):145-151.
[54] Barretto N, Jukneliene D, Ratia K, et al. The papain-like protease of severe acute respiratory syndrome coronavirus has deubiquitinating activity. J Virol, 2005, 79(24):15189-15198.
[55] Ghosh AK, Takayama J, Aubin Y, et al. Structure-based design, synthesis, and biological evaluation of a series of novel and reversible inhibitors for the severe acute respiratory syndrome-coronavirus papain-like protease. J Med Chem, 2009, 52(16):5228-5240.
[56] Frieman M, Basu D, Matthews K, et al. Yeast based small molecule screen for inhibitors of SARS-CoV. PLoS One, 2011, 6(12):e28479.
[57] Ratia K, Pegan S, Takayama J, et al. A noncovalent class of papain-like protease/deubiquitinase inhibitors blocks SARS virus replication. Proc Natl Acad Sci U S A, 2008, 105(42):16119-16124.
[58] Ghosh AK, Takayama J, Rao KV, et al. Severe acute respiratory syndrome coronavirus papain-like novel protease inhibitors: design,synthesis, protein-ligand X-ray structure and biological evaluation.J Med Chem, 2010, 53(13):4968-4979.
[59] Báez-Santos YM, Barraza SJ, Wilson MW, et al. X-ray structural and biological evaluation of a series of potent and highly selective inhibitors of human coronavirus papain-like proteases. J Med Chem, 2014, 57(6):2393-2412.
[60] Lin MH, Moses DC, Hsieh CH, et al. Disulfiram can inhibit MERS and SARS coronavirus papain-like proteases via different modes. Antiviral Res, 2018, 150:155-163.
[61] Chou CY, Chien CH, Han YS, et al. Thiopurine analogues inhibit papain-like protease of severe acute respiratory syndrome coronavirus. Biochem Pharmacol, 2008, 75(8):1601-1609.
[62] Cheng KW, Cheng SC, Chen WY, et al. Thiopurine analogs and mycophenolic acid synergistically inhibit the papain-like protease of Middle East respiratory syndrome coronavirus. Antiviral Res, 2015, 115:9-16.
[63] Lee H, Lei H, Santarsiero BD, et al. Inhibitor recognition specificity of MERS-CoV papain-like protease may differ from that of SARS-CoV. ACS Chem Biol, 2015, 10(6):1456-1465.
[64] Lee H, Ren J, Pesavento RP, et al. Identification and design of novel small molecule inhibitors against MERS-CoV papain-like protease via high-throughput screening and molecular modeling. Bioorg Med Chem, 2019, 27(10):1981-1989.
[65] Park JY, Yuk HJ, Ryu HW, et al. Evaluation of polyphenols from Broussonetia papyrifera as coronavirus protease inhibitors. J Enzyme Inhib Med Chem, 2017, 32(1):504-515.
[66] Cho JK, Curtis-Long MJ, Lee KH, et al. Geranylated flavonoids displaying SARS-CoV papain-like protease inhibition from the fruits of Paulownia tomentosa. Bioorg Med Chem, 2013, 21(11):3051-3057.
[67] Park JY, Kim JH, Kim YM, et al. Tanshinones as selective and slow-binding inhibitors for SARS-CoV cysteine proteases. Bioorg Med Chem, 2012, 20(19):5928-5935.
[68] Song YH, Kim DW, Curtis-Long MJ, et al. Papain-like protease (PLpro) inhibitory effects of cinnamic amides from Tribulus terrestris fruits. Biol Pharm Bull, 2014, 37(6):1021-1028.
[69] Park JY, Ko JA, Kim DW, et al. Chalcones isolated from Angelica keiskei inhibit cysteine proteases of SARS-CoV. J Enzyme Inhib Med Chem, 2016, 31(1):23-30.
[70] Park JY, Jeong HJ, Kim JH, et al. Diarylheptanoids from Alnus japonica inhibit papain-like protease of severe acute respiratory syndrome coronavirus. Biol Pharm Bull, 2012, 35(11):2036-2042.
[71] Azzi A, Lin SX. Human SARS-coronavirus RNA-dependent RNA polymerase: activity determinants and nucleoside analogue inhibitors. Proteins, 2004, 57(1):12-14.
[72] Warren TK, Jordan R, Lo MK, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature, 2016, 531(7594):381-385.
[73] de Wit E, Feldmann F, Cronin J, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proc Natl Acad Sci U S A, 2020, 117(12):6771- 6776.
[74] Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med, 2017, 9(396):eaal3653.
[75] Agostini ML, Andres EL, Sims AC, et al. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio, 2018, 9(2):e00221-18.
[76] Warren TK, Wells J, Panchal RG, et al. Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430. Nature, 2014, 508(7496):402-405.
[77] Yoon JS, Kim G, Jarhad DB, et al. Design, synthesis, and anti-RNA virus activity of 6'-fluorinated-aristeromycin analogues. J Med Chem, 2019, 62(13):6346-6362.
[78] Frick DN, Lam AM. Understanding helicases as a means of virus control. Curr Pharm Des, 2006, 12(11):1315-1338.
[79] Adedeji AO, Singh K, Calcaterra NE, et al. Severe acute respiratory syndrome coronavirus replication inhibitor that interferes with the nucleic acid unwinding of the viral helicase. Antimicrob Agents Chemother, 2012, 56(9):4718-4728.
[80] Adedeji AO, Singh K, Kassim A, et al. Evaluation of SSYA10-001 as a replication inhibitor of severe acute respiratory syndrome, mouse hepatitis, and Middle East respiratory syndrome coronaviruses. Antimicrob Agents Chemother, 2014, 58(8):4894-4898.
[81] Zaher NH, Mostafa MI, Altaher AY. Design, synthesis and molecular docking of novel triazole derivatives as potential CoV helicase inhibitors. Acta Pharm, 2020, 70(2):145-159.
[82] Chu CM, Cheng VC, Hung IF, et al. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax, 2004, 59(3):252-256.
[83] Chen XP, Cao Y. Consideration of highly active antiretroviral therapy in the prevention and treatment of severe acute respiratory syndrome. Clin Infect Dis, 2004, 38(7):1030-1032.
[84] de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture. Antimicrob Agents Chemother, 2014, 58(8):4875-4884.
[85] Zhang XW, Yap YL. Old drugs as lead compounds for a new disease? Binding analysis of SARS coronavirus main proteinase with HIV, psychotic and parasite drugs. Bioorg Med Chem, 2004, 12(10):2517- 2521.
[86] Nukoolkarn V, Lee VS, Malaisree M, et al. Molecular dynamic simulations analysis of ritonavir and lopinavir as SARS-CoV 3CL(pro) inhibitors. J Theor Biol, 2008, 254(4):861-867.
[87] Omrani AS, Saad MM, Baig K, et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection: a retrospective cohort study. Lancet Infect Dis, 2014, 14(11):1090-1095.
[88] Shalhoub S, Farahat F, Al-Jiffri A, et al. IFN-α2a or IFN-β1a in combination with ribavirin to treat Middle East respiratory syndrome coronavirus pneumonia: a retrospective study. J Antimicrob Chemother, 2015, 70(7):2129-2132.
[89] Khalid M, Al Rabiah F, Khan B, et al. Ribavirin and interferon- alpha2b as primary and preventive treatment for Middle East respiratory syndrome coronavirus: a preliminary report of two cases. Antivir Ther, 2015, 20(1):87-91.
[90] Chan JF, Chan KH, Kao RY, et al. Broad-spectrum antivirals for the emerging Middle East respiratory syndrome coronavirus. J Infect, 2013, 67(6):606-616.
[91] Minskaia E, Hertzig T, Gorbalenya AE, et al. Discovery of an RNA virus 3'->5' exoribonuclease that is critically involved in coronavirus RNA synthesis. Proc Natl Acad Sci U S A, 2006, 103(13):5108-5113.
[92] Smith EC, Blanc H, Surdel MC, et al. Coronaviruses lacking exoribonuclease activity are susceptible to lethal mutagenesis: evidence for proofreading and potential therapeutics. PLoS Pathog, 2013, 9(8):e1003565.
[93] Barnard DL, Hubbard VD, Burton J, et al. Inhibition of severe acute respiratory syndrome-associated coronavirus (SARSCoV) by calpain inhibitors and beta-D-N4-hydroxycytidine. Antivir Chem Chemother, 2004, 15(1):15-22.
[94] Barnard DL, Day CW, Bailey K, et al. Evaluation of immunomodulators, interferons and known in vitro SARS-coV inhibitors for inhibition of SARS-coV replication in BALB/c mice. Antivir Chem Chemother, 2006, 17(5):275-284.
[95] Agostini ML, Pruijssers AJ, Chappell JD, et al. Small-molecule antiviral β-d-N (4)-hydroxycytidine inhibits a proofreading-intact coronavirus with a high genetic barrier to resistance. J Virol, 2019, 93(24):e01348-19.
[96] Loutfy MR, Blatt LM, Siminovitch KA, et al. Interferon alfacon-1 plus corticosteroids in severe acute respiratory syndrome: a preliminary study. JAMA, 2003, 290(24):3222-3228.
[97] Hart BJ, Dyall J, Postnikova E, et al. Interferon-β and mycophenolic acid are potent inhibitors of Middle East respiratory syndrome coronavirus in cell-based assays. J Gen Virol, 2014, 95(Pt 3):571-577.
[98] Arabi YM, Alothman A, Balkhy HH, et al. Treatment of Middle East Respiratory Syndrome with a combination of lopinavir-ritonavir and interferon-β1b (MIRACLE trial): study protocol for a randomized controlled trial. Trials, 2018, 19(1):81.
[99] Shakya A, Bhat HR, Ghosh SK. Update on nitazoxanide: a multifunctional chemotherapeutic agent. Curr Drug Discov Technol, 2018, 15(3):201-213.
[100]Dang W, Xu L, Ma B, et al. Nitazoxanide inhibits human norovirus replication and synergizes with ribavirin by activation of cellular antiviral response. Antimicrob Agents Chemother, 2018, 62(11): e00707-18.
[101]Rossignol JF. Nitazoxanide: a first-in-class broad-spectrum antiviral agent. Antiviral Res, 2014, 110:94-103.
[102]Pan Q, de Ruiter PE, Metselaar HJ, et al. Mycophenolic acid augments interferon-stimulated gene expression and inhibits hepatitis C Virus infection in vitro and in vivo. Hepatology, 2012, 55(6):1673-1683.
[103]Pfefferle S, Sch?pf J, K?gl M, et al. The SARS-coronavirus-host interactome: identification of cyclophilins as target for pan-coronavirus inhibitors. PLoS Pathog, 2011, 7(10):e1002331.
[104]Ma-Lauer Y, Zheng Y, Male?evi? M, et al. Influences of cyclosporin A and non-immunosuppressive derivatives on cellular cyclophilins and viral nucleocapsid protein during human coronavirus 229E replication. Antiviral Res, 2020, 173:104620.
[105]Keyaerts E, Vijgen L, Maes P, et al. In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine. Biochem Biophys Res Commun, 2004, 323(1):264-268.
[106]Vincent MJ, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virol J, 2005, 2:69.
[107]Kono M, Tatsumi K, Imai AM, et al. Inhibition of human coronavirus 229E infection in human epithelial lung cells (L132) by chloroquine: involvement of p38 MAPK and ERK. Antiviral Res, 2008, 77(2): 150-152.
[108]Al-Bari MAA. Targeting endosomal acidification by chloroquine analogs as a promising strategy for the treatment of emerging viral diseases. Pharmacol Res Perspect, 2017, 5(1):e293.
[109]Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis, 2020 Mar 9. [Epub ahead of print]
[110]Sisk JM, Frieman MB, Machamer CE. Coronavirus S protein-induced fusion is blocked prior to hemifusion by Abl kinase inhibitors. J Gen Virol, 2018, 99(5):619-630.
[111]Coleman CM, Sisk JM, Mingo RM, et al. Abelson kinase inhibitors are potent inhibitors of severe acute respiratory syndrome coronavirus and middle east respiratory syndrome coronavirus fusion. J Virol, 2016, 90(19):8924-8933.
[112]Shin JS, Jung E, Kim M, et al. Saracatinib inhibits middle east respiratory syndrome-coronavirus replication in vitro. Viruses, 2018, 10(6):E283.
[113]Liu Q, Xia S, Sun Z, et al. Testing of Middle East respiratory syndrome coronavirus replication inhibitors for the ability to block viral entry. Antimicrob Agents Chemother, 2015, 59(1):742-744.
[114]Cheng DZ, Li Y. Clinical effectiveness and case analysis in 54 NCP patients treated with Lianhuaqingwen granules. World Chin Med, 2020, 15(2):150-154. (in Chinese)
程德忠, 李毅. 連花清瘟顆粒治療54例新型冠狀病毒肺炎患者臨床分析及典型病例報道. 世界中醫(yī)藥, 2020, 15(2):150-154.
[115]Yao KT, Liu MY, Li X, et al. Retrospective clinical analysis on treatment of Coronavirus disease 2019 with traditional Chinese Medicine Lianhua Qingwen. Chin J Exp Traditional Med Formulae, 2020-02-06. (in Chinese)
姚開濤, 劉明瑜, 李欣, 等. 中藥連花清瘟治療新型冠狀病毒肺炎的回顧性臨床分析. 中國實驗方劑學(xué)雜志, 2020-02-06.
[116]Fan YP, Wang YP, Ma Y, et al. Analysis on composition mechanism of Qingfei Paidu Tang from pathogenesis of cold pestilence of COVID-19. Chin J Exp Traditional Med Formulae, 2020-03-19. (in Chinese)
范逸品, 王燕平, 馬艷, 等. 從新型冠狀病毒肺炎的寒疫病機探析清肺排毒湯的組方機制. 中國實驗方劑學(xué)雜志, 2020-03-19.
[117]Wang RQ, Yang SJ, Xie CG, et al. Clinical observation of Qingfeipaidu decoction in the treatment of novel Coronavirus pneumonia. Pharmacol Clin Chin Mater Med, 2020-03-03. (in Chinese)
王饒瓊, 楊思進, 謝春光, 等. 清肺排毒湯治療新型冠狀病毒肺炎的臨床療效觀察. 中藥藥理與臨床, 2020-03-03.
重大新藥創(chuàng)制“十三五”國家科技重大專項(2017ZX 09201006-012);中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)與健康科技創(chuàng)新工程(2016-I2M- 3-022)
李艷萍,Email:liyanping@imb.pumc.edu.cn
2020-03-23
10.3969/j.issn.1673-713X.2020.02.001

