半乳糖凝集素3表達抑制對人胃癌MGC-803細胞中Bcl-2和Bax表達的影響及其促凋亡作用
吳雪艷,趙依納,2,王小杰,麻雯熠,王新杰,李 欣
(1. 承德醫學院人體解剖學教研室,河北 承德 067000;2. 河北生殖婦產醫院生殖醫學科,河北 石家莊 050000;3. 承德醫學院基礎醫學研究所,河北 承德 067000;4. 承德醫學院組織與胚胎學教研室,河北 承德067000;5. 河北省承德市中心醫院腫瘤內科,河北 承德067000)
胃癌是我國最常見的惡性腫瘤之一,其發生率和致死率在腫瘤中位于第3位,嚴重危害人類健康。半乳糖凝集素3(galectin-3)是半乳糖凝集素家族成員,其結構獨特,具有富含脯氨酸、甘氨酸的氨基端和帶有糖基識別結構域(carbohydrate recognition domain, CRD)的球形羧基端[1],主要定位于細胞質,在正常細胞和腫瘤細胞中廣泛表達,參與調節細胞的生長、凋亡與黏附、腫瘤細胞的轉移與侵襲和血管形成等多種功能[2]。galectin-3在乳腺癌[3]、結直腸癌[4]、肺癌[5]、甲狀腺癌[6]、口腔鱗狀細胞癌[7]和胃癌[8]等多種惡性腫瘤組織中高表達,并與腫瘤的惡性程度及轉移浸潤有關。近年來研究[9]顯示:galectin-3的表達異常與胃癌的發生、發展、侵襲和轉移等密切相關。本課題組前期研究[10]顯示:galectin-3在胃癌細胞系MGC-803細胞中的表達明顯上調,敲低galectin-3可抑制細胞的增殖。本研究為前期工作的延續,通過下調galectin-3的表達水平,觀察MGC-803細胞的凋亡情況以及凋亡相關蛋白Bcl-2和Bax的表達變化,從而為胃癌的發生機制研究提供實驗依據,為其靶向治療提供潛在靶點。
1 材料與方法
1.1 細胞、主要試劑和儀器人胃癌MGC-803細胞株購于上海中科院細胞庫。靶向galectin-3的siRNA、Lipofectamine2000(Lipo2000)轉染試劑、鼠抗人和兔抗人第二抗體購自美國 Invintrogen公司,Bcl-2和Bax兔抗人單克隆抗體購自美國Epitomics 公司,galectin-3單克隆抗體購自美國Sigma公司,DMEM培養基購自美國Gibco 公司,AnnexinⅤ-FITC/PI 凋亡檢測試劑盒購自聯科生物公司。流式細胞儀為美國BD 公司產品,HER Aceu 150型CO2培養箱為德國賀利公司產品。
1.2 細胞培養MGC-803細胞培養于含10% 胎牛血清(FBS)的DMEM中,在5% CO2、37℃的培養箱中放置,根據生長情況傳代。
1.3 siRNA轉染MGC-803細胞MGC-803細胞培養于60 mm培養板中,將細胞分為轉染靶向galectin-3 siRNA的siRNA干擾組、轉染非特異性siRNA的陰性對照組和只加轉染試劑的空白對照組。轉染前1 d按每孔2×105個細胞接種于6 孔培養板中,使細胞在24 h 內達到50%~70%的密度;在無血清DMEM中加入20 pmol·L-1siRNA Oligo后輕柔混勻,使終體積為250 μL;將5 μL Lipo2000轉染試劑稀釋于250 μL無血清DMEM培養基中,靜置5 min;將Lipo2000轉染試劑和siRNA Oligo混合,室溫孵育20 min;將混懸液加入6孔培養板中。轉染后6 h 更換含10%胎牛血清的培養基。轉染后48 h收集各組細胞。
1.4 Western blotting法檢測轉染后MGC-803細胞中galectin-3、Bcl-2和Bax蛋白表達水平收集各組MGC-803細胞,加入80 μL細胞裂解液反復凍融充分裂解,提細胞總蛋白后用BCA 法檢測蛋白濃度;將蛋白質變性后上樣,行12% SDS-PAGE凝膠電泳,每泳道30 μg。電轉至PVDF膜;5% 脫脂奶粉/TBST 溶液封閉2 h,一抗孵育4℃ 過夜(稀釋比例:galectin-3為1∶5 000,Bcl-2和Bax分別為1∶1 000,β-actin為1∶1 000);TBST洗膜;加入羊抗鼠二抗1∶5 000稀釋,常溫孵育2 h;使用ECL法獲得結果。用Quantity One 4.62軟件分析條帶。計算目的條帶與β-actin條帶的灰度值比值,作為galectin-3、Bcl-2和Bax蛋白相對表達水平,比值越大表示蛋白表達水平越高。
1.5 流式細胞術檢測細胞凋亡率各組細胞轉染后48 h,用預冷的無菌PBS緩沖液沖洗3次,采用0.25%胰蛋白酶消化貼壁細胞行成單細胞懸液;300 g離心5 min,PBS緩沖液沖洗2次;采用500 μL復性緩沖液重懸細胞,計數5×105個細胞,加入5 μL Annexin Ⅴ-FITC和10 μL PI染液,輕柔混勻,室溫避光孵育5 min;采用流式細胞儀檢測細胞凋亡率。
1.6 PI染色法檢測細胞凋亡情況MGC-803細胞轉染72 h后,收集細胞,制作成濃度為1×106mL-1細胞懸液;取95 μL細胞懸液,加入5 μL PI溶液染色,混勻,室溫避光下孵育5 min;在熒光顯微鏡下觀察,200倍鏡下選取6個不同視野進行陽性細胞計數,統計分析并拍照。
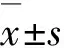
2 結 果
2.1 各組MGC-803細胞中galectin-3蛋白表達水平與空白對照組和陰性對照組(4.247%±0.112%和4.166%±0.090%)比較,siRNA干擾組MGC-803細胞中galectin-3蛋白表達水平(0.969%±0.061%)明顯下降(P<0.05);與空白對照組比較,陰性對照組MGC-803細胞中galectin-3蛋白表達水平差異無統計學意義(P>0.05)。見圖1。

Lane 1: siRNA interference group; Lane 2: Negative control group; Lane 3: Blank control group.
圖1 Western blotting法檢測各組MGC-803細胞中galectin-3蛋白表達電泳圖
Fig.1 Electrophoregram of expressions of galectin-3 protein in MGC-803 cells in various groups detected by Western blotting method
2.2 各組MGC-803細胞凋亡率流式細胞術檢測結果顯示:siRNA干擾組MGC-803細胞凋亡率為(46.746±1.113)%,明顯高于陰性對照組(16.556%±0.656%)和空白對照組(15.398%±0.911%)(P<0.05),而陰性對照組與空白對照組比較差異無統計學意義(P>0.05)。見圖2。

A: siRNA interference group; B: Negative control group; C: Blank control group.
2.3 PI熒光染色檢測各組MGC-803細胞凋亡情況siRNA干擾組凋亡細胞明顯增加,凋亡細胞出現細胞核固縮、染色質濃集、新月形和凋亡小體等細胞凋亡特征,陰性對照組僅有少量散在的凋亡細胞(圖3,見插頁四)。與陰性對照組(8+1)和空白對照組(7±2)比較,siRNA干擾組凋亡細胞數明顯增加(24±3)(P<0.05),陰性對照組與空白對照組凋亡細胞數比較差異無統計學意義(P>0.05)。
2.4 各組MGC-803細胞中Bcl-2 和Bax 蛋白表達水平與陰性對照組和空白對照組(0.382%±0.028%和0.428%±0.066%)比較,siRNA 干擾組抗凋亡蛋白Bcl-2蛋白表達水平(0.149%±0.019%)明顯降低(P<0.05);各組促凋亡蛋白Bax蛋白表達水平無明顯變化(1.495%±0.046%、1.476%±0.047%和1.519%±0.085%)(P>0.05)。見圖4。

Lane 1: siRNA interference group; Lane 2: Negative control group; Lane 3: Blank control group.
圖4 Western blotting法檢測各組MGC-803細胞中Bcl-2和Bax蛋白表達電泳圖
Fig.4 Electrophoregram of expressions of Bcl-2 and Bax proteins in MGC-803 cells in various groups detected by Western blotting method
3 討 論
目前胃癌主要的治療手段是根治性切除術,但術后復發、轉移率高是提高患者生存率的主要障礙[11]。近年來腫瘤的靶向治療為胃癌治療提供了新的思路,因此,尋找對胃癌侵襲和轉移有影響的特定靶點對提高患者生存率至關重要。研究[12]表明:在凋亡誘導劑作用下,galectin-3能轉位至核周膜,于線粒體內富集,可防止線粒體受破壞和抑制細胞色素C的釋放,對多種腫瘤細胞具有抗凋亡的作用。本研究在胃癌細胞中敲低galectin-3后,發現細胞凋亡率明顯升高,凋亡相關蛋白Bcl-2表達水平明顯降低。
本課題組前期研究[10]已成功地將靶向galectin-3的siRNA轉染入人胃癌MGC-803細胞,轉染后48 h達到70%以上的抑制率,且發現:galectin-3低表達可抑制MGC-803細胞的增殖。本研究繼續將靶向galectin-3的siRNA轉染入人胃癌MGC-803細胞,觀察敲低galectin-3表達對MGC-803細胞凋亡及相關蛋白Bcl-2和Bax 表達的影響,流式細胞術和PI染色法檢測結果均顯示:抑制galectin-3表達后細胞凋亡明顯增加,提示在胃癌發生過程中galectin-3抑制了細胞凋亡,由此推測,galectin-3具有成為胃癌靶向治療新基因靶點的可能。為探討其發生機制,本研究檢測了凋亡相關蛋白Bcl-2和Bax的表達情況。
細胞凋亡是一種受內在基因調控的細胞主動程序化的死亡過程,是機體維持穩定的重要調節機制[13]。細胞凋亡不足會引發癌癥[14],Bcl-2和Bax分別是抗細胞凋亡和促進細胞凋亡的基因。Bcl-2可以通過介導細胞膜的通透性來抑制細胞色素C等促凋亡蛋白的釋放,阻止細胞凋亡的級聯反應,其表達下調可使腫瘤細胞的凋亡率明顯上調[15]。Bax的功能則剛好相反,當受到凋亡信號的刺激后,Bax可誘導降低線粒體膜的電位,促進細胞色素C的釋放,啟動細胞凋亡級聯反應[16]。當細胞受到促凋亡因素刺激時,Bcl-2與Bax可相互作用,兩者的比率是啟動細胞凋亡的開關[17]。當Bcl-2/Bax比值上調時,形成Bcl-2同源二聚體,細胞凋亡出現抑制;反之,Bcl-2/Bax比值下調,則容易形成Bax同源二聚體,誘發細胞凋亡[18]。
本研究結果顯示:抑制galectin-3表達之后,siRNA干擾組細胞凋亡率較2個對照組明顯升高,siRNA干擾組細胞中Bcl-2蛋白表達水平明顯降低,而Bax蛋白表達水平未見明顯變化,由此推測,galectin-3的低表達對Bcl-2蛋白產生了較大影響。Bax蛋白雖然未見明顯變化,但Bcl-2/Bax比值亦下調,提示siRNA干擾組MGC-803細胞凋亡可能是galectin-3低表達所引發的Bcl-2下調所致,galectin-3和Bcl-2有很多相似之處,均可以促進細胞增殖,抑制細胞凋亡,且兩者在結構上還有著高度同源性序列,2種蛋白在C-羥基端有1個NWGR基序,包括了4個氨基酸 (Asu-Trp-Gly-Arg)[19],是凋亡抑制活性的關鍵結構,這個基序在Bcl-2中高度保守,對于抑制細胞程序性死亡的功能起著關鍵的作用。既然galectin-3與Bcl-2存在諸多相似性,那么二者之間的調控關系是否是互作蛋白等均有待于進一步探討。本課題組將對galectin-3、Bcl-2及各個凋亡途徑中的關鍵蛋白進行系統的研究,從而明確galectin-3參與的腫瘤調控通路及其作用途徑。

